放射性125I粒子植入治疗109例不可切除胰腺癌的临床分析
2016-12-22罗小美姜枫曾健滢牛立志
罗小美 姜枫 曾健滢 牛立志
放射性125I粒子植入治疗109例不可切除胰腺癌的临床分析
罗小美 姜枫 曾健滢 牛立志
胰腺癌是消化系统常见的恶性肿瘤,具有起病隐匿、发展迅速、恶性程度高、易早期转移、预后差等特点。在全世界各种癌症患者的综合排名中,胰腺癌死亡率分别占男性第8位,女性第9位[1]。根治性手术是目前治疗胰腺癌唯一可望治愈的治疗方式,但大多数胰腺癌患者发现时已经发展到晚期,失去手术机会[2]。对于不可切除性胰腺癌,暂没有标准的治疗方案。随着技术的发展,通过应用计算机立体定位计划系统(treatment plan system,TPS)设计方案,在现代影像设备(如B超、CT等)引导下将放射性粒子植入肿瘤内或受肿瘤浸润的组织中,通过其发出的持续、短距离放射线,不但可使肿瘤靶区达到有效放射剂量,而且不损伤或极小损伤周围正常组织,从而达到杀灭肿瘤细胞的目的。本研究回顾性分析109例在CT引导下125I粒子植入治疗不可切除性胰腺癌患者的资料,评价该技术的可行性及安全性。
一、资料与方法
1.一般资料:2008年1月至2015年3月间暨南大学医学院附属复大肿瘤医院共收治310例经病理确诊的胰腺癌患者。患者放弃手术及化疗的原因如下:(1)肿瘤弥漫性转移;(2)经综合分析原发灶不可切除;(3)患者拒绝外科手术和化疗,或化疗后寻求进一步治疗;(4)伴有严重并发症,如高血压、胸腔积液和腹水等;(5)年龄过高,手术风险高。患者在签署知情同意书后入组。入组条件:(1)治疗前卡氏评分(kamofsky performance status,KPS)≥70分;(2)血小板计数≥80×109/L,白细胞计数≥3×109/L,嗜中性粒细胞计数≥2×109/L,血红蛋白≥90 g/L;(3)前凝血酶国际标准化比值≥1.5;(4)无3级高血压、严重冠状动脉疾病、骨髓移植、呼吸系统疾病以及急慢性感染;(5)肝功能基本正常、腹水穿刺释放量<1 L;(6)患者可配合完成粒子植入治疗;(7)临床与随访资料完整。109例胰腺癌患者入组,其中男性68例,女性41例;年龄27~80岁,平均59岁;肿瘤位于胰头69例,胰体尾40例;肿瘤分期Ⅰ期4例,Ⅱ期13例,Ⅲ期19例,Ⅳ期73例;肿瘤直径1.5~11.2 cm,平均(4.8±1.7)cm。
2.125I粒子植入:术前采用德国Siemens(Somatom Definition AS )64层CT进行胰腺扫描,勾画出肿瘤轮廓,将相关数据输入计算机立体TPS 进行治疗计划设计。根据肿瘤体积的3个互相垂直的直径,以0.7 mCi活度的125I粒子(中国上海欣科医药有限公司提供的1125.3631AM.99型)、相隔1~1.5 cm平面播植的原则计算出粒子数及放射剂量。按患者肿瘤部位选择体位,常规消毒、铺巾、局部浸润麻醉,在超声(荷兰Philips iU22型超声仪)及CT引导下用介入穿刺针从穿刺点穿刺到靶区内,通过CT扫描确认到位后用粒子枪在病灶内依次植入125I粒子,间隔0.5 cm,植入面积达肿瘤周围1 cm。最后通过CT检查确定植入粒子数目、病灶体积变化及粒子分布情况。用放射性粒子植入TPS计算得出真实植入后的治疗剂量分布,得出以110 Gy为肿瘤匹配周边剂量(matched peripheral dose,MPD)线及剂量体积直方图,并对治疗质量进行评估。
3.术后评估及随访:记录患者术后的不良反应,根据疼痛评分标准(VAS法,10分制)进行疼痛评分,计算镇痛药物消耗量。术后第1个月及此后每间隔3个月行动态CT腹部扫描,并根据实体瘤疗效评价标准(RECIST 1.1)[3]进行总体疗效评价。完全缓解:肉眼所见肿瘤完全消失,且至少维持4周以上;部分缓解:肿瘤体积减小30%以上,且维持4周以上;稳定:肿瘤体积减小或增大不足25%,且无新病灶出现;进展:肿瘤体积增大超过25%,或出现新病灶。采用门诊复查、电话方式随访,随访时间从2008年2月至2015年5月,中位随访时间15.2个月。109例均获得随访记录。
4.统计学处理:采用Graphpad Prism 5(GraphPad, USA)软件进行统计学分析。治疗前后疼痛评分变化采用One Way ANOVA方法表示。P<0.05为差异具有统计学意义。
二、结果
1.125I粒子植入术后不良反应:所有患者均顺利完成125I粒子植入治疗。每例患者植入粒子5~70粒,平均(27.8±11.8)粒。所有患者无术中死亡。术后未发现胰瘘、胆漏和肠瘘等严重并发症。25例术后出现不良反应,其中7例(6.4%)发热,8例(7.3%)疼痛,3例(2.8%)血清胆红素升高,2例(1.8%)消化道出血,1例(0.9%)感染性休克,1例(0.9%)心衰,3例(2.8%)腹胀、腹泻,均经对症治疗2周后症状改善或消失。
2.疗效:3个月后行CT复查,大部分患者肿瘤局部控制良好(图1),14例(12.8%)部分缓解,88例(80.7%)稳定,7例(6.5%)疾病进展。
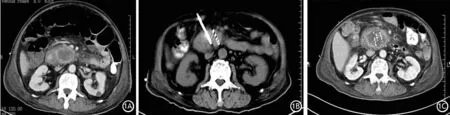
图1 胰腺肿瘤行125I粒子植入治疗。术前增强CT示胰头膨大呈肿块状,最大截面约4.7 cm×4.3 cm(1A);术中在肿瘤靶区植入125I粒子30粒,间隔0.5 cm,总活度21 mCi(1B);术后1个月增强CT示胰头部一肿块影,大小较前大致相仿,密度较低,内可见高密度碘粒子影(1C)
3.疼痛缓解情况:术前64例有疼痛症状,其中VAS≥7分13例,4~6分19例,≤3分32例。经皮125I粒子植入治疗后1周,49例(76.6%)疼痛明显缓解,VAS疼痛评分均降至3分以下,甚至疼痛消失(图2)。
讨论 胰腺癌属低氧性肿瘤,对γ射线极为敏感,少量的γ射线即可破坏DNA。125I放射性粒子能持续放射γ射线,从而阻止肿瘤细胞的繁殖,且对周围正常组织损伤较小。为提高疗效,靶区的放疗累积剂量需达到60 Gy以上才能取得较满意的疗效[4]。但胰头周围解剖复杂,血管较多,十二指肠、胆总管与胰头毗邻,因此肿瘤靶区难以达到有效放射剂量。常规胰腺癌外放疗标准剂量为60 Gy/10周,接近正常组织最大耐受剂量,但远非胰腺癌放射治疗肿瘤消退剂量[5]。如何提高胰腺癌靶区的放疗剂量、降低周围重要脏器的放射性损伤、提高患者的生活质量和远期生存率是目前临床研究的重点。文献报道[6-12],临床上放射性125I粒子植入治疗胰腺癌中肿瘤MPD在60~160 Gy之间。本研究采用的MPD为110 Gy。
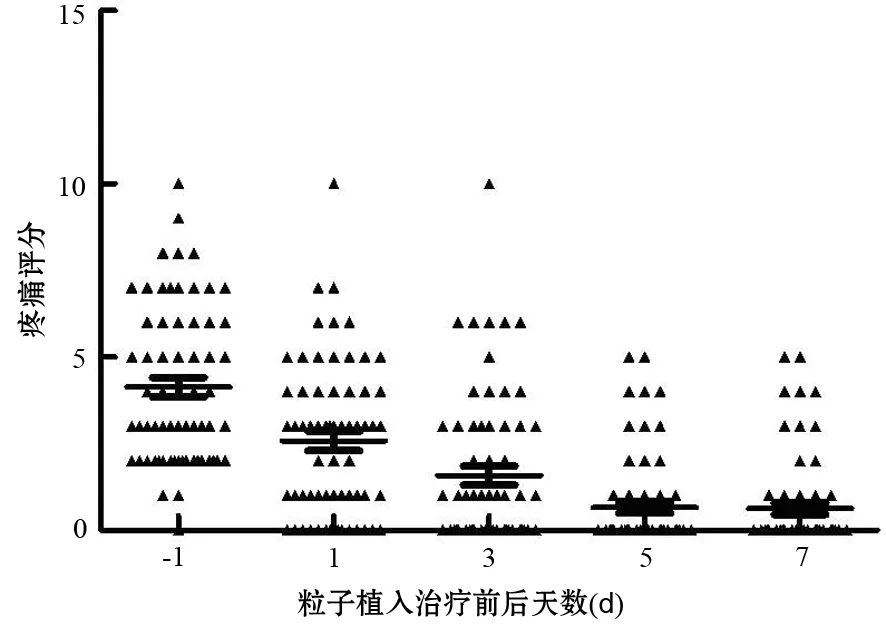
图2 125I粒子植入治疗前后患者疼痛评分的变化
胰腺癌粒子植入的引导入路主要是通过术中、经皮、经超声内镜(EUS)引导。术中植入放射性粒子可以确保粒子分布的均匀性,减少对瘤体周围组织的损伤,降低术后出血、感染等并发症发生率[13-14]。李会星等[15]报道,术后胰瘘发生率为16.3%,考虑与肿物位于胰头颈部或钩突部有关;经皮CT或超声引导植入粒子具有操作方便、迅速,可准确判断病灶与周围血管的解剖关系,可靠性、 安全性较好,同时通过适时监测可预防并及时处理穿刺并发症等优点[11-12,16-18],术后均未出现胰瘘、出血、消化道穿孔及感染等主要并发症,仅部分出现粒子移位;经EUS引导下植入粒子具有定位准确、创伤小、穿刺距离短、避免开腹等优点,术后也未出现上消化道出血、胰瘘、 放射性肠炎、消化道穿孔、感染等并发症[7,19-21]。本研究结果显示,125I粒子植入后均未发生胰瘘、胆漏和肠瘘等严重并发症,仅出现轻微的不良反应。究其原因,一方面是因为经皮CT或超声引导下植入125I粒子可实时、精准地穿入目标部位,减少穿刺次数,避免损伤周围重要组织;另一方面是因为术前准备时用泻药清洁肠道可预防因植入针穿入胃或横结肠造成的腹腔感染,围手术期应用止血药物可预防术后出血,应用抑制胰酶分泌的药物预防发生胰漏,应用胃肠动力药及胃肠道黏膜保护剂治疗可缓解胃、肠道的放射性炎症反应,给予充分营养支持并适当利尿治疗减少腹水产生等多种预防措施的实施。
本研究结果显示,125I粒子植入治疗1周后,除15例患者疼痛评分无明显变化或升高外,其余均降至3分以下或疼痛消失。患者疼痛缓解的原因可能是125I粒子持续性γ射线照射可最大程度地杀死肿瘤细胞[22],减少前列腺素、缓激肽以及5-羟色胺等致痛因子的释放[23],破坏癌组织侵犯的胰腺周围神经纤维[10]。疼痛评分无明显变化或升高可能与瘤区局部水肿压迫神经丛有关,但均于口服止痛药后消失。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90. DOI: 10.3322/caac.20107.
[2] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1):9-29. DOI:10.3322/caac.21208.
[3] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2):228-247. DOI:10.1016/j.ejca.2008.10.026.
[4] Ceha HM, van Tienhoven G, Gouma DJ, et al. Feasibility and efficacy of high dose conformal radiotherapy for patients with locally advanced pancreatic carcinoma[J]. Cancer, 2000, 89(11):2222-2229.
[5] 殷蔚伯, 谷铣之. 肿瘤放射治疗学[M]. 北京: 中国协和医科大学出版社,2008,776-782.
[6] 王俊杰, 修典荣, 冉维强,等. 术中超声引导放射性125I粒子植入治疗胰腺癌[J]. 中华放射医学与防护杂志, 2005, 25(5):441-443.DOI:10.3760/cma.j.issn.0254-5098.2005.05.011.
[7] Sun S, Xu H, Xin J, et al. Endoscopic ultrasound-guided interstitial brachytherapy of unresectable pancreatic cancer: results of a pilot trial[J]. Endoscopy, 2006, 38(4):399-403.
[8] 王俊杰,修典荣,冉维强,等. 术中超声引导放射性125I粒子组织间植入治疗胰腺癌[J]. 中华放射肿瘤学杂志, 2007, 16(1):34-37.DOI:10.3760/j.issn:1004-4221.2007.01.008.
[9] 王忠敏, 黄钢, 陈克敏,等.CT引导下~(125)I放射性粒子治疗胰腺癌的疗效观察[J]. 介入放射学杂志, 2009, 18(9):668-672.DOI: 10.3969/j.issn.1008-794X.2009.09.008.
[10] 陆健, 郑云峰, 张欢,等. CT导引下植入125I粒子治疗19例晚期胰腺癌的疗效观察[J]. 介入放射学杂志, 2010, 19(7):550-553.DOI:10.3969/j.issn.1008-794X.2009.09.008.
[11] 李胜勇,周忠晓,乔建文,等. CT引导下125I粒子组织间永久植入治疗胰腺癌16例[J]. 中国现代普通外科进展, ,2013, 16(12):966-968.DOI:10.3969/j.issn.1009-9905.2013.12.013.
[12] 牛洪欣, 张西坤, 徐忠法,等. 影像引导下放射性粒子植入治疗不可切除胰腺癌的疗效评价[J]. 中华普通外科杂志, 2015, 30(6):432-435.DOI:10.3760/cma.j.issn.1007-631X.2015.06.003.
[13] 黄洪军, 江勇, 吴宝强,等. 术中125I放射性粒子植入治疗不能切除晚期胰腺癌的并发症和预后分析[J]. 肝胆胰外科杂志, 2014, 26(4):281-284.
[14] 刘洋, 盛波, 姜凯,等. 术中放射性粒子植入治疗晚期胰腺癌的疗效[J]. 中华肝胆外科杂志, 2014, 20(6):446-448.DOI:10.3760/cma.j.issn.1007-8118.2014.06.014.
[15] 李会星, 史宪杰, 梁雨荣,等. 125I粒子植入治疗晚期胰腺癌术后胰瘘的危险因素[J]. 中华肝胆外科杂志, 2014, 20(12):862-865.DOI:10.3760/cma.j.issn.1673-4203.2014.09.010.
[16] Zhongmin W, Yu L, Fenju L, et al. Clinical efficacy of CT-guided iodine-125 seed implantation therapy in patients with advanced pancreatic cancer[J]. Eur Radiol, 2010, 20(7):1786-1791. DOI:10.1007/s00330-009-1703-0.
[17] 李红伟. CT导引下125I粒子植入治疗胰腺癌90例[J]. 中国医药指南, 2014, 15:154-155.
[18] Yu YP, Yu Q, Guo JM, et al. Effectiveness and security of CT-guided percutaneous implantation of (125)I seeds in pancreatic carcinoma[J]. Br J Radiol, 2014, 87(1039):20130642. DOI:10.1259/bjr.20130642.
[19] 金震东, 李兆申, 刘岩,等. 超声内镜引导下定向植入放射性125Ⅰ粒子治疗胰腺癌的临床研究[J]. 中华消化内镜杂志, 2006, 23(1):15-18.DOI:10.3760/cma.j.issn.1007-5232.2006.01.005.
[20] Jin Z, Du Y, Li Z, et al. Endoscopic ultrasonography-guided interstitial implantation of iodine 125-seeds combined with chemotherapy in the treatment of unresectable pancreatic carcinoma: a prospective pilot study[J]. Endoscopy, 2008, 40(4):314-320. DOI:10.1055/s-2007-995476.
[21] 孟浩,金震东,杜奕奇,等. 超声内镜引导下碘-125粒子种植治疗中晚期胰腺癌的近期疗效观察[J]. 中华胰腺病杂志, 2012, 12(4):262-264.DOI:10.3760/cma.j.issn.1674-1935.2012.04.014.
[22] Zhang FJ, Wu PH, Zhao M, et al. CT guided radioactive seed 125I implantation in treatment of pancreatic cancer [J]. Zhonghua Yi Xue Za Zhi, 2006, 86(4):223-227.
[23] 赵静,张建波. 放射性粒子植入治疗胰腺癌∥王娟. 腹部肿瘤放射性粒子治疗技术[M]. 北京: 人民卫生出版社, 2014,59-86.
(本文编辑:冀凯宏)
10.3760/cma.j.issn.1674-1935.2016.06.012
510632 广州,暨南大学医学院(罗小美);暨南大学医学院附属复大肿瘤医院(罗小美、姜枫、牛立志);广州复大肿瘤研究所(曾健滢)
牛立志,Email: niuboshi@fudahospital.com
2015-11-23)
