内镜黏膜下剥离术在治疗早期胃癌及癌前病变中的应用
2016-12-21周智诚黄神安付唆林
周智诚++黄神安++付唆林

[摘要] 目的 研究使用内镜黏膜下剥离术治疗早期胃癌及癌前病变的临床效果。 方法 将我院收治的40例早期胃癌及癌前病变的患者按其意愿分为对照组和试验组,分别采用常规外科开放手术和内镜黏膜下剥离术实施治疗。观察两组患者的手术时间、手术期间实际出血量、住院期间总费用、术后恢复时间、术后并发症以及术后随访。 结果 试验组患者的手术时间、手术期间实际出血量、住院期间总费用明显少于对照组;而试验组患者术后恢复时间、术后并发症也明显少于对照组。术后随访半年两组患者均无复发。 结论 应用内镜黏膜下剥离术治疗早期胃癌及癌前病变临床效果非常显著。
[关键词] 内镜黏膜下剥离术;早期胃癌;癌前病变;并发症
[中图分类号] R735.2 [文献标识码] B [文章编号] 1673-9701(2016)27-0087-04
胃癌是我国常见的恶性肿瘤,早期胃癌多无特异性症状,当临床症状明显时,病变已属晚期,其在癌症的死因中居2位[1]。手术切除是治疗早期胃癌的基本手段。早期胃癌漏诊率高,到发现时已有转移,手术效果差,术后5年生存率约25%[2],所以必须加强早癌的筛查。目前,胃镜结合病理组织学检查是诊断早期胃癌的有效手段。
本研究将系统全面地分析、归纳在我院诊治的早期胃癌及癌前病变患者内镜下的治疗,以及患者的愈后、治疗费用、局部淋巴结及其他脏器转移、复查内镜下表现等,为临床上治疗该类疾病提供帮助和参考。现报道如下。
1资料与方法
1.1一般资料
选择2010年6月1日~2015年2月28日我院收治的40例早期胃癌或癌前病变患者。与患者及家属交待行ESD或普外科手术治疗的优缺点,按照患者意愿分为两组,对照组行外科手术治疗,试验组行内镜下ESD治疗。对照组21例患者中男11例、女10例;患者年龄26~81岁,平均(52.8±2.6)岁;体重45~81 kg,平均(54.4±0.6)kg;胃镜活检病理诊断高级别上皮内瘤变9例,早期胃癌12例。试验组19例患者中男9例、女10例,患者年龄25~79岁,平均(51.6±2.7)岁,体重43~79 kg,平均(53.9±0.7)kg;胃镜活检病理诊断高级别上皮内瘤变11例,早期胃癌8例。两组患者一般资料组间无显著差异(P>0.05)。试验组患者如ESD术后,标本病理边缘阳性,则追加外科手术。
病例入选标准:①患者胃镜活检病理诊断高级别上皮内瘤变或早期胃癌;②各主要脏器功能表现良好;③患者及家属自愿参与,自由入组。
1.2方法
1.2.1 器械 内镜黏膜下剥离术所需要器械:富士胃镜、海博刀系统、富士双腔镜、超声小探头(Olympus UM-3R)、注射针、和谐夹、波士顿大钛夹、IT刀、Hook 刀、透明帽等。普外科开放手术所需外科常用器械:手术刀、手术剪、血管钳、手术镊、持针钳、牵引钩、缝针、缝线、高频电刀等。
1.2.2 术前 内镜黏膜下剥离术前常规检查血常规+血型、PT,评估心肺功能,完善胸部、全腹部CT排外其他脏器转移。术前常规行超声胃镜检查,所有病灶在黏膜层或黏膜肌层,抬举征阳性。ESD前,充分告知患者及家属内镜下治疗的优点以及并发症。所有患者均在插管下麻醉进行。
普外科开放手术前经胃镜活检并经病理学检查明确诊断为早期胃癌,有手术治疗适应证,并签署知情同意书。排除标准:存在其他部位原发性恶性肿瘤者;无法耐受手术治疗者;存在严重心脑血管疾病者。
1.2.3 步骤 (1)ESD过程:①标记;②黏膜下注射:若病变侵犯到黏膜下层,则病变抬举征阴性,应停止ESD术,重新选择普外科手术;③切开病变外侧缘黏膜;④剥离病变;⑤创面处理;⑥标本处理:确定病变性质和病灶切缘及基底有无病变累及。(2)普外科开放手术过程:患者取仰卧位,于全麻下进行手术治疗。手术切口选择腹部正中线,逐层分离腹腔内组织,充分暴露胃部组织,完成胃部相关动静脉血管结扎。将胃癌进行成功切除,并完成胃周围淋巴结清扫。
1.3 观察指标
(1)比较两组患者的手术时间、手术期间实际出血量、住院期间总费用、术后恢复时间、术后并发症;(2)术后1个月、3个月、半年复查胃镜,观察患者病灶胃镜下表现,是否有复发还是残留。如无复发及残留,以后每半年复查一次胃镜;(3)术后半年复查胸部、全腹部CT,比较两组患者的局部淋巴结及其他脏器转移情况。
1.4 统计学方法
采用SPSS17.0统计学软件进行处理,计量资料以均数±标准差(x±s)表示,采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术时间、手术期间实际出血量、住院期间总费用、术后恢复时间比较
对照组常规开放外科手术操作实施时间(88.21±8.67)min,手术期间出血量达(178.32±16.39) mL;试验组内镜黏膜下剥离术操作实施时间为(56.25±6.37) min,手术期间出血量达到(24.52±6.32)mL,两项指标数据组间比较差异有统计学意义(P<0.05)。对照组常规开放外科住院期间总费用(2.73±1.01)万元,术后恢复时间(6.23±2.45)d;试验组内镜黏膜下剥离术住院期间总费用(1.23±0.22)万元,术后恢复时间(2.56±1.07)d,两项指标数据组间比较差异有统计学意义(P<0.05)。见表1。
2.2 两组患者术后并发症比较
对照组常规普外科开放手术中有4例发生并发症,其中出血2例,术后感染2例,发生率达19.0%(4/21);行ESD患者术后有2例患者出现大出血,经过胃镜下止血及输血纠正贫血后血止,发生率达10.5%(2/19)。两组组间并发症发生率比较差异有统计学意义(χ2=4.685,P<0.05)。
2.3 两组术后复查及随访情况
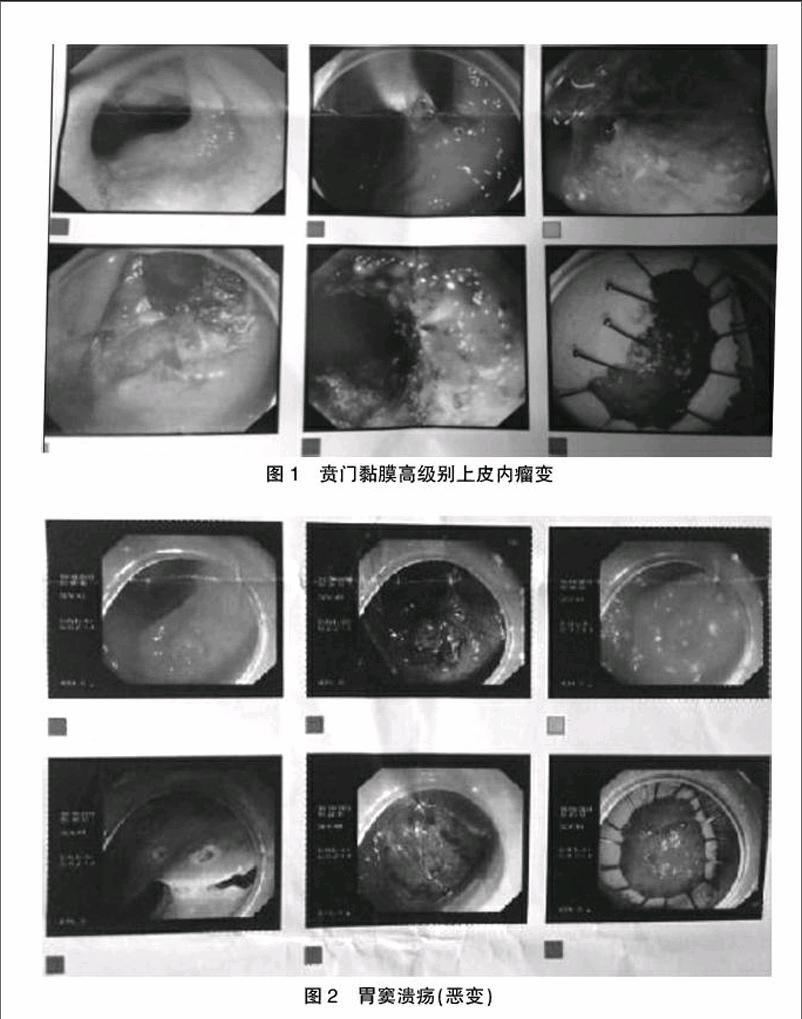
对照组21例患者均手术成功。试验组19例患者ESD术前病理诊断为高级别上皮内瘤变11例,早期胃癌8例。ESD术后整块组织病理诊断为高级别上皮内瘤变7例,其余黏膜内癌11例、黏膜下浅层癌1例(基底切缘阳性)。对1例黏膜下浅层癌及基底切缘阳性的患者追加外科手术,外科术后大体标本均未见癌细胞及脉管转移。40例患者均经内镜随访,术后1个月、3个月、半年患者内镜下均未见复发。图1、2为其中2例患者检查及ESD诊治过程。40例患者术后半年均复查胸部、全腹部CT,均未见局部淋巴结及其他脏器转移。
3讨论
早期胃癌是指癌组织浸润仅限于黏膜层及黏膜下层,不论是否有淋巴结转移。中国是胃癌发病率和死亡率最高的国家之一,发病率和死亡率均是世界平均水平两倍多。胃癌的发病率随着年龄的增加而显著升高,发病的高峰年龄在50~80岁,但已呈年轻化趋势。
胃的癌前病变是指一类容易发生癌变的胃黏膜病理组织学变化,即胃黏膜的异型增生和肠上皮化生。胃黏膜癌肿是一个多步骤癌变的过程,即慢性浅表性胃炎→萎缩性胃炎→肠上皮化生→异型增生→胃癌,在此期间出现的病变称之为癌前病变。对于重度的异型增生,必须及时处理,尽早治疗。
2000年国际癌症研究机构对于癌前病变统一以“上皮内瘤变”命名[3]。上皮内瘤变分为两级,即低级别上皮内瘤变和高级别上皮内瘤变。低级别上皮内瘤变相当于胃黏膜轻度和中度异型增生,临床随访研究显示部分低级别上皮内瘤变是可逆的,经积极合理的治疗,可以逆转。高级别上皮内瘤变相当于胃黏膜重度异型增生和原位癌。
内镜黏膜下剥离术(ESD)是一种内镜下治疗新技术。它具有可切除完整病灶[4]、提供完整病理诊断材料及预防复发等优点[5],较EMR相比可以显著减少病灶的残余率。胃高级别上皮内瘤变可选择行 ESD 治疗[6],术后创伤少,有完整标本,可以及时发现早癌,能阻止胃癌的发生及发展。
ESD技术现已在日本等[7]国家广泛应用,在我国一些大型医院开展较多。ESD可以一次性完整切除病灶[8],深度可以到达固有肌层,故可以提供准确的病理分期。此项技术在我国有着极大的发展空间,已经用于切除消化道早期肿瘤[9]及类癌、巨大息肉等。ESD一般在三甲医院实施,是内镜下三级手术,一般由副主任医师及以上级别医师操作,主要是由于此技术需要熟练掌握内镜及相关器械[10],能熟练处理出血、穿孔等并发症,这些制约ESD技术广泛开展[11]。ESD 术后要对完整切除的标本进行评估[12],看切缘是否干净,必要时行普外科手术治疗。
外科手术治疗以前被认为是早期胃癌的首选治疗方法,黏膜内癌和黏膜下癌的外科根治术后5年生存率高达99%、96%,但术后相关并发症发生率及死亡率分别高达43%和6.5%[13],手术后常感反酸、烧心、恶心等症状,患者生存质量明显下降,生活质量与进展期胃癌相似[14],手术并不能提高患者的生存质量。而且普外科手术创伤大、恢复时间长、费用高。
ESD治疗早期胃癌的适应证为[15]:不论病变大小,无合并溃疡存在的分化型黏膜内癌;肿瘤直径≤30 mm,合并溃疡存在的分化型黏膜内癌;肿瘤直径≤30 mm,无合并溃疡存在的分化型 sm1 黏膜下癌;肿瘤直径≤20 mm,无合并溃疡存在的未分化型黏膜内癌;大于20 mm的胃黏膜上皮内高级别瘤变;EMR 术后复发、再次行EMR困难的黏膜病变。
随着社会的进步,人们对治疗后生活质量的要求也在不断提高,ESD的发展为更多患者提供了另一种治疗选择[16],显著减少医疗费用及医疗资源的浪费。ESD可以避免不必要的过度手术治疗[17],减少治疗费用以及手术带来的相关并发症[18],对我国的卫生防治工作意义重大,对患者的健康及我国有限的医疗资源均有重要意义。
本文研究结果也显示:ESD能完全切除早期胃癌及癌前病变,而且能显著减少患者的医疗费用。ESD术后无严重并发症,而且保存了患者的正常胃腔,术后患者无特殊不适,随访无复发。由此可见,ESD必将成为治疗早期胃癌及癌前病变的一种新的、有效的微创手段。
[参考文献]
[1] Parkin DM,Bray FI,Devesa SS. Cancer burden in the year 2000. The global picture[J]. Eur J Cancer,2001,37(Suppl 8):S34- S66.
[2] Gotoda T,Yanaqisawa A,Sasako M,et al. Incidence of lymph node metastasis from early gastric cancer:Estimation with a large number of cases at two large centers[J]. Gastric Cancer,2000,3(4):219-225.
[3] Hamilton SR,Aaltonen LA. World Health Organization classification of tumors:Pathology and genetics of tumors of digestive system[M]. Lyon:IARC Press,2000:37-68.
[4] Thirumurthi S,Raju GS. How to deal with large colorectal polyps:Snare,endoscopic mucosal resection,and endoscopic submucosal dissection;resect or refer?[J]. Current Opinion in Gastroenterology,2016,32(1):26-31.
[5] 卢忠生,令狐恩强. 内镜下黏膜剥离术治疗消化道早癌及癌前病变[J]. 中华消化内科,2015,1(11):578-583.
[6] Li S,Xu M,Yuan C,et al. Two endoscopic submucosal dissection procedures for stripping huge segment of the gastric mucosa to treat early gastric signet ring cell carcinoma[J]. Journal of Cancer Research and Therapeutics,2015,11(Suppl C):253-257.
[7] Ishihara R,Iishi H,Uedo N,et al. Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan[J]. Gastrointest Endosc,2008,68(6):1066-1072.
[8] Joh DH,Park CH,Jung S,et al. Safety and feasibility of simultaneous endoscopic submucosal dissection for multiple gastric neoplasias[J]. Surgical Endoscopy,2015,29(12):3690-3697.
[9] 刘正,武彪. 腹腔镜联合内镜在胃肠道小肿瘤微创治疗中的应用[J]. 中国临床实用医学,2016,1(1):50-51.
[10] Chiu PW,Phee SJ,Bhandari P,et al. Enhancing proficiency in performing endoscopic submucosal dissection (ESD) by using a prototype robotic endoscope[J]. Endoscopy International Open,2015,3(5):E439-E442.
[11] Higuchi K,Tanabe S,Koizumi W,et al. Expansion of the indications for endoscopic mucosal resection in patients with superficial esophageal carcinoma[J]. Endoscopy,2007, 39(1):36-40.
[12] Lee JH,Kim KM. Clinicopathological factors of multiple lateral margin involvement after endoscopic submucosal dissection for early gastric cancer[J]. Endoscopy,2015,47(12):3460-3468.
[13] Onozato Y,Ishihara H,Iizuka H,et al. Endoscopic submucosal dissection for early gastric cancers and large flat adenomas[J]. Endoscopy,2006,38(10):980-986.
[14] Ono H,Kondo H,Gotoda T,et al. Endoscopic mucosal resection for treatment of early gastric cancer[J]. Gut,2001, 48(2):225-229.
[15] Lee IL,Lin PY,Tung SY,et al. Endoscopic submucosal dissection for the treatment of intraluminal gastric subepithelial tumors originating from the muscularis propria laye[J]. Endoscopy,2006,38(10):1024-1028.
[16] Ma LL,Zhou PH,Yao LQ,et al. Endoscopic submucosal dissection in upper gastrointestinal lesions[J]. Chin J Dig Endosc,2008,25(10):529-564.
[17] Saxena P. Second-look endoscopy after ESD:Can we finally see the forrest from the trees?[J]. Digestive Diseases and Sciences,2015,60(10):2860-2862.
[18] Nam MJ,Sohn DK,Hong CW,et al. Cost comparison between endoscopic submucosal dissection and transanal endoscopic microsurgery for the treatment of rectal tumors[J]. Annals of Surgical Treatment and Research,2015,89(4):202-207.
(收稿日期:2016-07-12)
