腔隙性脑梗死早期神经功能恶化的危险因素分析
2016-12-21李贯绯李丽牛晓立
李贯绯+李丽++牛晓立
[摘要] 目的 探讨急性腔隙性脑梗死(LI)患者发生早期神经功能恶化(END)的相关危险因素。 方法 连续选择2015年6月~2016年6月收治于我院神经内科的急性LI患者,依据LI发病后72 h内是否出现END,将患者分为END组和非END组。比较两组患者的一般临床资料、血液生化指标及影像学指标,进行单因素及多因素相关分析,筛选出影响END的相关危险因素。 结果 单因素分析结果显示,END组患者的年龄、糖尿病史、基线收缩压、基线美国国立卫生研究院卒中量表(NIHSS)评分、血清同型半胱氨酸、后循环病灶、责任动脉狭窄率≥50%与非END组比较差异有统计学意义(P<0.05)。多因素Logistic回归分析结果显示年龄、基线NIHSS评分、责任动脉狭窄率≥50%是发生END的独立预测因素。 结论 高龄、基线NIHSS评分高以及责任动脉狭窄率≥50%是急性LI患者发生END的独立危险因素,这些危险因素有助于评估LI的病情发展及判断预后。
[关键词] 腔隙性脑梗死;早期神经功能恶化;危险因素;缺血性卒中
[中图分类号] R743.3 [文献标识码] A [文章编号] 1673-9701(2016)27-0021-04
研究发现,约10%~40%的腔隙性脑梗死(lacunar infarction,LI)在起病72 h内出现神经功能缺损加重,即早期神经功能恶化(early neurological deterioration,END),是导致临床预后不良的主要原因[1]。目前,LI患者发生END的机制尚未明确,血栓局灶性积聚或不稳定斑块脱落随血流堵塞远端血管、血流动力学的异常、兴奋性毒性及炎性反应等,均被认为是END可能的发病机制,但各研究结论并不统一,且缺乏特异性的预测指标[2]。基于此,本文以急性LI患者为研究对象,分析发生END的危险因素,为探索LI的病情发展和预后判断提供客观的临床依据。
1 资料与方法
1.1一般资料
连续收集2015年6月~2016年6月在我院神经内科住院的120例急性LI患者。入组标准:LI的诊断符合全国第四届脑血管病会议所修订的《各类脑血管疾病诊断要点》诊断标准[3],并经头部MRI检查证实;发病时间≤48 h。排除标准:出血性脑卒中、短暂性脑缺血发作、脑动脉炎、脑肿瘤、颅内感染所致的神经功能缺损患者;伴有严重的心、肝、肾疾病者。
1.2 研究方法
依据LI发病后72 h内是否出现END,将患者分为END组和非END组。END判定标准为发病72 h内任一时间复评美国国立卫生研究院卒中量表(NIHSS)最高分较基线NIHSS评分增加≥2分[4]。共纳入120例LI患者,其中END组23例,非END组97例。比较两组患者的一般临床资料、血液生化指标及影像学指标。一般临床资料包括年龄、性别、既往病史、吸烟史、饮酒史、入院时血压、基线NIHSS评分;血液生化指标包括血尿酸、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖、纤维蛋白原、血清同型半胱氨酸(Hcy)、超敏C反应蛋白(hs-CRP)等;影像学指标包括病灶部位、头颅MRI上新发病灶是否多发(即分散的新发病灶≥2个)、责任动脉狭窄率≥50%等。
1.3 统计学方法
采用SPSS19.0统计学软件包进行处理,正态分布的计量资料以(x±s)表示,符合正态分布的计量资料采用t检验,计数资料比较采用χ2检验。采用多因素Logistic回归方法筛选END的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1一般临床资料
本研究纳入的120例LI患者中,男79例(65.8%),女41例(34.2%),平均年龄(64.1±10.4)岁。伴有危险因素包括高血压64例(53.3%)、糖尿病38例(31.7%)、心房颤动7例(5.8%)、冠心病15例(12.5%)、卒中史42例(35.0%)、吸烟史50例(41.7%)、饮酒史41例(34.2%)。
2.2 END组与非END组相关危险因素比较
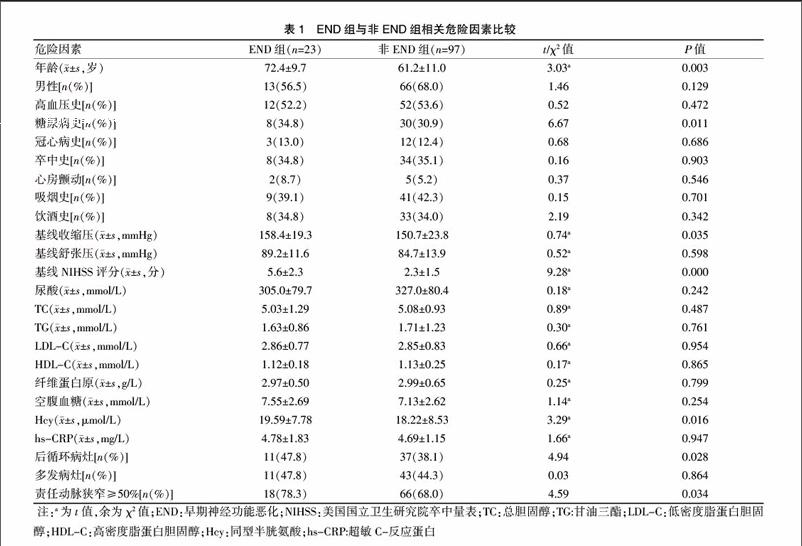
入组患者中有23例发生END(19.2%),与非END组比较,年龄、糖尿病史、基线收缩压、基线NIHSS评分、Hcy、后循环病灶、责任动脉狭窄率≥50%的差异有统计学意义(P<0.05)。其他指标包括性别、高血压史、冠心病史、卒中史、心房颤动史、烟酒史、基线舒张压、血尿酸、血脂、纤维蛋白原、空腹血糖、hs-CRP、新发病灶是否为多发病灶的差异均无统计学意义(P>0.05)(表1)。
2.3 影响END的多因素分析
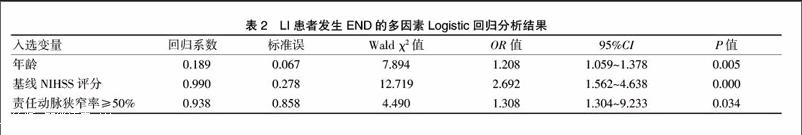
以是否发生END为因变量,将单因素分析中P<0.05的因素作为自变量纳入Logistic回归分析,结果显示年龄(OR=1.208,95%CI 1.059~1.378,P=0.005)、基线NIHSS评分(OR=2.692,95%CI 1.562~4.638,P=0.000)、责任动脉狭窄率≥50%(OR=1.308,95%CI 1.304~9.233,P=0.034)是导致LI患者发生END的独立危险因素(表2)。
3讨论
LI是我国最常见的缺血性卒中的临床类型,是指深部脑组织的微小梗死,病变通常不规则,直径约1~20 mm。END表现为原有的神经系统症状和体征进行性加重,神经功能减低[5],是导致LI患者近期和远期预后不良的主要原因之一。LI发生神经功能恶化的机制比较复杂,有研究指出可能与梗死面积扩大、颅内分支血管动脉粥样硬化、血流动力学变化以及病灶周围水肿有关[6],也可能是多种因素交互作用所致。因此,探索END的临床预测指标仍然是当前研究的焦点,但各研究对END的危险因素和预测指标仍有较大分歧[7]。因此,探讨END的危险因素,发现END预测指标,针对危险因素进行早期干预预防,对阻止卒中进展有很大意义。
本组120例患者中END的发生率为19.2%,与以往研究结论一致[8]。本文收集END组和非END组患者年龄、性别、高血压史、糖尿病史、冠心病史、心房颤动史、卒中史、吸烟史、饮酒史、基线血压、基线NIHSS评分、血尿酸、TC、TG、LDL-C、HDL、空腹血糖、纤维蛋白原、Hcy、hs-CRP、责任病灶部位、新发病灶是否多发、责任动脉狭窄率≥50%等相关影响因素,单因素分析结果显示,END组患者的年龄、糖尿病史、基线收缩压、基线NIHSS评分、Hcy、后循环病灶、责任动脉狭窄率≥50%高于非END组(P<0.05)。本文进一步对上述因素进行Logistic回归分析,结果显示年龄、基线NIHSS评分、责任动脉狭窄率≥50%是LI患者发生END的独立危险因素。
年龄是缺血性卒中的独立预测因素[9],LI的发病率与年龄呈正相关[10]。同时,年龄也是神经功能恶化的重要危险因素,尤其是超过60岁的患者发生神经功能恶化的风险更高[11],而且随着年龄的增长风险增高[12]。本研究结果显示END组平均年龄为(72.4±9.7)岁,非END组平均年龄(61.2±11.0)岁,两组比较差异有统计学意义(P<0.05),提示高龄是发生END的相关危险因素,原因考虑可能与高龄患者脑动脉硬化负荷更严重有关[13]。年龄虽然是不可干预的危险因素,但高龄的卒中患者需重点预防神经功能恶化的发生。
NIHSS评分反映的是神经功能缺损的严重程度,发病时NIHSS评分高反映卒中较为严重。既往研究[14]显示,NIHSS评分与缺血性卒中进展有关,是进展性卒中的独立危险因素。本研究结果显示END组基线NIHSS评分高于非END组,提示入院时神经功能缺损的严重程度是发生END的重要影响因素,即入院时NIHSS评分高与LI患者早期病情进展恶化相关。
以往普遍认为LI是穿支动脉闭塞所致,目前研究表明,除小动脉硬化外,大动脉狭窄或闭塞所造成的小动脉血流灌注减低和微栓子也是LI可能的发病机制[15]。有学者研究发现,LI合并大血管病变时神经功能恶化的发生率显著增高[16]。本研究结果显示,责任动脉狭窄率≥50%与神经功能恶化密切相关,其机制可能为大动脉粥样硬化斑块最初阻塞部分穿支动脉开口,随后斑块逐渐增大至完全堵塞穿支动脉开口,或者斑块直接延伸入穿支动脉,或者斑块堵塞相邻的穿支动脉[17]。另外,由于大动脉存在重度狭窄或闭塞,侧支循环的代偿能力下降,无法向缺血区供应血液,造成缺血区域扩大,神经功能缺损症状加重。
本研究存在下述几点不足:NIHSS评分对后循环梗死神经功能缺损的判定存在一定的局限性,可能对本实验部分结果有所影响;本研究纳入的患者为住院患者,在门诊治疗的患者,特别是病情比较轻、发病后病情稳定的患者未纳入本研究,存在选择性偏倚,可能会导致END组患者比例较实际高;本研究为单中心研究,样本量较小,特别是END组例数较少,不足以校正混杂因素,还需要扩大样本量进一步验证。
综上,高龄、基线NIHSS评分高以及责任动脉狭窄率≥50%是急性LI患者发生END的独立危险因素,在病程早期需要密切关注这些危险因素,以评估LI的病情发展及判断预后,针对危险因素采取相应的强化治疗方案,以防止出现神经功能恶化。
[参考文献]
[1] 王昭君,李芸,肖露露,等. 腔隙性脑梗死患者早期神经功能恶化相关因素及与脑白质病变的关联研究[J]. 中华神经科杂志,2014,47(9):633-637.
[2] Kwon HM,Lim JS,Park HK,et al. Hypertridyceridemia as a possible predictor of early neurological deterioration in acute lacunar stroke[J]. J Neurol Sci,201l,309(1-2):128-130.
[3] 全国第四届脑血管病学术会议. 各类脑血管病诊断要点(1995)[J]. 中华神经科杂志,1996,29(6):379-381.
[4] Hallevi H,Chernyshev OY,El Khoury R,et al. Intracranial atherosclerosis is associated with progression of neurological deficit in subcortical stroke[J]. Cerebrovasc Dis,2012, 33(1):64-68.
[5] 牛洪体,卫俊俊. 进展性脑梗死48例动态血压分析[J]. 中国现代医生,2013,51(23):126-127.
[6] 周佳佳,徐子奇,罗本燕. 进展性腔隙性脑梗死的发病机制、临床预测与治疗研究现状[J]. 中华神经科杂志,2013,46(7):494-495.
[7] Del BA,Palumbo V,Lamassa M,et al. Progressive lacunar stroke:Review of mechanisms,prognostic features,and putative treatments[J]. Int J Stroke,2012,7(4):321-329.
[8] 蔄红好,毕玉华,于永鹏,等. 单侧孤立基底节区腔隙性脑梗死早期神经功能恶化的多因素分析及缺血耐受的相关性研究[J]. 中国卒中杂志,2016,11(8):642-648.
[9] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国脑血管病一级预防指南2015[J]. 中华神经科杂志,2015,48(8):629-643.
[10] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国脑小血管病诊治共识[J]. 中华神经科杂志,2015,48(10):838-844.
[11] Zhou YT,Wang GS,Chen XD,et al. Transient and persistent symptoms in patients with lacunar infarction:Results from a prospective cohort study[J]. J Mul Healthcare,2015,8(24):511-517.
[12] Li Y,Liu N,Huang YH,et al. Risk factors for silent lacunar infarction in patients with transient ischemic attack[J]. Med Sci Monit,2016,22(11):447-453.
[13] Toni D,Di Angelantonio E,Di Mascio MT,et al. Types of stroke recurrence in patients with ischemic stroke:A substudy from the PRoFESS trial[J]. Int J Stroke,2014,9(7):873-878.
[14] Alton S,Karen A,Amelia KB,et al. The NIHSS score and its components can predict cortical stroke[J]. J Neurol Disord Stroke,2013,2(1):1026-1036.
[15] Yang L,Qin W,Zhang XY,et al. Infarct size may distinguish the pathogenesis of lacunar infarction of the middle cerebral artery territory[J]. Med Sci Monit,2016,22(20):211-218.
[16] Marquardt L,Kuker W,Chandratheva A,et al. Incidence and prognosis of>or=50% symptomatic vertebral or basi-lar artery stenosis:Prospective population-based study[J]. Brain,2009,123(4):982-988.
[17] Louis RC. Lacunar infarction and small vessel disease:Pathology and pathophysiology[J]. J Stroke,2015,17(1):2-6.
(收稿日期:2016-07-22)
