禽流感病毒N9亚型RT-PCR检测方法的建立
2016-12-17乔明明冯向辉王传彬才学鹏陈西钊
乔明明,孙 明,冯向辉,王 静,王传彬,才学鹏,陈西钊,*
(1.北京世纪元亨动物防疫技术有限公司,北京 100085;2.中国动物疫病预防控制中心,北京 100125)
禽流感病毒N9亚型RT-PCR检测方法的建立
乔明明1,孙 明1,冯向辉1,王 静1,王传彬2,才学鹏2,陈西钊1,2*
(1.北京世纪元亨动物防疫技术有限公司,北京 100085;2.中国动物疫病预防控制中心,北京 100125)
为建立一种简便、快速、灵敏、准确的禽流感病毒N9亚型检测方法,根据GenBank中收录的禽流感病毒N9亚型高度保守的基因序列设计引物,通过优化反应条件建立禽流感病毒N9亚型RT-PCR检测方法,并对该方法进行灵敏度、敏感性、特异性试验和临床样品检测。建立了禽流感病毒N9亚型RT-PCR检测方法,用该方法检测时,H7N9、H10N9均呈阳性,而非N9亚型的禽流感病毒及新城疫病毒等其他禽传染病病毒均呈阴性,能检测到1/32血凝单位的H7N9禽流感病毒。 建立了禽流感病毒N9亚型RT-PCR检测方法,具有操作简便、灵敏度高、特异性强的特点,值得推广应用。
禽流感病毒;N9亚型;RT-PCR
禽流感病毒(Avian influenza virus ,AIV)为单股负链RNA病毒,属于正黏病毒科、A型流感病毒属,具有抗原多样性和高度变异性。根据表面血凝素(HA)和神经氨酸酶(NA)的不同AIV可分为17个H亚型和10个N亚型。AIV主要感染禽类,个别亚型可感染人类、猪、马等哺乳动物。H7N9禽流感病毒是AIV的一个亚型,原属于低致病性病毒,仅在禽间发现;2013年3月下旬,上海、安徽两地出现严重的呼吸道感染患者[1-3],后经证实为新型H7N9禽流感病毒感染[4-5]。这种新型流感病毒遗传背景非常复杂[6],其HA基因与H7N3具有很高的同源性,NA基因与H4N9、H11N9同源性极高[7-8],因其对禽类致病力低而对人有很高的致病力和死亡率而增加了该病的防控难度[9],建立快速、准确的检测方法成为防控该病的关键。中华人民共和国国家卫生和计划生育委员会发布了人感染H7N9禽流感的诊疗方案,将从检测样品中分离到禽流感H7N9病毒或禽流感H7N9病毒核酸检测阳性等作为该病的确诊依据[10]。目前对该病的诊断主要是针对H7亚型建立的RT-PCR,还没有建立检测禽流感病毒N9亚型的RT-PCR的报道。因此,建立禽流感病毒N9亚型的RT-PCR检测方法对H7N9禽流感病毒感染的诊断和防控有重要意义。
1 材料与方法
1.1 材料
1.1.1 标准AIV毒株 灭活的标准AIV毒株H1~H15亚型和N1~N9亚型、新城疫病毒(NDV)、鸡产蛋下降综合征病毒(EDS-76)、鸡传染性支气管炎病毒(IBV)、传染性法氏囊病病毒(IBDV)、马立克氏病病毒(MDV)、鸭瘟病毒(DEV)弱毒疫苗株、鸭病毒性肝炎弱毒疫苗株,均由中国动物疫病预防控制中心兽医诊断室(农业部兽医诊断中心)保存;鸡新城疫耐热保护剂活疫苗(La Sota株)购自乾元浩生物股份有限公司。44份临床样品为北京世纪元亨动物防疫技术有限公司研发部实验室采集的浙江地区疑似流感症状的鸭子喉气管组织。
1.1.2 仪器与试剂 RNA提取试剂为Qiagen公司产品产品;AMV Reverse Transcriptase、RNase inhibitor、GoTaq DNA Polymerase为Promega公司产品;dNTP为北京华美生科生物技术有限公司产品;Trans 2K DNA Marker为北京全式金生物技术有限公司产品;TGRANDIENT PCR仪为HYBAID公司产品;UVI Firereader XS 凝胶成像系统为华粤有限责任公司产品。
1.2 方法
1.2.1 RT-PCR检测方法的建立及条件优化
1.2.1.1 引物设计 参照禽流感病毒N9亚型GenBank中高度保守的NA基因序列,应用DNA Man生物分析软件进行比对分析,找到保守同时完全区别于禽流感其他亚型的位点,应用Primer 5.0软件,针对这个特异性位置设计针对禽流感病毒N9亚型的特异性引物,预期扩增的片段大小为377bp,由上海捷瑞生物工程有限公司合成。引物序列为:
N9上游引物:5′-GCTGGCCACTATCATCACC-3′
N9下游引物:5′-TCGTTCCCCGTAACATGA-3′
1.2.1.2 病毒RNA模板提取 按照Qiagen的RNA提取试剂盒说明书进行RNA提取。
1.2.1.3 RT-PCR扩增 本试验为反转录和PCR同时进行,反应液总体积为25μL组成成分如下:5×buffer 5μL(含MgCl2),2.5mmol/L dNTPs 2.5μL,10μmol/L上游和下游引物1.8μL,TaqDNA聚合酶(5U/μL) 1μL,AMV反转录酶(10U/μL)0.2μL,RNA酶抑制剂(40U/μL)0.3μL,无菌无核酸酶水12.5μL,提取的样品RNA 2μL。RT-PCR反应条件:42℃ 45min;94℃ 3min;94℃ 30s,55℃ 30s,72℃ 30s,进行35个循环;72℃ 7min。
1.2.1.4 RT-PCR扩增体系及程序的条件优化 在RT-PCR反应体系中使用不同PCR缓冲液、引物浓度、反转录酶浓度及退火温度,观察其对检测结果的影响,确定最佳的PCR缓冲液、引物浓度、反转录酶浓度及退火温度。
1.2.2 检测方法的灵敏度试验 禽流感病毒H7N9参考毒株血凝效价为512,将该毒株稀释成1个血凝效价,再逐倍稀释至1/32,用建立的禽流感N9检测方法分别对稀释的样品进行检测,确定该检测方法的灵敏度。
1.2.3 检测方法的敏感性试验 用建立的检测方法检测禽流感病毒H7N9、H10N9两株病毒,分析该方法对禽流感N9亚型不同毒株的敏感性。
1.2.4 检测方法的特异性试验 用建立的禽流感病毒N9亚型RT-PCR方法检测灭活的标准AIV毒株H1~H15亚型和N1~N8亚型、NDV、EDS-76、IBV、IBDV、MDV、鸭瘟弱毒疫苗株、鸭病毒性肝炎弱毒疫苗株,SPF鸡胚尿囊液、SPF鸡肌肉组织、SPF鸡脑组织、SPF鸡喉气管组织、SPF鸡喉气管拭子、SPF鸡泄殖腔拭子,分析结果以确定检测方法的特异性。
1.2.5 临床样品检测 用建立的检测方法对44份临床收集的疑似禽流感病毒病料进行检测,对该方法进行效果验证。
2 结果
2.1 RT-PCR检测方法的条件优化
经过反复试验,选出最佳反应条件为绿色反应缓冲液、引物浓度为0.6μmol/L、反转录酶浓度为0.08U、退火温度为52℃,得出的最佳反应体系为:在25μL反应体系中,5×buffer 5μL(含MgCl2),2.5mmol/L dNTPs 2.5μL,10μmol/L上游和下游引物1.5μL,TaqDNA聚合酶(5U/μL) 1μL,AMV反转录酶(10U/μL)0.2μL,RNA酶抑制剂(40U/μL)0.3μL,无菌无核酸酶水12.5μL,最后加入提取的RNA模板2μL。RT-PCR反应条件:42℃ 45min;94℃ 3min,94℃ 30s,52℃ 30s,72℃ 30s,35个循环;72℃ 7min。
2.2 检测方法的灵敏度
将禽流感H7N9参考毒株稀释成1个血凝效价,再逐倍稀释至1/32,用建立的禽流感N9检测方法分别对稀释的样品进行检测,结果如图1所示,最低能检测到1/32个血凝单位的H7N9病毒。
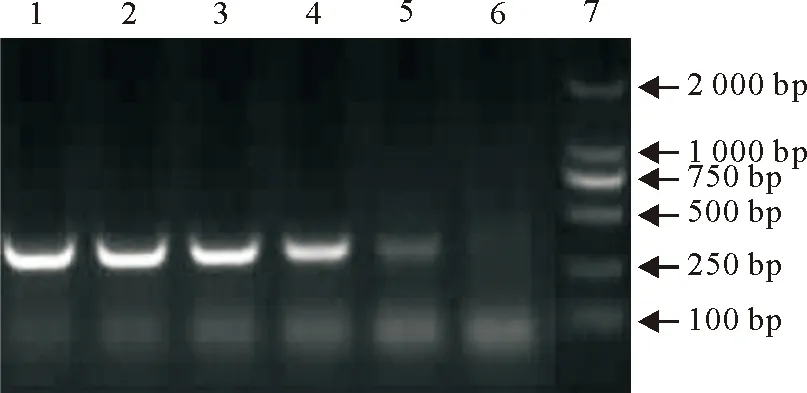
1.阳性对照;2~5.依次为1/2、1/4、1/16、1/32个血凝单位的H7N9;6.阴性对照;7.DNA标准 DL 2000
1.Positive control ;2-5.1/2,1/4,1/16,1/32HAU H7N9successively;6.Negative control;7.DNA Marker DL 2000
图1 禽流感病毒N9亚型RT-PCR灵敏度
Fig.1 RT-PCR sensitivity of avian influnza virus subtype N9
2.3 检测方法的敏感性
用建立的禽流感N9亚型检测方法检测禽流感病毒H7N9、H10N9两株病毒,结果两株病毒均呈阳性,表明该方法可检测多种N9亚型的禽流感病毒(图2)。
2.4 检测方法的特异性
用建立的禽流感病毒N9亚型RT-PCR检测灭
活的标准AIV毒株H1~H15亚型和N1~N9亚型、NDV、EDS-76、IBV、IBDV、MDV、鸭瘟弱毒疫苗株、鸭病毒性肝炎弱毒疫苗株,SPF鸡胚尿囊液、SPF鸡肌肉组织、SPF鸡脑组织、SPF鸡喉气管组织、SPF鸡喉气管拭子、SPF鸡泄殖腔拭子,检测结果均为阴性,建立的方法具有良好的特异性。
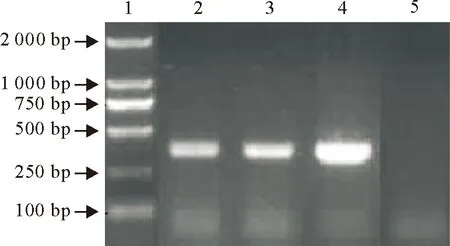
1.DNA 标准DL 2000;2.H7N9;3.H10N9;4.阳性对照;5.阴性对照
1.DNA Marker DL 2000;2.H7N9;3.H10N9;4.Positive control;5.Negative control
图2 禽流感病毒N9亚型RT-PCR敏感性
Fig.2 RT-PCR sensibility of avian influnza virus subtype N9
2.5 临床样品检测结果
用建立的检测方法对44份临床收集的疑似禽流感病毒病料进行检测,结果检出5份阳性样品(图3),经测序验证5份阳性样品的扩增产物均为禽流感N9亚型的基因片段。

1~22、25~46.临床样品; 23、47.阳性对照; 24、48.阴性对照;M.DNA 标准DL 2000
1-22,25-46.Clinical samples; 23,47.Positive control;24,48.Negative control; M.DNA Marker DL 2000
图3 部分禽流感病毒N9亚型RT-PCR临床样品检测结果
Fig.3 Detection results of avian influnza virus subtype N9in clinical samples by RT-PCR
3 讨论
2013年流行的禽流感病毒H7N9亚型病毒,NA蛋白上发生5个氨基酸的缺失,这样的缺失可改变病毒的嗜亲性,从而影响到病毒的复制能力[11]。新型H7N9病毒所表现出来的人类组织趋向性及引起人类严重的呼吸系统疾病的特征说明,病毒在引起人类大流行的进程中已经发生了关键性的变异[12],一旦人传人的传播途径得以实现,那么人类将面临极其严重的公共卫生问题[13-14]。
目前诊断禽流感N9亚型的常用方法主要为神经氨酸酶抑制试验,耗时、费力等存在诸多问题,严重影响了对这种疾病的有效控制,远远不能满足现代养禽业的发展。RT-PCR技术可从基因水平检测到病毒,具有灵敏性高、特异性强、操作简捷等特点,更适合实验室的快速检测与诊断。
本研究建立的禽流感病毒N9亚型的RT-PCR检测方法,采用柱式提取核酸[15],反转录和PCR扩增一步法检测,简便、快捷、减少污染机率。该检测方法是针对所有的N9亚型的保守区域设计的引物,可用于N9亚型的分型,与其他亚型没有交叉。与H7亚型的诊断试剂盒结合使用,可准确地检测到新型H7N9禽流感病毒。
[1] Gao R,Cao B,Hu Y,et al.Human infection with a novel avian-origin influenza A (H7N9) virus[J].N Engl J Med,2013,368(20):1888-1897.
[2] 朱闻裴,高荣宝,王大燕,等.H7亚型禽流感病毒概述[J].病毒学报,2013,29(3):245-249.
[3] 孙 阳,沈银忠,林 萍,等.新型禽流感:H7N9[J].检验医学,2013,28(9):739-744.
[4] Lu Jing,Wu Jie,Zeng Xianqiao,et al.Continuing reassortment leads to the genetic diversity of influenza virus H7N9N in Guangdong China[J].J Virol,2014,88(15): 8297-8306.
[5] 秦彦珉,梅树江,谢 旭,等.深圳市 19例人感染 H7N9禽流感确诊病例流行病学分析[J].中国公共卫生,2015,31(1):11-13.
[6] 郭晓兰,司露露,管大伟,等.两株人H7N9禽流感病毒的全基因组测序及分子特征分析[J].中山大学学报,2015,36(2):167-175.
[7] 唐国建,李国民,焦夕琴,等.疑似H7N9禽流感病毒感染患者流感病毒通用引物检测结果分析[J].检验医学与临床,2013,10(24):3359-3360.
[8] 翁育伟,张拥军,谢剑锋,等.福建省首例人感染H7N9禽流感病例实验室诊断和病毒序列分析[J].中国人兽共患病学报,2013(6):543-546.
[9] 陈永雪.基于禽中低致病性的H7N9禽流感模型的动力学性质[J].生物数学学报,2014,29(4):627-634.
[10] 中华人民共和国国家卫生和计划生育委员会.人感染H7N9禽流感诊疗方案(2版) [J].传染病信息,2013,26(2):65-67.
[11] Kageyama T,Fujisaki S,Takashita E,et al.Genetic analysis of novel avian A (H7N9) influenza viruses isolated from patients in China,February to april 2013[J].Euro Surveill,2013,18(15):20453-20467.
[12] 于玉凤,郭晓兰,王 颖,等.H7N9禽流感病毒对人类致病的分子基础分析[J].中山大学学报:医学科学版,2013,34(5):657-655.
[13] Chen Y,Liang W,Yang S,et al.Human infections with the emerging avian influenza A H7N9virus from wet market poultry: clinical analysis and characterisation of viral genome[J].Lancet,2013,381(9981):1916-1925.
[14] 张宏伟.H7N9禽流感的病毒特征及其对人类健康的潜在威胁[J].第二军医大学学报,2013,34(6):591-594.
[15] 张险朋,董 瑜,温贤诚,等.三种核酸提取方法检测禽流感病毒的比较[J].动物医学进展,2014,35(11):116-119.
Development of RT-PCR for Detection of Avian Influnza Virus Subtype N9
QIAO Ming-ming1,SUN Ming1,FENG Xiang-hui1,WANG Jing1,WANG Chuan-bing2,CAI Xue-peng2,CHEN Xi-zhao1,2
(1.BeijingAnhealAnimalAntiepidemicTechniqueLimitedCompany,HaidianDistrict,Beijing,100085,China;2.ChineseCenterforAnimalDiseaseControlandPrevention,ChaoyangDistrict,Beijing,100125,China)
To develop a RT-PCR kit for detection and identification of avian influnza virus subtype N9,a pairs of primes were designed for subtype N9avian influenza virus according to the sequences of high pathogenic avian influnza virus subtype N9in GenBank,after the optimization of reaction condition.The experiments about sensitivity,specificity were conducted.The RT-PCR method for detection of avian influnza virus subtype N9was established.Subtype H7N9and H10N9was positively while others were showed a negative result.The sensitivity of this method was 1/32hemagglutinin unit for subtype H7N9.The method is convenient,low cost and suitble for popularization and application.
Avian influenza virus;N9subtype;RT-PCR
2015-05-17
乔明明(1980-),女,山东烟台人,硕士,主要从事动物疫病诊断学研究。*通讯作者
S855.3
A
1007-5038(2016)01-0025-04
