大黄素治疗大鼠急性肝功能衰竭时核因子- B的动态变化
2016-12-21王凤玲
于 盈,王凤玲
(浙江省台州市立医院感染内科,浙江 台州 318000)
大黄素治疗大鼠急性肝功能衰竭时核因子- B的动态变化
于 盈,王凤玲
(浙江省台州市立医院感染内科,浙江 台州 318000)
目的 探讨大黄素治疗大鼠急性肝功能衰竭时大鼠肝脏中核因子- B(NF- B)的动态变化。方法 将SD大鼠随机分为健康对照组、肝衰竭模型组(ALF组)、大黄素治疗组。以 D-氨基半乳糖(D-Gal)建立大鼠急性肝功能衰竭模型,建模后12 h,大黄素治疗组腹腔注射10 mg/kg大黄素,2次/天。ALF组及大黄素治疗组分别在建模后24,72,120,168 h随机各取6只大鼠,取门静脉血查肝功能,10%甲醛液固定肝组织,免疫组化检测NF- B。结果 造模后24 h,大鼠血清丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)明显升高,且显著高于健康对照组(以72 h为著),差异有统计学意义(t=5.521,7.743,P<0.01);建模后72 h相同时点,ALF组大鼠肝功能指标均显著高于大黄素治疗组(P<0.01);建模后24 h,ALF组NF- B表达高于健康对照组(q=3.325,P<0.01),其表达72 h达高峰,120 h后逐渐下降;建模后72,120,168 h大黄素治疗组与 ALF组的NF- B表达水平比较,差异有统计学意义(q=5.638,5.527,5.314,P<0.01)。结论 大黄素对大鼠急性肝功能衰竭有保护作用,其机制可能与下调NF- B的表达有关。
肝功能衰竭;急性;大黄素;核因子- B;大鼠
肝功能衰竭是由多种因素引起的肝细胞合成、分泌及生物转化严重障碍临床综合征,患者以黄疸、肝性脑病、腹腔积液、凝血功能障碍等为主要临床表现。其包括急性、慢性和亚急性肝功能衰竭,其中急性肝功能衰竭(ALF)是由于肝脏功能急剧减退,导致以明显黄疸、凝血功能低下和肝性脑病为主要表现的综合征,是最严重的一种表现。ALF患者发病急,病情进展迅速,当前临床尚无特效治疗方法。大黄是临床使用较广泛的中药之一,其主要有效成分为大黄素,不少临床研究和试验研究发现,大黄素具有多种生物学作用,包括抗炎、肝功能保护、免疫调节等,也有不少学者采用大黄制剂防治肝癌、保护肝功能等[1-4]。细胞增殖S期会表达核因子-κB(NF-κB)蛋白,不少研究发现,NF-κB能参与细胞增殖过程,NF-κB的变化能直接反映细胞的增殖功能,因此可用来评价肝细胞的再生作用。本研究中拟通过建立ALF大鼠模型,采用大黄素干预,分析NF-κB变化,探讨大黄素对肝脏功能保护作用的可能机制。
1 材料与方法
1.1 仪器与试药、动物
1.1.1 仪器及试药
主要仪器包括全自动生化分析仪(济宁市润煤工矿物资有限公司)。主要试剂包括NF-κB一抗(广州泰诺迪生物科技有限公司);D-氨基半乳糖(D-Gal,重庆医科大学化学教研室);大黄素(广州泰诺迪生物科技有限公司,批号为110756-200110)。NF-κB免疫组化试剂盒(广州泰诺迪生物科技有限公司)。
1.1.2 试验动物及分组
研究符合动物试验伦理学原则。选取健康清洁级雄性SD大鼠(温州医学院实验动物中心,动物合格证编号为2010-04-12)54只,体质量180~220 g。按随机数字表法分成健康对照组(6只),肝功能衰竭模型组(ALF组,24只),大黄素治疗组(24只)。3组大鼠均给予相同喂养条件和饮食:温度18~26℃,相对湿度5% ~10%,噪声小于85 dB,每1 h通气换风8~12次,饲喂量5 g。术前12 h禁食,术前4 h禁饮。大黄素治疗组和ALF组分别于建模后24,72,120,168 h取6只大鼠,采集门静脉血标本,同时留取肝组织标本。
1.2 模型建立
准确称取 D-Gal 10 g,溶入0.9%氯化钠注射液100 mL中,采用1 mol/L NaOH调溶液pH至7.0,溶液最终浓度在10%。ALF组大鼠腹腔注射1.25 g/kg D-Gal溶液,健康对照组大鼠注射等量生理盐水。12 h后,大黄素治疗组大鼠腹腔注射 10 mg/kg大黄素,2次/天。健康对照组大鼠在给药24 h后留取静脉血,取肝组织。ALF组及大黄素治疗组分别在给药后24,72,120,168 h时取6只大鼠行腹腔麻醉,取静脉血,同时留取大鼠肝组织。静脉血离心取上清液,在-80℃冰箱保存;大鼠肝组织采用甲醛固定,行病理及免疫组化检测。
1.3 检测方法
全自动生化分析仪检测血清标本中肝功能指标变化,包括丙氨酸氨基转移酶(ALT)和天门冬酸氨基转移酶(AST)。甲醛固定肝组织,石蜡包埋切片,苏木素-伊红(HE)染色,在显微镜下观察肝组织病理学变化。
甲醛固定肝组织,脱水,检测NF-κB水平,严格按照试剂盒说明操作。采用苯基丁酸(PBA)为阴性对照,以出现棕黄色细胞核为阳性。采用Image-ProPlus 6.0图像分析,测量肝组织平均光密度 OD值,光密度OD=积分光密度(IODSUM)/组织面积(Area SUM)。
1.4 统计学处理
采用 Microsoft Excel软件建立数据库,SPSS 18.0软件进行统计学分析。多样本计量资料比较采用 SNK法,组内不同时间点比较采用 LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 ALT与AST水平
血清ALT和AST经方差齐性检验,组间两两比有显著性差异(F=36.28,P<0.01);建模24 h后,ALF组肝功能指标均显著上升,与对照组相比有显著性差异(t=5.521,7.743,P<0.01);建模后24 h,ALF组和大黄素治疗组血清ALT和AST等差异不明显,建模后72 h达高峰。此后,大黄素治疗组ALT和AST显著下降,相同时间点,显著低于ALF组(P<0.01)。ALF组和大黄素治疗组建模后120,168 h血清ALT和AST均持续下降。详见表1。
表1 各组大鼠不同时点肝功能变化(s,U/L,n=6)
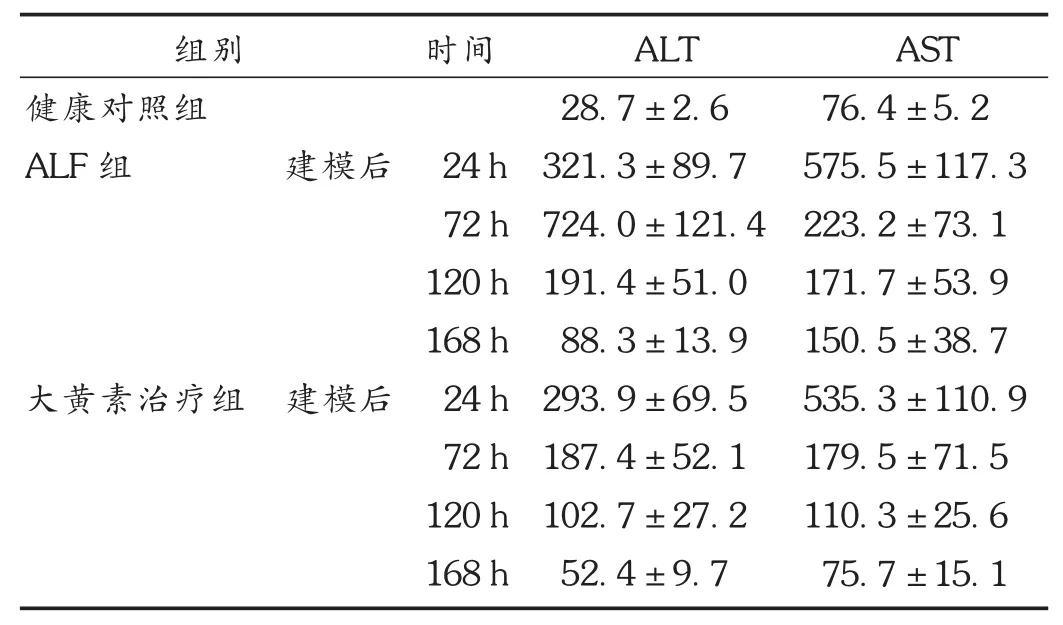
表1 各组大鼠不同时点肝功能变化(s,U/L,n=6)
注:与健康对照组比较, P<0.05;与 ALF组同时点比较,P<0.05。
组别 时间健康对照组ALF组 建模后 24 h 72 h 120 h 168 h大黄素治疗组 建模后 24 h 72 h 120 h 168 h ALT 28.7±2.6 321.3±89.7 724.0±121.4 191.4±51.0 88.3±13.9 293.9±69.5 187.4±52.1 102.7±27.2 52.4±9.7 AST 76.4±5.2 575.5±117.3 223.2±73.1 171.7±53.9 150.5±38.7 535.3±110.9 179.5±71.5 110.3±25.6 75.7±15.1
2.2 肝组织病理学改变
HE染色结果表明,健康对照组大鼠肝组织结构完整,能清晰看到肝索。注射 D-Gal后,ALF组大鼠肝组织染色显示,肝小叶结构破坏,肝细胞大面积坏死。见图1和图2。
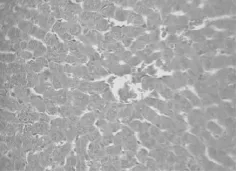
图1 健康对照组大鼠肝组织(HE染色,×400)
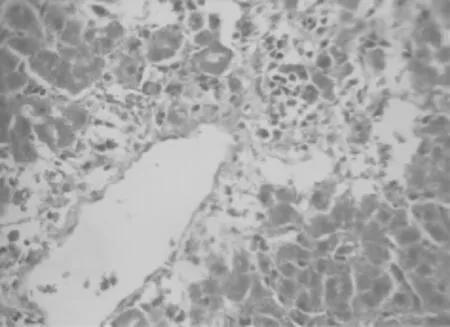
图2 ALF组大鼠肝组织(HE染色,×400)
2.3 肝组织NF- B的表达
健康对照组 NF-κB不表达或有少量表达,24 h后,ALF组 NF-κB水平显著高于健康对照组(q=3.325,P<0.01),ALF组和大黄素治疗组NF-κB均在72 h达到最高,随后开始缓慢下降。72 h开始至168 h,大黄素治疗组肝组织NF-κB表达较ALF组明显减少(q=5.638,5.527,5.314,P<0.01)。详见表2。
表2 各组大鼠不同时点肝组织内NF- B表达水平比较(s, g/mL,n=6)
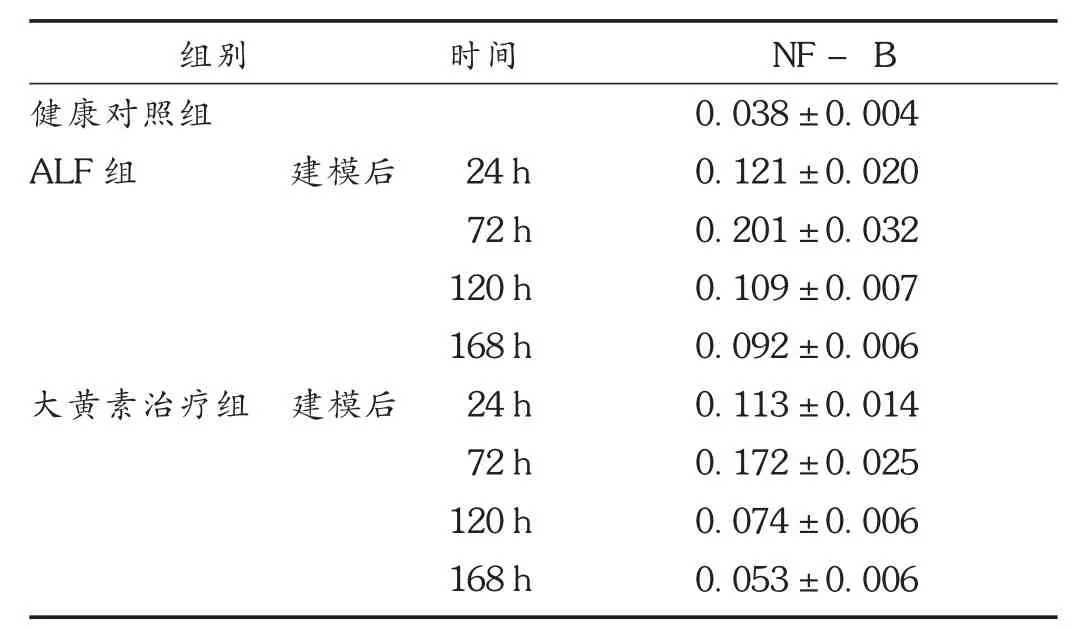
表2 各组大鼠不同时点肝组织内NF- B表达水平比较(s, g/mL,n=6)
注:与健康对照组相比, P<0.05;与 ALF组同时点比较,P<0.05。
组别 时间健康对照组ALF组 建模后 24 h 72 h 120 h 168 h大黄素治疗组 建模后 24 h 72 h 120 h 168 h NF- B 0.038±0.004 0.121±0.020 0.201±0.032 0.109±0.007 0.092±0.006 0.113±0.014 0.172±0.025 0.074±0.006 0.053±0.006
3 讨论
急性肝功能衰竭最突出的表现是短时间内肝细胞变性、坏死等,炎性因子显著增加,由于ALF病情进展快,存在多种并发症,临床治疗难度较大,而且预后极差,死亡率很高,其治疗是研究的难点和重点。肝移植治疗肝功能衰竭较有效,但临床应用中由于供体缺乏、费用昂贵,无法推广采用[5-6],故研究更加合理的中药治疗有重要现实意义。
大黄素是大黄主要有效成分之一,属于蒽醌类,又名朱砂莲甲素,提取出的大黄素常温下呈针状结晶状。近几年医学领域中对大黄素的研究较为广泛,当前的研究发现,大黄素具有多种生物学作用,包括肝细胞保护、抗炎、抗肿瘤作用等,有学者分析了大黄在急性胰腺炎中的应用,治疗前,两组患者淀粉酶、二胺氧化酶(DAO)等指标差异不明显,连续治疗1周,两组患者血淀粉酶、DAO等均显著下降,观察组血淀粉酶、DAO显著低于对照组(P<0.05),故认为大黄能抑制钠离子和钾离子,促进上皮细胞离子主动运转,具有广泛抗菌、抗病毒的效果[7]。大黄素对机体具有双重调节作用,既能抑制T淋巴细胞增殖,减小脓毒血症阳性率,减小炎性因子过度释放,又能抑制不同有丝分裂刺激脾细胞增殖。
本研究中建立了大鼠急性肝功能衰竭模型,同时在建模72 h后注射大黄素,结果大鼠血清ALT及AST水平显著下降,且与肝衰竭模型组比较,差异有统计学意义,说明大黄素对肝功能有一定保护作用。在以往的研究中发现,大黄素能抑制炎性因子作用,减少内毒素血症,同时在清除氧自由基、减少炎性递质方面也有明显作用[8]。其他研究中还发现,注射大黄素后,体内炎性因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1等的分泌显著减少,故认为大黄素能减少肝细胞凋亡,减轻炎性反应[9]。本试验中,大黄素的肝保护作用可能与上述机制有关。
NF-κB为反映肝细胞增殖的重要蛋白质,细胞DNA的合成与NF-κB密切相关[10]。NF-κB对启动细胞增殖有重要作用,其表达量能直接反映细胞增殖和复制活跃程度,已成为反映细胞增殖效应的重要指标[11-14]。
本研究中观察了NF-κB水平的变化,结果显示,随着时间的推移,肝衰竭模型组大鼠肝组织的NF-κB水平上升,在72 h达到最高峰,随后逐渐下降,而采用大黄素处理后,NF-κB则明显下降,且下降趋势一直持续到建模后168 h,这种变化趋势与肝衰竭模型组存在明显差异。说明大黄素不仅会对ALT和AST产生影响,还会影响NF-κB的表达。提示大黄素可能通过抑制炎症细胞分泌和聚集减少NF-κB表达,进而发挥抗细胞凋亡作用。
综上所述,本研究中通过建立肝衰竭大鼠模型,同时注射大黄素进行治疗,分析大黄素对肝细胞增殖的影响,发现大黄素可能减少炎性因子的释放,抑制IKK细胞信号传导通路,进而达到抑制肝细胞凋亡的效果,也能为肝细胞再生提供微环境,这可能是其治疗肝功能衰竭的机制,对大黄素今后的应用提供了理论基础。
[1]刘 岸,罗 江,张坚红,等.大黄素联合吉西他滨抑制体内外胰腺癌生长及其机制研究[J].中国中西医结合杂志,2012,32(5):652-656.
[2]董妙先,綦艳秋,朱兰芹,等.大黄素对肝纤维化大鼠肝脏组织中Ⅰ型前胶原mRNA表达的影响[J].齐齐哈尔医学院学报,2013,34(14):2 029-2 030.
[3]阮志燕,商 玲,邓向亮,等.大黄素对CT26结肠癌小鼠调节性 T细胞功能的影响[J].实用医学杂志,2014,30(15):2 377-2 380.
[4]Chen XH,Sun RS,Hu JM,et al.Inhibitory effect of emodinon bleomycin-induced pulmonaryfibrosisin mice[J].ClinExp Pharmacol Physiol,2009,36(2):146-153.
[5]Bernal W,Auzinger G,Dhawan A,et al.Acute liver failure[J].Lancet,2010,376(9 736):190-201.
[6]Lee WM.Acute liver failure[J].Semin Respir Crit Care Med,2012,33(1):36-45.
[7]张 扬,扈晓宇,骆建兴,等.清热化瘀中药对急性肝衰竭模型大鼠肝功能及生存期的影响[J].世界华人消化杂志,2012,20(21):1 961-1 966.
[8]Ha MK,Song YH,Jeong SJ,et al.Emodin inhibitsproinflammatory responses and inactivates histone deacetylase 1in hypoxic rheumatoid synoviocytes[J].Biol Pharm Bull,2011,34(9):1 432-1 437.
[9]Ding Y,Zhao L,Mei H,et al.Exploration of Emodin to treatalphanaphthylisothiocyanate-induced cholestatic hepatitis viaanti-inflammatory pathway[J].Eur J Pharmacol,2008,590(1-3):377-386.
[10]Celis JE,Madsen P,Celis A,et al.Cyclin(PCNA,auxiliaryprotein of DNA polymerase delta)is a central component ofthe pathway(s)leading to DNA replication and cell division[J].FEBS Lett,1987,220(1):1-7.
[11]Moldovan GL,Pfander B,Jentsch S.PCNA,the maestro ofthe replication forK[J].Cell,2007,129(4):665-679.
[12]Kang JS,Kang HG,Dark YI,et al.Expression ofepithelial cell adhesion molecule and proliferating cell nuclear antigen in diethylnitrosamine-induced hepatocarcinogenesis in mice[J].Exp Ther Med,2013,5(1):138-142.
[13]Li S,Zhong J,Yang Q,et al.Effect of seaweed pigmentglycoprotein on the expression of PCNA and Bcl-2 protein in hepatocarcinoma cells in mice[J].Journal of Hygiene Research,2011,40(2):220-222.
[14]Alenzi FQ,E-Nashar EM,A-Ghamdi SS,et al.Investigation of Bcl-2 and PCNA in Hepatocellular Carcinoma:Relation to Chronic HCV[J].Egypt Natl Canc Inst,2010,22(1):87-94.
Effects of Emodin on NF-κB in Rats with Acute Liver Failure
Yu Ying,Wang Fengling
(Department of Infectious Diseases,Taizhou Municipal Hospital,Taizhou,Zhejiang,China 318000)
Objective To explore the dynamic changes of NF-κB in the liver of rats treated with emodin in acute hepatic failure.M ethods SD rats were randomly divided into three groups:healthy control group,liver failure model group(ALF group),and emodin group.A rat model of acute liver failure was made by D-galactosamine(D-Gal).12 h after the model was established,the emodin group received intraperitoneal injection of 10 mg/kg emodin twice daily.At 24,72,120 and 168 h after modeling,6 rats were randomly selected from the ALF group and the emodin group.The hepatic function was examined by portal vein blood.Liver tissue was fixed with 10% formalin,and immunohistochemistry was used to detect NF-κB.Results After 24 h of modeling,the levels of alanine aminotransferase(ALT) and aspartate aminotransferase(AST) in serum were significantly higher than those in the healthy control group,the difference was statistically significant(t=5.521,7.743,P<0.01);after 72 h of modeling,the liver function of rats in ALF group was significantly higher than that of emodin group at the same time point(P<0.01);after 24 h of modeling,the expression of NF-κB in ALF group was significantly higher than that in healthy control group(q=3.325,P <0.01),and reached the peak at 72 h,and decreased after 120 h.There were significant differences in the expression of NF-κB between the emodin group and the Alf group(q=5.638,5.527,5.314,P<0.01)at 72,120 and 168 h after modeling.Conclusion Emodin has protective effect on acute liver failure in rats,and its mechanism may be related to the down-regulation of NF-κB expression.
liver function failure;acute;emodin;NF-κB;rats
2016-07-13;
2016-08-11)
浙江省中医药科学研究基金计划项目,项目编号:2010ZA118;浙江省台州市椒江区科技计划项目,项目编号:112070。
R285.5;R282.71
A
1006-4931(2016)22-0023-04
