不同饵料对方格星虫存活和生长的影响
2016-12-19李俊伟朱长波郭永坚颉晓勇陈素文张文文
李俊伟,朱长波,郭永坚,颉晓勇,陈素文,张文文
( 中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300 )
不同饵料对方格星虫存活和生长的影响
李俊伟,朱长波,郭永坚,颉晓勇,陈素文,张文文
( 中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300 )
在室内养殖箱中(31 cm × 20 cm × 30 cm)开展4种不同饵料对方格星虫生长和存活影响的研究。试验共分4个处理组,分别为配合饲料组、马尾藻组、发酵马尾藻组和附着物质组,各设5个重复。在每个养殖箱底部铺设相同厚度(10 cm)的细沙,投放5条方格星虫(0.95±0.13) g,养殖时间共60 d。试验结果显示,附着物质组中方格星虫的存活率和特定生长率最高(1.10%),显著高于其他 3组(P<0.05)。马尾藻组方格星虫的成活率显著高于配合饲料中组和发酵马尾藻组(P<0.05),但是其特定生长率较低。试验结束时,各处理组沉积物中氧化还原电位值均降低,且配合饲料组、马尾藻组和发酵马尾藻组显著低于附着物质组(P<0.05)。试验结果表明,采用配合饲料粉、马尾藻粉、发酵马尾藻粉直接饲喂方格星虫的生长效果较差,而附着物质有利于方格星虫的生长和存活。同时,附着物质的应用有利于保持沉积物氧化状态。因此,在方格星虫饵料中添加附着物质可以促进其生长,而在其饵料配制过程中大型藻粉、配合饲料粉的添加和加工方式仍需进一步开展研究。
方格星虫;饵料;存活率;生长
光裸方格星虫(Sipunculusnudus)属于星虫动物门,是一种营穴居生活的大型底栖动物,多栖息于沙质为主的滩涂区域,广泛分布于中国近海沿岸[1-3]。光裸方格星虫(方格星虫)具有重要的食用和药用价值[4-5],现代医学研究表明方格星虫含有多种活性物质,具有提高免疫力、抗疲劳及延缓衰老等效果[4-5],同时在其体内提取的多糖物质也表现出一定的抗菌作用[6]。方格星虫在生态系统中也具有较为重要的生态意义[7-10]。由于方格星虫摄食和利用表层沉积物中的营养物质,并将粪便排泄在洞穴深处,实现了将表层沉积物质向底层的搬运和封埋,属于下行搬运者[7,11]。星虫类动物对沉积物中有机质的摄食利用可以减少有机质在沉积物表层的积累,对改善沉积物的理化特征具有重要作用[12-14]。
近年来,方格星虫人工繁育的成功极大地促进其生物学研究[15-18]。在方格星虫培育阶段,单细胞藻类和表层沉积物是其主要的营养来源[19-20]。随着养殖规模和养殖密度的增加,培育饵料的产量限制了方格星虫的苗种产量和质量。目前,有关方格星虫稚幼虫阶段对饲料中糖、蛋白质、脂肪和微量元素需求方面的研究已经开展[2,21]。由于方格星虫的消化能力较弱,对于不同物质的消化和利用能力具有差异。因此,有必要针对适合方格星虫生长和利用的饵料来源开展研究。
本研究初步比较了配合饲料粉、马尾藻(Scagassum)粉、发酵马尾藻粉和附着物质对方格星虫的饲喂效果,旨在为中间培育阶段方格星虫营养需求研究和生产提供基础数据。
1 材料与方法
1.1 试验材料
养殖试验在室内养殖箱中进行,试验时间为60 d。试验共4个处理组,包括配合饲料组、马尾藻组、发酵马尾藻组以及附着物质组,每个处理组分别设5个重复。在养殖箱(31 cm×20 cm×30 cm)底部铺设相同厚度(10 cm)的细沙并注入等量海水,测定底质和水层中的初始氧化还原电位值。在每个养殖箱中放入5条方格星虫,体质量为(0.95±0.13) g。
配合饲料粉和马尾藻粉的粒径均小于0.28 mm,其有机质含量和蛋白质含量见表1。发酵马尾藻的配制:在3 g马尾藻粉中加入0.5 g芽孢杆菌(Bacillus)干粉(菌含量:10 ×108cfu/g)和0.5 g砂糖,溶于水后充气发酵24 h得到混合物质,用以饲喂发酵马尾藻组方格星虫;附着物质的获取:在池塘中放置波纹板培养附着藻类,5 d后将波纹板上的附着物质刷洗后饲喂附着物质组星虫,附着物质主要为硅藻类中的舟形藻(Navicula)和菱形藻(Nitzschia)。在投喂时,所有饵料均用200 mL水混匀后泼洒于养殖箱中。
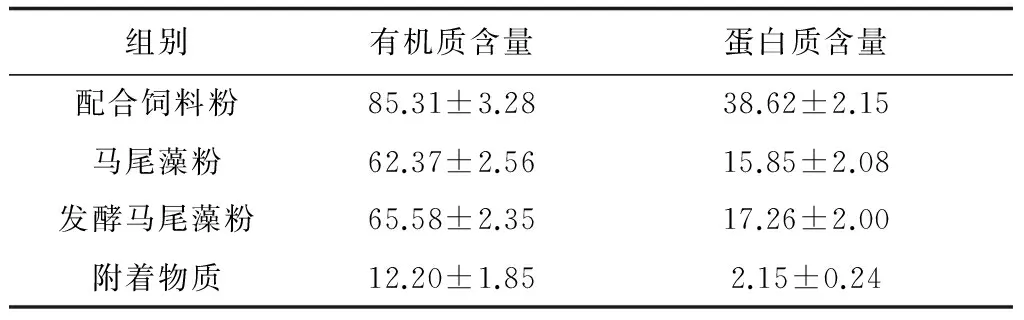
表1 不同饵料中有机质和蛋白质含量 %
1.2 日常管理
采用充气石进行连续充氧,养殖期间溶解氧质量浓度高于6 mg/L,养殖期间不换水。试验期间,各处理组投喂频率为1次/5 d ;配合饲料、马尾藻、发酵马尾藻组的每次投喂量为3 g,附着物质组每次投喂的附着物质干质量也为3 g。
1.3 样品的收集及测定
水体的温度、盐度、pH 以及溶解氧采用YSI (556,YSI Incorporated,Yellow Springs,OH,USA)进行现场测定。用氧化还原电位仪(SX-630,上海)测定试验初始和结束时水体和底质中的氧化还原电位值。
试验结束时,将方格星虫取出计数并称量质量。试验初始和结束时,将方格星虫放置4 h,以排出消化道内容物,再逐条擦干,称量质量。样品有机质含量采用马弗炉灼烧法(550 ℃)进行测定;样品中蛋白质含量采用考马斯亮蓝法测定。
1.4 计算公式
试验期间,对方格星虫的成活率和特定生长率进行计算和分析:
存活率/%=n1/n2×100%
特定生长率/%·d-1=(lnm2-lnm1)/t×100%
式中,n1和n2分别为试验初始和结束时养殖箱内方格星虫的数量(条);m1和m2分别为每个养殖箱中方格星虫的平均初始体质量和平均终末体质量(g);t为试验进行的时间(d)。
1.5 数据分析
采用SPSS 17.0进行数据统计和分析。百分数值均进行数据转换后进行方差分析。不同处理组间的数据差异采用One-way ANOVA 进行分析,显著度为P<0.05。
2 结 果
2.1 水质
养殖箱内的水温23~30 ℃,盐度29~31;pH 8.0~8.3,溶解氧>6.0 mg/L。
2.2 沉积物和水层中氧化还原电位变化
试验初期,4个处理组底质中氧化还原电位值为101~112 mV,处理组间无显著差异(P>0.05)。 试验结束时,4个处理组中仅有附着物质组的底质氧化程度较高,氧化还原电位值为46.4 mV,显著高于其他3组(P<0.05),其中发酵马尾藻组底质中氧化还原电位值接近-225 mV。4个处理组水层中的氧化还原电位值均为正值,其中马尾藻组和附着物质组显著高于其他两组(P<0.05)(图1)。
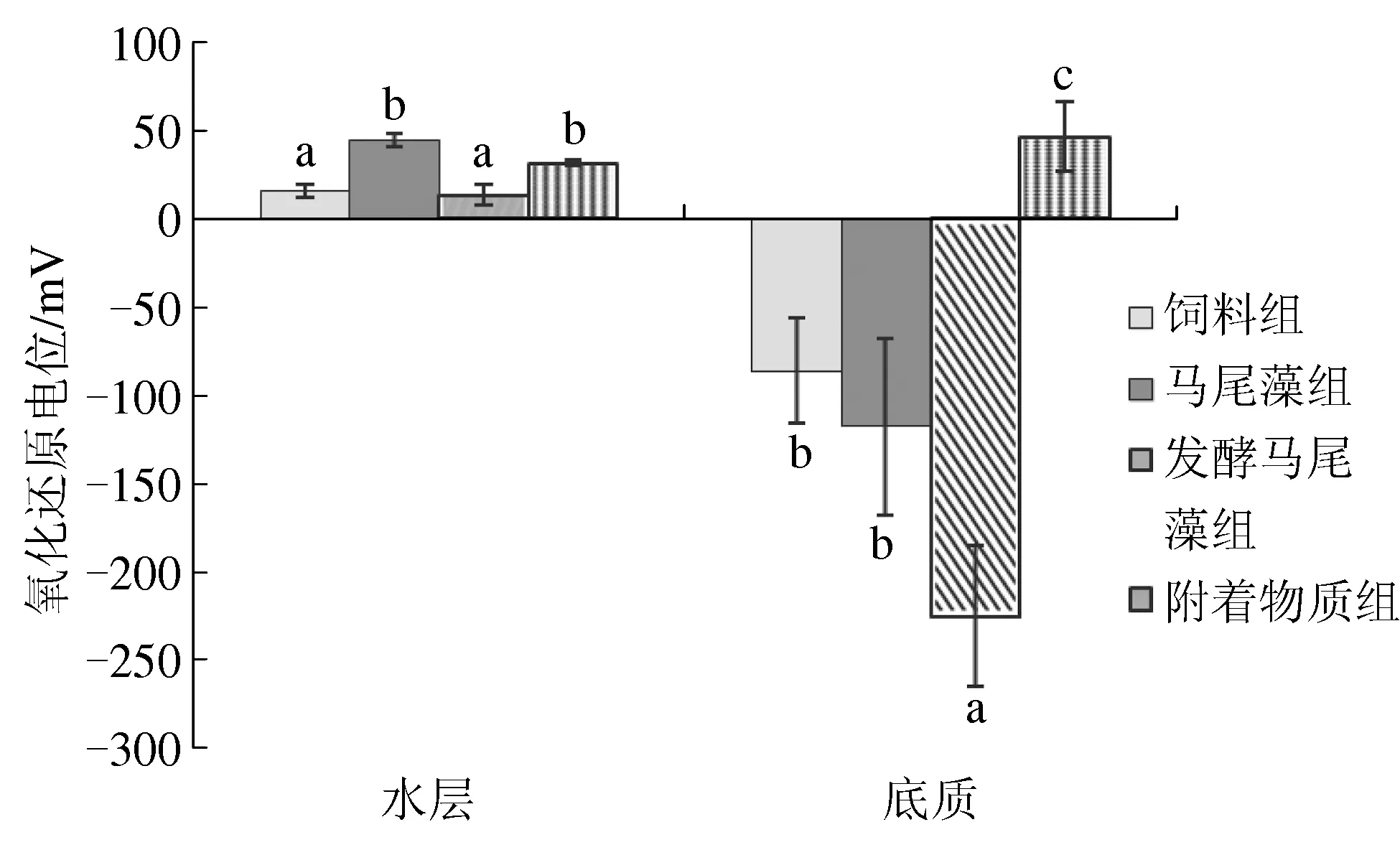
图1 试验结束时不同处理组水层和底质中的氧化还原电位值数据为平均值±标准差 (n=5).字母a和b表示不同处理组之间的数据差异显著(P<0.05).
2.3 方格星虫的存活与生长
试验结束时,不同处理组方格星虫表现出不同的成活率(图 2),配合饲料组、马尾藻组、发酵马尾藻组和附着物质组成活率分别为20%、88%、20%和90%,附着物质组和马尾藻组显著高于配合饲料组和发酵马尾藻组(P<0.05)。试验期间,仅有附着物质组方格星虫体质量明显增加,发酵马尾藻组质量增加不明显,其他两组(配合饲料组、马尾藻组)的方格星虫体质量均减少(表2)。
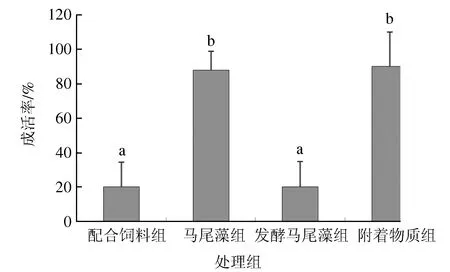
图2 试验结束时不同处理组中方格星虫的成活率数据为平均值±标准差 (n=5).字母a和b表示不同处理组之间的数据差异显著(P<0.05).
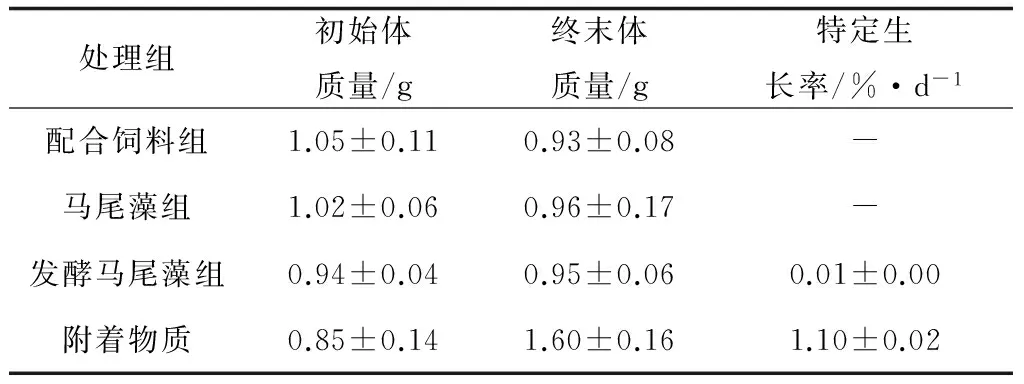
处理组初始体质量/g终末体质量/g特定生长率/%·d-1配合饲料组1.05±0.110.93±0.08-马尾藻组1.02±0.060.96±0.17-发酵马尾藻组0.94±0.040.95±0.060.01±0.00附着物质0.85±0.141.60±0.161.10±0.02
-表示该组方格星虫的特定生长率为负值.
2.4 底质中有机质含量变化
试验结束时,各处理组底质中有机质含量比初始有机质含量(0.75%)略有增加(图3)。发酵马尾藻组底质有机质含量增加幅度最大,其他3组有机质含量增幅相近,各处理组之间无显著差异(P>0.05)(图3)。
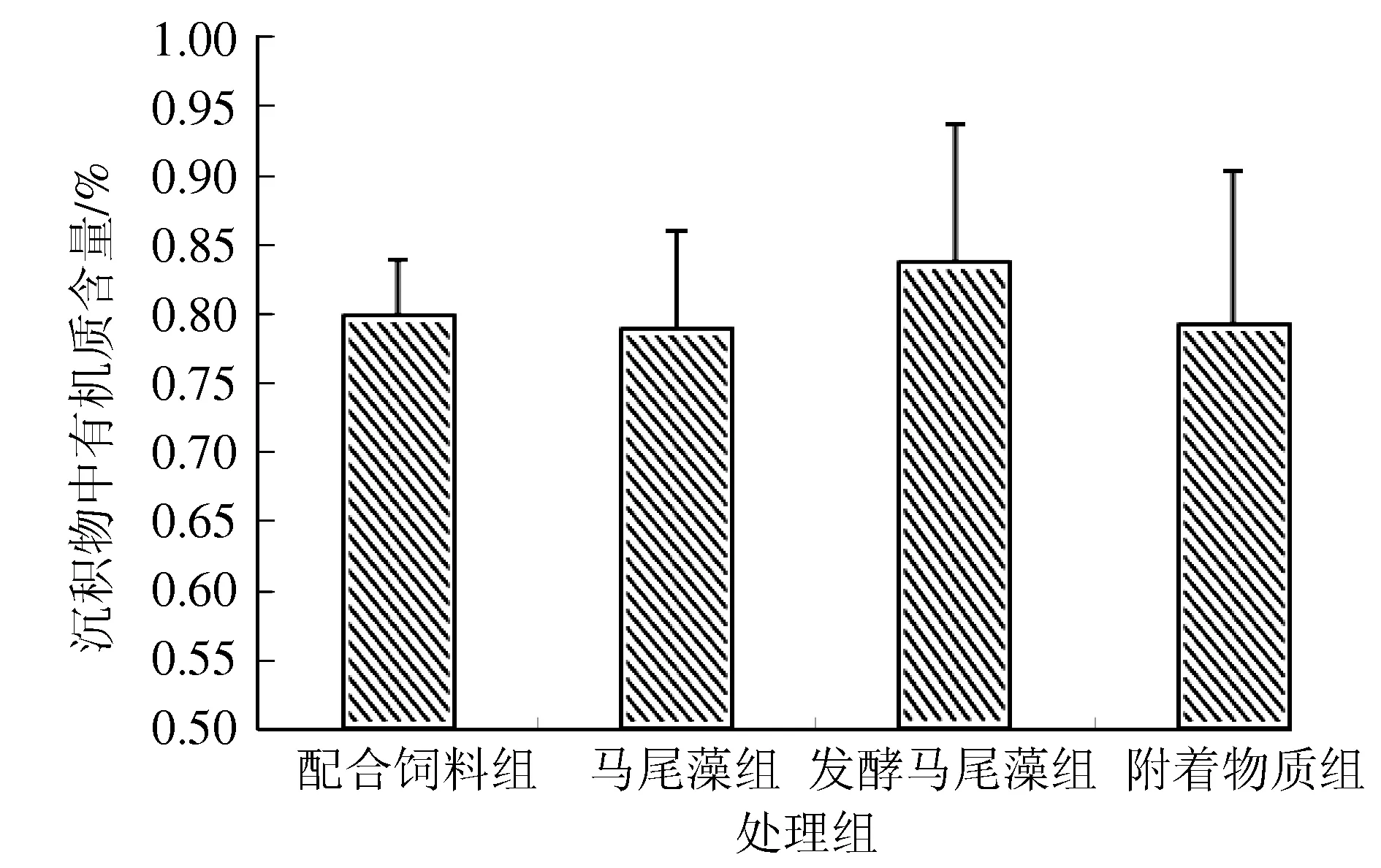
图3 试验结束底质中有机质含量数据为平均值±标准差 (n=5).
3 讨 论
3.1 方格星虫对饵料的摄食与利用
在自然界中,经过变态阶段的方格星虫可以通过翻吻结构摄取沉积物表层有机质,其中底栖硅藻、浮游生物沉降及细菌-有机质颗粒等是其营养物质的主要来源[19]。在人工培育过程中,方格星虫所栖息的沙层中有机质含量较低,缺乏适口饵料。仅投喂单胞藻类,易导致营养不平衡、营养供给量不足,从而造成星虫生长缓慢。因此,在方格星虫培育过程中需要投喂适宜的营养物质以促进其快速生长。
方格星虫作为底栖沉积食性动物,与刺参的摄食方式具有相似之处:通过吻部或触手结构摄取泥沙和有机质,对于食物的选择性较差[19,22]。研究发现,方格星虫和仿刺参(Apostichopusjaponicus)体内消化酶活性普遍低于鱼体内消化酶活性[15,23-26],这可能与星虫、仿刺参体内无专门消化腺有关;二者均具有较长的消化道,尤其方格星虫的双螺旋消化道结构为充分消化利用物质起到了重要作用。因此,提供利于消化吸收的营养物质更有利于方格星虫的生长。该研究中,通过4种不同来源的有机质对方格星虫存活和生长的影响,初步研究配合饲料粉、马尾藻粉、发酵马尾藻粉及附着物质在方格星虫培育过程中的应用价值。试验中附着物质组方格星虫表现出明显的生长优势,其特定生长率达到1.1%,显著高于其他三组(P<0.05)。与其他研究中的生长数据相比,附着物质组质量增加数的效果也较为明显[8]。配合饲料组方格星虫的成活率和生长均表现最差,表明方格星虫对于该配合饲料的吸收利用较差,其他研究也表明方格星虫对于鲻鱼(Mugilcephalus)残饵、粪便的生长利用率也较低[8]。因此,对于高蛋白配合饲料在方格星虫生长过程中的应用方式仍需深入研究。
大型藻类中的马尾藻通常被认为是沉积食性动物的主要选择,但是该研究中马尾藻粉对方格星虫生长的影响并未表现出预期效果(表 2)。研究表明沉积食性的仿刺参对褐藻的消化利用率较低,其主要原因是纤维素酶和褐藻酸酶活性较低[27],有学者认为,这两种消化酶是外源性酶,很可能是由外源食物携带的微生物产生[28-29]。本研究中方格星虫摄食马尾藻粉的生长效果不明显,可能与其体内相关的消化酶活性较低有关系。饲料原料经过微生物发酵处理后,由于一系列生物化学反应,一些大分子有机物会被降解为易消化吸收的小分子物质[30-31]。该试验中经芽孢杆菌发酵的马尾藻粉对方格星虫的促生长效果并不明显(表 2),仅能够维持方格星虫的正常代谢。由于试验中所用的马尾藻粉粒径小于0.224 mm,符合该生长阶段方格星虫摄食器官的摄取范围。因此,有关大型海藻粉作为方格星虫饵料的研究需要进一步深入开展。
3.2 方格星虫对底质的适应性
方格星虫对于还原性的底质具有较强的耐受能力[7],该研究中马尾藻组氧化还原电位值接近120 mV,而方格星虫存活率仍较高(88%)。其他数据表明,较低的氧化还原电位并非是影响其存活的关键因素。其他研究表明,沉积食性的底栖动物,如仿刺参对于附着物具有较高的消化和利用能力,主要原因可能是附着物中富含的硅藻和细菌是影响其肠道微生物功能的重要因素[28],硅藻和细菌对于动物的蛋白酶活性影响显著[32]。附着物质组中由于硅藻为其主要营养物质,而波纹板上的细菌可能通过方格星虫的摄食过程进入到其消化道中,对有机质起到分解作用,有利于星虫对营养物质的消化和吸收,其促生长效果仍需进一步研究。
4 结 论
该文研究了4种不同来源的有机质对方格星虫存活和生长的影响,研究发现高蛋白配合饲料粉、马尾藻粉、发酵马尾藻粉直接作为饵料对方格星虫的促生长效果不明显,其投喂方式和添加比例仍需进一步研究。池塘中培养的底栖硅藻等附着物质对于方格星虫的促生长效果明显,结果表明在池塘中悬挂附着板等结构以增加附着生物量,定期刷洗可以增加方格星虫的天然饵料,在提高方格星虫生长性能方面具有一定作用。
[1]李凤鲁,周红,王玮.中国沿海星虫动物门名录[J].青岛海洋大学学报,1992,22(2):72-88.
[2]张琴,许明珠,童潼,等.饲料中不同糖源对方格星虫稚虫日增重和消化酶的影响[J].南方水产科学,2014,10(1):21-26.
[3]李俊伟,朱长波,颉晓勇,等.方格星虫的繁育、养殖及研究开发进展[J].南方水产科学,2014,10(5):94-98.
[4]蒋定文,沈先荣,贾福星,等.海洋星虫提取物的营养分析及免疫调节作用的初步观察[J].中国生化药物杂志,2004,25(2):96-97.
[5]沈先荣,蒋定文,贾福星,等.方格星虫延缓衰老作用研究[J].中国海洋药物,2004,23(1):30-32.
[6]夏乾峰,谭河林,覃西,等.方格星虫多糖抗菌活性的初步研究[J].中国热带医学,2007,7(12):2192-2193.
[7]Li J W,Zhu C B,Guo Y J,et al.Experimental study of bioturbation bySipunculusnudusin a polyculture system[J].Aquaculture,2015(437):175-181.
[8]李俊伟,朱长波,郭永坚,等.光裸方格星虫生物扰动对混养系统沉积物及间隙水中营养物质的影响[J].渔业科学进展,2015,36(1):103-110.
[9]宋忠魁,刘婷,杨家林,等.广西沿海裸体方格星虫群体遗传多样性及遗传分化[J].水产科学,2011,30(12):749-753.
[10]申欣.星虫动物线粒体基因组全序列的基因排列和特征比较[J].水产科学,2012,31(9):554-559.
[11]孙刚,房岩.底栖动物的生物扰动效应[M].北京:科学出版社,2013:30-40.
[12]Shields M A,Kedra M.A deep burrowing sipunculan of ecological and geochemical importance[J].Deep Sea Research,2009,56(1):2057-2064.
[13]郑忠明.刺参养殖池塘沉积物-水界面营养盐通量的研究[D].青岛:中国海洋大学,2010:105-111.
[14]Wang F,Wang W X,Huang X P.Spatial distribution of gut juice extractable Cu,Pb and Zn in sediments from the Pearl River Estuary,Southern China[J].Marine Environmental Research,2012,77(6):112-119.
[15]张琴,许明珠,程光平,等.不同糖源对方格星虫稚虫生长、成活率及体组成的影响[J].渔业科学进展,2013,10(5):82-88.
[16]邹杰,彭慧婧,童潼,等.方格星虫亲体养殖与生殖细胞发育[J].水产科学,2011,30(8):467-470.
[17]邹杰,彭慧婧,童万平.方格星虫海区围网中间培育研究[J].水产科学,2013,32(4):197-200.
[18]刘旭佳,彭银辉,林景超,等.铜和镉对方格星虫的急性毒性研究[J].水产科学,2015,34(2):95-99.
[19]童潼,邹杰,蔡德建,等.方格星虫消化道发育与摄食研究[J].广西科学院学报,2011,27(3):218-220.
[20]蒋艳,蔡德建,邹杰,等.方格星虫苗种池塘中间培育试验研究[J].广西科学,2010,17(2):175-177.
[21]许明珠,张琴,童万平,等.饲料糖水平对方格星虫稚虫生长、体组成和消化酶活性的影响[J].动物营养学报,2013,25(3):534-542.
[22]汪洋,郑忠明,周朝生,等.南移刺参摄食三种沉积物饵料下的生长和能量收支比较[J].生态科学,2012,31(6):613-618.
[23]李芹,刁晓明.不同饵料对瓦氏黄颡鱼稚鱼生长和消化酶活性的影响[J].水生态学杂志,2009,2(1):98-102.
[24]袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612-615.
[25]张杏波,梁旭方,朱 滔,等.食性对草鱼消化道发育及三种消化酶活性的影响[J].水生生物学报,2012,36(3):569-572.
[26]阮国良,杨代勤,严安生.不同发育时期月鳢消化酶活性的研究[J].水生态学杂志,2010,3(1):93-97.
[27]唐黎,王吉桥,许重,等.不同发育期的幼体和不同规格刺参消化道中四种消化酶的活性[J].水产科学,2007,26(5):275-277.
[28]孙奕,陈玛.刺参体内外微生物组成及其生理特征的研究[J].海洋与湖沼,1989,20(4):300-307.
[29]王吉桥,蒋湘辉,赵丽娟,等.不同饲料蛋白源对仿刺参幼参生长的影响[J].饲料博览,2007,19(10):9-13.
[30]Ramachandran S,Bairagi A,Ray A K.Improvement of nutritive value of grass pea(Lathyrussativus) seed meal in the formulated diets for rohu,Labeorohita(Hamilton) fingerlings after fermentation with a fish gut bacterium[J].Bioresource Technology,2005,96(13):1465-1472.
[31]姜燕.刺参发酵饲料的制作工艺与应用效果研究[D].青岛:中国海洋大学,2014:13-20.
[32]史策.鲜活菱形筒柱藻(硅藻)对刺参饵料效果的研究[D].青岛:中国海洋大学,2014:52-65.
EffectsofDietTypesonSurvivalandGrowthofSipunculaSipunculusnudus
LI Junwei,ZHU Changbo,GUO Yongjian,XIE Xiaoyong,CHEN Suwen,ZHANG Wenwen
( Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization,Ministry of Agriculture,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China )
SipunculaSipunculusnuduswith body weight of (0.95±0.13) g was reared in tanks of each 31 cm × 20 cm × 30 cm with 10 cm depth fine sand bottom at a density of five individuals per tank,and fed shrimp formula feed (SD),gulfweed (Sargassumsp)diet (GD),and fermentation gulfweed diet (FD) and attachments containing diatom (DD) for 60 d with five duplication to study the effect of four diets on growth and survival of sipuncula.The maximal survival rate and the best growth (1.10%/d) were observed in the sipuncula in group DD,significantly higher than those in the other treatments (P<0.05).There was significantly higher survival rate in groups GD,SD,and FD than in groups SD and DD (P<0.05),with poor growth in group GD.At end of the experiment, redox potential Eh of the sediment was significantly lower in group GD than that in group SD (P<0.05).These findings indicated that the poor growth was found in the sipuncula fed shrimp formula feed, gulfweed diet and fermentation gulfweed diet,and that good growth and higher survival in the sipuncula fed the attachments containing diatom which was conducive to maintaining sediment oxidation state.It is needed to further research for supplementation and processing of macroalga powder in sipuncula feed.
Sipunculusnudus;diet;survival rate;growth
S968.9
A
1003-1111(2016)01-0027-05
10.16378/j.cnki.1003-1111.2016.01.005
2015-05-07;
2015-08-31.
广东省自然科学基金资助项目(2015A030310260);中央级公益性科研院所基本科研业务费专项资金资助项目(2014TS03; 2014ZD01).
李俊伟(1982-),男,助理研究员,博士;研究方向:水产养殖生态与技术.E-mail: lijunwei303@163.com.通讯作者: 颉晓勇(1976-),男,副研究员,博士;研究方向; 水产养殖.xiexiaoyongsh@sina.com
