四种因子对仿刺参幼参生长的影响
2016-12-19李石磊木云雷滕炜鸣付成东刘项峰于佐安王庆志
李石磊,木云雷,滕炜鸣,付成东,刘项峰,于佐安,张 明,王庆志,陈 远
( 辽宁省海洋水产科学研究院,辽宁省应用海洋生物技术开放试验室,辽宁 大连 116023 )
四种因子对仿刺参幼参生长的影响
李石磊,木云雷,滕炜鸣,付成东,刘项峰,于佐安,张 明,王庆志,陈 远
( 辽宁省海洋水产科学研究院,辽宁省应用海洋生物技术开放试验室,辽宁 大连 116023 )
以益生菌、水温、寡糖和配合饲料为因素,仿刺参幼参的特定生长率为指标,通过L9(34)正交试验方法,研究4种因子对仿刺参幼参生长的影响,获得各因子的最佳组合参数。试验结果显示,4种因子对幼参特定生长率的影响均极显著(P<0.01),影响因素为益生菌>水温>寡糖>配合饲料。最佳的因素搭配为益生菌5 mL/m3,水温24 ℃,壳寡糖+褐藻胶寡糖混合0.002 g/L,幼参B型配合饲料。各因素水平对仿刺参幼参特定生长率影响为益生菌5 mL/m3>15 mL/m3>10 mL/m3,水温24 ℃>17 ℃>10 ℃,壳寡糖+褐藻胶寡糖>褐藻胶寡糖>壳寡糖,幼参饲料B型>幼参饲料加强型>稚参饲料。
仿刺参;特定生长率;益生菌;寡糖;正交设计
仿刺参(Apostichopusjaponicus)又称刺参,属于棘皮动物门、海参纲、楯手目、刺参科、仿刺参属[1]。海产八珍之一,富含蛋白质、黏多糖、维生素、氨基酸、海参皂苷以及多种微量元素和众多生理活性物质,具有极高的营养和药用价值。刺参产业发展迅速,总产量10年间增加了27倍[2],养殖的过速发展及集约化养殖模式下的不规范运作导致该产业存在较多问题。如各阶段饵料营养配比不尽合理,化学药品和抗生素的过量滥用造成环境污染,导致食品安全隐患,严重影响了该产业的持续稳定发展。
温度是影响仿刺参生长的重要因子之一,过高或过低的水温均会抑制仿刺参的生长。适温范围内,随着水温的升高,仿刺参的呼吸和基础代谢水平增加,而当温度继续升高超出适温范围时,仿刺参的呼吸代谢率又开始减慢,降低能量和物质的消耗,进入夏眠状态[3-4]。水温过低时,仿刺参会进入冬季半休眠状态。不同规格的仿刺参对温度的适应能力不同,小规格仿刺参的夏眠临界温度高于大中规格[5]。益生菌可以调整微生态失调,保持生态平衡,提高水产养殖动物的健康水平,以达到防病、治病的效果。益生菌作为一种新型的抗生素替代品以其安全、环保等特点被广泛应用在水产养殖当中。益生菌对仿刺参的养殖水体具有良好的改善作用[6-7],可有效地提高幼参消化功能和非特异性免疫能力[8-9],促进仿刺参的生长[10-11]。寡糖,又称低聚糖,是指2~10个单糖通过糖苷键连接而成的直链或支链的一类糖。寡糖可改善水产动物肠道内的微生态环境,能够提高水产动物免疫相关酶的活性,提高机体的免疫功能,增强其抵抗疾病的能力,是一类稳定、安全和环保的抗生素替代物。近年来的研究表明,通过注射卡拉胶寡糖可以增强仿刺参免疫活性[12],饲料中添加壳寡糖,对仿刺参的生长和抵抗灿烂弧菌(Vibriasplendidus)的能力有一定的促进作用[13],饲料中添加半乳甘露寡糖不仅可以提高仿刺参免疫力,并且可以提高特定生长率,并改善体壁氨基酸组成[14]。仿刺参幼参苗种的室内养殖需要投喂一定比例的人工配合饲料,饲料的质量是关系刺参生长和水体环境的重要因素,不同原料成分和配比的配合饲料对仿刺参生长的影响也有所不同。我国学者在仿刺参饲料的蛋白和脂肪需求量、不同蛋白来源组成、饲料添加剂等方面做过大量的研究[15-18]。研究表明,仿刺参稚参在粗蛋白水平为18.21%~24.18%、粗脂肪为5%时,获得最大生长;投喂植物性为主的饲料时,仿刺参的营养价值较高;饲料中添加甘草酸、硒酵母和维生素E对仿刺参的特定生长率均有显著的影响。
本试验主要针对仿刺参幼参培育阶段,利用正交设计方法,探讨温度、益生菌、寡糖、配合饲料4种因子对仿刺参幼参生长的影响,获得上述各因子的最佳组合参数,为安全健康的仿刺参养殖模式构建提供可靠的基础数据。
1 材料与方法
1.1 益生菌、寡糖和配合饲料
试验用益生菌为工大3号,由大连工业大学生物技术实验室提供。主要成分为该实验室前期筛选得到的菌株芽孢杆菌(Bacillus)2株、乳酸杆菌(Lactobacillus)2株及实验室保藏的酵母菌和乳酸菌,6株菌进行混合培养,混合培养的活菌数达1.0×108cfu/mL;壳寡糖和褐藻胶寡糖由大连化学物理研究所提供;配合饲料分为幼参B型,幼参加强型,稚参类3种,由大连海洋大学提供。
1.2 试验方法
幼参购自大连水益生海洋生物科技有限公司,个体湿质量(1.52±0.34) g,试验采用L9(34)正交试验设计,设4个因素3个水平(表1),各组因素水平正交设计见表2。试验采用9个1.6 m3水槽,每个水槽内悬挂3个聚乙烯网片制作成的网箱作为平行组,网箱口高于水面以防幼参爬出,网箱内放上与箱底大小相当的黑色波纹板一块,板上钻有直径2 cm的小孔5~7个,便于幼参附着摄食和饵料投喂,利用控温设备使各组水温变化幅度保持±0.5 ℃。每个网箱内放置幼参30头,试验开始前饥饿48 h,用分析天平逐个测量全部幼参个体湿质量,试验期间每日16:00投喂配合饵料,投喂量为幼参体质量的10%,益生菌和寡糖每5 d投放一次,每次的投放量为寡糖2 mg/L,寡糖混合组为壳寡糖+褐藻胶寡糖各1 mg/L。每10 d换水一次。62 d后试验结束,饥饿48 h,用分析天平逐个测量全部幼参个体湿质量。计算各网箱幼参特定生长率:
特定生长率/%·d-1=(lnmt-lnm0)/t×100%
式中,m0为幼参个体平均初质量(g),mt为幼参个体平均末质量(g),t为试验天数(d)。
正交试验设计及试验数据方差分析处理均使用SPSS 16.0软件。

表1 因素水平
2 试验结果
2.1 各组幼参生长结果
试验结果表明,第7组的幼参特定生长率值最高,其次是第4组,然后是第9组, 24 ℃下,3组幼参的特定生长率平均值要高于17 ℃和10 ℃组, 17 ℃下,3组的特定生长率平均值高于10 ℃(表2)。在试验阶段,幼参的特定生长率值随着水温的升高而变大。

表2 各组试验幼参特定生长率
2.2 正交方差分析
将幼参特定生长率取反正弦值,通过SPSS 16.0软件进行方差分析,结果见表3。4种因素对幼参特定生长率的影响均极显著(P<0.01),水温和益生菌(P=0.000)较寡糖(P=0.006)和配合饲料(P=0.008)对幼参特定生长率有更大的影响,益生菌的平方和大于水温的平方和,故益生菌对幼参特定生长率的影响大于水温。影响因素的顺序为益生菌、水温、寡糖和配合饲料。

表3 方差分析
2.3 水温对幼参特定生长率的影响
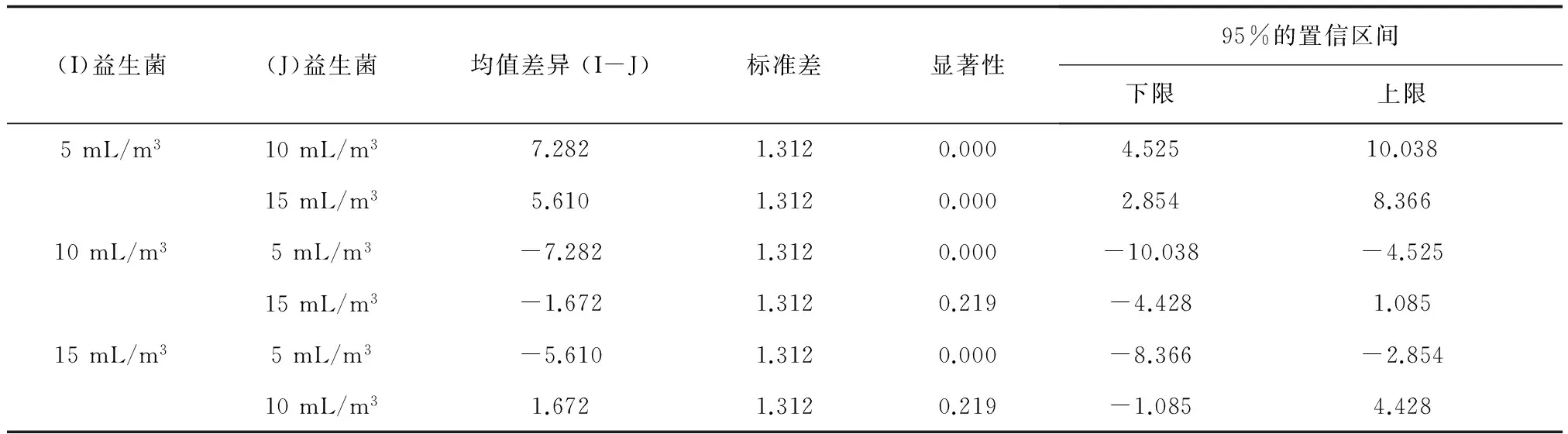
水温对幼参的特定生长率,24 ℃均值最大(32.324) ̄(表4),且24 ℃>17 ℃>10 ℃(表4);由水温配对比较(表5)可见,24 ℃与10 ℃及17 ℃的幼参特定生长率差异极显著(P<0.01),10 ℃和17 ℃的幼参特定生长率差异显著(0.01 表4 水温单因素统计量 表5 水温的配对比较 益生菌对幼参特定生长率,5 mL/m3试验组均值最大(32.900)(表6),且5 mL/m3>15 mL/m3>10 mL/m3;由益生菌配对比较(表7)可见,5 mL/m3试验组与10 mL/m3、15 mL/m3试验组的幼参特定生长率差异极显著(P<0.01),10 mL/m3和15 mL/m3试验组的幼参特定生长率差异不显著(P>0.05)。 表6 益生菌单因素统计量 表7 益生菌的配对比较 壳寡糖+褐藻胶寡糖的幼参特定生长率,均值最大(30.468),且壳寡糖+褐藻胶寡糖>褐藻胶寡糖>壳寡糖(表8);壳寡糖与褐藻胶寡糖差异显著(0.01 表8 寡糖单因素统计量 表9 寡糖的配对比较 配合饲料对幼参生长率,幼参B型均值最大(30.96),且幼参B型>幼参加强型>稚参类(表10);由配合饲料配对比较(表9)可见,稚参类与幼参B型差异极显著(P<0.01),稚参类和幼参加强型差异不显著(P>0.05),幼参B型和幼参加强型差异不显著(P>0.05)。 表10 配合饲料单因素统计量 表11 配合饲料配对比较表 综合以上正交试验数据的方差分析结果可知,各因素水平对幼参特定生长率影响的强弱顺序为:益生菌5、15、10 mL/m3,水温24、17、10 ℃,壳寡糖+褐藻胶寡糖>褐藻胶寡糖>壳寡糖,幼参B型>幼参加强型>稚参类。4种因素对幼参特定生长率的影响均极显著(P<0.01),影响因素的顺序为益生菌>水温>寡糖>配合饲料。因此可以确定最佳的因素搭配为益生菌5 mL/m3,水温24 ℃,壳寡糖+褐藻胶寡糖2 mg/L,幼参B型。这与本次试验的结果位次相同。 不同规格的仿刺参对温度的适应能力也不尽相同。Yang等[12]采用质量20~134 g的仿刺参进行研究,认为最佳生长温度为10~20 ℃;Dong[13]采用9~10 g的仿刺参进行研究,认为在12~18 ℃,仿刺参幼参的生长速度随着温度的升高而增加,但过高的温度会导致生长速度下降,仿刺参幼参的适温为12~21 ℃,最适生长水温为16~18 ℃[14]。本试验中生长率最高的组别温度为24 ℃,仿刺参体质量为(1.52±0.34) g,推测这可能是由于本次试验所用仿刺参规格不同于以上研究所导致。夏季仿刺参幼参室内保苗处于高水温期,本试验所选用24 ℃水温也是从现实角度考虑,试验结果对生产具有一定的指导作用。 根据微生态制剂的物质组成,可将其划分为益生菌、益生元和合生元。目前水产中常用的益生菌种类包括弧菌属(Vibrio)、芽孢杆菌属、酵母菌属(Saccharomyces)及乳酸菌属一些种类。益生元指一些非消化性食物成分,最早发现的益生元是双歧因子,后来发现多种不能消化的寡糖可作为益生元。合生元为益生菌和益生元结合的生物制剂,其特点是同时发挥益生菌和益生元的作用。 有研究表明,在仿刺参养殖中投喂益生菌,可以有效的改善水质,同时益生菌本身含有大量的营养物质,为机体提供营养[19],通过竞争、抑制和排斥作用,帮助建立和维持正常的水产动物肠道优势种群,提高无脊椎动物体液因子中的酶活力,增强免疫力和抗病性。益生菌可以减少机体皮质醇的分泌和热休克蛋白的表达,提高水产动物应激条件下的耐受力[20-21]。在海参养殖中添加益生菌,可以有效促进刺参的生长,如袁成玉等[7]使用光合细菌和芽孢杆菌投喂幼参能明显促进幼参生长;周慧慧等[8]采用分离自刺参肠道的益生菌投喂稚参,显著提高了稚参的成活率和生长率。也有学者对益生元在仿刺参养殖中的作用进行了研究,韩丽蓉等[10]进行了壳寡糖对仿刺参生长、免疫反应和抗病力的影响研究,结果表明饲料中添加壳寡糖对仿刺参的生长有一定程度的促进作用,能提高机体免疫反应,并在一定程度上增强仿刺参抗病力。王际英等[11]研究发现,以饲料添加剂的形式在仿刺参配合饲料中添加适量的半乳甘露寡糖不仅可以提高其特定生长率,改善体壁营养组成,还可以提高仿刺参机体免疫力,在 0.2%添加量即可起到促进生长、提高免疫力的作用,当添加量高于1.2%时,降低了仿刺参的生长性能及相关免疫酶活性。益生菌和益生元在水产动物养殖中的相互作用是研究的热点问题之一。Zhang等[22]研究发现,果糖和地衣芽孢杆菌(B.licheniformis)可以显著的提高三角鲂(Megalobramaterminalis)免疫力和抗氧活能力,混合投喂的效果好于单独投喂。Lin等[23]研究表明壳寡糖和凝结芽孢杆菌(B.coagulans)提高锦鲤(Cyprinuscarpio)的免疫力和抗病力。Ai等[24]研究发现枯草芽孢杆菌(B.subtilis)可以促进大黄鱼(Larimichthyscrocea)生长,增强免疫力,但单独使用低聚果糖以及二者混合使用效果不明显。Daniels等[25]研究发现,饲料中补充益生菌、益生元和合生元,可以改善欧洲龙虾(Homarusgammarus)幼虫的生长和存活率,芽孢杆菌能大幅度提高幼虫的抗逆性。在海参饲料中添加枯草芽孢杆菌和果聚糖,枯草芽孢杆菌和果聚糖可协同作用,有效提高仿刺参免疫力,改善抗病力[26]。在本试验中所用的益生菌为芽孢杆菌、乳酸菌及酵母菌混合菌类,试验尝试了不同投喂剂量的益生菌和不同种类寡糖的配比组合,结果表明,5 mL/m3的益生菌与0.002 g/L的褐藻胶寡糖+壳寡糖混合搭配投喂条件下,仿刺参幼参的生长速度最快,而这种搭配组合对仿刺参幼参的免疫指标的影响及其作用机理还需进一步研究。 4种因素对仿刺参幼参的生长均具有极显著影响,其影响效果依次为益生菌>水温>寡糖>配合饲料。最佳的投喂组合为即益生菌5 mL/m3,水温24 ℃,壳寡糖+褐藻胶寡糖2×10-6mg/L,幼参B型。本次试验通过正交设计试验研究了水温、复合益生菌、寡糖和配合饲料4种因素对仿刺参幼参生长的影响,找到了仿刺参幼参保苗阶段各因素的最佳配比组合,为安全健康的仿刺参保苗新模式的构建提供基础数据。 致谢: 感谢大连工业大学肖珊老师、大连化学物理研究所许青松副研究员和大连海洋大学任同军老师提供的益生菌、寡糖和配合饲料。 [1]廖玉林.中国动物志-棘皮动物门-海参纲[M].北京:科学出版社,1997:53-64. [2]杨红生.刺参生物学-理论与实践[M].北京:科学出版社,2014. [3]Dong Y,Dong S,Tian X,et al.Effects of diel temperature fluctuations on growth,oxygen consumption and proximate body composition in the sea cucumberApostichopusjaponicusSelenka[J].Aquaculture,2006(255):514-521. [4]An Z,Dong Y,Dong S.Temperature effects on growth-ration relationships of juvenile sea cucumberApostichopusjaponicus(Selenka)[J].Aquaculture,2007(272):644-648. [5]Yang H,Yuan X,Zhou Y,et al.Effects of body size and water temperature on food consumption and growth in the sea cucumberApostichopusjaponicus(Selenka) with special reference to aestivation[J].Aquaculture Research,2005,36(11):1085-1092. [6]武鹏,赵大千,蔡欢欢,等.3种微生态制剂对水质及刺参幼参生长的影响[J].大连海洋大学学报,2013,28(1):21-26. [7]赵留群,肖珊,刘彤,等.3种微生态制剂对幼刺参养殖水体水质的影响[J].大连工业大学学报,2014,33(6):391-394. [8]田相利,赵坤,王军,等.泼洒和投喂芽孢杆菌对刺参生长以及消化和免疫相关酶活性的影响[J].中国海洋大学学报:自然科学版,2015,45(1):18-25. [9]李丽丽,关晓燕,顾英,等.芽孢杆菌B4对刺参肠道免疫酶及消化酶的影响[J].饲料研究,2015(3):58-61. [10]袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612-615. [11]周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对稚参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):775-783. [12]马悦欣,许珂,王银华,等.κ-卡拉胶寡糖对仿刺参溶菌酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].大连海洋大学学报,2010,25(3):224-227. [13]韩丽蓉,徐玮,汪东风,等.壳寡糖对刺参生长、免疫反应和抗病力的影响[J].中国海洋大学学报:自然科学版,2014,44(3):34-39. [14]王际英,宋志东,李培玉,等.饲料添加半乳甘露寡糖对刺参幼参生长、体壁营养组成及免疫力的影响[J].中国水产科学,2014,20(2):310-319. [15]朱伟,麦康森,张百刚,等.刺参稚参对蛋白质和脂肪需求量的初步研究[J].海洋科学,2005,29(3):54-58. [16]王吉桥,蒋湘辉,赵丽娟,等.不同饲料蛋白源对仿刺参幼参生长的影响[J].饲料博览,2007(10):9-13. [17]陈效儒,张文兵,麦康森,等.饲料中添加甘草酸对刺参生长、免疫及抗病力的影响[J].水生生物学报,2010,34(4):731-738. [18]张琴,麦康森,张文兵,等.饲料中添加硒酵母和维生素E对刺参生长、免疫力及抗病力的影响[J].动物营养学报,2011,23(10):1745-1755. [19]Tinh N T N,Phuoc N N,Dierckens K,et al.Gnotobiotically grown rotiferBrachionusplicatilissensu strictu as a tool for evaluation of microbial functions and nutritional value of different food types[J].Aquaculture,2006,253(1/4):421-432. [20]Avella M A,Gioacchini G,Decamp O,et al.Application of multi-species ofBacillusin sea bream larviculture[J].Aquaculture,2010,305(1/4):12-19. [21]Rollo A,Sulpizio R,Nardi M,et al.Live microbial feed supplement in aquaculture for improvement of stress tolerance[J].Fish Physiology & Biochemistry,2006,32(2):167-177. [22]Zhang C N.Combined effects of dietary fructooligosaccharide andBacilluslicheniformison innate immunity,antioxidant capability and disease resistance of triangular bream (Megalobramaterminalis)[J].Fish & Shellfish Immunology,2013,35(5):1380-1386. [23]Lin S,Mao S,Guan Y,et al.Effects of dietary chitosan oligosaccharides andBacilluscoagulanson the growth, innate immunity and resistance of koi (Cyprinuscarpiokoi)[J].Aquaculture,2012(342):36-41. [24]Ai Q,Xu H,Mai K,et al.Effects of dietary supplementation ofBacillussubtilisand fructooligosaccharide on growth performance,survival,non-specific immune response and disease resistance of juvenile large yellow croaker,Larimichthyscrocea[J].Aquaculture,2011,317(1):155-161. [25]Daniels C L,Merrifield D L,Einar Ringø,et al.Probiotic,prebiotic and synbiotic applications for the improvement of larval European lobster (Homarusgammarus) culture[J].Aquaculture,2013,416(2):396-406. [26]Zhang Q.Interaction of dietaryBacillussubtilisand fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopusjaponicus[J].Fish & Shellfish Immunology,2010,29(2):204-211. EffectsofProbiotics,Temperature,Oligosaccharide,andFormulatedFeedonGrowthinJuvenileSeaCucumberApostichopusjaponicus LI Shilei,MU Yunlei,TENG Weiming,FU Chengdong,LIU Xiangfeng,YU Zuoan,ZHANG Ming,WANG Qingzhi,CHEN Yuan ( Liaoning Key Lab of Marine Fishery Molecular Biology,Liaoning Ocean and Fisheries Science Research Institute,Dalian 116023,China ) Effects of probiotics,water temperature,oligosaccharide,and formulated feed on specific growth rate of juvenile sea cucumberApostichopusjaponicuswere investigated in a L9(34) orthogonal experiment to optimize the four factors.The results showed that there was significant influence of the factors on specific growth rate of juvenile sea cucumber (P<0.01),as the order of probiotics> water temperature> oligosaccharide> formulated feed.The best growth performance of the juveniles was observed under the conditions of probiotic at a dose of 5 mL/m3,water temperature 24 ℃,oligochitosan and alginate oligomers mixed at a dose of 0.002 g/L,and formulated feed type B.The strong-to-weak order of various factors and levels on specific growth rate of the juveniles was expressed as probiotic 5 mL/m3>15 mL/m3>10 mL/m3,water temperature 24 ℃>17 ℃>10 ℃,oligochitosan and alginate oligomers mixed> alginate oligomers > oligochitosan,type B for sea cucumber juvenile > fortified feed of sea cucumber juvenile > feed for sea cucumber juvenile. Apostichopusjaponicus;specific growth rate(SGR);probiotic;oligosaccharide;orthogonal design S968.9 A 1003-1111(2016)01-0021-06 10.16378/j.cnki.1003-1111.2016.01.004 2015-05-07; 2015-09-15. 辽宁省科技计划项目(2015103044);大连市科技兴海专项资金资助项目(大海渔科字20140101);大连市科技计划项目(2012B14NC127). 李石磊(1981-),男,助理研究员;研究方向:海洋动物遗传育种与养殖技术.E-mail:lnlylsl@126.com.通讯作者:陈远(1960-),男,研究员;研究方向:海洋经济动物繁育及增养殖技术.E-mail:chenyuan65432101@sina.com.

2.4 益生菌对幼参特定生长率的影响

2.5 寡糖对幼参特定生长率的影响


2.6 配合饲料对幼参特定生长率的影响


3 讨 论
3.1 温度对仿刺参幼参生长的影响
3.2 益生菌和益生元对仿刺参生长的影响
4 结 论
