植物乳酸杆菌对凡纳滨对虾生长、消化酶活性和肠道组织形态的影响
2016-12-19郑晓婷段亚飞董宏标杨莺莺张家松
郑晓婷,段亚飞,董宏标,杨 铿,杨莺莺,张家松
( 1.中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300;2.上海海洋大学 水产与生命学院,上海 201306 )
植物乳酸杆菌对凡纳滨对虾生长、消化酶活性和肠道组织形态的影响
郑晓婷1,2,段亚飞1,董宏标1,杨 铿1,杨莺莺1,张家松1
( 1.中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300;2.上海海洋大学 水产与生命学院,上海 201306 )
将体质量(8.10±0.13) g的凡纳滨对虾放养在室内500 L玻璃纤维水桶中,以不同剂量(0、0.5%、1.0%和2.0%)的植物乳酸杆菌菌液(密度109cfu/mL)拌料投喂,观察凡纳滨对虾的生长、消化酶活性和肠道组织结构的变化。结果显示,投喂15 d后,0.5%和1%菌液组对虾的平均体质量、质量增加率和特定生长率均显著高于对照组(P<0.05),饲料系数显著降低(P<0.05);0.5%菌液组对虾肝胰腺消化酶和肠道消化酶活性显著增强(P<0.05),对虾肠上皮细胞高度显著增加(P<0.05)。研究结果表明,投喂0.5%植物乳酸杆菌可显著提高凡纳滨对虾消化酶活性和肠上皮细胞高度,促进对虾生长。
植物乳酸杆菌;凡纳滨对虾;生长;消化酶;肠道组织
凡纳滨对虾(Litopenaeusvannamei)对环境适应性强、抗病力强、生长快,是世界主要的养殖虾类之一。近年来,随着集约化养殖程度的提高,水质污染严重,虾类病害频发[1-5]。传统养殖主要通过大量换水、使用抗生素和化学药物等来稳定水质,预防病害,但这增加了水质污染的风险,容易造成水产动物肠道菌群失调和药物残留等问题[6-7]。
益生菌安全、长效,可部分或全部替代抗生素,成为对虾病害防控的研究热点。研究表明[8-17],益生菌能净化水质,维持良好的养殖环境,增强水产动物免疫力,促进动物存活和生长。植物乳酸杆菌(Lactobacillusplantarum)为革兰氏阳性菌,厌氧或兼性厌氧,繁殖时能产生特有的乳酸菌素[18]。乳酸菌素能调节胃肠道菌群平衡,改善肠道微生态环境,保护和促进有益菌的生长[19-20]。植物乳酸杆菌作为益生菌,既可作为水产动物饲料添加剂,又可作为微生态制剂用于改善养殖水质[9-10,18,21]。然而,目前关于植物乳酸杆菌作为饲料添加剂在对虾中的研究主要集中在免疫调节方面[18,22-23],而其对对虾消化酶活性和肠道结构影响的研究较少。笔者给凡纳滨对虾投喂添加不同剂量植物乳酸杆菌的饲料,研究其对凡纳滨对虾生长、消化酶活性和肠道组织形态的影响,以期为其在对虾养殖中的应用提供参考。
1 材料与方法
1.1 材料
试验用凡纳滨对虾取自中国水产科学研究院南海水产研究所深圳试验基地,平均体质量(8.10±0.13) g,暂养于500 L玻璃纤维桶中。7 d暂养中,水温26~30 ℃,盐度32,pH 7.8~8.6;持续充气,日换水10%;投喂对虾基础配合饲料。
试验用植物乳酸杆菌制剂购自广州欣海利生生物科技有限公司,菌液密度为109cfu/mL。凡纳滨对虾配合饲料为“恒兴牌”2号料,主要营养成分:粗蛋白40%、粗纤维5%、粗灰分15%、粗脂肪6%、钙3%、总磷1.5%、赖氨酸2%,水分12.5%等。
1.2 试验设计
经暂养的对虾随机分为4组:对照组只投喂对虾配合饲料,试验组在对虾配合饲料中分别添加体积质量比为0.5%、1.0%和2.0%植物乳酸杆菌剂。试验饲料经搅拌均匀后,室内低温晾干,冰箱4 ℃保存备用。
养殖试验在室内500 L玻璃纤维水桶中进行,每组3个平行,每个平行100尾对虾,养殖期为15 d。养殖试验期间,日投喂4次,投喂量为对虾体质量4%。养殖条件与暂养期间基本一致。
1.3 生长指标测定
养殖试验开始和结束时停止投喂24 h,分别测定对虾体质量,按下式计算质量增加率、特定生长率与饲料系数:
质量增加率/%=(m1-m0)/m0×100%
特定生长率/%·d-1=(lnm1-lnm0)/t×100%
饲料系数=m2/(m1-m0)
式中,m1为试验结束时对虾平均体质量(g),m0为试验开始时对虾平均体质量(g),t为养殖时间(d),m2为试验期间对虾摄食饲料的干物质总质量(g)。
1.4 消化酶活性测定
养殖试验结束时,每个平行组随机取5尾虾,分别取肝胰腺和肠道组织,液氮冷冻处理后保存于-80 ℃备用。取肝胰腺和肠道组织样品,按1∶9(m/V)加入预冷的0.85%生理盐水,冰浴匀浆后2500 r/min离心10 mim,取上清液用于测定消化酶活性。淀粉酶、脂肪酶、胃蛋白酶、胰蛋白酶和组织总蛋白含量均采用南京建成生物工程研究所的试剂盒进行测定。
组织中每毫克蛋白在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位;37 ℃条件下,每克组织蛋白与底物反应1 min,每消耗1 μmol底物为1个脂肪酶活力单位;每毫克组织蛋白37 ℃每分钟分解蛋白生成1 μg氨基酸相当于1个胃蛋白酶活力单位;在pH 8.0、37 ℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个胰蛋白酶活力单位;组织蛋白含量测定采用考马斯亮蓝法。
1.5 肠道黏膜的组织学观察
每个平行组随机选取3尾虾的肠道,用Bouin氏液固定24 h后,流水冲洗,梯度乙醇逐步脱水,二甲苯透明,石蜡包埋,切片厚5 μm,H·E染色,封片后自然风干。ZEISS Axio Scope.A1型光学显微镜观察和拍照,每个处理组随机选取5张400倍下的组织切片,使用ImagePro Plus 6.0软件对图片进行校准,测量肠上皮细胞高度。
1.6 数据统计分析
试验数据均用平均值±标准差表示,用SPSS 22.0软件对数据进行单因素方差分析,进行多重比较,P<0.05表示差异显著。
2 结 果
2.1 植物乳酸杆菌对凡纳滨对虾生长性能的影响
各处理组对虾的生长见表1。各处理组对虾的终末体质量、质量增加率和特定生长率均随植物乳酸杆菌添加量的增加先升后降。其中,0.5%菌液组和1%菌液组对虾的终末体质量、质量增加率和特定生长率均显著高于对照组和2%菌液组(P<0.05),而饲料系数则显著低于对照组和2%菌液组(P<0.05),0.5%和1%菌液组组间差异不显著(P>0.05)。
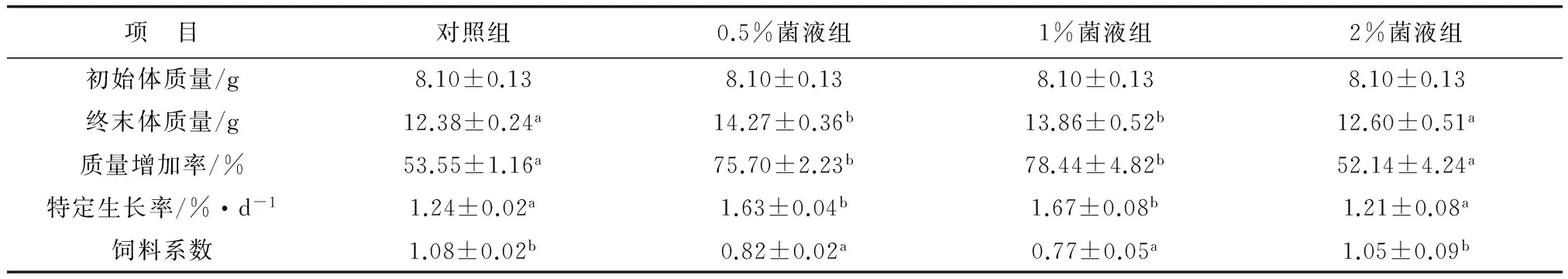
表1 植物乳酸杆菌对凡纳滨对虾生长的影响
注:同行数据上标不同字母的平均值间差异显著(P<0.05),余同.
2.2 植物乳酸杆菌对凡纳滨对虾肝胰腺和肠道消化酶活性的影响
各处理组凡纳滨对虾肝胰腺和肠道的消化酶活性见图1。0.5%、1%和2%菌液组对虾肝胰腺中淀粉酶、脂肪酶和胰蛋白酶活性均显著升高(P<0.05),约为对照组的2倍(图1a)。0.5%、1%和2%菌液组肠道中脂肪酶活性均显著高于对照组(P<0.05);肠道胃蛋白酶活性虽然高于对照组,但4个处理组间差异不显著(P>0.05)。0.5%菌液组肠道中的胰蛋白酶活性显著高于对照组(P<0.05),1%和2%菌液组均低于对照组(图1b)。
2.3 植物乳酸杆菌对凡纳滨对虾肠黏膜组织形态的影响
各处理组凡纳滨对虾肠道组织形态的显微结构见图2。0.5%菌液组对虾肠道形态较其他3组完整,肠壁由内向外分层清晰,依次为单层柱状上皮细胞、结缔组织、肌层和结缔组织;肠上皮细胞紧密连接,未见明显的上皮细胞脱落,细胞游离面的微绒毛排列整齐、致密。投喂乳酸杆菌组对虾的肠上皮细胞高度均高于对照组,其中0.5%和2%菌液组显著高于对照组(P<0.05),但1%菌液组和对照组间差异不显著(P>0.05)(图3)。
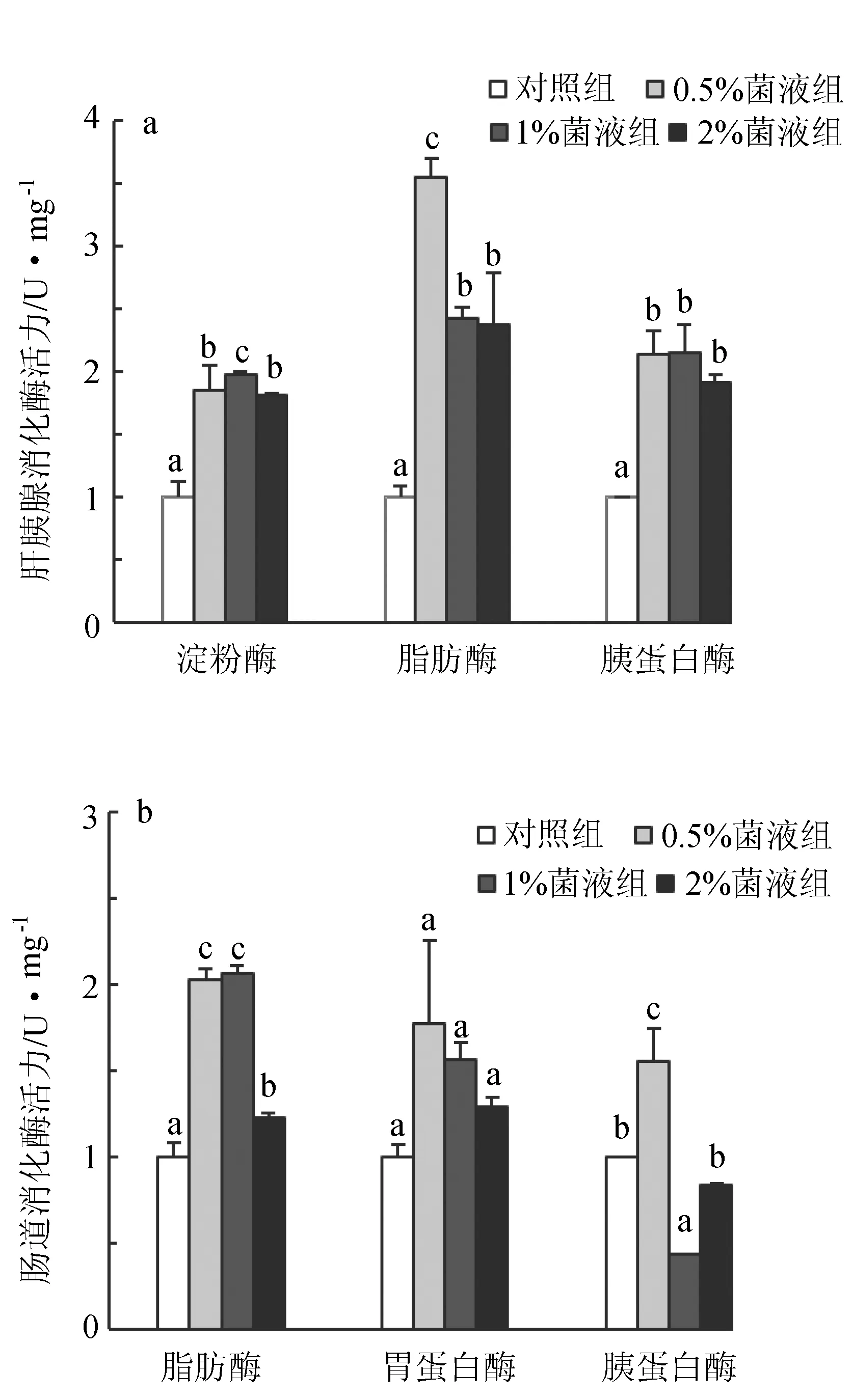
图1 植物乳酸杆菌对凡纳滨对虾肝胰腺(a)和肠道(b)消化酶活性的影响
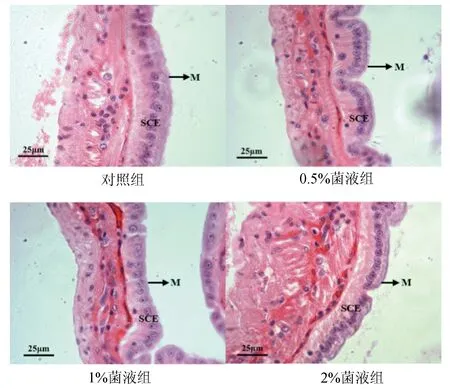
图2 植物乳酸杆菌对凡纳滨对虾肠道黏膜组织形态结构的影响SCE:肠上皮细胞;M:微绒毛;标尺=25 μm.
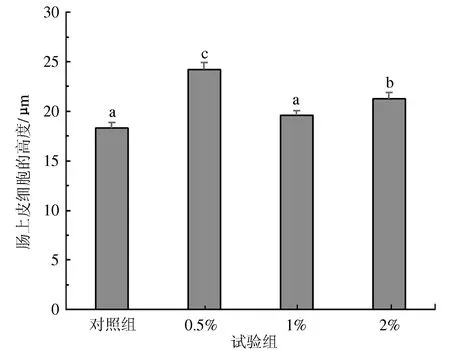
图3 植物乳酸杆菌对凡纳滨对虾肠上皮细胞高度的影响
3 讨 论
3.1 植物乳酸杆菌对凡纳滨对虾生长性能的影响
植物乳酸杆菌是一种重要的益生菌,常作为饲料添加剂,通过定殖于动物体胃肠道等部位后大量繁育,可抑制病原菌的生长,产生维生素和促进生长因子等物质,增加机体对饲料的消化和吸收,提高生长与成活[24-25]。本次试验结果表明,饲料中添加植物乳酸杆菌促进了凡纳滨对虾的生长,但其作用与菌液密度有关。密度过高,其促进对虾生长的作用不显著。当植物乳酸杆菌的添加密度为0.5%和1%时,凡纳滨对虾的终末体质量、质量增加率和特定生长率均显著高于对照组和2%菌液组,饲料系数显著低于对照组和2%菌液组,表明植物乳酸杆菌密度是影响其作用效果的重要因素,只有在饲料中添加适当的益生菌密度,才能促进对虾的健康生长。这与斑节对虾(Penaeusmonodon)[26]、仿刺参(Apostichopusjaponicus)[11]等的研究结果相似。有研究发现[25],斜带石斑鱼(Epinepheluscoioides)摄食含植物乳酸杆菌(108cfu/kg)的饲料4周后,质量增加率和饲料效率显著高于其他处理组(0、106cfu/kg、1010cfu/kg组)。
益生菌作为饲料添加剂,除自身可帮助动物对食物的消化,提高饲料的利用效率外,其菌体本身还含有大量的营养物质,可以供给动物生长需要[27-28]。这也是植物乳酸杆菌能促进对虾生长的原因之一,但植物乳酸杆菌的营养成分和作用需深入研究。植物乳酸杆菌的最适添加密度对凡纳滨对虾生长性能的影响是否与生长发育阶段和养殖条件等有关,亦有待进一步的深入研究。
3.2 植物乳酸杆菌对凡纳滨对虾消化酶活性的影响
对虾对营养物质的消化吸收主要靠消化道分泌的消化酶,其活性的高低可用于衡量对虾消化能力[29-32]。益生菌能诱导动物分泌消化酶,这些酶与动物体内的酶共同起作用,从而提高饲料转化率,促进动物生长[33-34]。Liu等[35]在纳豆中发现的枯草芽孢杆菌(Bacillussubtilis)E20可提高对虾蛋白酶活性,促进对虾生长。Nimrat等[36]从斑节对虾肠道中分离的枯草芽孢杆菌F6和肠球菌(Enterococcussp.)S2显著提高了斑节对虾胰蛋白酶和糜蛋白酶活性及对虾终末体质量。Talpur等[10]发现,植物乳酸杆菌可显著提高远海梭子蟹(Portunuspelagicus)的存活率以及蛋白酶和淀粉酶活性。
Collington等[37]认为,乳酸杆菌产生的酸性代谢产物使肠道环境偏酸性,而大多数消化酶的最适pH均偏酸性(如淀粉酶6.5、胃蛋白酶1.5~5.0)。有机酸的产生还可加强肠道蠕动和消化酶的分泌,有利于机体对营养物质的消化吸收。本研究中,0.5%处理组的对虾肝胰腺和肠道的消化酶活性均高于对照组,表明适当密度的植物乳酸杆菌能刺激对虾肝胰腺和肠道分泌消化酶,增强对虾对饲料的消化和吸收,促进生长。宿主机体消化酶活性的提高是由益生菌自身消化酶的补充,抑或是益生菌刺激了宿主机体消化酶的分泌增加,尚有待于进一步研究。
3.3 植物乳酸杆菌对凡纳滨对虾肠道形态结构的影响
对虾肠上皮细胞具有吸收和分泌等功能,其游离面伸出的微绒毛能够显著增大细胞表面积,有利于吸收营养和肠道微生物的附着。研究表明,乳酸杆菌定殖在动物肠道内会产生短链脂肪酸,短链脂肪酸作为主要能源而为肠上皮细胞吸收利用,提高消化道营养吸收[38]。本研究中,饲料添加0.5%的植物乳酸杆菌可以显著提高凡纳滨对虾肠上皮细胞的高度和微绒毛密度,增大吸收面积,促进对虾生长,与Daniels等[28,39]的研究结果相似。投喂1%植物乳酸杆菌组的对虾生长性能显著高于对照组,但该组对虾肠上皮细胞高度虽然高于对照组,但差异不显著,具体原因还有待进一步研究。
4 结 论
饲料中添加植物乳酸杆菌能促进对虾肠上皮细胞增高,增强肠道对营养物质的吸收,有助于促进对虾消化酶活性,增强机体对蛋白质、淀粉等营养物质的消化分解,促进对虾生长。在本试验条件下,凡纳滨对虾饲料中植物乳酸杆菌的最适添加量为0.5%。
[1]Flegel T W.Historic emergence,impact and current status of shrimp pathogens in Asia [J].Journal of Invertebrate Pathology,2012,110(2):166-173.
[2]Kondo H,Tinwongger S,Proespraiwong P,et al.Draft genome sequences of six strains ofVibrioparahaemolyticusisolated from early mortality syndrome/acute hepatopancreatic necrosis disease shrimp in Thailand [J].Genome Announc,2014,2(2):214-221.
[3]Kumar B K,Deekshit V K,Raj J R M,et al.Diversity ofVibrioparahaemolyticusassociated with disease outbreak among culturedLitopenaeusvannamei(Pacific white shrimp) in India [J].Aquaculture,2014,433(1):247-251.
[4]Nunan L,Lightner D,Pantoja C,et al.Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico [J].Dis Aquat Organ,2014,111(1):81-86.
[5]Tran L,Nunan L,Redman R M,et al.Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp [J].Dis Aquat Organ,2013,105(1):45-55.
[6]Akinbowale O L,Peng H,Barton M D.Antimicrobial resistance in bacteria isolated from aquaculture sources in Australia [J].J Appl Microbiol,2006,100(5):1103-1113.
[7]Angulo F,Nargund V,Chiller T.Evidence of an association between use of anti-microbial agents in food animals and anti-microbial resistance among bacteria isolated from humans and the human health consequences of such resistance [J].Journal of Veterinary Medicine,Series B,2004,51(8/9):374-379.
[8]Chen X,Lin H Z,Jiang S G,et al.Dietary supplementation of honeysuckle improves the growth,survival and immunity ofPenaeusmonodon[J].Fish and Shellfish Immunol,2013,35(1):161-169.
[9]Suzer C,Coban D,Kamaci H O,et al.Lactobacillusspp.bacteria as probiotics in gilthead sea bream (SparusaurataL.) larvae:effects on growth performance and digestive enzyme activities [J].Aquaculture,2008,280(1/4):140-145.
[10]Talpur A D,Ikhwanuddin M,Abdullah M D D,et al.IndigenousLactobacillusplantarumas probiotic for larviculture of blue swimming crab,Portunuspelagicus(Linnaeus,1758):effects on survival,digestive enzyme activities and water quality [J].Aquaculture,2013,416/417(2):173-178.
[11]Wang J H,Zhao L Q,Liu J F,et al.Effect of potential probioticRhodotorulabenthicaD30 on the growth performance,digestive enzyme activity and immunity in juvenile sea cucumberApostichopusjaponicus[J].Fish and Shellfish Immunol,2015,43(2):330-336.
[12]Yang S P,Wu Z H,Jian J C,et al.Effect of marine red yeastRhodosporidiumpaludigenumon growth and antioxidant competence ofLitopenaeusvannamei[J].Aquaculture,2010,309(1/4):62-65.
[13]姜松,王军红,范嗣刚,等.添加光合细菌对糙海参幼苗培育阶段的影响研究 [J].南方水产科学,2014,10(6):78-82.
[14]邓吉朋,黄建华,江世贵,等.生物絮团在斑节对虾养殖系统中的形成条件及作用效果 [J].南方水产科学,2014,10(3):29-37.
[15]杨世平,吴灶和,简纪常.饲料中添加沼泽生红冬孢酵母对凡纳滨对虾消化酶及肠道微生物的影响[J].水产科学,2011,30(7):391-394.
[16]朱强,夏艳秋,熊晓辉,等.灵芪菌质对凡纳滨对虾生长及非特异性免疫的影响[J].水产科学,2012,31(7):398-402.
[17]刘小玲,徐向群,黄燕华,等.桦褐孔菌多糖对凡纳滨对虾生长和血清免疫相关酶活性的影响[J].水产科学,2014,33(4):201-207.
[18]Kongnum K,Hongpattarakere T.Effect ofLactobacillusplantarumisolated from digestive tract of wild shrimp on growth and survival of white shrimp (Litopenaeusvannamei) challenged withVibrioharveyi[J].Fish and Shellfish Immunol,2012,32(1):170-177.
[19]Eijsink V G,Axelsson L,Diep D B,et al.Production of class Ⅱ bacteriocins by lactic acid bacteria; an example of biological warfare and communication [J].Antonie Van Leeuwenhoek,2002,81(1/4):639-654.
[20]Corr S C,Li Y,Riedel C U,et al.Bacteriocin production as a mechanism for the antiinfective activity ofLactobacillussalivariusUCC118 [J].Proceedings of the National Academy of Sciences,2007,104(18):7617-7621.
[21]Van Doan H,Doolgindachbaporn S,Suksri A.Effects of low molecular weight agar andLactobacillusplantarumon growth performance,immunity,and disease resistance of basa fish (Pangasiusbocourti,Sauvage 1880) [J].Fish and Shellfish Immunol,2014,41(2):340-345.
[22]Chiu C H,Guu Y K,Liu C H,et al.Immune responses and gene expression in white shrimp,Litopenaeusvannamei,induced byLactobacillusplantarum[J].Fish and Shellfish Immunol,2007,23(2):364-377.
[23]Vieira F D N,Buglione N C C,Mourio J L P,et al.Time-related action ofLactobacillusplantarumin the bacterial microbiota of shrimp digestive tract and its action as immunostimulant [J].Pesquisa Agropecuária Brasileira,2008,43(6):763-769.
[24]Van Doan H,Doolgindachbaporn S,Suksri A.Effect ofLactobacillusplantarumand Jerusalem artichoke (Helianthustuberosus) on growth performance,immunity and disease resistance of Pangasius catfish (Pangasiusbocourti,Sauvage 1880) [J].Aquaculture Nutrition,2015,doi:10.1111/anu.12263.
[25]Son V M,Chang C C,Wu M C,et al.Dietary administration of the probiotic,Lactobacillusplantarum,enhanced the growth,innate immune responses,and disease resistance of the grouperEpinepheluscoioides[J].Fish and Shellfish Immunol,2009,26(5):691-698.
[26]Anand P S S,Kohli M P S,Kumar S,et al.Effect of dietary supplementation of biofloc on growth performance and digestive enzyme activities inPenaeusmonodon[J].Aquaculture,2014,418/419(1):108-115.
[27]Wang Y B.Effect of probiotics on growth performance and digestive enzyme activity of the shrimpPenaeusvannamei[J].Aquaculture,2007,269(1):259-264.
[28]Daniels C L,Merrifield D L,Boothroyd D P,et al.Effect of dietaryBacillusspp.and mannan oligosaccharides (MOS) on European lobster (HomarusgammarusL.) larvae growth performance,gut morphology and gut microbiota [J].Aquaculture,2010,304(1/4):49-57.
[29]Soleimani N,Hoseinifar S H,Merrifield D L,et al.Dietary supplementation of fructooligosaccharide (FOS) improves the innate immune response,stress resistance,digestive enzyme activities and growth performance of Caspian roach (Rutilusrutilus) fry [J].Fish and Shellfish Immunol,2012,32(2):316-321.
[30]Mohapatra S,Chakraborty T,Prusty A K,et al.Use of different microbial probiotics in the diet of rohu,Labeorohitafingerlings:effects on growth,nutrient digestibility and retention,digestive enzyme activities and intestinal microflora [J].Aquaculture Nutrition,2012,18(1):1-11.
[31]Hauville M R,Zambonino I J L,Gordon Bell J,et al.Effects of a mix ofBacillussp.as a potential probiotic for Florida pompano,common snook and red drum larvae growth performances and digestive enzyme activities [J].Aquaculture Nutrition,2015,22(1):51-60.
[32]文国樑,林黑着,李卓佳,等.饲料中添加复方中草药对凡纳滨对虾生长、消化酶和免疫相关酶活性的影响 [J].南方水产科学,2012,8(2):58-63.
[33]Aguirre G G,Lara F M,Sanchez M J G,et al.The use of probiotics in aquatic organisms:a review [J].African Journal of Microbiology Research,2012,6(23):4845-4857.
[34]Balcazar J L,De B I,Ruiz Z I,et al.The role of probiotics in aquaculture [J].Vet Microbiol,2006,114(3/4):173-186.
[35]Liu C H,Chiu C S,Ho P L,et al.Improvement in the growth performance of white shrimp,Litopenaeusvannamei,by a protease-producing probiotic,BacillussubtilisE20,from natto [J].J Appl Microbiol,2009,107(3):1031-1041.
[36]Nimrat S,Tanutpongpalin P,Sritunyalucksana K,et al.Enhancement of growth performance,digestive enzyme activities and disease resistance in black tiger shrimp (Penaeusmonodon) postlarvae by potential probiotics [J].Aquaculture International,2013,21(3):655-666.
[37]Collington G,Parker D,Armstrong D.The influence of inclusion of either an antibiotic or a probiotic in the diet on the development of digestive enzyme activity in the pig [J].British Journal of Nutrition,1990,64(1):59-70.
[38]Pirarat N,Pinpimai K,Endo M,et al.Modulation of intestinal morphology and immunity in Nile tilapia (Oreochromisniloticus) byLactobacillusrhamnosusGG [J].Res Vet Sci,2011,91(3):92-97.
[39]Zhang J,Liu Y,Tian L,et al.Effects of dietary mannan oligosaccharide on growth performance,gut morphology and stress tolerance of juvenile Pacific white shrimp,Litopenaeusvannamei[J].Fish and Shellfish Immunol,2012,33(4):1027-1032.
EffectsofLactobacillusplantarumonGrowthPerformance,GutHistologyandActivityofDigestiveEnzymesinPacificWhiteLegShrimp,Litopenaeusvannamei
ZHENG Xiaoting1,2,DUAN Yafei1,DONG Hongbiao1,YANG Keng1,YANG Yingying1,ZHANG Jiasong1
( 1.Key Laboratory of South China Sea Fisheries Resources Development and Utilization,Ministry of Agriculture,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China )
Pacific white leg shrimpLitopenaeusvannameiwith initial body weight of (8.10±0.13) g was randomly allocated into 4 groups and fed the basal diet supplemented withLactobacillusplantarumadditives at a rate of 0,0.5%,1.0% and 2.0% in 15 days to investigate the effects ofL.plantarumon growth performance,digestive enzyme activities and gut histology in Pacific white leg shrimp.Results showed that there were significantly higher final body weight,weight gain rate,and specific growth rate and significantly lower food conversion rate in 0.5% and 1% groups than those in the control group (P<0.05).The shrimp fed the diet containing 0.5%L.plantarumhad significantly higher digestive enzyme activities in the hepatopancreas and gut and enterocyte height than the shrimp fed the control diet (P<0.05).In conclusion,dietaryL.plantarumat optimal supplemental level of 0.5% led to improve the growth performance,activities of digestive enzymes and gut morphology of Pacific white leg shrimp.The findings can provide technical support and experimental basis in the effective use ofL.plantarumin shrimp culture.
Lactobacillusplantarum;Litopenaeusvannamei;growth performance;digestive enzyme;intestinal histology
S968.22
A
1003-1111(2016)01-0001-06
10.16378/j.cnki.1003-1111.2016.01.001
2015-08-08;
2015-10-10.
国家“十二五”科技支撑计划项目(2011BAD13B10);中央级公益性科研院所基本科研业务费专项资金项目(2014TS26,2014TS15);广东省海洋渔业科技推广专项(A201501B15,A201508B05);广东省海洋经济创新发展示范项目(GD2013-B03-005);上海海洋大学2014年研究生科研基金资助项目(A1020914090071).
郑晓婷(1990-),女,硕士研究生;研究方向:对虾健康养殖.E-mail:xtzheng1990@163.com.通讯作者:张家松(1971-),男,副研究员,博士;研究方向:设施渔业健康养殖技术. E-mail:jiasongzhang@hotmail.com.
