甜菊糖的应用研究进展
2016-12-19刘贵君石浩
刘贵君,石浩
(浙江工业大学药学院,浙江杭州310014)
甜菊糖的应用研究进展
刘贵君,石浩*
(浙江工业大学药学院,浙江杭州310014)
甜菊糖是从甜叶菊中提取的糖苷类化合物,具有甜度高、热量低的特点及降血压、降血脂、抗菌等多种生物活性。由于甜菊糖及其衍生物价格相对低廉且易于大量提取制备,已被广泛应用于食品饮料、医药和有机化学等领域。对近年来甜菊糖及其衍生物在以上各方面的开发应用进行了综述。
甜菊糖苷;甜菊糖;异斯特维醇;衍生物
0 前言
甜叶菊,原产于巴拉圭和巴西交界的高山草地,并被当地人用作甜茶或甜味剂使用。我国于1976年将甜叶菊引入中国,并试种成功[1],由于我国气候和土壤条件适宜,目前,已在我国福建、云南等地大量种植。甜叶菊叶片中除了有机酸和无机杂质以外,还富含黄酮类和甜菊糖苷类化学成分[2-3]。黄酮类化合物具有抗肿瘤,抗氧化等多种药理活性;甜菊糖苷(Steviol glycosides)则是一类具有多种用途的甜味剂。

表1 甜菊糖苷类化合物的结构及成分
1 甜菊糖概述
甜菊糖苷(Steviolglycosides)是多种结构相似的二萜类化合物的混合物,其基本结构及主要成分见表1,其中甜菊糖(Stevioside)的含量最高(10%左右),莱鲍迪苷A(Rebaudiana A)甜度最高且口感最好,其含量为1%左右。甜菊糖为白色结晶或粉末,易溶于水和甲醇,稳定性好,不易受温度、pH值和微生物发酵的影响。被称为世界上继蔗糖、甜菜糖外的“世界第三糖源”,其甜度高(约为蔗糖的150~300倍)、热量低(约为蔗糖的1/ 250)、对高血压、糖尿病、肥胖病、龋齿等具有一定的辅助治疗作用,到目前为止,未发现其有任何毒性和副作用。2011年,欧盟委员会允许将甜菊糖用作食品添加剂,表明甜菊糖已被广泛认可。中国是世界上甜菊糖苷的主要生产和出口国家,据海关统计,我国甜菊糖苷每年的出口数量占全球市场的80%以上。
2 甜菊糖苷在食品饮料行业的应用
甜菊糖由于其甜度高、热量低、口感清新、对人体无副作用等特点被广泛应用于食品饮料等行业。1985年6月,我国卫生部批准将甜菊糖用作食品添加剂;1990年,卫生部扩大其适用范围,批准将其用作医药用甜味剂辅料;1999年,制定了甜菊糖苷标准(GB 8270-1999),迄今,甜菊糖已被广泛应用于饮料、蜜饯、果脯、糕点、乳制品、降血压或减肥等功能性食品以及卷烟行业中。
甜菊糖虽然甜度高,但后味却带有苦涩和甘草的余味,原因可能是其提取过程中苦味杂质的残留或甜菊糖的基本结构和糖配基等的影响[4]。然而,将甜菊糖与柠檬酸、苹果酸,乳酸以及氨基酸等混合使用时,可消除甜菊糖后味的影响,有利于提高甜菊糖的口感[5]。此外,将甜菊糖与其他甜味剂进行复配,制成复合甜味剂,如赤藓糖醇和甜菊糖的天然复配,不仅增强了其保健功能,而且降低了赤藓糖醇的成本,掩盖甜菊糖的不良口感。甜菊糖可替代15%~35%的蔗糖生产饮料或酒类,不仅不影响口感,而且由于甜菊糖的抑菌效果,还能延长饮料的保质期,改善酒质。而将甜菊糖用于果脯、糕点制作,不仅大大降低了成本,还降低了热量,满足了日常低糖摄入人群的需求。将甜菊糖用于乳制品的生产,不仅能改善乳制品的口感,甜菊糖作为双歧杆菌生长的促进剂,不但能促进人体内双歧杆菌和乳酸杆菌的增殖,还能抑制大肠杆菌等的生长[6]。用甜菊糖替代30%~50%的蔗糖加工水产品,能防止水产制品中蛋白质变质或因酸败反应而引起褐变、发霉现象[6]。将甜菊糖用于酱油等调味品中,不仅能防止其褐变反应,还能抑制其咸度。
3 甜菊糖苷在医药行业中的应用
3.1 在药剂上的应用
目前,在药剂中,一般使用蔗糖作为矫味剂,但在临床应用中却存在一些弊端。比如大量的蔗糖将限制糖尿病患者的使用,同时,由于蔗糖的存在使得药剂色泽变黄,影响外观。阮文幼[7]曾利用甜菊糖代替肌苷口服液中的蔗糖,发现新配置的肌苷口服液具有粘稠度小、过滤快和成品透明度好、色泽好、成本低、不影响疗效、口感好等优点。除此之外,蔗糖在药剂使用中具有大量食用可能会诱发癌症,造成龋齿;在酸性的中药药剂溶液中不稳定,会降低其甜度;在清热解毒及收涩类药剂中甜度降低;蔗糖的存在不利于微生物的控制,从而影响药剂质量等缺点[8]。甜菊糖具有甜度高、热量低、无副作用、预防龋齿、在3~10的pH范围内稳定、不发酵的特点,在制药过程中,使其成为代替蔗糖用作糖浆、冲剂、丸剂等药剂的矫味剂。
数百年前,用甜叶菊作甜味剂的人就已经意识到其降血压、降血糖的功能。后期的实验研究发现,其降血压的作用主要是通过降低细胞外Ca2+的内流、减少Na+再吸收和刺激血管舒张剂前列腺素生成三种途径来实现的[9],其降血糖的作用则是通过刺激胰岛素的分泌和周围组织对胰岛素的敏感性来促进血液中葡萄糖的代谢[10]、抑制肠道中葡萄糖的吸收和肝脏中葡萄糖的生成两种途径来实现的[11]。此外,甜菊糖对血压正常的人并不发挥降压作用,且仅仅在血糖高的情况下才发挥其降血糖的作用,因此正常人也可大量食用[12]。
甜菊糖和甜菊醇可通过影响细胞因子的表达,通过抑制NF-κB信号通路,从而减少被多糖所诱导的促炎因子的生成[13],还能有效抑制引起局部炎症和皮肤癌的TPA的生成[14],从而具有抗炎作用。甜菊糖和苦参提取物复配使用对引起婴幼儿腹泻的轮状病毒具有抑制所用,但单一使用其中任何一种时都会使抗腹泻作用降低[15]。被东莨菪碱诱发了记忆障碍的大鼠在服用甜菊糖苷之后,其脑部AChE活性和脑氧化应激水平升高的情况被抑制[16],说明甜菊糖具有抗失忆作用。
甜叶菊不同溶剂的提取物均属于混合物,其中的化合物成分极为复杂,不仅包括甜菊糖苷类化合物,还包括黄酮、尼克酸、核黄素、生物碱、单宁等。以水作为溶剂的甜叶菊提取物并没有表现出抗菌作用[17-18],但以丙酮作为溶剂的甜叶菊提取物对革兰阳性菌的抗菌作用强于格兰阴性菌,以丙酮、乙醇溶液作为溶剂的甜叶菊提取物抗菌活性强于仅以丙酮作为溶剂的提取物的抗菌活性,以乙酸乙酯作为溶剂的甜叶菊提取物对毛癣菌和白色念珠菌表现出很高的抗菌活性[17-19]。
3.3 甜菊糖衍生物的药理作用
甜菊糖不仅可直接用于食品及医药行业,由于其自身和衍生物均是以相同的二萜骨架为苷元的糖苷类化合物,对其结构进行改造可进一步扩展其在生物医药领域的用途[20-21]。甜菊糖经酶解或使用高碘酸钠和大量强碱处理可以得到斯特维醇(steviol),甜菊糖经酸解后得到异斯特维醇(isosteviol),若在10%氢氧化钾溶液中加热回流1 h,可得到甜菊双糖苷(Steviobioside),如scheme 1。实验研究表明,斯特维醇、异斯特维醇和甜菊双糖苷等衍生物都具有一定的生物活性。

Scheme 1
异斯特维醇也具降血糖[22]、降血压[23]作用,还对缺血心脏具有一定的保护作用[24],通过抑制DNA聚合酶和DNA拓扑异构酶Ⅱ来治疗炎症和癌症[25]等。斯特维醇在药物的肾脏转运和清除过程中起重要作用[26],不仅可影响肾脏功能,还对某些肾脏疾病有一定的治疗作用[27]。甜菊糖苷、斯特维醇、甜菊双糖苷对结核分枝杆菌H37RV的生长都有一定的抑制活性,其中甜菊醇的活性最弱,而甜菊双糖苷活性最强。
近十几年来,不断有人对甜菊糖苷的糖配基进行结构修饰,其目的是提高其甜度以及改善其后味,对斯特维醇、异斯特维醇的苷元进行结构修饰,其目的是提高其抗菌、抗肿瘤、抗高血压以及调节植物生长等活性[28]。Wonganan O等[29]和Zou M等[30-31]均对异斯特维醇骨架进行简单的结构修饰,并分别考察其对大鼠主动脉的舒张作用和人类不同肿瘤细胞系(如HepG2、MGC-803、MDAMB-231等)的抑制作用,实验结果显示,其中有些衍生物表现出更好的降血压和抗肿瘤作用。Lin L等[32]以甜菊双糖苷为原料,Kataev V E等[33-36]和Khaybullin R N等[37]以异斯特维醇作为原料,均分别合成了一系列含异斯特维醇骨架的分子钳型化合物或大环化合物,并分别考察其抗菌活性和对结核分枝杆菌H37RV的活性。实验结果发现,合成的其中一些钳型化合物或大环化合物显示出十分优越的抗菌活性和抗结核活性,如化合物1~4(scheme 2)对结核分枝杆菌H37RV表现出最为优越的活性,其对H37Rv菌株的MIC分别为3.1μg/mL,1.7μg/mL,5.0μg/mL,0.7μg/mL(抗结核药吡嗪酰胺MIC=12.5μg/mL)。此外,化合物4对M.Avium,M.Terrae,MLU三种菌株表现出良好的活性,其MIC值分别为0.7μg/mL,0.35μg/mL,0.7μg/mL。
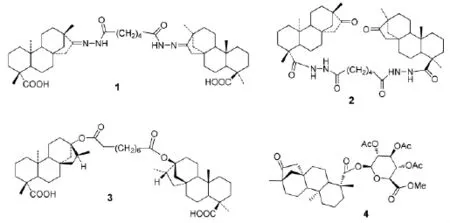
Scheme 2
4 甜菊糖苷在有机化学中的应用
将甜菊糖苷在酸性条件下水解,可得到一种具有贝叶烷骨架的四环二萜类化合物——异斯特维醇,因其分子结构本身的刚性和特有的凹槽结构以及其化学结构稳定,手性环境优越的特点,近年来被开发应用于有机催化、分子识别及自组装等方面。
4.1 有机催化中的应用
右边不远处,是一个穿着黑西服套装的男人,他嘴里叼着一根烟,一副不耐烦的表情,皱着眉头,不时吐出一个烟圈。
陶京朝课题组自2010年开始,以异斯特维醇作为原料合成一系列双官能团硫脲类催化剂,用于催化一系列不对称反应,该类催化剂表现出良好的不对称催化作用。
An J Y等[38-40]在异斯特维醇的19位分别引入4-羟基-L-脯氨酸、L-苏氨酸,L-丝氨酸,合成一系列氨基-硫脲类化合物5~10(scheme 3),并考察了这一系列两亲化合物在有机相和水相中直接催化不对称Aldol反应、不对称α-胺氧化反应、不对称Mannich反应和不对称Biginelli反应中的催化活性和立体选择性。实验结果发现,化合物5的催化活性优于化合物6,在水相中直接催化不对称Aldol反应,催化量为1%,环己酮、环戊酮和丙酮与芳香醛不对称Aldol反应的ee值分别为99%,98%和90%。化合物6在水相中对醛、酮与取代亚硝基苯的不对称α-胺氧化反应的催化活性优于化合物5,室温反应3~5 min,即可完成催化反应,且ee值均大于90%。化合物6和10对环己酮、硝基苯甲醛与非强给电子基团取代的苯胺的直接不对称Mannich反应有着优越的选择性,化合物6仅5%的催化量可得到syn构型为主的加成产物,化合物10可得到anti构型为主的加成产物,其ee值均高达99%。
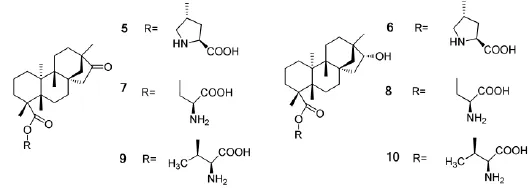
Scheme 3
此外,在异斯特维醇的16位分别引入环己二胺和脯氨酸,合成一系列氨基-硫脲类化合物11~16(scheme 4),并考察其催化不对称Michael加成、α-取代的苯基腈与N-马来酰亚胺反应催化活性和立体选择性[41-43]。实验结果显示,催化剂11和12对催化异丁醛和β-硝基苯乙烯的不对称Michael加成、化合物13和14对催化乙酰丙酮与β-硝基苯乙烯的不对称Michael加成反应、化合物13~16对α-取代的苯基腈与N-马来酰亚胺反应均有着高效的催化活性和立体选择性,以化合物11和13作为催化剂主要得到R构型的加成产物,化合物12和14作为催化剂主要得到S构型的加成产物,其收率均高于95%、ee值均高于97%。化合物13可催化α-取代的苯基腈与N-马来酰亚胺的大量反应而不降低其收率和ee值,具有应用于工业生产的潜力。

Scheme 4
4.2 分子识别中的应用
Kataev V E等[44-45]以水-氯仿层模拟生物膜,考察了含两个异斯特维醇骨架的钳型化合物17~20(Scheme 5)对D/L-色氨酸等氨基酸的手性识别转移能力。遗憾的是,钳型化合物17识别转移D/L-色氨酸的能力最强,但对映选择性较差,钳型化合物19和20对D/L-苯丙氨酸甲酯则没有表现出没有识别性能。
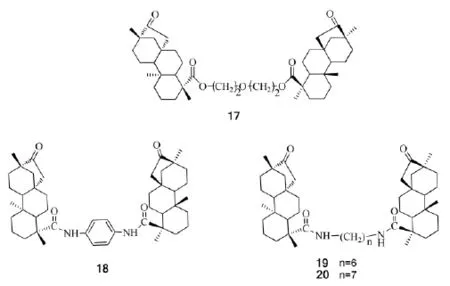
Scheme 5
4.3 其他
Zhang T等[46]合成了一类含异斯特维醇骨架的碱金属盐化合物21~26(Scheme 6),并采用加热-冷却的方法考察其在不同有机溶剂中的选择性凝胶能力、相转变温度和最小凝胶化浓度。其中,化合物24在卤代溶剂中表现出良好的凝胶能力,其在碘苯中的相转变温度达77℃,在二氯甲烷和氯仿中的最小凝胶化浓度为0.1%g/mL,且在室温下都可以将有机溶剂从大量的水中凝胶化。

Scheme 6
Lohoelter C等[47]合成了一系列含异斯特维醇的苯并菲缩酮、三蝶烯衍生物,并用石英晶体微天平(QCM)检测其作为亲和材料追踪不稳定的芳香化合物的能力。其中,化合物27(Scheme 7)能在很低的芳香化合物浓度下,显示出尤为强烈的信号,这表明化合物27作为芳香化合物的高亲和能力的材料。质子物筛选还发现,化合物27能作为一种传感器上的极有潜力的亲和材料,用于追踪空气中浓度很稀的芳香化合物。
Mamedova V L等[48]用异斯特维醇先与甲醇钠反应,再分别与葡萄糖酸钙、葡萄糖酸亚铁、氯化亚铜和氯化镍进行交换反应,生成在异斯特维醇骨架19位以金属离子桥连的分子钳化合物28~31(scheme 8)。同时,利用异斯特维醇衍生物32与三乙胺反应,再分别与葡萄糖酸钙、葡萄糖酸亚铁、氯化亚铜和氯化镍进行交换反应生成在异斯特维醇骨架16位以金属离子桥连的分子钳化合物33~36(scheme 6),并认为其可用于药剂学、金属催化或新的磁性材料。

Scheme 7

Scheme 8
5 总结与展望
甜菊糖来源丰富,价格低廉,其高甜度、低热量的特点使其被广泛应用于食品饮料等行业。甜菊糖本身具有的生物活性,使其成为新药研发中一种极具潜力的先导化合物。对甜菊糖及其衍生物的结构进行修饰,可使其具有更高的生物活性,在新药开发领域具有重要的用途。甜菊糖四环二萜的骨架特有的刚性、凹槽结构和手性环境使其在有机化学、超分子化学等方面的也有着重要的应用,因此,甜菊糖是一种有着广泛应用前景的天然产物资源,有待进一步开发和利用。
[1]唐志发.甜菊糖的崛起与发展战略[J].中国食品工业,1999,6(2):52.
[2]赵瑜藏,张运申.甜菊的化学成分及开发利用研究[J].安阳师范学院学报,2000,(3):40.
[3]Chaturvedula V S,Clos J F,Rhea J,et al.Minor diterpenoids glycosides from the leaves of stevia rebaudiana morita[J].Phytoehem let,2011,4(3):209.
[4]王德冀.关于甜菊糖苷的甜度、甜味和苦涩后味的成因机理[J].中国食品添加剂,2007,(3):46.
[5]杨远志,李发财,琚争艳,等.甜菊糖的应用现状及发展前景[J].发酵科技通讯,2011,40(1):40.
[6]郭雪霞,赵仁邦.甜菊糖苷的保健功能及其在食品中的应用[J].中国食物与营养,2012,18(1):32.
[7]阮文幼.应用甜菊糖甙作肌苷口服液的调味剂[J].中国药学杂志,1994,29(12):716.
[8]卢建峰,赵喜兰.探讨甜菊糖在药剂中的应用[J].中外女性健康月刊,2014,(4X):19.
[9]Tirapelli C R,Ambrosio S R,de Oliveira A M,et al.Hypotensive action of naturally occurring diterpenes:a therapeutic promise for the treatment of hypertension[J].Fi toterapia,2010,81(7):690.
[10]Jeppesen P B,Gregersen S,Poulsen C R,et al.Stevioside acts directly on pancreaticβcells to secrete insulin:actions independent of cyclic adenosine monophosphate and adenosine triphosphate-sensitivie K+-channelactivity[J]. Metabolism-Clinical and Experimental,2000,49(2):208.
[11]Chatsudthipong V,Muanprasat C.Stevioside and related compounds:therapeutic benefits beyond sweetness[J].Pharmacol Therapeut,2009,121(1):41.
[12]Maki k c,Curry L L,Carakostas M C,et al.The hemodynamic effects of rebaudioside A in healthy adults with normal and low-normal blood pressure[J].Food Chem Toxicol,2008,46(7):40.
[13]Wang T,Guo M,song X,et al.Stevioside plays an antiinflammatory role by regulating the NF-κB and MAPK pathways in S.aureus-infected mouse mammary glands[J]. Inflammation,2014,37(5):1837.
[14]Yasukawa K,Kitanaka S,Seo S.Inhibitory effect of stevioside on tumor promotion by 12-O-tetradecanoyl-phorbol-13-acetate in two-stage carcinogenesis in mouse skin [J].Biol.Pharm.Bull.,2002,25(11):1488.
[15]Alfajaro M M,Rho M C,Kim H J,et al.Anti-rotavirus effects by combination therapy of stevioside and Sophora favescens extract[J].Res.Vet.Sci.,2014,96(3):567.
[16]Sharma D,Puri M,Tiwary A K,et al.Antiamnesic effect of stevioside in scopolamine-treated rats[J].Indian J.Pharmacol,2010,42(3):164.
[17]Alonso Paz E,Cerdeiras M,Fernandez J,et al.Screening of uruguayan medicinal plants for antimicrobial activity[J]. J.Ethnopharmacol,1995,45(1):67.
[18]Tadhani M B,Subhash R.In vitro antimicrobial activity of Stevia rebaudiana Bertoni leaves[J].Trop J Pharm Res,2007,5(1):557.
[19]Jayaraman S,Manoharan M S,Illanchezian S.In vitro antimicrobial and antitumor activities of Stevia rebaudiana(Asteraceae)leaf extracts[J].Trop J Pharm Res,2008,7(4):1143.
[20]Ogawa T,Nozaki M,Matsui M.Total synthesis of stevioside[J].Tetrahedron,1980,36(18),2641-2648.
[21]Mosetting E,Nes W R.SteviosideⅡThe structure of the aglycon[J].J.Org.Chem.,1955,20:884.
[22]Xu D Y,Xu M,Lin L,et al.The effect of isosteviol on hyperglycemia and dyslipidemia induced by lipotoxicity in rats fed with high-fat emulsion[J].Life Sci,2012,90(1):30.
[23]Wong K L,Yang H Y,Chan P,et al.Isosteviol as a potassium channel opener to lower intracellular calcium concentrations in cultured aortic smooth muscle cells[J]. Planta Med,2004,70(2):108.
[24]Xu D Y,Li Y F,Wang J P,et al.The cardioprotective effect of isosteviol on rats with heart ischemia-reperfusion injury[J].Life Sci,2007,80(4):269.
[25]Mizushina Y,Akihisa T,Ukiya M,et al.Structural analysis of isosteviol and related compounds as DNA polymerase and DNA topoisomerase inhibitors[J].Life Sci,2005,77(17):2127.
[26]Wei Y,Xi L,Yao X,et al.Quantitative structure-activity relationship analysis of a series of human renal organic anion transporter inhibitors[J].Arch Pharm,2012,345(10):759.
[27]Yuajit C,Muanprasat C,Gallagher A R,et al.Steviol retards renal cyst growth through reduction of CFTR expression and inhibition of epithelial cell proliferation in a mouse model of polycystic kidney disease[J].Biochem Pharmacol,2014,88(3):412.
[28]毛近隆.天然活性成分甜菊苷化学结构修饰的研究进展[J].北京联合大学学报,2011,25(1):70.
[29]Wonganan O,Tocharus C,Puedsing C,et al.Potent vasorelaxant analogs from chemical modification and biotransformation of isosteviol[J].Eur J Med Chem,2013,62C(7):771.
[30]Zou M,Yu S,Wang Ke,et al.Glycosylation of ent-kaurene derivatives and an evaluation of their cytotoxic activities[J].Chin J Nat Med,2013,11(3):0289.
[31]Li J,Zhang D,Wu X.Synthesis and biological evaluation of novel exo-methylene cyclopentanone tetracyclic diterpenoids as antitumor agents[J].Bioorg.Med.Chem.Lett.,2011,42(21):130.
[32]Lin L,Lee L,Sheu S,et al.Study on the Stevioside analogues of Steviolbioside,Steviol,and isosteviol 19-alkyl amide dimers:synthesis and cytotoxic and antibacterial activity[J].Chem.Pharm.Bull.,2004,52(9):1117.
[33]Kataev V E,Militsina O I,Strobykina I Y,et al.Synthesis and anti-tuberculous activity of diesters based on isosteviol and dicarboxylic acids[J].Pharm.Chem.J.,2006,40(9):473.
[34]Garifullin B F,Strobykina I Y,Mordovskoi G G,et al. Synthesis and antituberculosis activity of derivatives of the diterpenoid isosteviol with azine,hydrazide,and hydrazone moieties[J].Chem.Nat.Compd.s,2011,47(1):55.
[35]Khaybullin R N,Strobykina I Y,Dobrynin A B,et al. Synthesis and antituberculosis activity of novel unfolded and macrocyclic derivatives of ent-kauranesteviol[J]. Bioorg.Med.Chem.Lett.,2012,22(22):6909.
[36]Andreeva O V,Sharipova R R,Strobykina I Y,et al. Development of synthetic approaches to macrocyclic glycoterpenoids on the basis of glucuronic acid and diterpenoid isosteviol[J].Russ.J.Org.Chem.,2015,51(9):1324.
[37]Khaybullin R N,Strobykina I Y,Gubskaya V P,et al. New maloate macrocycle bearing two isosteviol moieties and its adduct with fullerene C60[J].Mendeleev Commun,2011,21(3):134.
[38]An J Y,Zhang Y X,Wu Y,et al.Simple amphiphilic isosteviol-proline conjugates as chiral catalysts for the direct asymmetric aldol reaction in the presence of water[J]. Tetrahedron:Asymmetry,2010,21(6):688.
[39]An J Y,Wang C C,Xu Y Z,et al.Highly enantioselectiveα-aminoxylation reactions catalyzed by isosteviol-proline conjugates in buffered aqueous media[J].Catal Lett,2011,141(8):1123.
[40]An J Y,Wang C C,Liu Z P,et al.Isosteviol proline conjugates as highly efficient amphiphilic organocatalysts for asymmetric three-component mannich reactionsinthe presence of water[J].Helv Chim Acta,2012,95(1):43.
[41]Ma Z W,Liu Y X,Zhang W J,et al.highly enantioselective Michael additions of isobutyraldehyde to nitroalkenes promoted by amphiphilic bifunctional primary amine-thioureas in organic or aqueous medium[J].Eur.J. Org.Chem.2011,(33):6747.
[42]Ma Z W,Liu Y X,Huo L J,et al.Doubly stereocontrolled asymmetric Michael addition of acetylacetone to nitroolefins promoted by an isosteviol-derived bifunctional thiourea[J].Tetrahedron:Asymmetry,2012,23(6-7):443.
[43]Ma Z W,Wu Y,Sun B,et al.Thiourea-catalyzed asymmetric conjugate addition of a-substituted cyanoacetates to maleimides[J].Tetrahedron:Asymmetry,2013,24(1):7.
[44]Kataev V E,Strobykina I Y,Militsina O I,et al.Isosteviol and some of its derivatives as receptors and carriers of amino acid picrates[J].Tetrahedron Lett.,2006,47(13):2137.
[45]Kataev V E,Militsina O I,Strobykina I Y,et al.Synthesis and anti-tubercular activity of diesters on the basis of isosteviol and dicarboxylic acids[J].J.Pharm.Chem,2006,40(9):473.
[46]Zhang T,Wu Y,Gao L,et al.A novel Na+coordination mediated supramolecular organogel based on isosteviol:water-assistedself-assembly,insitu forming and selective gelation abilities[J].Soft Matter,2013,9(3):638.
[47]Lohoelter C,Brutschy M,Lubczyk D,et al.Novel supramolecular affinity materials based on(-)-isosteviol as molecular templates[J].Beilstein J.Org.Chem.,2013,9:2821.
[48]Mamedova V L,Sharafutdinova D R,Nikitina K A,et al.Metal derivatives of diterpenoid isosteviol[J].Russ.J. Gen.Chem.,2014,84(4):700.
中国取得嘧啶胺类杀菌剂开发重大突破
近日,沈阳化工研究院农药研究所(现已更名为:沈阳中化农药化工研究有限公司)刘长令团队取得了嘧啶胺类杀菌剂开发的重大突破。经过近10年时间三代化合物的研究(涉及二十多种不同结构),成功解决了困扰行业的毒性难题,这也是该团队研究30年的首次突破。利用“中间体衍生化方法”得到嘧啶胺类化合物,完全符合各大研发公司的期望和产业发展的方向:毒性低、结构新颖,性能好,性价比高。嘧啶胺类杀菌剂对霜霉病,白粉病等防治有显著效果,涉及到全世界霜霉病相关的15亿美元市场,白粉病相关的20亿美元市场,商业前景非常好。
(来源:http://cn.agropages.com/News/NewsDetail——12999.htm)
Progress in Application of Stevioside
LIU Gui-jun,SHIHao*
(College of Pharmaceutical Sciences,Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
Stevioside extracted from stevia rebaudiana,has its character of high-sweetness,low heat and a wide variety of biological activities such as antihypertensive,antihyperlipidemic,antimicrobial and so on.Stevioside can be easily obtained on a large scale and cheap,as well as its derivatives have been widely applied in food,drinks,pharmaceutical industry and organic chemistry.The progress in application of stevioside and its derivatives was summarized in this paper.
steviol glycosides;stevioside;isosteviol;derivatives
1006-4184(2016)11-0034-08
2016-04-13
浙江省自然科学基金项目(LY13B020013)。
刘贵君(1991-),女,硕士研究生,主要从事天然产物结构改造及手性识别分离研究。
*通讯作者:石浩,E-mail:shihao@zjut.edu.cn。
