跑台运动对肥胖大鼠海马内GLUT4和CD36等的影响
2016-12-19张云丽娄淑杰李静静
张云丽,娄淑杰,蔡 明,李静静,辛 磊
跑台运动对肥胖大鼠海马内GLUT4和CD36等的影响
张云丽1,2,娄淑杰1,蔡 明1,李静静1,辛 磊1
目的:探讨8周有氧耐力运动对肥胖大鼠海马内葡萄糖转运体4 (Glucose transporter 4,GLUT4)和脂肪酸转位酶(fatty acid translocase,TAT/CD36)及其相关指标的影响。方法:7周龄SD雄性大鼠随机分为普通饲料组(C)和高脂饲料组(H),分别以普通饲料和高脂饲料饲养8周后,C组大鼠随机等分为普通饲料安静组(NC)和普通饲料运动组(NE)。选取H组中体质量超过C组大鼠平均体质量加1.4倍标准差的大鼠20只,随机等分为肥胖安静组(OC)和肥胖运动组(OE)。NC组和OC组大鼠不运动,NE组和OE组大鼠经1周适应性运动后进行8周中等强度的跑台运动。末次运动结束后 24 h,禁食过夜,每组大鼠中随机选取 6 只,10%水合氯醛麻醉,冰上分离海马组织,Western blotting法检测海马内GLUT4、CD36、PI3K、p-PI3K、AMPKα、p-AMPKα、ACC和p-ACC的表达。结果:肥胖大鼠海马内CD36的蛋白表达显著增加,但GLUT4、PI3K、AMPKα和ACC的蛋白表达以及PI3K、AMPKα和ACC的磷酸化水平均无显著变化。跑台运动对肥胖大鼠海马内CD36、GLUT4、PI3K、AMPKα和ACC的蛋白表达以及PI3K、AMPKα和ACC的磷酸化水平均无显著性影响。结论:实验证实大鼠海马内存在CD36的蛋白表达,并且首次发现高脂膳食诱导的肥胖大鼠出现海马内CD36的蛋白表达显著增加,但跑台运动未能对肥胖大鼠海马内GLUT4和CD36及其相关指标产生显著性影响。
大鼠;海马;运动;高脂膳食;肥胖;葡萄糖转运体4;脂肪酸转位酶
葡萄糖转运体4 (Glucose transporter 4,GLUT4)在海马CA1-CA3区锥体细胞层以及齿状回颗粒细胞层表达[36]。中枢神经系统内GLUT4的表达和转位可能通过与外周组织类似的机制介导,如Piroli等[39]认为,胰岛素可以刺激大鼠海马内GLUT4从胞浆转位到质膜。Bakirtzi等[5]报道,在原代培养的小脑神经元,胰岛素刺激GLUT4转位到细胞表面,同时发现,长期体育锻炼可以增加小脑GLUT4的蛋白表达,进而明显增加小脑的葡萄糖摄取。然而,运动能否影响高脂膳食诱导的肥胖大鼠海马内GLUT4的蛋白表达尚不完全清楚。
外周组织中脂肪酸转位酶(fatty acid translocase,FAT/CD36)已被广泛研究,但有关CD36在大脑中作用的相关信息却鲜有报道。研究显示,CD36存在于一些脑区的神经元,如从大鼠下丘脑腹内侧核(VMN)分离的神经元,显示CD36的mRNA表达[27,28],但高脂膳食和运动能否影响大鼠海马内CD36的蛋白表达却是未知的。
针对上述问题,本实验选用普通膳食大鼠和高脂膳食诱导的肥胖大鼠为研究对象,观察运动对肥胖大鼠海马内GLUT4和CD36蛋白表达的影响。此外,本实验还评估了与GLUT4和CD36功能相关的分子,如磷酯酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC )。
1 材料与方法
1.1 实验动物
7周龄清洁级雄性SD大鼠70只,体质量190±10 g,购自上海西普尔-必凯实验动物有限公司(许可证号SCXK(沪)2013-0016)。大鼠分笼饲养,每笼3~5只,动物房温度22℃±2℃,光照遵循12 h:12 h明暗周期,自由摄食和饮水。
最初的适应性喂养结束后,将大鼠随机分为普通饲料组(C)和高脂饲料组(H),C组20只,H组50只。实验第8周末,将C组大鼠随机分为普通饲料安静组(NC)和普通饲料运动组(NE),每组10只,继续进食普通饲料。选取H组中体质量超过C组大鼠平均体质量加1.4倍标准差的大鼠[45],并随机分为肥胖安静组(OC)和肥胖运动组(OE),每组10只,继续进食高脂饲料。普通饲料及高脂饲料均由上海斯莱克实验动物有限责任公司提供(表1)。NC组1只大鼠在实验过程中因病死亡,OE组2只大鼠不能完成运动被淘汰。至运动干预结束,各组大鼠数量为NC组为9只、NE组为10只、OC组为10只、OE组为8只。所有的实验程序均经上海体育学院科学研究伦理委员会批准(批准号:No.05-2013)。实验方案符合上海体育学院实验动物管理和使用规程。
1.2 试剂和仪器
兔多克隆抗体PI3K p85、Phospho-PI3K p85(Tyr458)/p55 (Tyr199)、ACC、Phospho-ACC(Ser79),兔单克隆抗体AMPKα、Phospho-AMPKα(Thr172)、β-Actin,辣根酶标记的羊抗兔IgG二抗、彩色预染蛋白质分子量标准均购于Cell Signaling公司。BCA蛋白浓度测定试剂盒(增强型)、BeyoECL Plus (超敏ECL化学发光试剂盒)及PVDF膜购于碧云天生物试剂公司。兔多克隆抗体GLUT4购于Abcam公司,兔多克隆抗体CD36购于Santa Cruz公司,兔多克隆抗体GAPDH购于杭州贤至生物科技有限公司。膜蛋白,核蛋白和胞质蛋白抽提试剂盒购于生工生物工程(上海)有限公司。蛋白质电泳仪、蛋白质转移装置购于美国Biorad公司。
1.3 运动训练方案
NC组和OC组大鼠不运动。NE组和OE组大鼠经1周适应性运动后进行8周坡度0°的跑台运动,1次/天,5次/周。运动训练方案参考Bedford等[8]的研究制定。运动负荷安排如下:按11 m/min,10 min/天开始运动,之后每天以1 m/min增加运动速度,5 min/天增加运动时间,直至跑速为18 m/min,运动时间为40 min/天。然后维持跑速为18 m/min,运动时间为40 min/天,直至实验结束。
1.4 标本采集与储存
运动干预结束24 h后,禁食过夜,每组大鼠中随机选取 6只,10%水合氯醛麻醉,麻醉剂量为0.3 ml/100 g体重。迅速取脑,冰上分离海马组织,冻存于液氮中,后-80℃保存。
1.5 Western blot法检测海马蛋白表达
将海马组织剪碎,用蛋白抽提试剂盒依次提取胞质蛋白(用于检测PI3K-p85、pPI3K-p85-Tyr458、AMPKα和pAMPKα-Thr172、ACC、p-ACC-Ser79)和膜蛋白(用于检测GLUT4和CD36)。BCA法检测样品蛋白浓度,用裂解液将各组样品的蛋白浓度调平后,加入相应量蛋白上样缓冲液(5×),沸煮10 min,进行SDS-PAGE电泳,后转移至 PVDF膜上。然后用体积分数5%的脱脂牛奶室温摇床封闭1 h,接着依次与相应一抗4℃孵育过夜。TBST洗膜3次,每次5 min。室温孵育二抗1 h后,TBST洗膜3次,每次5 min,后用ECL法发光,显影。Gel Doc EZ凝胶成像仪(美国Bio-Rad公司)将X光片扫描成图像并保存为电脑文件后,用Image J软件进行图像分析。
1.6 统计学分析
2 结果
2.1 海马内 GLUT4和CD36蛋白表达
双因素方差分析(整体分析)结果表明,膳食因素对海马内GLUT4的蛋白表达无显著性影响(P>0.05),但对海马内CD36的蛋白表达有显著性影响(P<0.05)。运动因素对海马内GLUT4和CD36的蛋白表达均无显著性影响(P>0.05)。膳食和运动对海马内GLUT4和CD36的蛋白表达不具有显著性交互作用(P>0.05,表2)。

表2 大鼠海马内GLUT4和CD36的双因素方差分析结果一览表Table 2 Results of Two-way ANOVA on GLUT4 and CD36 in Rat Hippocampus
单因素方差分析结果显示,与NC组比较,OC组大鼠海马内GLUT4的蛋白表达有升高趋势,但差异无显著性意义(P>0.05);与NC组比较,OC组大鼠海马内CD36的蛋白表达显著增加(P<0.05);与NC组比较,NE组大鼠海马内GLUT4和CD36的蛋白表达均无显著性变化(P>0.05);与OC组比较,OE组大鼠海马内GLUT4和CD36的蛋白表达也无显著性变化(P>0.05,图1)。
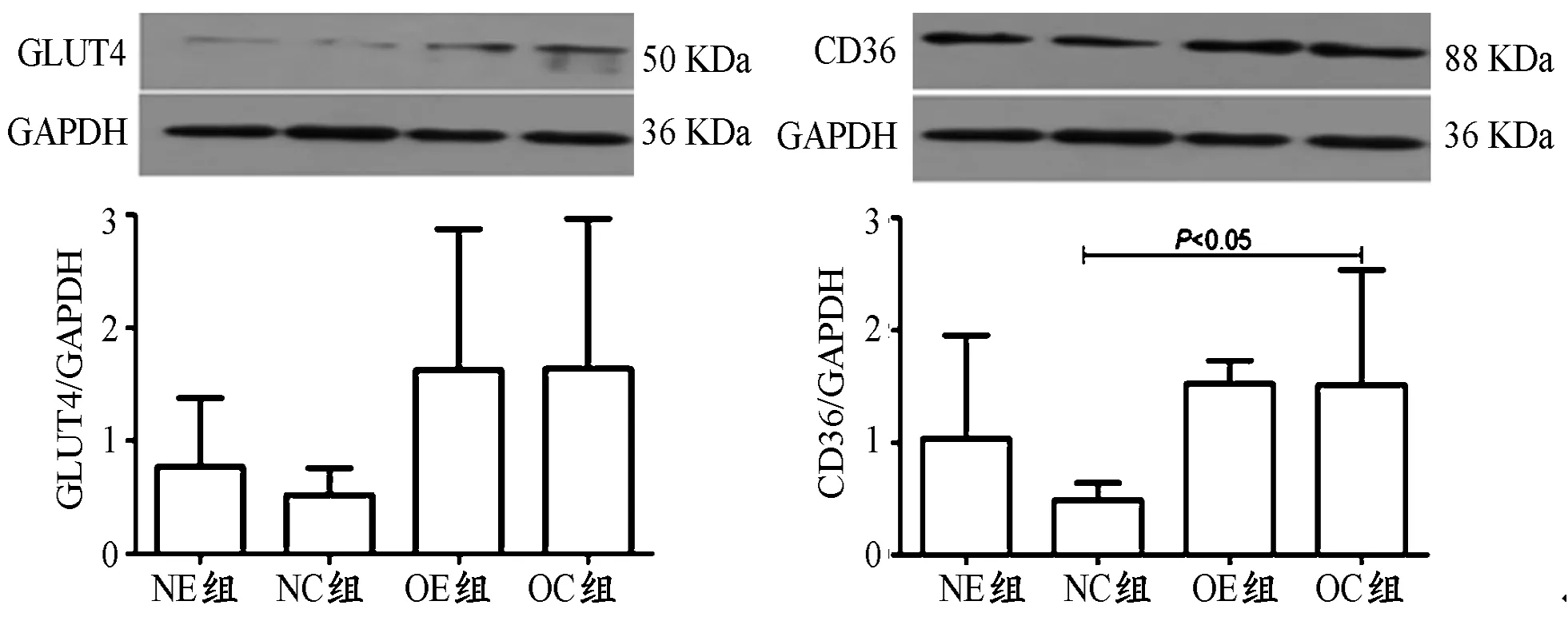
图1 海马内GLUT4和CD36蛋白表达统计图Figure 1. Expression of GLUT4 and CD36 Protein of Hippocampus
2.2 海马内PI3K和AMPK信号通路
双因素方差分析(整体分析)结果表明,膳食因素对海马内PI3K p85、pPI3K p85、AMPKα、pAMPKα、ACC和pACC均无显著性影响(P>0.05)。运动因素对海马内PI3Kp85、pPI3Kp85、AMPKα、pAMPKα、ACC和pACC均无显著性影响(P>0.05)。膳食和运动对海马内PI3Kp85、pPI3Kp85、AMPKα、pAMPKα、ACC和pACC不具有显著性交互作用(P>0.05,表3)。
单因素方差分析结果发现,与NC组比较,OC组大鼠海马内PI3K、AMPKα和ACC的蛋白表达和磷酸化水平均无显著性变化(P>0.05);与NC组比较,NE组大鼠海马内PI3K、AMPKα以及ACC的蛋白表达和磷酸化水平均无显著性变化(P>0.05);与OC组比较,OE组大鼠海马内PI3K、AMPKα和ACC的蛋白表达和磷酸化水平均无显著性变化(P>0.05,图2)。

图2 海马PI3K、AMPKα和ACC蛋白表达统计图Figure 2. Expression of PI3K,AMPKα and ACC Protein of Hippocampus
3 讨论
海马组织除了参与学习和记忆外,其对食欲和能量平衡的影响也开始被报道[10,17],如McNay等[33]认为,高脂饮食诱导的胰岛素抵抗与海马功能受损相关联。此外,McNay等[32]使用脑微透析法,发现海马依赖性自发交替任务测试中,海马细胞外葡萄糖浓度降低,提示,海马依赖的学习记忆与葡萄糖代谢有关。海马损伤引起的功能改变显著增加食物摄入和体质量,与肥胖的形成有关[18,19]。上述研究表明,能量平衡的失调以及肥胖的产生不仅与经典的下丘脑信号系统缺陷有关,海马在其中也发挥了重要作用,并且海马内能量平衡的失调可能与海马依赖性认知功能障碍之间存在关联。因此,明确高脂膳食和运动对海马内糖脂代谢相关蛋白的影响,可对深入理解营养性肥胖和胰岛素抵抗相关疾病的病理生理基础以及认知功能障碍的治疗提供一些参考。
3.1 高脂膳食和运动对大鼠海马内GLUT4的影响
葡萄糖是大脑中的主要能量供给底物,其穿过细胞膜的转运是葡萄糖代谢的第一步,运输速率由促进葡萄糖转运的葡萄糖转运蛋白决定。到目前为止,已经确定了14种葡萄糖转运蛋白家族成员。GLUT4是葡萄糖转运蛋白家族成员之一,相对分子质量约为45~55 kDa,由12个跨膜片段(M1-M12)和1个位于N 端的胞外环状结构域组成。
本实验发现,高脂膳食诱导的肥胖大鼠海马内GLUT4的蛋白表达无显著性变化,另外,运动干预对肥胖大鼠海马内GLUT4的蛋白表达也无显著性影响。高脂膳食和运动干预对大鼠海马内GLUT4的蛋白表达无显著性影响的原因可能与以下因素有关:1)海马内GLUT4的浓度较低,如Detka等[20]研究了海马中3种葡萄糖转运蛋白的表达,发现GLUT1浓度最高,其次是GLUT3,而GLUT4浓度最低;2)海马内葡萄糖的运输以GLUT1和GLUT3为主,如Duelli等[21]报道,海马中大多数葡萄糖摄取是通过表达于微血管和神经胶质细胞的GLUT1以及表达于神经元突起[30]的GLUT3介导;3)海马内GLUT1和GLUT3的运输也许能够满足本实验中大鼠海马内葡萄糖代谢的需求,正如Emmanuel等[22]提出,GLUT1和GLUT3的运输足够满足休息时葡萄糖代谢的需求,只有在持续的认知活动过程中能源利用激增时才需要额外诱导GLUT4的参与。
Winocur等[42]报道,肥胖Zucker大鼠海马内GLUT4由胞浆向质膜的转位降低。赵海燕等[3]认为,GLUT4的表达减少、转位受阻及含GLUT4的囊泡不能与细胞膜融合或已融合但GLUT4活性降低等因素均可导致葡萄糖摄取出现障碍。转位后GLUT4的活性降低可能与p38分裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)有关,但目前对于p38MAPK的具体作用机制以及是否存在其他因子参与GLUT4内在活性的调节还有待进一步研究证实[1]。
由于本研究所使用的蛋白抽提试剂盒只能提取总膜蛋白,无法分离获得纯化的细胞内外膜蛋白,此局限性导致无法确定长期高脂膳食和运动干预对海马内GLUT4转位的影响。另外,本研究也未能进一步确定长期高脂膳食和运动干预对海马内GLUT4内在活性的影响,因此,检测海马内GLUT4的转位以及内在活性的变化将成为以后的一个研究方向。
3.2 高脂膳食和运动对大鼠海马内PI3K的影响
高脂膳食除了可以影响胰岛素作用的外周靶器官的胰岛素敏感性,还可以影响脑内某些区域的胰岛素敏感性,引起中枢胰岛素抵抗的出现。Pratchayasakul 等[40]研究发现,12周高脂膳食引起大鼠脑内神经元胰岛素受体(insulin receptor ,IR),胰岛素受体底物-1(insulin receptor substrate 1,IRS-1)和蛋白激酶B (protein kinase B ,PKB,也被称为Akt)的磷酸化水平均出现下降。但McNeilly等[35]研究表明,高脂饮食喂养的动物虽然出现外周胰岛素抵抗,但海马内胰岛素信号并没有发生显著性改变。可见,外周胰岛素抵抗与海马内胰岛素信号的改变之间并非总是保持一致。
McEwen 等[31]发现,胰岛素受体与敏感性葡萄糖转运蛋白GLUT4均在海马内表达。Grillo等[24]报道,侧脑室注射胰岛素增加Akt磷酸化,同时伴随GLUT4转位到海马质膜增加,这可由PI3K抑制剂阻断。对人神经母细胞瘤细胞进行的研究也表明,胰岛素以PI3K依赖性方式刺激GLUT4转位到质膜,并增加葡萄糖摄取[11]。除了影响GLUT4的转位,PI3K信号通路活化还可以诱导GLUT4蛋白表达,并促进能量代谢和细胞存活[9]。McNay等[34]认为,IRS-PI3K-GLUT4信号通路是中枢神经系统内胰岛素作用最可能的信号转导途径,因此,该信号通路可能在海马葡萄糖代谢中发挥了重要作用。鉴于GLUT4和胰岛素信号通路之间的密切关联,本研究进一步检测了海马内胰岛素信号通路的关键分子之一——PI3K。如同高脂膳食诱导的肥胖对GLUT4的影响,本实验并没有检测到肥胖大鼠海马内胰岛素信号通路的关键分子PI3K磷酸化水平的显著变化,这意味着,海马胰岛素信号级联的近端部分并没有因为17周高脂膳食而受损,该实验结果与McNeilly等[35]的实验结果类似。另外,本实验未发现8周跑台运动对肥胖大鼠海马PI3K磷酸化水平有显著性影响,这一结果与运动对肥胖大鼠海马GLUT4蛋白表达的影响相一致。本实验结果表明,海马内PI3K的激活以及膜蛋白GLUT4的表达不受17周高脂膳食和8周运动干预的显著影响。
3.3 高脂膳食和运动对大鼠海马内CD36的影响
除了葡萄糖代谢,脂质代谢对于大脑也至关重要。Ouellet等[37]证实,二十二碳六烯酸和二十碳五烯酸可以通过扩散通过血脑屏障,但该研究也承认脂肪酸转运蛋白的参与。CD36属于B类清道夫受体家族,是一种表面糖蛋白,定位于细胞的囊泡膜、质膜和线粒体膜上[12,13]。Xu等[44]认为,CD36可以在不影响脂肪酸质膜通量的情况下,通过增强脂肪酸的细胞内代谢来增加脂肪酸的摄取。研究表明,CD36表达于小鼠多个脑区的神经细胞[23],那么,海马是否存在CD36蛋白表达?齐勇等[2]通过免疫组化法发现,正常大鼠和脑出血大鼠海马处血管内皮细胞存在CD36表达。本实验通过Western blotting法证实,大鼠海马内存在CD36的蛋白表达,并且首次发现,高脂肪饮食诱导的肥胖可以引起海马CD36蛋白表达显著增加,表明高脂饮食引起的代谢改变可以调节海马脂肪酸转运蛋白的表达,进而可能增加海马对脂肪酸的摄取和利用,这将减少葡萄糖供能,这也许是高脂膳食诱导的肥胖对海马GLUT4和PI3K无显著影响的原因之一。另外,本实验发现,8周跑台运动对大鼠海马CD36蛋白表达无显著性影响。这与本研究对GLUT4的检测类似,由于无法获得纯化的质膜蛋白和线粒体膜蛋白,因此,无法确定高脂膳食和运动干预是否影响CD36向质膜或线粒体膜的转位。
值得注意的是,CD36在中枢神经系统中发挥多种作用。脑缺血时,CD36在促进炎症反应中发挥关键作用[15],此外,CD36还可能参与了缺血后星形胶质瘢痕的形成[6]。有趣的是,CD36还被证明与阿尔茨海默氏病有关,过表达淀粉样前体蛋白的小鼠缺失CD36,可改善认知功能的恶化[38]。虽然本研究证实了CD36在海马内表达,但是,有关CD36在海马中究竟发挥何种作用及其作用机制却是未知的,需要进一步深入探讨。
3.4 高脂膳食和运动对大鼠海马内AMPK-ACC信号通路的影响
Chabowski等[14]报道,用激动剂AICAR药理激活心肌细胞 AMPK的同时,CD36的mRNA及蛋白表达水平均显著增加。那么,高脂膳食诱导的肥胖引起的海马CD36蛋白表达升高是否与AMPK信号通路有关?虽然,AMPK在外周组织代谢调控中的重要性已被认知许久,但其在大脑功能中的作用却是近些年才被研究。Culmsee等[16]报道,AMPK的催化亚基(alpha1和alpha2)和非催化亚基(β2和γ1)在海马神经元表达。AMPK级联反应的一个主要靶点是ACC[43],AMPK的激活可以磷酸化ACC的Ser79位点导致ACC的失活[26]。ACC可以将乙酰辅酶A转变为丙二酸单酰辅酶A,而丙二酰辅酶A是脂肪酸从头合成的主要构件以及肉碱棕榈酰转移酶1的变构抑制剂[25]。AMPK通过调节下游ACC和肉碱棕榈酰转移酶1在控制脂质代谢中起核心作用[41]。
鉴于肥胖大鼠海马CD36蛋白表达的改变可能与AMPK信号通路有关以及AMPK和ACC在脂质代谢中的重要作用,本实验进一步评估了AMPK和ACC的蛋白表达以及磷酸化水平。本研究发现,AMPKα和ACC均在海马内表达,但高脂膳食诱导的肥胖大鼠海马AMPKα和ACC蛋白表达和磷酸化水平均无显著变化。本实验结果显示,肥胖大鼠海马CD36蛋白表达升高与AMPK信号通路的变化并不一致。Andersson等[4]的研究表明,运动本身并不引起大鼠下丘脑AMPK活性的显著变化。同样,本研究也显示,运动对正常和肥胖大鼠海马AMPKα和ACC活性无显著影响。但Marosi等[29]的研究结果表明,15周的运动引起大鼠海马AMPK磷酸化水平增加。本实验与Marosi等的研究结果出现不同的原因可能来自运动周期长短的差异,Marosi等采用的运动周期长达15周,而本实验采用的运动周期仅为8周。Bayod等[7]报道,36周运动干预后,大鼠不同的大脑区域,包括海马磷酸化AMPK水平增加。总之,海马AMPK的激活可能是运动干预的关键靶分子,但运动干预对AMPK信号通路发挥显著影响可能需要较长的时间。
4 结论
本研究证实大鼠海马内存在CD36蛋白表达,且首次发现高脂膳食诱导的肥胖可以引起大鼠海马CD36蛋白表达显著升高。但海马GLUT4蛋白表达以及PI3K、AMPKα和ACC的蛋白表达和磷酸化水平均不受高脂膳食和运动干预的显著影响。
[1]刘树欣,刘玉倩,王海涛,等.运动对葡萄糖转运蛋白4介导的骨骼肌糖摄取调节机制的研究进展[J].中国康复医学杂志,2010,25(6):592-594.
[2]齐勇,唐涛,罗杰坤,等.益气活血法对脑出血大鼠脑内TSP-1、TSP-2及其受体CD36表达的影响[J].中国老年学杂志,2007,27(10):913-916.
[3]赵海燕,王勇,马永平,等.胰岛素信号转导障碍与胰岛素抵抗[J].新医学,2010,41 (4):267-271.
[4]ANDERSSON U,TREEBAK J T,NIELSEN J N,etal.Exercise in rats does not alter hypothalamic AMP-activated protein kinase activity[J].Biochem Biophys Res Commun,2005,329(2):719-725.
[5]BAKIRTZI K,BELFORT G,LOPEZ-COVIELLA I,etal.Cerebellar neurons possess a vesicular compartment structurally and functionally similar to Glut4-storage vesicles from peripheral insulin- sensitive tissues[J].J Neurosci,2009,29(16):5193-5201.
[6]BAO Y,QIN L,KIM E,etal.CD36 is involved in astrocyte activation and astroglial scar formation[J].J Cereb Blood Flow Metab,2012,32(8):1567-1577.
[7]BAYOD S,DEL VALLE J,CANUDAS A M,etal.Long-term treadmill exercise induces neuroprotective molecular changes in rat brain[J].J Appl Physiol (1985),2011,111(5):1380-1390.
[8]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[9]BENARROCH E E.Insulin-like growth factors in the brain and their potential clinical implications[J].Neurology,2012,79(21):2148-2153.
[10]BENOIT S C,DAVIS J F,DAVIDSON T L.Learned and cognitive controls of food intake[J].Brain Res,2010,1350:71-76.
[11]BENOMAR Y,NAOUR N,AUBOURG A,etal.Insulin and leptin induce Glut4 plasma membrane translocation and glucose uptake in a human neuronal cell line by a phosphatidylinositol 3-kinase-dependent mechanism[J].Endocrinology,2006,147(5):2550-2556.
[12]BONEN A,CAMPBELL S E,BENTON C R,etal.Regulation of fatty acid transport by fatty acid translocase/CD36[J].Proc Nutr Soc,2004,63(2):245-249.
[13]CAMPBELL S E,TANDON N N,WOLDEGIORGIS G,etal.A novel function for fatty acid translocase (FAT)/CD36:Involvement in long chain fatty acid transfer into the mitochondria[J].J Biol Chem ,2004,279(35):36235-36241.
[14]CHABOWSKI A,MOMKEN I,COORT S L,etal.Prolonged AMPK activation increases the expression of fatty acid transporters in cardiac myocytes and perfused hearts[J].Mol Cell Biochem,2006,288(1-2):201-212.
[15]CHO S,PARK E M,FEBBRAIO M,etal.The class B scavenger receptor CD36 mediates free radical production and tissue injury in cerebral ischemia[J].J Neurosci,2005,25(10):2504-2512.
[16]CULMSEE C,MONNIG J,KEMP B E,etal.AMP-activated protein kinase is highly expressed in neurons in the developing rat brain and promotes neuronal survival following glucose deprivation[J].J Mol Neurosci ,2001,17(1):45-58.
[17]DAVIDSON T L,CHAN K,JARRARD L E,etal.Contributions of the hippocampus and medial prefrontal cortex to energy and body weight regulation[J].Hippocampus,2009,19(3):235-252.
[18]DAVIDSON T L,KANOSKI S E,CHAN K,etal.Hippocampal lesions impair retention of discriminative responding based on energy state cues[J].Behav Neurosci,2010,124(1):97-105.
[19]DAVIDSON T L,KANOSKI S E,SCHIER L A,etal.A potential role for the hippocampus in energy intake and body weight regulation[J].Curr Opin Pharmacol,2007,7(6):613-616.
[20]DETKA J,KUREK A,BASTA-KAIM A,etal.Elevated brain glucose and glycogen concentrations in an animal model of depression[J].Neuroendocrinology,2014,100:178-190.
[21]DUELLI R,MAURER M H,STAUDT R,etal.Correlation between local glucose transporter densities and local 3-O-methylglucose transport in rat brain[J].Neurosci Lett,2001,310:101-104.
[22]EMMANUEL Y,COCHLIN L E,TYLER D J,etal.Human hippocampal energy metabolism is impaired during cognitive activity in a lipid infusion model of insulin resistance[J].Brain Behav,2013,3(2):134-144.
[23]GLEZER I,BITTENCOURT J C,RIVEST S.Neuronal expression of Cd36,Cd44,and Cd83 antigen transcripts maps to distinct and specific murine brain circuits[J].J Comp Neurol,2009,517(6):906-924.
[24]GRILLO C A,PIROLI G G,HENDRY R M,etal.Insulin-stimulated translocation of GLUT4 to the plasma membrane in rat hippocampus is PI3-kinase dependent[J].Brain Res,2009,1296:35-45.
[25]HARDIE D G,CARLING D.The AMP-activated protein kinase--fuel gauge of the mammalian cell[J].Eur J Biochem,1997,246(2):259-273.
[26]HARDIE D G,PAN D A.Regulation of fatty acid synthesis and oxidation by the AMP-activated protein kinase[J].Biochem Soc Trans,2002,30(pt 6):1064-1070.
[27]LE F C,DUNN-MEYNELL A,MUSATOV S,etal.FAT/CD36:A major regulator of neuronal fatty acid sensing and energy homeostasis in rats and mice[J].Diabetes,2013,62(8):2709-2716.
[28]LE F C,IRANI B G,MAGNAN C,etal.Characteristics and mechanisms of hypothalamic neuronal fatty acid sensing[J].Am J Physiol Regul Integr Comp Physiol,2009,297(3):R655-R664.
[29]MAROSI K,BORI Z,HART N,etal.Long-term exercise treatment reduces oxidative stress in the hippocampus of aging rats[J].Neuroscience,2012,226:21-28.
[30]MCCALL A L,VAN BUEREN A M,MOHOLT-SIEBERT M,etal.Immunohistochemical localization of the neuron-specific glucose transporter (GLUT3) to neuropil in adult rat brain[J].Brain Res,1994,659(1-2):292-297.
[31]MCEWEN BS,REAGAN LP.Glucose transporter expression in the central nervous system:Relationship to synaptic function[J].Eur J Pharmacol,2004,490(1-3):13-24.
[32]MCNAY E C,MCCARTY R C,GOLD P E.Fluctuations in brain glucose concentration during behavioral testing:dissociations between brain areas and between brain and blood[J].Neurobiol Learn Mem,2001,75(3):325-337.
[33]MCNAY E C,ONG C T,MCCRIMMON R J,etal.Hippocampal memory processes are modulated by insulin and high-fat-induced insulin resistance[J].Neurobiol Learn Mem,2010,93(4):546-553.
[34]MCNAY E C,RECKNAGEL A K.Brain insulin signaling:A key component of cognitive processes and a potential basis for cognitive impairment in type 2 diabetes[J].Neurobiol Learn Mem,2011,96(3):432-442.
[35]MCNEILLY A D,WILLIAMSON R,BALFOUR D J,etal.A high-fat-diet-induced cognitive deficit in rats that is not prevented by improving insulin sensitivity with metformin[J].Diabetologia,2012,55(11) :3061-3070.
[36]MESSARI S E,T-IKHLEF A,AMBROISE D H,etal.Expression of insulin-responsive glucose transporter GLUT4 mRNA in the rat brain and spinal cord:An in situ hybridization study[J].J Chem Neuroanat,2002,24(4):225-242.
[37]OUELLET M,EMOND V,CHEN C T,etal.Diffusion of docosahexaenoic and eicosapentaenoic acids through the blood-brain barrier:An in situ cerebral perfusion study[J].Neurochem Int,2009,55(7):476-482.
[38]PARK L,WANG G,ZHOU P,etal.Scavenger receptor CD36 is essential for the cerebrovascular oxidative stress and neurovascular dysfunction induced by amyloid-beta[J].Proc Natl Acad Sci U S A,2011,108(12):5063-5068.
[39]PIROLI G G,GRILLO C A,REZNIKOV L R,etal.Corticosterone impairs insulin-stimulated translocation of GLUT4 in the rat hippocampus[J].Neuroendocrinology,2007,85(2):71-80.
[40]PRATCHAYASAKUL W,KERDPHOO S,PETSOPHON-SAKUL P,etal.Effects of high-fat diet on insulin receptor function in rat hippocampus and the level of neuronal corticosterone[J].Life Sci,2011,88:619-627.
[41]RONNETT G V,KLEMAN A M,KIM E K,etal.Fatty acid metabolism,the central nervous system,and feeding [J].Obesity (Silver Spring),2006,14(suppl 5):201S-207S.
[42]WINOCUR G,GREENWOOD C E,PIROLI G G,etal.Memory impairment in obese Zucker rats:an investigation of cognitive function in an animal model of insulin resistance and obesity[J].Behav Neurosci,2005,119(5):1389-1395.
[43]WINDER W W,HARDIE D G.Inactivation of acetyl-CoA carboxylase and activation of AMP-activated protein kinase in muscle during exercise[J].Am J Physiol,1996,270(2 pt 1):E299-E304.
[44]XU S,JAY A,BRUNALDI K,etal.CD36 enhances fatty acid uptake by increasing the rate of intracellular esterification but not transport across the plasma membrane[J].Biochemistry,2013,52(41):7254-7261.
[45]ZHANG H X,MAO L M,LIU L G,etal.Adiponectin levels in dietary induced obesity and obesity-resistant rats[J].Acta Nutrimenta Sinica,2010,32(4):316-319.
Effects of Treadmill Exercise on GLUT4,CD36 and Related Proteins in the Hippocampus of Obese Rats
ZHANG Yun-li1,2,LOU Shu-jie1,CAI Ming1,LI Jing-jing1,XIN Lei1
Objective:To investigate the impact of 8-week aerobic endurance exercise training on glucose transporter 4 (GLUT4),fatty acid translocase(CD36) and related indexes in the hippocampus of obese rats. Methods:7-week-old male SD rats were randomly divided into normal diet group (C) and high fat diet group (H). The rats were maintained for 8 weeks on either normal diet or high fat diet. And then,the rats in group C were randomly and equally divided into normal diet sedentary group (NC) and normal diet exercise group (NE). Twenty rats in group H,whose body weight values were above the mean value plus 1.4 times the standard deviations of the body weights of rats in group C,were picked out and then randomly divided into obese sedentary group (OC) and obese exercise group (OE). Rats in group NC and group OC were without exercise training. Rats in group NE and group OE were performed an 8-week moderate intensity treadmill exercise training after being adapted to the treadmill for a week. The rats were fasted overnight 24 hours after the last exercise training,and then 6 rats were randomly selected in each group,anaesthetized with 10% chloral hydrate. Hippocampal tissues were isolated in ice bath. The expressions of GLUT4,CD36,PI3K,p-PI3K,AMPKα,p-AMPKα,ACC and p-ACC were detected by Western blotting. Results:The protein expression of CD36 in the hippocampus of obese rats was significantly increased,but the protein expressions of GLUT4,PI3K,AMPKα and ACC as well as the phosphorylation levels of PI3K,AMPKα and ACC were not significantly changed. The treadmill exercise training did not show significant effects on the protein expressions of CD36,GLUT4,PI3K,AMPKα and ACC as well as the phosphorylation levels of PI3K,AMPKα and ACC in the hippocampus of obese rats. Conclusion:The results demonstrated that CD36 protein was expressed in rat hippocampus,and this study found for the first time that CD36 protein expression increased significantly in the hippocampus of high fat diet-induced obese rats,while the treadmill exercise training did not exert significant effects on GLUT4,CD36 and related indexes.
rats;hippocampus;exercise;highfatdiet;obesity;glucosetransporter4;fattyacidtranslocase
2016-01-01;
2016-06-29
国家自然科学基金项目(81572241),上海市人类运动能力开发与保障重点实验室(上海体育学院)基金项目(11DZ2261100)。
张云丽(1977-),女,江苏徐州人,讲师,在读博士研究生,主要研究方向为运动和脑健康,Tel:(0635)8539810,E-mail:zhangyunli@lcu.edu.cn;娄淑杰(1963-),女,内蒙古人,教授,博士,博士研究生导师,主要研究方向为运动神经生物学,Tel:(021)51253243,E-mail:shujielou319@163.com;蔡明(1986-),男,山东日照人,在读博士研究生,主要研究方向为运动神经生物学,E-mail:ethan321@126.com。
1.上海体育学院 运动科学学院,上海 200438;2.聊城大学 体育学院,山东 聊城 252059 1.Shanghai University of Sport,Shanghai 200438,China;2.Liaocheng University,Liaocheng 252059,China.
G804.2
A
10.16469/j.css.201607007
