海岛棉GbTCP15基因的克隆与表达分析
2016-12-17倪志勇曲延英蔡永生陈全家
郑 凯,倪志勇,曲延英,王 怡,蔡永生,陈全家
(新疆农业大学 农学院/农业生物技术重点实验室,乌鲁木齐 830052)
海岛棉GbTCP15基因的克隆与表达分析
郑 凯,倪志勇,曲延英,王 怡,蔡永生,陈全家*
(新疆农业大学 农学院/农业生物技术重点实验室,乌鲁木齐 830052)
根据陆地棉GhTCP15基因序列,设计1对引物,通过PCR技术从海岛棉品种‘新海21号’中克隆一个同源基因,命名为GbTCP15。海岛棉GbTCP15基因具有一个1 056 bp开放阅读框,编码351个氨基酸,预测分子量约为38 057.4 kD,等电点为9.01,序列中含有一个高度保守的TCP结构域。氨基酸序列对比表明,海岛棉GbTCP15蛋白与其他植物中的TCP蛋白有较高的一致性,说明该基因在进化过程中是相当保守的。亚细胞定位结果显示,GbTCP15主要分布在细胞核上,推测GbTCP15在复制和转录的过程中发挥着信号转导以及转录调控等作用。进化树分析表明,海岛棉GbTCP15基因与雷蒙德氏棉GrTCP15基因分布在同一分支上。实时荧光定量PCR表明,海岛棉GbTCP15基因在茎部和15 d纤维中表达量较高。研究表明,GbTCP15转录因子可能参与棉花纤维以及表皮毛的发育。
海岛棉;TCP;克隆;序列分析;表达分析
TCP家族是植物特有的一类转录因子,在植物中广泛存在,同时也在植物的生长发育过程中起重要作用,目前已知在拟南芥中有24个TCP转录因子[1],在水稻中有20个TCP转录因子[2]。早期发现的4个TCP基因分别为玉米(Zeamays)的TB1(teosintebranched1)、金鱼草(Antirrrhinummajus)的CYC(cycloidea),以及水稻(Oryzasativa)的PCF1和PCF2(proliferatingcellfactors1,proliferatingcellfactors2),TCP则分别来自这几个基因名称的首字母[3]。通过对这4个基因序列比较发现,序列中均含有一个由60个氨基酸组成的高度保守的区域,也叫TCP结构域(TCP domain),能够形成一个碱性-螺旋-环-螺旋的结构又称(bHLH结构域)[4]。推测TCP结构域的功能可能作用于蛋白二聚化以及与DNA结合这些方面。除了bHLH结构外,CYC和TB1还有一个保守的富含极性氨基酸的区域[3],大约有18个氨基酸组成,可以形成一个亲水α螺旋的R结构区。
根据TCP基因家族与DNA结合的位点序列不同,TCP家族又被分为2个亚族(ClassⅠ和ClassⅡ)。由于TCP结构的差异,ClassⅡ类又被分成两类进化分支。一类是含有金鱼草生长调节因子cincinnata,称为CIN支;另一类在bHLH区之间有一个富含谷氨酸和半胱氨酸的保守区域ECE区(也称ECE支),包括CYC、TB1以及拟南芥的TCP1、TCP12等[5-6]。在功能上大致也分两类,即ClassⅠ类和ClassⅡ类,ClassⅠ类在植物生长发育过程中发挥正调控的功能,主要是促进细胞分化,在植物分生组织中起作用[7];ClassⅡ类对生长发育进行负调控,主要是抑制细胞的增值[8]。目前,针对棉花纤维发育相关的TCP转录因子的研究还很少。夏桂先研究组从陆地棉中克隆了一个GhTCP14转录因子,研究表明GhTCP14可能是生长素调控纤维起始和伸长的一个上游调控子[9]。张献龙研究组在海岛棉中分离了一个TCP家族的转录因子GbTCP,在棉纤维伸长期(5~15 d)高表达[10]。
TCP家族的转录因子在植物的整个生长周期中参与多种途径的调控。然而,有关TCP转录因子参与调控棉花纤维发育的相关研究还不是很多,尤其是在海岛棉纤维发育时期的功能还有待进一步的探究。本研究从海岛棉中克隆一个TCP转录因子GbTCP15,分析该基因的蛋白结构和表达特征,为今后棉花TCP转录因子在纤维发育阶段的功能及分子机制的研究奠定基础。
1 材料和方法
1.1 试验材料
棉花品种‘新海21号’由新疆农业大学农业生物技术重点实验室提供,试验材料于2015年7月种植在阿克苏16团新疆农业科学研究院试验基地。按照正常田间管理,在花期挂牌标记棉铃,开花当天记为0 d以及开花后的5 d、10 d、15 d、20 d、25 d、30 d(开花天数)的棉花纤维,以及开花当天的花瓣、花萼、子房以及柱头,取样后置于液氮速冻后保存于-80 ℃冰箱备用。
室内取‘新海21号’种子剥去种皮,将种仁浸泡于70 %无水乙醇消毒3 min后,用无菌水反复冲洗3~5次,将种子平铺在放有滤纸的发芽盒中,28 ℃暗培养4 d然后取下胚轴,剩余的移植到营养液中继续生长,待第一片真叶展开时,取根、茎、叶,将样品置于液氮速冻后保存于-80℃冰箱,用于提取总RNA。
1.2 方 法
1.2.1 棉花总RNA提取及第一链cDNA合成 按Trizol试剂盒(Tiangen)使用说明,分别提取0 d、5 d、10 d、15 d、20 d、25 d、30 d以及根、茎、叶、下胚轴和开花当天的花瓣、花萼、子房、柱头的总RNA。使用DnaseⅠ(Tiangen)去除基因组DNA污染。按照First Strand cDNA Synthesis试剂盒(Thermo试剂公司)说明书操作步骤,以获得不同时期棉花纤维和其他组织的总RNA为模板,反转录合成cDNA第一链。
1.2.2 海岛棉GbTCP15基因的克隆及序列分析 以拟南芥AtTCP15基因(AT1G69690.1)序列作为BlaseP查询序列,在全基因组信息库(https://phytozome.jgi.doe.gov)和美国国家生物技术信息中心(http://www.ncbi.nlm.nih.gov)中搜索棉花TCP家族基因与AtTCP15序列保守的序列,将其在已经公布的棉花数据库中比对,获得1个cDNA序列,然后根据该序列的ORF设计了引物。

表1 引物序列
根据海岛棉GbTCP15 基因的cDNA序列设计引物,用引物GbTCP15-F 和GbTCP15-R 扩增GbTCP15 ORF(表1),以棉花纤维0 d的cDNA第一链为模板,扩增基因。扩增体系为25 μL,其中含有cDNA 1 μL;10×缓冲液(含Mg2+)2.5 μL;2.5 mmol/L dNTP 2 μL;Taq酶0.5 μL;正反引物各1 μL,补充水到25 μL。PCR反应条件为94 ℃预变性3 min;94 ℃变性30 s;55 ℃复性30 s;72 ℃延伸1 min,35个循环,72 ℃延伸1 min。PCR产物置1%琼脂糖中电泳,经紫外凝胶成像仪观察结果。采用琼脂糖凝胶回收试剂盒(TIANGEN )回收目的片段,回收产物与 载体pEASY-T1(全式金生物公司)连接后转化Trans1-T1 Phage Resistant 感受态细胞(全式金生物公司),涂在含有卡那抗性的LB固体培养基上,过夜培养后,挑取阳性克隆经菌液PCR验证后,将阳性克隆送深圳华大基因公司测序。
1.2.3 生物信息学分析 将所得的GbTCP15基因的ORF用DNAMAN翻译成蛋白序列,利用SMART软件预测蛋白质的保守功能域(http://smart.embl-heidelberg.de/)。用EXPASy的Prot-Param tool 在线程序(http://web.expasy.org/cgi-bin/protparam/protparam)预测蛋白的分子量和等电点。使用在线软件InterProScan(http://www.ebi.ac.uk/interpro/sequencesearch)对蛋白质进行一级结构分析。利用PSIRRED Server工具预测蛋白质的二级结构(http://bioinf.cs.ucl.ac.uk/psipred/)。利用SWISS-MODEL工具预测蛋白质三级结构(http://swissmodel.expasy.org/)。利用DNAMAN软件和Blast检索GenBank进行多重序列比对和同源性分析。用ClustalX比对蛋白氨基酸序列,用MEGA6.0软件构建系统进化树,采用邻位相连法(Neighbor-Joining, NJ)构建进化树,BootStrap 参数设置为1000次重复,使分支结果更为可靠。用Post(http://www.psort.org/)在线工具预测蛋白的亚细胞定位。
1.2.4 实时荧光定量PCR 根据GbTCP15基因的cDNA序列设计引物GbTCP15-qF和GbTCP15-qR,以GbUBQ7基因为内参基因,扩增引物为GbUBQ7-F和GbUBQ7-R(表1),利用实时荧光定量PCR,以棉花开花当天(0 d)的胚珠和开花后5 d、10 d、15 d、20 d、25 d、30 d的纤维组织反转录的产物以及根、茎、叶、下胚轴和开花当天的花瓣、花萼、子房、柱头反转录的产物为模板,检测GbTCP15基因在不同组织和不同发育时期棉纤维中的表达情况。20 μL PCR扩增体系为:混合液2×TransStart Tip Green qPCR SuperMix 10 μL(全式金生物公司);校正液Passive Reference Dye(50×)0.4 μL(全式金生物公司);正反引物各0.4 μL;模板1 μL;ddH2O 7.8 μL。用实时荧光定量专用96孔板(applied biosystems,美国),ABI 7500 Fast荧光定量PCR仪(ABI Prism,美国)进行实时定量PCR分析,每个样品重复3次。采用两步法,PCR程序为94 ℃ 30 s;94 ℃ 5 s,60℃ 30 s,共40个循环;结果采用2-ΔΔCt法处理数据,并制作柱形图显示该基因在不同棉花组织和不同棉纤维时期的表达情况。试验进行3次生物学重复。
2 结果与分析
2.1 海岛棉GbTCP15基因的克隆与序列分析
以‘新海21号’5 d 棉花纤维cDNA为模板,根据引物GbTCP15-F和GbTCP15-R,用RT-PCR方法,获得目的片段。GbTCP15编码区长1 056 bp(图1),运用DNAMAN分析得出,该编码区编码351个氨基酸,其中丝氨酸占11.7%,苏氨酸占8.5%,甘氨酸和脯氨酸各占8.3%,亮氨酸占7.4%,丙氨酸占6.8%;预测分子量为38 057.4 kD,等电点为9.01。通过NetPhos 2.0 Serve预测GbTCP15蛋白的磷酸化位点(图2),GbTCP15含有26个丝氨酸(Ser)、8个苏氨酸(Thr)、1个络氨酸(Tyr)位点。由此推测磷酸化作用可能主要与这2个蛋白的活性调控有关。
通过对蛋白质结构域分析发现(图3)GbTCP15蛋白的N端具有一个TCP家族特有保守结构域,该结构域为ClassⅠ型TCP家族基因所特有的,因此认定该基因属于棉花TCP转录因子家族。

M. Marker;1. GbTCP15图1 棉花GbTCP15基因PCR产物电泳分析Fig.1 Electrophoresis of PCR product of cotton GbTCP15 genes

图2 GbTCP15蛋白磷酸化位点预测Fig.2 GbTCP15 protein phosphorylation sites prediction
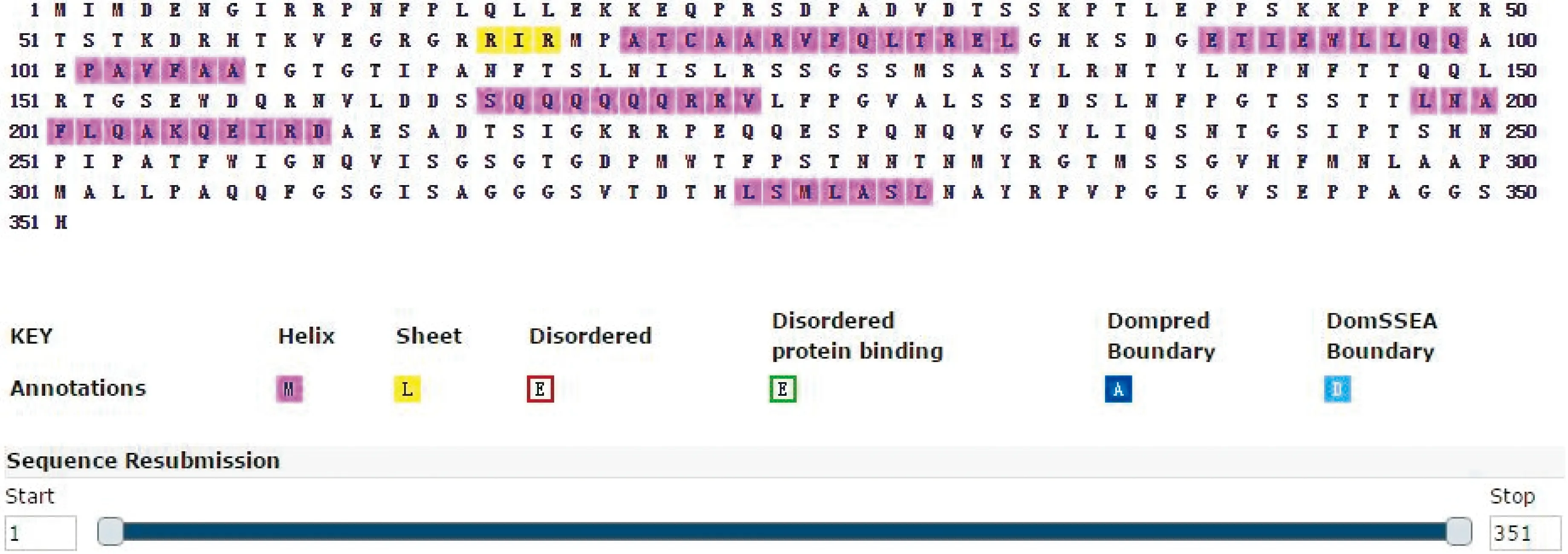
Helix.α螺旋;Sheet.β折叠 图4 GbTCP15蛋白的氨基酸二级结构预测Helix. Alpha helix;Sheet. Beta foldingFig.4 GbTCP15 protein secondary structure prediction

A. GbTCP15蛋白的氨基酸序列;B. 蛋白结构示意图,方框部分代表TCP结构域图3 GbTCP15蛋白的氨基酸序列以及蛋白结构示意图A. Amino acid sequence of GbTCP15;B. Schematic diagram of GbTCP15,Box part represents TCP domain structureFig.3 GbTCP15 protein amino acid sequence and protein structure diagram
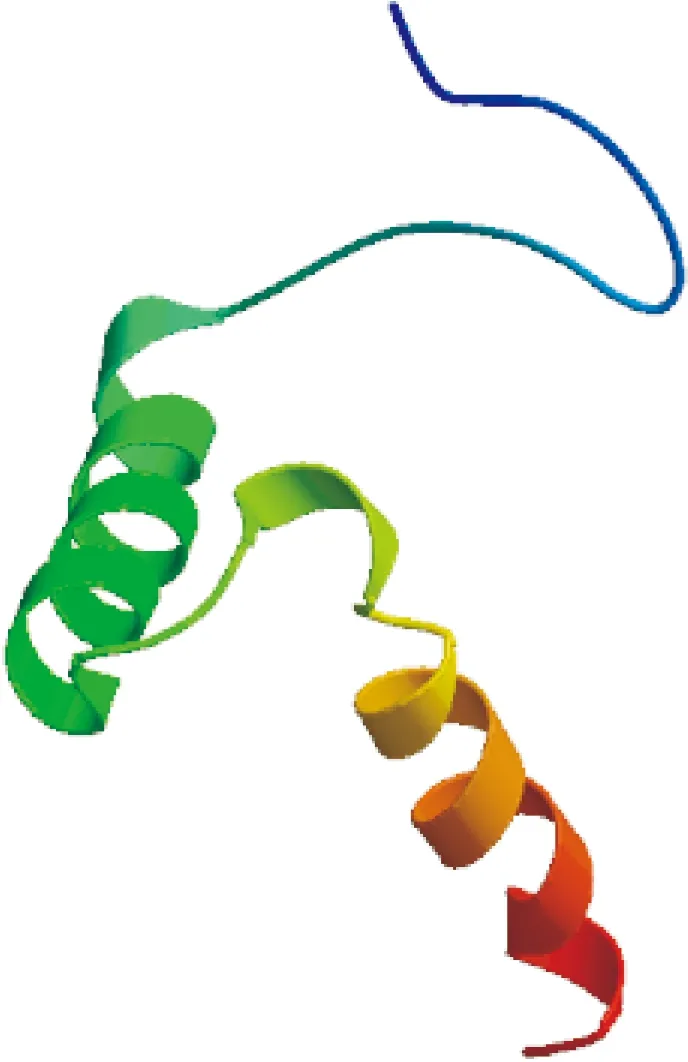
图5 GbTCP15蛋白的三级结构Fig.5 Tertiary structure of GbTCP15
利用PSIRRED Server程序(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白质的二级结构,GbTCP15蛋白由351个氨基酸组成,其中7个氨基酸形成α-螺旋,1个氨基酸可能形成β-折叠。组成α-螺旋氨基酸的比例占87%,β-折叠占13%。分布如图4所示。
通过SWISS-MODEL工具预测蛋白质三级结构,得到该蛋白的三级结构图(图5),与其他TCP蛋白的三级结构类似,其三级结构主要为α-螺旋—β-折叠—α-螺旋,这与二级结构预测结果基本一致。

GbTCP15.海岛棉;GaTCP15.亚洲棉(Cotton_A_33342); GhTCP15.陆地棉(CotAD_65741); GrTCP15.雷蒙德氏棉(XP_012465080); AtTCP15.拟南芥(AT1G69690); BrachypodiumTCP15.二穗短柄草(XP_003570652); SorghumTCP 15.高粱(EES07255); PrunusTCP.果梅(XP_008221641); ArachisTCP15.花生(XP_016202735);CucumisTCP15.黄瓜(XP_011655678); CacaoTCP.可可(XP_007046143); ViniferaTCP15.葡萄(XP_002274048); OryzaTCP15.水稻(XP_015641757); ZeaTCP14.玉米(XP_0086462571)图6 GbTCP15与其他TCP氨基酸序列对比分析GbTCP15. Gossypium barbadense; GaTCP15.Gossypium arboreum(Cotton_A_33342); GhTCP15.Gossypium hirsutum(CotAD_65741); GrTCP15.Gossypium raimondii(XP_012465080); AtTCP15.Arabidopsis thaliana(AT1G69690); BrachypodiumTCP15.Brachypodium distachyon(XP_003570652); SorghumTCP15.Sorghum bicolor(EES07255); PrunusTCP15.Prunus mume(XP_008221641); ArachisTCP15.Arachis ipaensis(XP_016202735); CucumisTCP15.Cucumis sativus(XP_011655678); CacaoTCP.Theobroma cacao(XP_007046143); ViniferaTCP15.Vitis vinifera(XP_002274048); OryzaTCP15.Oryza sativa(XP_015641757); ZeaTCP14.Zea mays(XP_0086462571)Fig.6 Amino acid sequence alignment of GbTCP15 with other related proteins
借助NCBI数据库将碱基序列翻译成氨基酸序列,用DNAMAN对海岛棉GbTCP15和雷蒙德氏棉GrTCP15(Gossypiumraimondii,XP_012465080)之间进行氨基酸序列比对,其一致性为98.01%。海岛棉GbTCP15与亚洲棉GaTCP15(Gossypiumarboreum,Cotton_A_33342)、陆地棉GhTCP15(Gossypiumhirsutum,CotAD_65741)、可可TCP(Theobromacacao,XP_007046143)、高粱TCP 15(Sorghumbicolor,EES07255)、水稻TCP15(Oryzasativa,XP_015641757)、玉米TCP(Zeamays,XP_0086462571)、花生TCP15(Arachisipaensis,XP_016202735)、黄瓜TCP15(Cucumissativus,XP_011655678)、葡萄TCP15(Vitisvinifera,XP_002274048)、拟南芥TCP15(Arabidopsisthaliana,AT1G69690)和二穗短柄草TCP15(Brachypodiumdistachyon,XP_003570652)氨基酸序列一致性分别为94.56%、96.25%、81.29%、50.66%、38.11%、44.73%、51.43%、54.97%、61.49%、51.70%、50.33%。这些TCP相关的蛋白都有一个高度保守的TCP domain,其他区域一致性较低(图6)。
2.2 海岛棉GbTCP15亚细胞定位及功能预测分析
利用POSRT 3.0软件对GbTCP15的亚细胞定位进行预测分析,结果显示,GbTCP15在细胞核和细胞质中的分布比例分别为30%、10%,在细胞核中的分布最多,结果表明GbTCP15基因编码的蛋白其作用发生在植物的细胞核内。
运用Protfun2.2软件对GbTCP15的功能进行预测分类,结果显示该蛋白在辅因子生物结合、运输和结合、监管职能、嘌呤和嘧啶以及翻译过程中发挥的可能性分别是0.210、0.773、0.034、0.331、0.071,而作为信号转导分子、转录因子、转录调控因子发挥功能的可能性分别是0.205、0.219、0.111(表2),这些数据明显高于其他功能。考虑该基因家族的特性,综合判断GbTCP15可能在复制、转录和运输的过程中发挥着信号转导以及转录调控等作用。
2.3 海岛棉GbTCP15系统进化分析
利用MEGA6软件对上述物种的TCP氨基酸进行同源性比较并构建系统发育树(图7)表明,GaTCP15和GhTCP15聚集在同一分支,GbTCP15 和GrTCP15聚在同一分支,表明海岛棉TCP15基因与雷蒙德氏棉的同类基因的亲缘关系较近。
2.4 GbTCP15表达模式分析
采用实时荧光定量PCR方法分析GbTCP15基因在棉花不同纤维时期的表达量以及在棉花的营养器官和生殖器官中的表达情况。由图8可知,GbTCP15基因在纤维发育的第15天时表达量最高,明显高于其他发育时期的棉纤维,并且该基因在纤维发育的后期,即次生壁增后期和脱水成熟期表达量非常低。据此推测GbTCP15基因可能在棉纤维起始阶段和纤维伸长期中发挥一定的功能。同时在根、茎、叶和下胚轴中也检测到GbTCP15基因的表达(图9),而且在茎上的表达明显高于根、叶和下胚轴,说明GbTCP15基因可能在棉花茎秆表皮毛的发育中也发挥着一定的作用。

表2 GbTCP15功能分析结果

图7 GbTCP15蛋白与其他植物相关蛋白序列的系统进化树Fig.7 Phylogenetic analysis of GbTCP15 with other related proteins in different plants
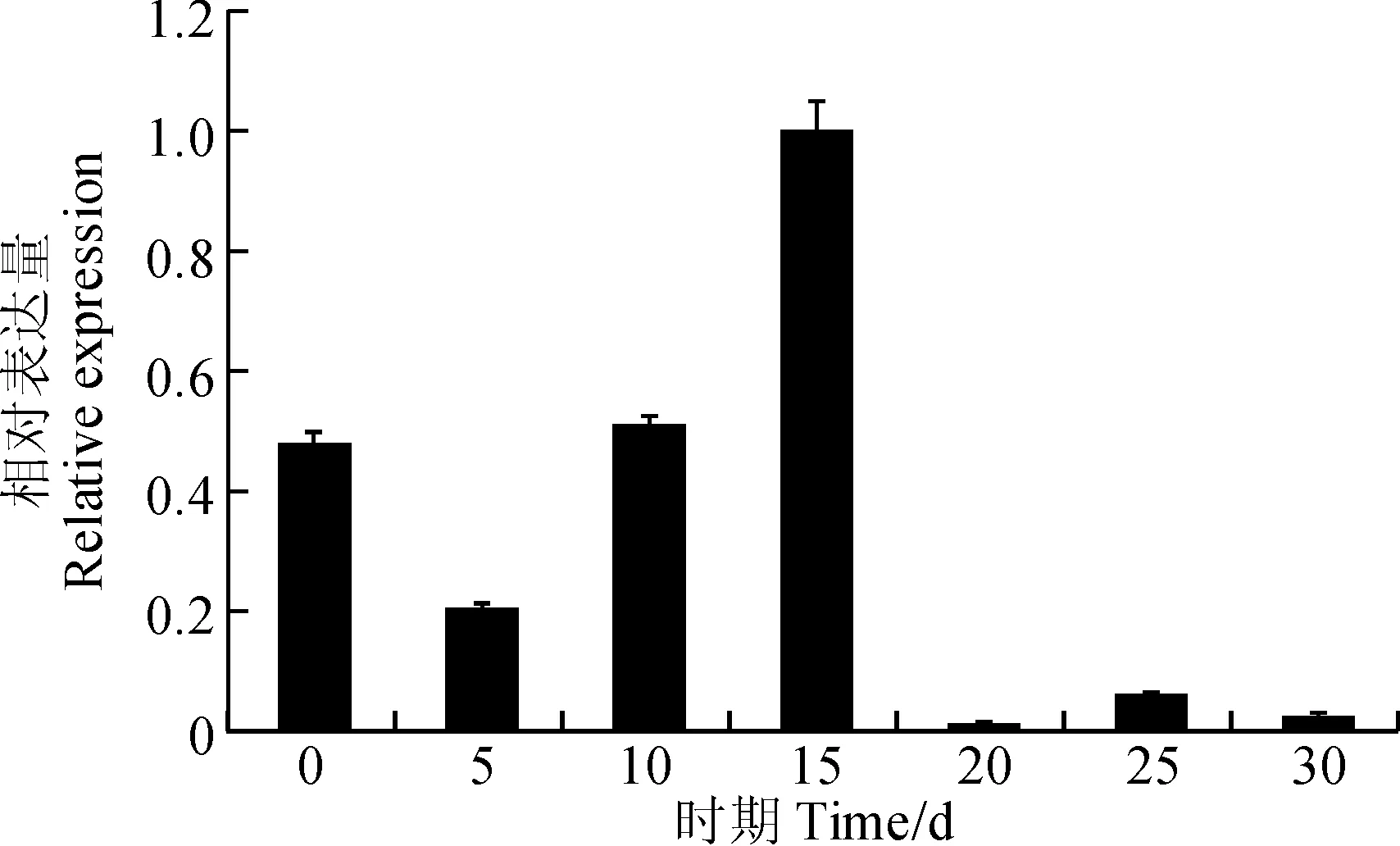
图8 GbTCP15基因在不同纤维时期的表达情况Fig.8 GbTCP15 gene expression in different fiber periods
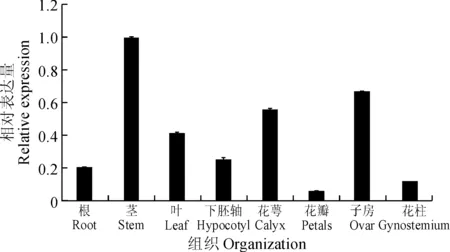
图9 GbTCP15基因在棉花营养器官中的表达情况Fig.9 GbTCP15 gene expression in the different tissues and organs of cotton
3 讨 论
棉花纤维的生长发育过程决定了成熟纤维的产量和品质,近几年,针对棉纤维发育的相关研究备受关注,但是到目前为止,控制纤维发育的关键基因和调控机理还不清楚,因此针对棉花纤维开展分子机制的研究具有重要的理论意义和应用价值。
TCP转录因子是植物特有的一类基因家族,在植物发育过程中发挥着重要的作用;棉花纤维细胞是棉花胚珠外珠被表皮细胞经分化突起和极性伸长而形成的单细胞。现有的研究表明,TCP转录因子在植物生长发育过程中发挥的作用大部分与细胞的生长、增殖和分化有关,通过调控细胞分裂进一步控制植物侧枝、花等器官的生长发育。如玉米的TB1基因作用在两方面:一是抑制分生组织的生长发育,调控顶端优势,二是通过抑制雄花原基发育调控雄花的形成[11];金鱼草的CYC基因则调控花的对称发育[12];而水稻的PCF1和PCF2基因则是调控分生组织中的Pcan基因的转录[13]。
本研究从海岛棉‘新海21号’材料的棉纤维中成功克隆1个TCP转录因子基因,将其命名为GbTCP15;该基因编码的氨基酸序列含有一个保守的TCP结构域,通过聚类分析显示,该基因属于TCP转录家族的ClassⅠ类。现有的研究表明,拟南芥TCP家族中ClassⅠ类分支上的TCP蛋白在植物的分生组织上发挥着作用,同时也参与细胞的形成和发育。例如:拟南芥AtTCP14在种子萌发过程中起调控作用[14];AtTCP16在花粉发育中起调控作用[15];AtTCP15控制叶片的形状[16];AtTCP20参与调控细胞的分裂、伸长和分化[17]。Wang等[9]克隆了1个陆地棉的TCP转录因子,研究显示该转录因子隶属于Class Ⅰ 类分支,并且该转录因子在棉花起始和伸长阶段特异性表达。
通过荧光定量PCR技术发现克隆的GbTCP15基因在棉花15 d的纤维中和植株的茎部优势表达,说明GbTCP15基因可能在棉花的表皮细胞中表达量较高,进一步暗示该转录因子可能在棉花纤维发育伸长期中起一定作用。关于GbTCP15基因的功能,以及该基因在纤维伸长期的调控机理之间的关系尚需进一步的研究。
[1] NAVAUD O, DABOS P, CARNUS E,etal. TCP transcription factors predate the emergence of land plants[J].JournalofMolecularEvolution, 2007, 65(1):23-33.
[2] YAO X, MA H, WANG J,etal. Genome-wide comparative analysis and expression pattern of TCP gene families inArabidopsisthalianaandOryzasativa[J].JournalofIntegrativePlantBiology, 2007, 49(6):885-897.
[3] PILAR CUBAS, LAUTER N, DOEBLEYJ,etal. The TCP domain: a motif found in proteins regulating plant growth and development[J].PlantJournal, 1999, 18(2):215-222.
[4] 刘伟娜,韩建民. 棉花TCP家族转录因子基因GhTCP1的克隆与表达分析[J]. 棉花学报, 2010, 22(5):409-414.
LIU W N,HAN J M. Cloning and expression analysis of cotton transcription factor geneGhTCP1[J].CottonScience, 2010, 22(5):409-414.
[5] HOWARTH D G, DONOGHUE M J. Phylogenetic analysis of the “ECE” (CYC/TB1) clade reveals duplications predating the core eudicots[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2006, 103(24):9 101-9 106.
[6] AGUILAR-MARTNEZ J A, POZA-CARRIN C, CUBAS P.ArabidopsisBRANCHED1 acts as an integrator of branching signals within axillary buds[J].PlantCell, 2007, 19(19):458-472.
[7] KOSUGI S, OHASHI Y. DNA binding and dimerization specificity and potential targets for the TCP protein family[J].PlantJournal, 2002, 30(3):337-348.
[8] NAVAUD O, DABOS P, CARNUS E,etal. TCP transcription factors predate the emergence of land plants[J].JournalofMolecularEvolution, 2007, 65(1):23-33.
[9] WANG M Y, XIA G X. The cotton transcription factorTCP14 functions in auxin-mediated epidermal cell differentiation and elongation[J].PlantPhysiology, 2013, 162(3):1 669-1 680.
[10] HAO J, TU L, HU H,etal. GbTCP, a cotton TCP transcription factor, confers fibre elongation and root hair development by a complex regulating system[J].JournalofExperimentalBotany, 2012, 63(17):6 267-6 281.
[11] DOEBLEY J, STEC A, HUBBARD L. The evolution of apical dominance in maize[J].Nature, 1997, 386(6 624):485-488.
[12] LUO D, CARPENTER R, COPSEY L,etal. Control of organ asymmetry in flowers ofAntirrhinum[J].Cell, 1999, 99(4):367-376.
[13] KOSUGI S, OHASHI Y. PCF1 and PCF2 specifically bind to cis elements in the rice proliferating cell nuclear antigen gene[J].PlantCell, 1997, 9(9):1 607-1 619.
[14] TATEMATSU K K N, KAMIYA Y,etal. Transcription factorAtTCP14 regulates embryonic growth potential during seed germination inArabidopsisthaliana[J].PlantJournalforCell&MolecularBiology, 2008, 53(1):42-52.
[15] TAKEDA T, AMANO K, OHTO M A,etal. RNA interference of theArabidopsisputative transcription factorTCP16 gene results in abortion of early pollen development[J].PlantMolecularBiology, 2006, 61(1/2):165-177.
[16] KIEFFER M, MASTER V, WAITES R,etal.TCP14 andTCP15 affect internode length and leaf shape inArabidopsis[J].PlantJournal, 2011, 68(1):147-158.
[17] HERVÉ C, DABOS P, BARDET C,etal.Invivointerference withAtTCP20 function induces severe plant growth alterations and deregulates the expression of many genes important for development[J].PlantPhysiology, 2009, 149(3):1 462-1 477.
(编辑:宋亚珍)
Cloning and Expression Analysis of GbTCP15 in Gossypium barbadense
ZHENG Kai, NI Zhiyong, QU Yanying, WANG Yi, CAI Yongsheng, CHEN Quanjia*
(Agronomy Courtyard/ Key Laboratory of Agricultural Biological Technology, Xinjiang Agricultural University, Urumqi 830052,China)
According to the coding sequence ofGhTCP15 gene,a pair of primers were designed. The homologous sequence ofGbTCP15 gene,was cloned from cotton(GossypiumbarbadenseL.)cultivar Xinhai 21 using reverse transcription PCR methods in this study.GbTCP15 gene contained open reading frame(ORF) of 1 056 bp in length, 351 amino acids residues with a predicted molecular mass of about 38 057.4 kD and a basic isoelectric point of 9.01,with a highly conservative TCP domain in the encoded putative protein. Amino acid sequence alignment revealed of GbTCP15 protein shared high degree of identity with other higher plant TCP proteins and the gene in evolution has proved to be conservative. Subcellular localization showed thatGbTCP15 expressed possibly in cell nucleus. Thus, we speculated thatGbTCP15 play a role on signal transduction and transcriptional regulatory during replication and transcription. The phylogenetic tree showed thatGbTCP15 was located at the same distribute withGossypiumraimondiiGrTCP15. The experment results of real time PCR exhibited thatGbTCP15 had a higher expression level in stems and fibers (15 d). Above results suggested thatGbTCP15 transcription factor may be involved in the cotton fiber and table fur development.
GossypiumbarbadenseL.;TCP;cloning;sequence analysis;expression analysis
1000-4025(2016)10-1925-08
10.7606/j.issn.1000-4025.2016.10.1925
2016-06-22;修改稿收到日期:2016-09-12
国家自然科学基金(31560405);新疆维吾尔自治区高技术研究发展计划(201411103);中国博士后科学基金(2015M582741)
郑 凯(1988-),男,在读硕士研究生,主要从事棉花分子育种研究。E-mail:zhengkai555@126.com
*通信作者:陈全家,教授,博士生导师,主要从事棉花遗传育种研究。E-mail:chenqjia@126.com
Q785;Q786
A
