胡杨叶片解剖特征及其可塑性对土壤条件响应
2016-12-17董芳宇王文娟崔盼杰王健铭张天汉李景文
董芳宇,王文娟,崔盼杰,王健铭,张天汉,李景文
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京100083)
胡杨叶片解剖特征及其可塑性对土壤条件响应
董芳宇,王文娟,崔盼杰,王健铭,张天汉,李景文*
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京100083)
表型可塑性对极端干旱区植物个体适应具有重要的意义。该研究选择内蒙古额济纳胡杨林内不同土壤条件下胡杨个体,对其叶片解剖结构与土壤因子关系进行分析,阐明不同土壤条件下叶片解剖结构及其可塑性规律。结果表明:除主脉木质部与维管束面积比外,异质性的土壤条件下胡杨叶片各解剖结构均存在明显的趋异适应;土壤水、盐条件影响了以上表皮细胞为代表的表皮组织的生长发育,土壤肥力影响了以主脉维管束为代表的输导组织以及栅栏组织的生长;生境环境异质性是胡杨叶片解剖结构可塑性的根本原因,解剖结构可塑性使得胡杨在不同环境、同一环境不同结构形成适应性差异,不同土壤条件下叶片主脉木质部、主脉维管束的可塑性较大,是胡杨适应异质性土壤条件的主要结构。叶片解剖结构特征及其可塑性对胡杨适应干旱环境具有重要生态作用。
胡杨;解剖结构;可塑性;土壤含水量;土壤盐分;土壤肥力
荒漠区极端干旱环境下个体适应性是生态学研究的重要内容。叶片对环境变化敏感且可塑性较大,一般认为叶片各组织解剖结构特征是响应环境变化或反映植物对环境适应能力的最重要的指标[1]。如白潇等[2]发现叶厚度、上表皮细胞厚度、栅栏组织厚度等多项解剖结构在河西走廊3个唐古特白刺(NitrariatangutorumBobr.)居群中存在差异;王仁忠等[3]认为随降水和海拔梯度的增加,中国东北地区羊草(Leymuschinensis)的叶厚度、导管直径增加。这些研究表明,植物叶片各解剖结构随环境变化将产生相应的适应性变化。
胡杨(Populuseuphratica)作为重要的抗逆种质资源,是维持荒漠河岸林生态系统平衡的关键种[4]。胡杨在生长与繁殖适应方面,特别是胡杨叶片对干旱生境的适应具有明显的特殊性,如胡杨叶片异型叶而表现出形态多样性等,对胡杨叶片的适应性,特别是解剖结构的研究对于揭示胡杨形态适应的机理有重要的理论意义[5-8]。目前,丁伟等[7]对柴达木盆地胡杨成树与幼树叶片解剖结构进行了比较,杨赵平等[8]对塔里木大学校园内雌雄株胡杨叶片的解剖结构进行了比较,从不同侧面很好地阐述了胡杨叶片适应多样性及其规律,但形态适应性与异质性生境是密切相关的,探讨不同环境胡杨叶片解剖结构表现出的适应性规律,对于深入揭示其形态适应具有重要理论和实践意义。
额济纳胡杨林是内蒙古西部干旱区唯一的天然乔木林,也是中国天然胡杨林的集中分布区之一,更是西北地区重要的生态屏障[9-13],近年来来黑河上游来水的不均匀性导致下游额济纳绿洲胡杨林不同区域存在水土条件空间异质性,那么不同水土条件下胡杨在形态特征适应方面是否存在差异的?差异的原因是什么?为此,本研究选择了内蒙古额济纳胡杨林为研究对象,针对该区不同土壤条件,分析了胡杨叶片解剖结构特征及其可塑性差异,以期阐明胡杨个体对不同土壤条件的叶片解剖结构适应策略及其影响因子,为揭示胡杨形态适应多样性机理提供理论依据。
1 研究方法
1.1 研究区概况
研究区位于黑河下游额济纳胡杨林自然保护区内,该区年平均气温8.3 ℃,年最高气温42.2 ℃,年最低气温-37.6 ℃,年降水量37.9~49.3 mm,年蒸发量3 746~4 213 mm[4]。额济纳胡杨林自然保护区由于河流水资源的短缺、人为对河流水文过程的干扰及地形特征差异,土壤条件异质性差异很大。故依据保护区内不同干旱程度的土壤条件,选择了二道桥(EDQ)、七道桥(QDQ)、八道桥(BDQ)胡杨林集中分布区为取样地点,各取样点的生境概况见表1。
1.2 材料和方法
1.2.1 野外调查及取样 于2015年生长季,在额济纳绿洲胡杨林自然保护区自中心向外围设置3个样点(二道桥、七道桥、八道桥),每个样点设置10个20 m×20 m的样方,在每个样方内选取胸径一致的3株胡杨,每株中部采集5片成熟健康叶片,立即用FAA固定液固定。与此同时,在每个样方内进行植被调查。土壤材料的取样依据胡杨细根在土壤中分布规律。细根是吸收土壤水分和养分的主要器官,影响植株地上各组织的生长发育,本研究选择影响地上植株生长发育的主要细根分布层,其中细根活跃区为0~60 cm土层[14]。在调查样方内采用五点取样法采集除去凋落物后0~30 cm和30~60 cm土壤样品5份,混匀后作为每个样方的土壤样品。
1.2.2 指标测定 (1)叶片性状:叶片样品进行常规石蜡切片操作。在每片叶片距叶尖1/3处沿中脉切取0.5 cm×0.5 cm小片,切片厚度8~10 μm,番红-固绿双重染色,中性树胶封片。筛选效果较好的视野,OLYMPUS显微镜下观察拍照,使用系统自带测量工具测量相关指标。主要包括叶厚度、上下角质层厚度、上下表皮细胞厚度、孔下室深度、上下栅栏组织厚度、海绵组织厚度、主脉维管束面积、主脉木质部面积、晶异细胞直径,并计算角质层厚度、栅海比(栅栏组织厚度/海绵组织厚度)、叶片结构紧密度(栅栏组织厚度/叶厚度)、叶片结构疏松度(海绵组织厚度/叶厚度)、主脉木质部与主脉维管束面积比[2,14-15]。(2)土壤性状:土壤样品测定均采用常规农化分析法。样品取回当天测湿重,105 ℃下烘箱烘至恒重后测得干重,计算土壤含水量。其他土壤样品室内自然风干,测定土样的pH(电位法)、电导率(浸提法)、全氮含量(凯氏定氮法)、全磷含量(钼蓝法)、全钾含量(火焰光度法)。

表1 3个胡杨群落生境特征
1.2.3 数据分析 分别计算每株及样地内叶片数据平均值,依据每个取样点10个样方的叶片及土壤数据进行数据分析。采用One-way ANOVA对额济纳胡杨林不同生境下土壤条件及不同土壤条件下胡杨叶片解剖结构差异性进行比较,根据变异系数、可塑性指数对不同土壤条件下叶片各解剖结构进行可塑性分析;基于PCA分析揭示主要叶片适应结构,选取前两个主成分为坐标轴获得指标排序图;同时对土壤因子提取主成分,并利用解剖特征与土壤因子的PCA分析结果进行线性回归分析。所有分析均使用SPSS22.0软件完成,数据标准化处理后使用Canoco软件作图。
叶片结构可塑性水平采用以下公式[16]:
变异系数= 标准差/算术平均值
可塑性指数=(最大值-最小值)/最大值
2 结果与分析
2.1 额济纳不同生境土壤条件比较
额济纳不同样点(二道桥、七道桥、八道桥)各土壤因子间存在显著性差异(表2)。其中,二道桥土壤含水量、电导率显著高于七道桥、八道桥,表现出优越的土壤水盐条件;七道桥0~30 cm土壤全氦、全碳,以及30~60 cm土壤全氦、全碳、全磷、全钾均具有最大值,表现出明显的养分优势;而八道桥土壤pH值显著高于二道桥和七道桥。这说明额济纳胡杨林不同生境的土壤条件存在异质性差异。
2.2 不同土壤条件下胡杨叶片解剖特征
首先,胡杨叶片表皮特征在不同土壤条件下差异显著,且二道桥胡杨叶片角质层厚度、上表皮细胞厚度、下表皮细胞厚度、孔下室深度显著大于七道桥、八道桥(表3)。图1中二道桥胡杨叶片具有2层表皮细胞,也验证了二道桥胡杨叶片表皮组织更加发达。一般认为,角质层厚度增加可抵御强光伤害,抑制蒸腾作用失水;表皮细胞增厚可加强贮水功能等[17-19]。二道桥样点土壤含水量相对较高,但胡杨叶片表皮组织厚度显著高于七道桥、八道桥,这可能是因为一定范围的土壤水分含量对表皮细胞的生长起促进作用,也可能与地上高温干旱、光强等环境的适应有关。
其次,二道桥与八道桥胡杨叶片下栅栏组织厚度、栅栏组织厚度、栅海比、叶片结构紧密度显著大于七道桥,说明该生境中胡杨叶片栅栏组织更加发达。一般认为发达的栅栏组织提高了水分自输导组织至表皮的运输效率及光能利用效率,高叶片结构紧密度可降低蒸腾耗散[20],因此,二、八道桥胡杨更能通过发达的栅栏组织有效利用水分和光能。海绵组织厚度与物种抗旱性呈负相关[19],七道桥胡杨的海绵组织厚度及叶片结构疏松度最大,说明七道桥胡杨抗旱性水平较低,需要通过其他策略增强抗旱性。事实上,七道桥胡杨叶片内存在大量晶异细胞(图1),且七道桥胡杨叶片晶异细胞直径显著大于二道桥、八道桥。一般认为晶异细胞在适应高盐环境中起重要作用,同时在细胞缺水时进行调节[21-23]。七道桥胡杨叶片通过较大的晶异细胞使其具有较强的适盐耐旱的能力。
再次,在叶片输导组织特征方面,胡杨叶片主脉维管束面积、主脉木质部面积均为八道桥最大,二道桥次之,七道桥最小。一般认为发达的叶片输导组织可增强叶片水分吸收与输送能力,从而更好适应缺水环境,同时增加支持力以抵抗强风损伤[20]。八道桥处于绿洲外围且土壤极为干旱,受强风影响也较大,因此胡杨更能通过改善叶片输导组织特征,从而增加吸收土壤中的水分以适应干旱与强风的环境。
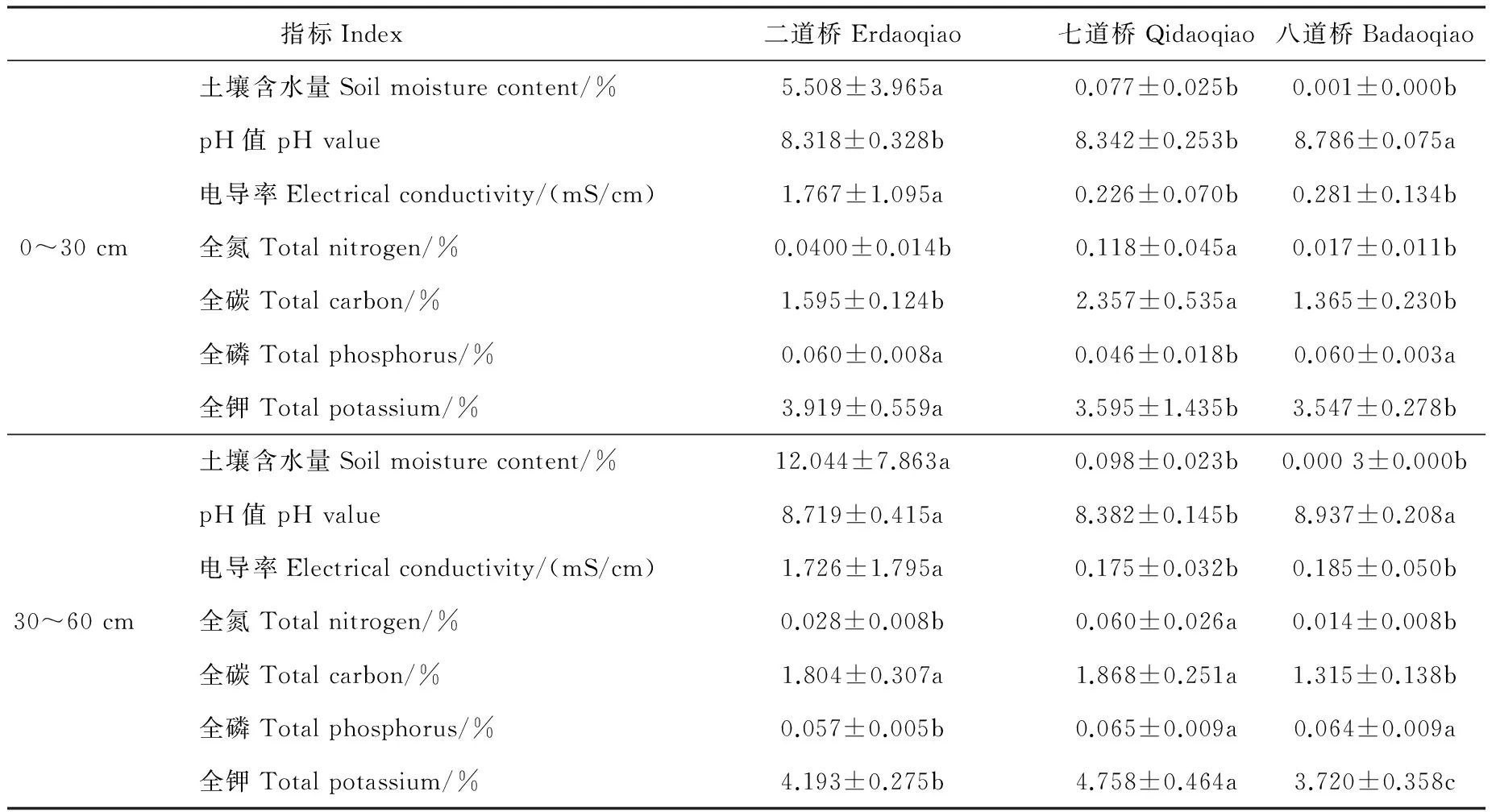
表2 额济纳不同生境土壤条件比较
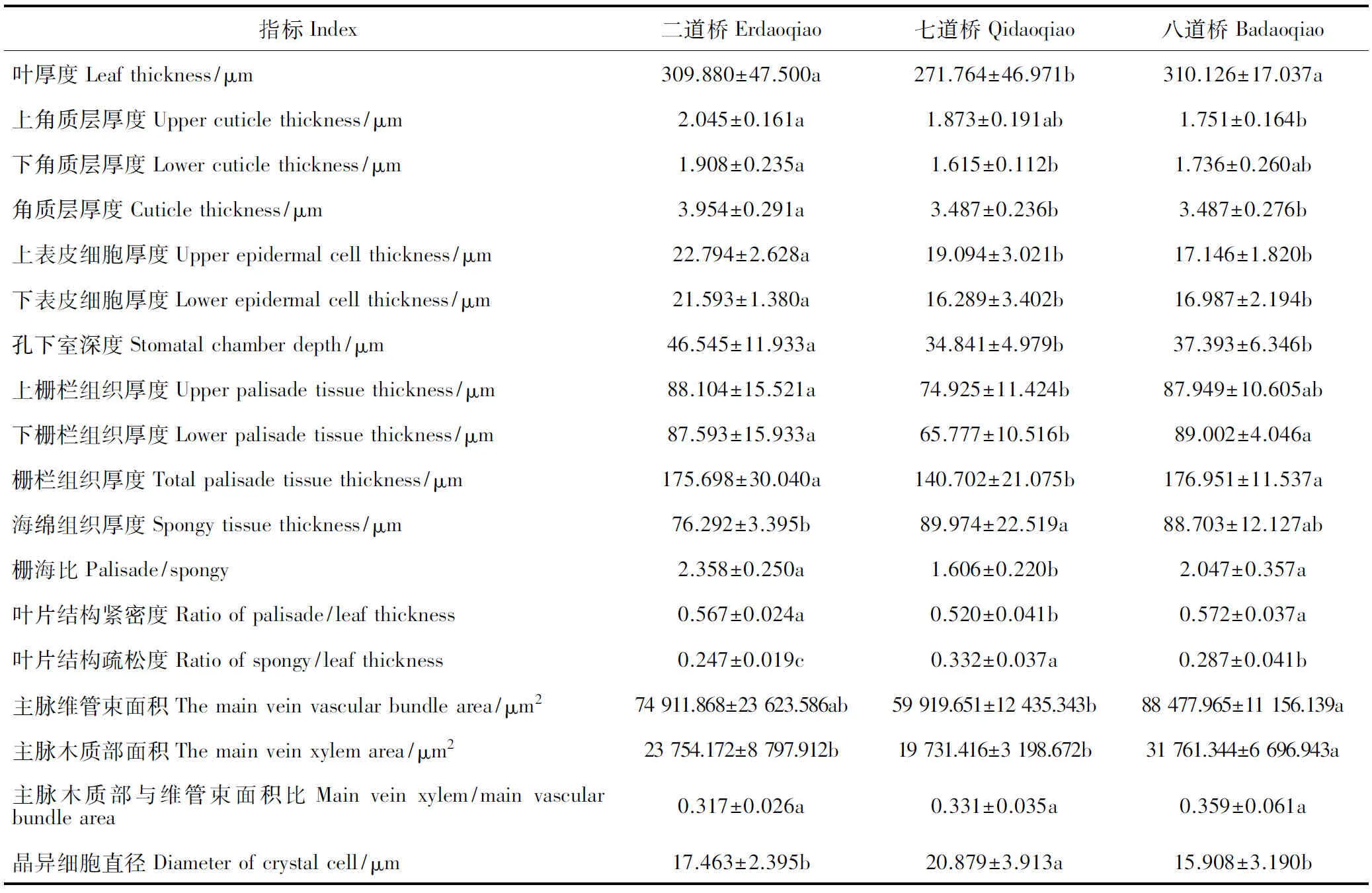
表3 额济纳不同生境下胡杨叶片解剖结构特征差异
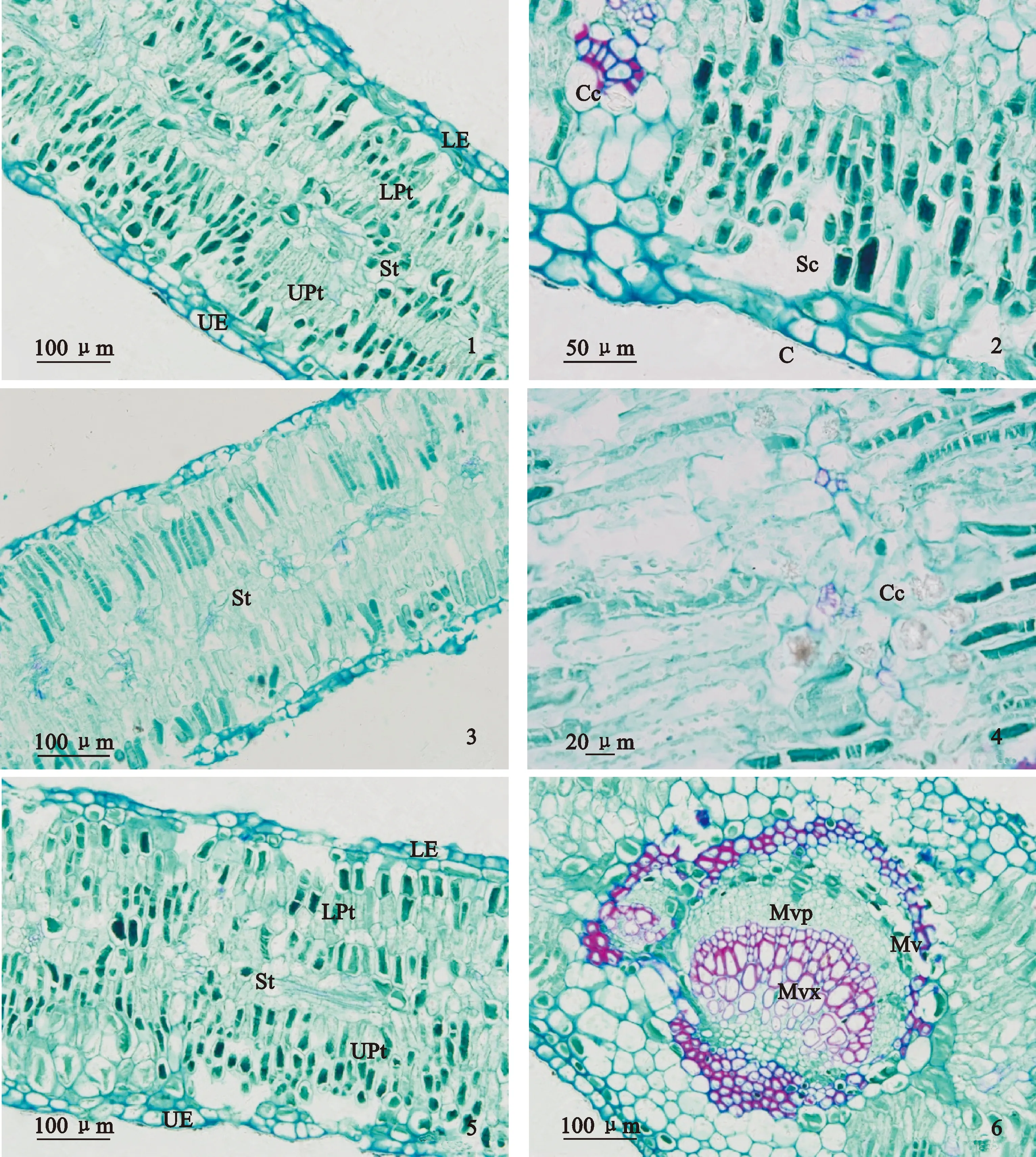
1.二道桥胡杨叶片栅栏组织;2.二道桥胡杨叶片表皮;3.七道桥胡杨叶片海绵组织;4.七道桥胡杨叶片中的晶异细胞;5.八道桥胡杨叶片栅栏组织;6.八道桥胡杨叶片输导组织;C.角质层;Sc.孔下室;UE.上表皮细胞;LE.下表皮细胞;UPt.上栅栏组织;LPt.下栅栏组织;St.海绵组织;Mv.主脉;Mvx.主脉木质部;Mvp.主脉韧皮部;Cc.晶异细胞图1 胡杨叶片横切面1. Palisade tissue of P. euphratica in Erdaoqiao;2. Leaf epidermis of P. euphratica in Erdaoqiao;3. Spongy tissue of P. euphratica in Qrdaoqiao;4. Crystal cells of P. euphratica in Qrdaoqiao;5. Palisade tissue of P. euphratica in Badaoqiao;6. Conducting tissue of P. euphratica in Badaoqiao;C. Cuticle;Sc. Stomatal chamber;UE. Upper epidermal cell;LE. Lower epidermal cell;UPt. Upper palisade tissue;LPt. Lower palisade tissue;St. Spongy tissue;Mv. Main vein;Mvx. Main vein xylem;Mvp. Main vein phloem;Cc. Crystal cellFig.1 Leaf cross-sections of P. euphratica
2.3 不同土壤条件下胡杨叶片解剖特征可塑性分析
可塑性是物种增加适合度、扩大生态幅的重要适应策略,反映了物种适应环境能力的大小[24]。变异系数可反映物种潜在适应能力,可塑性指数可反映物种克服环境异质性的能力[25]。从表4可以发现,不同土壤条件下,胡杨叶片主脉木质部面积、主脉维管束面积、孔下室深度的变异系数较高,其主脉木质部面积、晶异细胞直径、主脉维管束面积的可塑性指数较大。不同土壤条件下主脉木质部面积及主脉维管束面积的变异系数和可塑性指数均较大,反映出胡杨叶片输导组织具有极强的可塑性水平,是适应额济纳不同土壤条件的重要的叶片结构特征。同时,不同土壤条件下叶片结构紧密度的变异系数与可塑性指数均最小,说明该叶片结构特征不易受到土壤环境异质性的影响。

表4 额济纳不同生境下胡杨叶片解剖结构变异系数和可塑性指数
2.4 胡杨叶片解剖结构及土壤因子的PCA分析
对胡杨17个叶片解剖指标在标准化处理后进行主成分分析,结果表明,前4个主成分共携带85.85%的原始信息,第一(PC1-1)、二(PC1-2)、三(PC1-3)、四(PC1-4)主成分分别解释了47.34%、19.84%、10.88%、7.79%的原始信息(表5),选择前两个主成分做PCA排序图(图2)。指标所指示箭头间夹角越小,则相关性越强。由PCA排序图可知,叶片上栅栏组织、下栅栏组织、栅栏组织厚度所表示箭头间以及主脉维管束面积、主脉木质部面积所表示箭头间夹角较小,存在较大的相关性。PC1-1中主脉维管束面积、主脉木质部面积以及上栅栏组织、下栅栏组织、栅栏组织厚度的载荷值较大,但存在较强的相关性,故分别选择载荷值最大的主脉维管束面积、栅栏组织厚度作为PC1-1的代表性指标,同理可得PC1-2、PC1-3及PC1-4的代表性解剖指标分别为上表皮细胞厚度、海绵组织厚度、晶异细胞直径。一般认为叶片主脉维管束是运输水分及养分的主要结构,栅栏组织是光合作用及水分利用、养分生产的重要场所,因此PC1-1集中代表了胡杨叶片解剖结构对土壤水分及养分的利用能力;表皮细胞具有贮水、保水功能[17-19],故PC1-2可反映胡杨叶片解剖结构的水分调节能力;海绵组织与物种抗旱性呈负相关[19],故PC1-3代表了胡杨叶片解剖结构的耐旱能力;一般认为晶异细胞是耐盐碱环境的重要结构[21-23],故PC1-4可反映胡杨叶片解剖结构的抗盐能力。

I. 叶厚度;II. 上角质层厚度;III. 下角质层厚度;IV. 角质层厚度;V. 上表皮细胞厚度;VI. 下表皮细胞厚度;VII. 孔下室深度;VIII. 上栅栏组织厚度;IX. 下栅栏组织厚度;X. 栅栏组织厚度;XI. 海绵组织厚度;XII. 栅海比;XIII. 叶片结构紧密度;XIV. 叶片结构疏松度;XV. 主脉维管束面积;XVI. 主脉木质部面积;XVII. 晶异细胞直径图2 额济纳胡杨叶片解剖结构指标PCA排序图I. Leaf thickness;II. Upper cuticle thickness;III. Lower cuticle thickness;IV. Cuticle thickness;V. Upper epidermal cell thickness;VI. Lower epidermal cell thickness;VII. Stomatal chamber depth;VIII. Upper palisade tissue thickness;IX. Lower palisade tissue thickness;X. Total palisade tissue thickness;XI. Spongy tissue thickness;XII. Palisade/spongy;XIII. Ratio of palisade/leaf thickness;XIV. Ratio of spongy/leaf thickness;XV. The main vein vascular bundle area;XVI. The main vein xylem area;XVII. Diameter of crystal cellFig.2 PCA ordination diagram of leaf anatomical structure indices of P. euphratica in Ejina
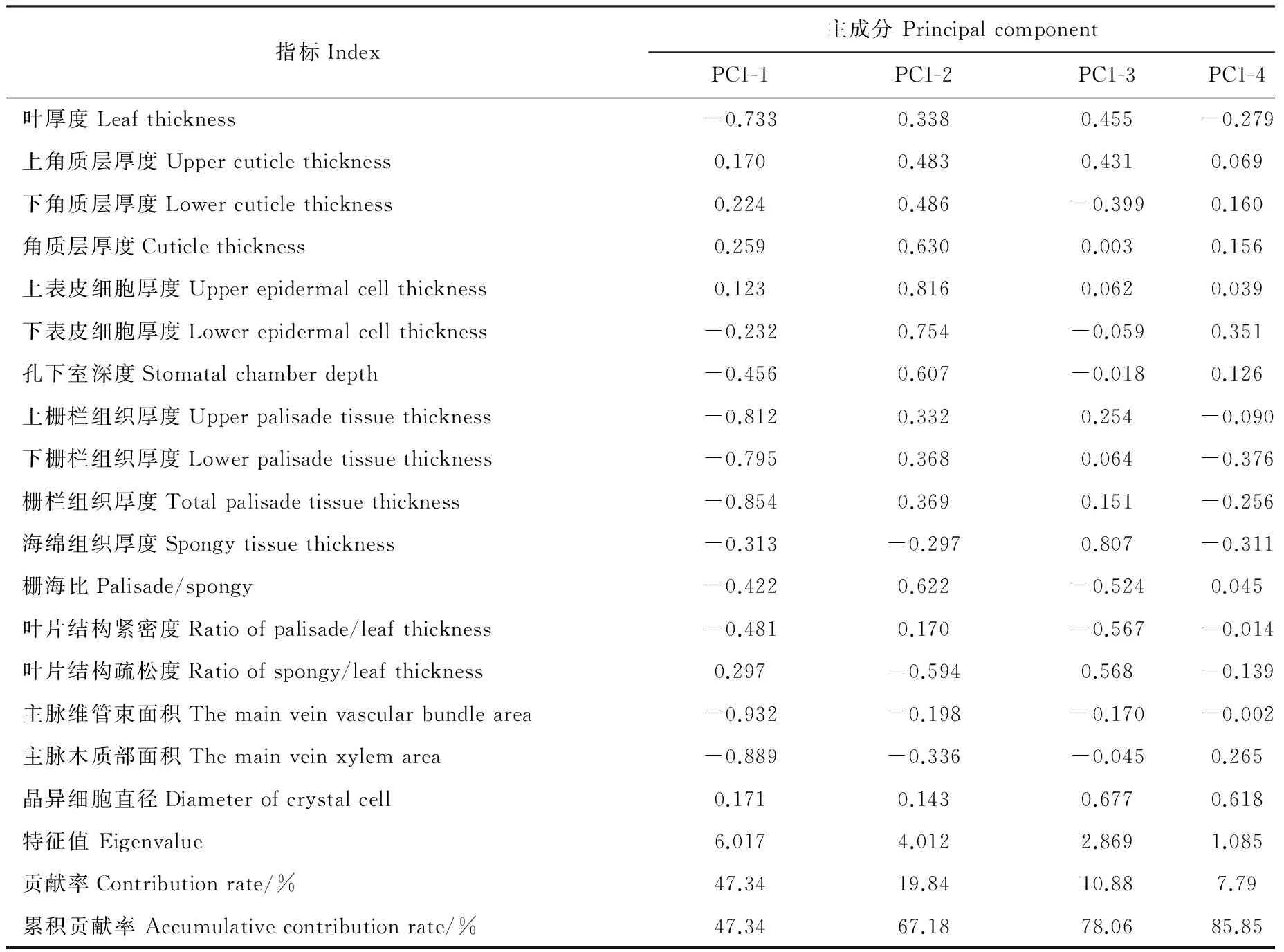
指标Index主成分PrincipalcomponentPC1-1PC1-2PC1-3PC1-4叶厚度Leafthickness-0.7330.3380.455-0.279上角质层厚度Uppercuticlethickness0.1700.4830.4310.069下角质层厚度Lowercuticlethickness0.2240.486-0.3990.160角质层厚度Cuticlethickness0.2590.6300.0030.156上表皮细胞厚度Upperepidermalcellthickness0.1230.8160.0620.039下表皮细胞厚度Lowerepidermalcellthickness-0.2320.754-0.0590.351孔下室深度Stomatalchamberdepth-0.4560.607-0.0180.126上栅栏组织厚度Upperpalisadetissuethickness-0.8120.3320.254-0.090下栅栏组织厚度Lowerpalisadetissuethickness-0.7950.3680.064-0.376栅栏组织厚度Totalpalisadetissuethickness-0.8540.3690.151-0.256海绵组织厚度Spongytissuethickness-0.313-0.2970.807-0.311栅海比Palisade/spongy-0.4220.622-0.5240.045叶片结构紧密度Ratioofpalisade/leafthickness-0.4810.170-0.567-0.014叶片结构疏松度Ratioofspongy/leafthickness0.297-0.5940.568-0.139主脉维管束面积Themainveinvascularbundlearea-0.932-0.198-0.170-0.002主脉木质部面积Themainveinxylemarea-0.889-0.336-0.0450.265晶异细胞直径Diameterofcrystalcell0.1710.1430.6770.618特征值Eigenvalue6.0174.0122.8691.085贡献率Contributionrate/%47.3419.8410.887.79累积贡献率Accumulativecontributionrate/%47.3467.1878.0685.85
另外,对14个土壤因子指标进行PCA分析,结果(表6)表明,前4个主成分共携带84.883%的原始信息,第一(PC2-1)、二(PC2-2)、三(PC2-3)、四(PC2-4)主成分分别解释了37.335%、27.995%、11.188%、8.365%的原始信息,其中第一、二主成分的特征值较大分别为5.227、3.919。PC2-1中TN1、TC1、TP1、TN2、TC2、TK2的载荷值较大,可反映土壤肥力;PC2-2中SMC1、EC1、SMC2、EC2的载荷值较大,可反映土壤水盐条件。
2.5 胡杨叶片解剖结构与土壤因子的关系
将胡杨叶片上表皮细胞厚度、栅栏组织厚度、海绵组织厚度、主脉维管束面积、晶异细胞直径分别与土壤因子提取的4个主成分进行多元线性回归分析。分析结果表明,通过叶片上表皮细胞厚度、栅栏组织厚度、主脉维管束面积与土壤因子间建立回归模型的P值小于0.05,模型有意义(表7)。其中,上表皮细胞厚度与土壤水盐条件之间存在一元线性回归关系且呈正相关,且调整后R2解释率为47.7%;栅栏组织厚度、主脉维管束面积与土壤肥力之间存在一元线性回归关系且均呈负相关,调整后R2解释率分别为36.4%、36.7%。这说明土壤水盐条件可较好地解释以上表皮细胞厚度为代表的表皮特征变化,土壤肥力可较好地解释不同生境下栅栏组织厚度、主脉维管束面积变化。
3 讨论与结论
土壤条件异质性对于胡杨叶片形态构建有着重要的影响,随着土壤干旱程度变化,胡杨叶片解剖结构发生不同的适应性变化,反映了胡杨叶片在不同程度干旱胁迫下的形态适应多样性。
3.1 不同土壤条件胡杨叶片解剖结构生态适应性
不同土壤条件中的胡杨叶片,其内部解剖结构呈现明显的趋异适应。二道桥土壤条件异质性强,含水量变化大(0.25%~23.37%),且绿洲内胡杨以母株为中心呈集群分布,减小了干旱区强风及沙尘暴引起的对叶片的机械损伤及强蒸腾作用,形成湿润的小环境,在较低的空气干旱、土壤干旱程度及较高的异质性环境下,胡杨在叶片解剖结构上主要表现为增加表皮组织厚度及栅栏组织厚度以规避不良环境;七道桥土壤含水量极低(0.06%~0.11%),在土壤干旱胁迫下,胡杨在叶片解剖结构上表现为通过增加晶异细胞直径以适应环境;八道桥处于沙漠与绿洲交界处,沙尘暴及强风频繁且胡杨林呈零散分布,故空气湿度极低,且八道桥主要为沙土,沙土持水能力弱,故土壤含水量极低,因此在严重的空气干旱、土壤干旱双重胁迫及强风侵袭下,胡杨叶片解剖结构上表现为以更厚的栅栏组织,更大的主脉维管束面积和主脉木质部面积以适应高温、干旱环境。

表6 土壤因子主成分载荷矩阵、特征值、贡献率和累计贡献率

表7 主要叶片解剖特征与土壤因子的回归模型
叶片解剖结构在一定程度上能反映物种所在环境情况[26-27],环境影响了额济纳胡杨叶片解剖结构的生长发育。由于各解剖指标及不同深度土壤因子间存在不同程度的相关性,故对17个解剖结构指标及14个土壤指标分别进行了PCA分析,结果表明上表皮细胞厚度、栅栏组织厚度、海绵组织厚度、主脉维管束面积和晶异细胞直径可作为胡杨的代表性解剖结构特征,土壤因子可归纳为土壤水盐条件及土壤肥力两个相互独立的主成分。经二者线性回归分析结果表明,额济纳土壤水、盐条件影响了胡杨叶片以上表皮细胞为代表的表皮组织的发育,土壤肥力影响了胡杨叶片栅栏组织以及输导组织的发达程度,即土壤水盐条件及土壤肥力深刻影响了额济纳胡杨叶片解剖结构的生长发育,且不同土壤因子影响的叶片解剖结构指标不同。
3.2 不同土壤条件胡杨叶片解剖结构可塑性
可塑性是植物通过增加形态结构的变异性与灵活性以克服环境异质性[1,28-29],Cordell等认为叶片解剖结构变异是表型可塑性的结果[30],不同的环境下叶片通过增加某种结构机能,可扩大生态适应范围,即适应性可塑性[29](adaptive plasticity)。本研究认为同一生境的不同叶片解剖结构、同一物种在不同生境的可塑性差异是额济纳不同生境下胡杨广泛适应分布的原因。
对3个不同土壤条件胡杨叶片解剖结构的研究表明,不同解剖结构的变异系数及可塑性指数不同,表明了胡杨叶片各个解剖结构的变异性与灵活性是其适应于多样化生境的一种策略。这与多数研究结果一致,即可塑性是物种适应环境异质性的重要策略[24-25,31]。本研究中叶片主脉木质部和主脉维管束的变异系数及可塑性指数较高,是胡杨叶片适应环境变化的主要结构。叶片输导组织是连接叶片和植物主干及地下根系的中间结构,其主要功能是增强叶片机械支撑作用,减小强风损伤,以及吸收和运输土壤水分至叶片各组织,其功能也间接反映出额济纳地区地上的强风及地下土壤干旱是当地胡杨生长发育的主要环境胁迫因子。主脉维管束面积作为输导组织的代表性结构,受土壤肥力影响较大。叶片结构紧密度的变异系数与可塑性指数均最小,栅栏组织与叶厚度的比值与植物利用光能的效率有关[7],由于二、七、八道桥的胡杨林属于额济纳生境差异较大的3个胡杨集中分布区,因此在光能利用上差异不大,这反映在叶片解剖结构上即为叶片结构紧密度的可塑性水平较低。
胡杨在不同生境下可塑性存在差异,生境环境异质性是胡杨叶片结构在二、七、八道桥可塑性差异的根本原因。二、七、八道桥生境在林下草本种类、人为干扰类型、土壤类型及含水量上均存在差异,在这种高的环境异质性下,胡杨叶片解剖结构高的可塑性既是对极端干旱区多样生境的适应性响应,也是胡杨克服环境异质性而集中分布并成为优势种的适应策略。
此外,叶片解剖结构可塑性弥补了由胡杨种群遗传退化引起的低适应性。国内外许多研究认为表型可塑性和生态型差异是物种在多样生境生存并广泛分布的主要策略。耿宇鹏等[24]认为表型可塑性和遗传多样性在植物适应变化生境中互相补充、相互权衡;Williams等[32]发现羽绒狼尾草(Pennisetumsetaceum)种群间遗传变异小,形态特征可塑性是其在夏威夷不同海拔高度下适应分布的主要原因;Marco等[33]发现将蒲公英(Taraxacumofficinale)引入干旱地区后,可塑性在适应环境中起到次要作用。胡杨作为有性繁殖易失败、克隆繁殖为主的物种,生长发育不仅对环境依赖性大,而且缺乏遗传变异,遗传多样性降低导致的林木退化必然对适应多样化生境不利[10]。因此,强大的解剖结构可塑性,弥补了胡杨适应异质性生境的短板,叶片主脉木质部较高的可塑性、叶片解剖结构在生境间的可塑性差异在胡杨适应多样生境并实现广泛分布中起重要作用。
综上所述,通过对不同土壤条件下胡杨叶片解剖结构及其可塑性分析,发现不同土壤条件下胡杨叶片解剖结构呈现明显的趋异适应现象,胡杨叶片解剖结构的适应策略为:二道桥胡杨主要增加表皮组织及栅栏组织厚度以规避不良环境,七道桥胡杨主要增加晶异细胞直径以适应土壤干旱,八道桥胡杨叶片主要通过增加栅栏组织厚度及输导组织面积以抵御空气干旱及土壤干旱双重胁迫。额济纳胡杨叶片解剖结构特征与土壤肥力、土壤水盐特征显著相关,而正是解剖结构可塑性,使得同一环境不同结构、同一物种在不同环境形成适应性差异。正是这些不同特征的解剖结构及其可塑性,使胡杨能够长期适应荒漠区高温干旱的环境。
[1] BRADSHAW A D. Evolutionary significance of phenotypic plasticity in plants [J].AdvancesinGenetics,1965, 13: 115-155.
[2] 白 潇,李 毅,苏世平,等. 不同居群唐古特白刺叶片解剖结构特征对生境的响应研究[J].西北植物学报,2013, 33(10): 1 986-1 993.
BAI X,LI Y,SU S P,etal.Responses of leaf anatomical characteristics ofNitrariatangutorumBobr. from different populations to habitats [J].ActaBot.Boreal.-Occident.Sin.,2013, 33(10): 1 986-1 993.
[3] WANG R Z, HUANG W W, CHEN L,etal. Anatomical and physiological plasticity inLeymuschinensis(Poaceae) along large-scale longitudinal gradient in northeast China [J].PLoSOne,2011, 6(11): 1-8.
[4] CAO D C,LI J W,HUANG Z Y,etal. Reproductive characteristics of aPopuluseuphraticapopulation and prospects for its restoration in China[J].PLoSOne,2012, 7(7): e39121.
[5] ZHUANG L, CHEN Y N, LI W H,etal. Anatomical and morphological characteristics ofPopuluseuphraticain the lower reaches of Tarim River under extreme drought environment [J].JournalofAridLand,2011, 3(4): 261-267.
[6] 周翰儒,耿月娥. 新疆五种旱生植物叶和同化枝解剖构造的初步研究[J].安徽大学学报(自然科学版),1993, 3: 66-71.
ZHOU H R,GENG Y E. A preliminary study of anatomical structure of leaves or assimiting branches of five xerophytes growing in Xinjiang [J].JournalofAnhuiUniversity(Natural Science Edition),1993, 3: 66-71.
[7] 丁 伟,杨振华,张世彪,等. 青海柴达木地区野生胡杨叶的形态解剖学研究[J].中国沙漠,2010, 30(6): 1 411-1 415.
DING W,YANG Z H,ZHANG S B,etal.Morphological and anatomical structure of leaves onPopuluseuphraticaOliv. in Qaidam Basin [J].JournalofDesertResearch,2010, 30(6): 1 411-1 415.
[8] 杨赵平,刘 琴,李志军. 胡杨雌雄株叶片的比较解剖学研究[J].西北植物学报,2011, 31(1): 79-83.
YANG Z P,LIU Q,LI Z J. Leaf blade comparative anatomy between the female and the male ofPopuluseuphraticaOliv.[J].ActaBot.Boreal.-Occident.Sin., 2011, 31(1): 79-83.
[9] 黄晶晶,井家林,曹德昌,等. 不同林龄胡杨克隆繁殖根系分布特征及其构型[J].生态学报,2013, 33(14): 4 331-4 342.
HUANG J J,JING J L,CAO D C,etal.Cloning root system distribution and architecture of different forest agePopuluseuphraticain Ejina Oasis[J].ActaEcologicaSinica,2013, 33(14): 4 331-4 342.
[10] 张玉波,李景文,张 昊,等. 胡杨种子雨散布的时空分布格局[J].生态学报,2005,25(8): 1 994-2 000.
ZHANG Y B, LI J W, ZHANG H,etal. Spatiotemporal patterns of seed dispersal inPopuluseuphratica[J].ActaEcologicaSinica, 2005, 25(8):1 994-2 000.
[11] 井家林,夏延国,郝 鹏,等. 土壤类型及其含水量与盐分对胡杨根蘖发生影响[J].东北林业大学学报,2013, 41(12): 42-46.
JING J L,XIA Y G,HAO P,etal.Impacts of soil type, water content and salinity on the root sucker occurrence mechanism ofPopuluseuphratica[J].JournalofNortheastForestryUniversity,2013, 41(12): 42-46.
[12] 李志军,焦陪陪,周正立,等. 灰叶胡杨根蘖繁殖的形态解剖学特征[J].植物学报,2012, 47(2): 133-140.
LI Z J, JIAO P P, ZHOU Z L,etal. Morphological and anatomical features of root sucker propagation ofPopuluspruinosa[J].ChineseBulletinofBotany,2012, 47(2): 133-140.
[13] 张玉芬,张大勇. 克隆植物的无性与有性繁殖对策[J].植物生态学报,2006, 30(1): 174-183.
ZHANG Y F,ZHANG D Y. Asexual and sexual reproductive strategies in clonal plants [J].JournalofPlantEcology, 2006, 30(1): 174-183.
[14] 夏延国,董芳宇,吕 爽,等. 极端干旱区胡杨细根的垂直分布和季节动态[J].北京林业大学学报,2015, 37(7): 37-44.
XIA Y G, DONG F Y, LÜ S,etal. Vertical distribution and seasonal dynamics of fine roots inPopuluseuphraticaplantation in the extremely drought area[J].JournalofBeijingForestryUniversity, 2015, 37(7): 37-44.
[15] NARGIS NAZ, MANSOOR HAMEED, TAHIRA NAWAZ,etal. Structural adaptations in the desert halophyteAeluropuslagopoides(Linn.) Trin. ex Thw. under high salinity [J].JournalofBiologicalResearch-Thessaloniki, 2013,19: 150-164.
[16] ASHTON P M S., OLANDER L P, BERLYN G P,etal. Changes in leaf structure in relation to crown position and tree size ofBetulapapyriferawithin fire-origin stands of interior cedar-hemloc[J].CanadianJournalofBotany, 1998, 76(7): 1 180-1 187.
[17] 黄振英,吴 鸿,胡正海. 30种新疆沙生植物的结构及其对沙漠环境的适应[J].植物生态学报,1997, 21(6): 521-530.
HUANG Z Y,WU H, HU Z H. The structure of 30 species of psammophytes and their adaptation to the sandy desert environment in Xinjiang [J].ActaPhytoecologicaSinica, 1997, 21(6): 521-530.
[18] 黄振英,吴 鸿,胡正海. 新疆 10 种沙生植物旱生结构的解剖学研究[J].西北植物学报,1995, 15(6): 56-61.
HUANG Z Y, WU H, HU Z H. An anatomical study on xeromorphic of the psammophytes in Xinjiang [J].ActaBot.Boreal.-Occident.Sin.,1995, 15(6): 56-61.
[19] 张 义,王得祥,宋 彬,等. 基于叶片解剖结构的西宁市11种城市森林植物抗旱性评价[J].西北农林科技大学学报(自然科学版),2014, 42(8): 86-92.
ZHANG Y,WANG D X,SONG B,etal.Leaf anatomical structure based drought resistance evaluation of 11 urban forest plants in Xining City[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed),2014, 42(8):86-92.
[20] 燕 玲,李 红,贺 晓,等. 阿拉善地区9种珍稀濒危植物营养器官生态解剖观察[J].内蒙古农业大学学报,2000, 21(3): 65-71.
YAN L,LI H,HE X,etal.Ecological anatomy of nine Priority species in Alasan area [J].JournalofInnerMongoliaAgriculturalUniversity,2000, 21(3): 65-71.
[21] 李正理,李容敖. 我国甘肃九种旱生植物同化枝的解剖观察[J].植物学报,1981, 23(3): 181.
LI Z L, LI R A. Anatomical observation of assimilating branches of nine xerophytes in Gansu[J].ActaBotanicaSinica,1981, 23(3): 181-185.
[22] 刘家琼. 我国荒漠不同生态类型植物的旱生结构[J].植物生态学与地植物学丛刊,1982, 6(4): 314-319.
LIU J Q. The xeromorphic structure of different typical plants in desert of China[J].ActaPhytoecologicaETGeobotanicaSinica, 1982, 6(4): 314-319.
[23] 苏培玺,安黎哲,马瑞君,等. 荒漠植物梭梭和沙拐枣的花环结构及C4光合特征[J].植物生态学报,2005, 29(1): 1-7.
SU P X, AN L Z, MA R J,etal. Kranz anatomy and C4photosynthetic characteristics of two desert plants,HaloxylonammodendronandCalligonummongolicum[J].ActaPhytoecologicaSinica,2005, 29(1): 1-7.
[24] 耿宇鹏,张文驹,李 博,等. 表型可塑性与外来植物的入侵能力[J].生物多样性,2004, 12(4): 447-455.
GENG Y P,ZHANG W J,LI B,etal.Phenotypic plasticity and invasiveness of alien plants[J].BiodiversityScience,2004, 12(4): 447-455.
[25] VALLADARES F, WRIGHT S J, LASSO E,etal.Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest[J].Ecology,2000, 81(7): 1 925-1 936.
[26] 何冬梅,刘 庆,林 波,等. 人工针叶林林下11种植物叶片解剖特征对不同生境的适应性[J].生态学报,2008, 28(10): 4 739-4 749.
HE D M, LIU Q, LIN B,etal. Adaption of leaf anatomical characteristics of eleven understory species to different environments in coniferous plantations [J].ActaEcologicaSinica,2008, 28(10): 4 739-4 749.
[27] MOTT K A, GIBSON A C, OLEAR J W. The adaptive significance of amphistomatic leaves [J].PlantCell&Environment,1982, 5(6): 445-460.
[28] PIGLIUCCI M. Phenotypic Plasticity: Beyond nature and nurture [J]. Johns Hopkings University Press, Baltimore and London,2001, 304(4): 397-399.
[29] SULTAN S E. Phenotypic plasticity and plant adaptation [J].ActaBotanicaNeerlandica,1995, 44(44): 363-383. (Special Jubilee Symposium Volume)
[30] CORDELL S, GOLDSTEIN G, MUELLER-DOMBOIS D,etal. Physiological and morphological variation inMetrosiderospolymorpha,a dominant Hawaiian tree species,along an altitudinal gradient: the role of phenotypic plasticity [J].Oecologia,1998, 113: 188-196.
[31] 崔秀萍,刘果厚,张瑞麟. 浑善达克沙地不同生境下黄柳叶片解剖结构的比较[J].生态学报,2006, 26(6): 1 842-1 847.
CUI X P,LIU G H,ZHANG R L.Comparison of leaf anatomical structure betweenSalixgordejeviigrowing under contrasting habitats of Otingdag Sandland andSalixmicrotachyavar.bordensisgrowing on the lowlands of dunes [J].ActaEcologicaSinica,2006, 26(6): 1 842-1 847.
[32] WILLIAMS D G, MACK R N, BLACK R A. Ecophysiology of introducedPennisetumsetaceumon Hawaii:the role of phenotypic plasticity [J].Ecology,1995, 76: 1 569 -1 580.
[33] MARCO M, CRISTIAN A, CRISTIAN T. Functional differences in response to drought in the invasiveTaraxacumofficinalefrom native and introduced alpine habitat ranges [J].PlantEcology&Diversity,2011, 4(1): 37-44.
(编辑:裴阿卫)
Plasticity Response of Leaf Anatomical Characteristics of Populus euphratica in Different Soil Conditions
DONG Fangyu, WANG Wenjuan, CUI Panjie, WANG Jianming, ZHANG Tianhan, LI Jingwen*
(The Key Laboratory for Silviculture and Conservation of Ministry of Education,Beijing Forestry University,Beijing,100083,China)
Phenotypic plasticity play the important role in the plant individual adaptation in extreme arid region. In this study, leaf anatomical structures ofPopuluseuphraticawere quantitatively analyzed to reveal the differences of phenotypic adaptive plasticity in three different soil conditions(Erdaoqiao, Qidaoqiao, Badaoqiao) in Egina, Innermongolia. The results showed that leaf anatomical structures ofP.euphraticapresented obvious divergence phenomenon in the heterogeneous soil conditions. Leaf anatomical structures ofP.euphraticain Erdaoqiao, Qidaoqiao, Badaoqiao had different degrees of differences except main vein xylem/main vascular bundle area, and spongy tissue thickness had significant differences among three soil conditions. Soil moisture and salinity affected growth of epidermal tissue in represents of upper epidermal cell, and soil fertility affected growth of conducting tissue in represents of the main vein vascular bundle and palisade tissue in Ejina. Environmental heterogeneity is the root cause of leaf anatomical plasticity ofP.euphratica. Leaf anatomical plasticity makeP.euphraticaadapt to different environments and different structures form adaptability difference in the same environment. Variation coefficient and plasticity index of the main vein xylem area and the main vein vascular bundle area were high, which showed main vein xylem and main vein vascular bundle were the major structure ofP.euphraticain response to conditional changes. Leaf anatomical structure characteristics and its plasticity are the important adaptive strategy ofP.euphraticain the dryland.
Populuseuphratica;anatomical structure;plasticity;soil moisture ;soil salinity;soil fertility
1000-4025(2016)10-2047-11
10.7606/j.issn.1000-4025.2016.10.2047
2016-04-10;修改稿收到日期:2016-10-10
国家自然科学基金(31570610,31070553),林业公益性科研专项(201404304-6)
董芳宇(1992-),在读硕士研究生,主要从事生物多样性研究。E-mail:dongfangyu527@sina.com
*通信作者:李景文,博士,教授,主要从事生物多样性研究。E-mail:lijingwen@bjfu.edu.cn
Q948.118
A
