芽孢杆菌T3菌株对镉胁迫下蒌蒿生理特性和根际微生物的影响
2016-12-17周小梅赵运林库文珍
周小梅,赵运林,董 萌,库文珍
(1 湖南城市学院 建筑与城市规划学院,湖南益阳 413000;2 中南林业科技大学,长沙 410004;3 湖南城市学院 化学与环境工程学院,湖南益阳 413000)
芽孢杆菌T3菌株对镉胁迫下蒌蒿生理特性和根际微生物的影响
周小梅1,赵运林2*,董 萌3,库文珍3
(1 湖南城市学院 建筑与城市规划学院,湖南益阳 413000;2 中南林业科技大学,长沙 410004;3 湖南城市学院 化学与环境工程学院,湖南益阳 413000)
为探讨镉(Cd)胁迫条件下蒌蒿对促生细菌(PGPB)的响应机制,以芽孢杆菌T3(Bacillussp.)菌株为对象,通过盆栽试验,研究不同Cd处理水平下芽孢杆菌T3菌株对蒌蒿生长、生理、Cd富集转运以及根际微生物的影响。结果表明:(1)在Cd胁迫条件下,芽孢杆菌T3菌株可显著促进蒌蒿地上部、地下部及总干物质的积累,但对株高和根冠比的影响不明显。(2)芽孢杆菌T3菌株能显著促进Cd胁迫条件下蒌蒿对Cd的富集与转运,相比单一Cd胁迫,蒌蒿地上部生物富集系数(BCF)增加了8.3%~29.3%,地下部BCF减少了6.6%~11.1%,同时转运系数(TF)增加了20.8%~38.3%。(3)在Cd胁迫和芽孢杆菌T3菌株的共同作用下,蒌蒿叶绿素a、叶绿素b和总叶绿素含量明显增加。(4)芽孢杆菌T3菌株使Cd胁迫条件下蒌蒿体内丙二醛(MDA)含量显著减少,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性明显增加,可有效抵御由Cd胁迫所产生的氧化伤害。(5)芽孢杆菌T3菌株能显著增加Cd胁迫条件下蒌蒿根际土壤细菌、放线菌数量及微生物总量,可减少蒌蒿根际土壤真菌的数量,但与对照差异不显著。研究表明,在Cd胁迫条件下芽孢杆菌T3菌株对蒌蒿生长、生理和根际土壤微生物环境可产生积极影响,可增强蒌蒿植物对Cd胁迫环境的适应性,从而提高其对Cd的耐受能力。
促生细菌;镉胁迫;蒌蒿;生长生理;根际微生物
近年来,由于工农业的快速发展和农药化肥的不合理使用等,致使土壤发生严重重金属污染[1]。镉(Cd)毒性极强,一旦被农作物吸收富集,将危害极大。洞庭湖流域是湖南省乃至全国重要的农业生产区,湿地土壤Cd污染较为严重[2],急需生态修复。蒌蒿(ArtemisiaselengensisTurcz.)属菊科蒿属多年生草本,俗称芦蒿、藜蒿等,是洞庭湖湿地优势植物,是一种较具潜力的Cd污染修复植物[3],但由于生物量相对较小,极大地影响了其在湿地Cd土壤污染修复中的运用。
植物促生细菌(plant growth-promoting bacteria,PGPB)近年来被广泛运用于改善植物根际土壤微生物环境,促进植物生长,增强植物对逆境的适应,提高植物的修复效率等[4-6]。因此,研究蒌蒿对Cd胁迫环境中PGPB的响应机制极其重要。Ma等[7]研究表明,接种具镍(Ni)抗性的PGPB菌株SRA2可使印度芥菜的生物量增加285%。Sheng等[8]将具多金属抗性的PGPB菌株芽孢杆菌(Bacillussp. )J119接种到玉米、油菜等植物中,发现菌株J119可显著促进重金属向植物地上部转运。Zhang等[9]研究发现,接种PGPB菌株后植株体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)以及过氧化氢酶(CAT)活性均显著增加,增强了植物抵御逆境胁迫的能力。韩坤等[10]将芽孢杆菌(Bacillussp.)菌株接种到小麦根系后,发现盐胁迫下小麦幼苗的叶绿素含量明显增加,抗氧化酶活性显著增强,有效缓解了盐胁迫对小麦的毒害效应。赵青云等[6]发现,香草兰接种枯草芽胞杆菌(Bacillussubtilis)Y-IVI后,其根际微生态有明显改善并且干物质重也显著增加。然而关于PGPB对Cd胁迫下蒌蒿生长、生理与根际微生物的影响研究目前尚无报道。
因此,本研究通过盆栽试验,以具促生功能的植物促生细菌芽孢杆菌T3菌株为对象,探讨PGPB对不同Cd处理水平下蒌蒿生长、抗性生理、Cd富集转运与根际微生物的影响,以揭示蒌蒿在Cd胁迫下对PGPB的响应机制,为洞庭湖湿地Cd污染土壤构建有效的生态修复技术提供科学依据。
1 材料和方法
1.1 供试材料
PGPB菌株T3分离自蒌蒿根际土壤,经鉴定为芽孢杆菌(Bacillussp.)。它能产酸、分泌吲哚乙酸(IAA)和合成铁载体,对Cd2+的耐受浓度为50 mg·L-1[11]。在超净工作台上,挑取少量T3菌体于液体LB培养基中,于培养箱内震荡培养16 h(30 ℃、150 r·min-1),菌液经离心 5 min(4 ℃、8 000 r·min-1)后,倒出上清液,用无菌生理盐水润洗2次,再用无菌生理盐水调节菌悬液浓度为6.8×108cfu·mL-1,制成接种菌剂。
基质是采用购自湖南省长沙市红星花卉大市场的营养土,经测定全Cd含量为0.25 mg·kg-1,自然风干与灭菌处理后,添加不同浓度的Cd(以Cd2+计算,使各处理培养基质中Cd2+浓度分别为0、10、20、30 mg·kg-1),并施入N、P、K复合肥100 mg·kg-1拌匀,于实验室平衡备用。
蒌蒿植株采自南洞庭湖管竹山(112°19′33.4″E,28°55′14.9″N),并定植于湖南城市学院苗圃。为保证试验用苗的一致性,剪取长势基本一致的蒌蒿茎段若干于苗圃大棚进行扦插栽培。
1.2 试验设计
2014年8月18日,将平衡了45 d的基质进行装盘(孔穴盘的底径为3 cm、高为8.5 cm、上口径为6.2 cm),每穴称装基质100 g,量取菌剂50 mL,以等量无菌生理盐水为对照(CK),与基质充分混匀。选取生长健壮的、长势基本一致的蒌蒿扦插苗若干(带3片完全展开叶)移栽至孔穴盘,每处理移栽16株,浇透水,置于湖南城市学院苗圃大棚,正常养护管理60 d后(蒌蒿生长期间棚内气温为25 ℃~37 ℃,相对湿度为60%~90%,盘内土壤含水量为70%~80%),取样进行各指标的测定。
1.3 测定指标及方法
1.3.1 植株生长指标 将从孔穴盘中取出的蒌蒿植株于自来水下冲冼干净,并于Na2-EDTA溶液(浓度为20 mmol·L-1,为去除吸附在根表面的Cd2+)中浸泡20 min,之后去离子水反复冲冼并吸干多余水分。直尺测量蒌蒿植株的株高,置于烘箱中,105 ℃杀青15 min,75 ℃烘干至恒重,分别称量蒌蒿植株的总干重、地下部和地上部干重并计算根冠比。
根冠比=地下部干重/地上部干重。
1.3.2 植株生理生化指标 选用蒌蒿植株的第4叶进行叶绿素、丙二醛(MDA)含量及SOD、POD和CAT活性的测定。参照李合生[12]的方法进行叶绿素含量,SOD、POD与CAT活性的测定[12],参照Cakmak和 Marschner[13]的方法进行MDA含量的测定。
1.3.3 植株镉含量、富集系数和转运系数 将各处理的蒌蒿地下部与地上部干样分别研磨粉碎,并称取样品0.2 g,参照梁泰帅等[1]方法进行样品的消解,采用原子吸收分光光度计法测定其地下部和地上部Cd含量,并计算总Cd含量、生物富集系数(BCF)以及转运系数(TF)。
BCF=植株组织中Cd含量/土壤中Cd含量);
TF=植株地上部Cd含量/植株地下部Cd含量)。
1.3.4 根际土壤微生物数量 轻轻抖动从孔穴盘中取出的蒌蒿植株,即附着在根系上的土为根际土壤,参照李振高等[14]方法进行根际土壤细菌、真菌和放线菌数量的测定。
1.4 数据统计分析
采用Excel 2003处理数据,SPSS19.0统计分析,LSD做差异显著性分析(P<0.05)。
2 结果与分析
2.1 芽孢杆菌 T3菌株对镉胁迫下蒌蒿生长特性的影响
由表1可知,蒌蒿株高、地下部、地上部及总干重与根冠比均随Cd胁迫浓度的增加表现为先增后减的趋势,并在CK20和T20处理水平下达到最大值,且最大值大多与相应对照(CK0和T0)差异显著。与单一Cd胁迫(CK)相比,T3菌剂和Cd2+共同处理的蒌蒿上述生长指标均不同程度增加,T0、T10、T20处理的地上部干重、总干重以及T20处理的地下部干重的增幅均达到显著水平,其中T20处理地下部干重、地上部干重、总干重分别比CK20显著增加25.0%、15.1%和15.9%。另外,与CK相对,蒌蒿地下部干重的增幅(22.2%~28.6%)远大于地上部(5.0%~17.0%)。除此,与CK0相比较,CK30处理的地上部干重和总干重均显著降低,T30处理的地上部干重虽仍显著降低,但其总干重已与CK0无显著差异。可见,适宜浓度Cd胁迫能明显促进蒌蒿植株生长,但过高浓度Cd胁迫却显著抑制其干物质积累,芽孢杆菌 T3菌株能够有效促进Cd胁迫环境中蒌蒿干物质积累,缓解高浓度(30 mg·kg-1)Cd胁迫造成的伤害。
2.2 芽孢杆菌 T3菌株对镉胁迫下蒌蒿叶绿素含量的影响
研究表明,随Cd胁迫浓度的增加蒌蒿叶绿素含量呈先升后降的趋势,在CK10和T10处理水平下,叶绿素a、叶绿素b和总叶绿素含量均达最大值并与相应对照(CK0和T0)差异显著,之后随Cd胁迫浓度的增加均呈下降趋势(表2)。与单一Cd(CK)胁迫相比,蒌蒿叶绿素a含量在T10和T30处理水平下显著增加10.1%和14.1%,而叶绿素b和总叶绿素含量在所有处理水平下均显著增加且增幅分别为14.1%~40.4%和8.8%~20.6%(表2)。可见,适应浓度Cd胁迫有利于促进蒌蒿叶绿素含量的增加,而高浓度Cd胁迫则引起其含量的减少,芽孢杆菌 T3菌株有利于促进Cd胁迫环境中蒌蒿叶绿素含量的增加。
2.3 芽孢杆菌 T3菌株对镉胁迫下蒌蒿MDA含量与抗氧化酶活性的影响
首先,研究表明,随Cd胁迫浓度的增加蒌蒿MDA含量呈上升趋势,与CK0相比,CK10、CK20和CK30处理水平下MDA含量均显著增加,但与T0相比,T10处理水平下蒌蒿MDA含量变化不明显。与单一Cd(CK)胁迫相比,蒌蒿MDA含量明显下降,其中在T20和T30处理水平下,MDA含量显著减少了13.7%和19.4%(表3)。其次,从表3可以看出,随Cd胁迫浓度的增加蒌蒿SOD、POD和CAT活性呈先升后降的趋势,在CK10和T20处理水平下,SOD、POD和CAT活性达最大值并与相应对照(CK0和T0)差异显著,之后随Cd胁迫浓度的增加,SOD、POD和CAT活性呈下降趋势。与单一Cd(CK)胁迫相比,蒌蒿SOD、POD和CAT活性在T10、T20和T30处理水平下显著增加6.3%~27.1%、12.7%~43.1%和14.1%~45.8%。另外,与CK0相比,CK30处理下的SOD、POD和CAT活性均显著降低,而T30处理下的CAT活性仍显著增加,虽然SOD、POD活性有所下降,但差异不显著。可见,Cd胁迫处理增强了蒌蒿的膜质过氧化程度,促进其MDA含量的增加,适宜浓度Cd胁迫处理可增强蒌蒿体内的抗氧化酶活性,芽孢杆菌 T3菌株能显著减少Cd胁迫条件下蒌蒿的MDA含量并增强其抗氧化酶活性。

表1 芽孢杆菌 T3菌株对镉胁迫下蒌蒿生长特性的影响
注: 处理组合中,CK和T分别表示无菌生理盐水和T3菌剂处理,0、10、20、30分别表示Cd胁迫浓度(mg·kg-1);同列不同小写字母表示5%水平上的差异显著;下同
Note: in the process of combination, CK and T represent sterile saline and T3 inoculants, respectively; 0,10,20 and 30 represent Cd stress concentration(mg·kg-1), respectively; the different normal letters in the same column mean significant difference at the 5% level; the same as followed

表2 芽孢杆菌T3菌株对镉胁迫下蒌蒿叶绿素含量的影响
2.4 芽孢杆菌 T3菌株对镉胁迫下蒌蒿Cd富集转运的影响
首先,与CK0和T0相比,各浓度Cd胁迫处理蒌蒿地下部、地上部与总Cd含量显著增加,且随Cd胁迫浓度的增加呈上升趋势;与单一Cd(CK)胁迫处理相比,芽孢杆菌 T3菌株处理促进了蒌蒿地上部Cd的积累和总Cd含量的增加,而减少了地下部Cd的含量,其中T10、T20和T30处理蒌蒿地上部Cd含量,以及T20和T30处理蒌蒿从土壤中富集的总Cd含量均显著增加,而T20和T30处理地下部Cd含量显著减少;相同处理下,蒌蒿地上部Cd含量明显大于地下部含量(表4)。
其次,生物富集系数(BCF)是评价植物从土壤中富集重金属能力强弱的指标[1,15]。表4显示,与CK0和T0相比,各浓度Cd胁迫处理蒌蒿地上部和地下部的BCF值均显著增加,且随Cd胁迫浓度的增加呈下降趋势,并分别在T10和CK10处理下达到最大值。与单一Cd(CK)胁迫相比,芽孢杆菌 T3菌株处理蒌蒿地上部BCF值显著增加8.3%~29.3%,而地下部BCF值降低了6.6%~11.1%;在相同处理下,蒌蒿地上部的BCF值明显大于地下部,表明地上部是蒌蒿富集Cd的主要部位。
再次,转运系数(TF)可用来评价植物将重金属由地下部转运至地上部的能力[1,15]。从表4可知,与CK0和T0相比,各浓度Cd胁迫处理蒌蒿TF值都不同程度降低,并随Cd胁迫浓度的增加基本呈下降趋势,CK20和CK30处理下达到显著水平;相比单一Cd(CK)胁迫,芽孢杆菌 T3菌株处理蒌蒿TF值显著增加了20.8%~38.3%。
以上结果说明:Cd胁迫处理可显著增加蒌蒿对Cd的生物富集,但却降低了蒌蒿对Cd的转运,芽孢杆菌 T3菌株促进了Cd胁迫条件下蒌蒿地上部对Cd的富集,但却降低了蒌蒿地下部Cd的富集量,促进了Cd向蒌蒿地上部的转运。
2.5 芽孢杆菌 T3菌株对镉胁迫下蒌蒿根际土壤微生物的影响
从表5可以看出,蒌蒿根际土壤细菌、放线菌、真菌和微生物总数均随Cd胁迫浓度的增加呈先升后降的趋势,在CK20和T20处理水平下,细菌、放线菌和微生物总数均达最大值并与相应对照(CK0和T0)差异显著,在CK10和T10处理水平下,真菌数量达到最大值并与相应对照(CK0和T0)差异显著。另外,与CK0和T0相比,CK30和T30处理下真菌数量仍有所增加,虽然CK30处理下放线菌数量显著低于对照,但T30处理下其数量仍显著高于对照。与单一Cd(CK)胁迫相比,蒌蒿根际土壤细菌和微生物总数在所有的处理水平下均显著增加,真菌数量略有减少,在T0、T10和T30处理水平下,放线菌数量显著增加。可见,适宜浓度Cd胁迫能明显增加蒌蒿根际土壤细菌、放线菌和微生物总数,但过高浓度则引起其数量的下降,真菌数量在所有的Cd胁迫条件下均高于相应对照(CK0和T0),芽孢杆菌 T3菌株能明显增加Cd胁迫条件下蒌蒿根际土壤细菌、放线菌和微生物总数,但对真菌影响不明显。

表3 芽孢杆菌T3菌株对镉胁迫下蒌蒿MDA含量与抗氧化酶活性的影响

表4 芽孢杆菌 T3菌株对镉胁迫下蒌蒿Cd富集转运特征的影响

表5 芽孢杆菌T3菌株对镉胁迫下蒌蒿根际土壤微生物数量的影响
3 讨论与结论
Cd的生物毒性和迁移性极强,进入植物体可产生多种伤害,其中生物量的变化是植物响应Cd胁迫的综合反映[1]。相关研究表明, PGPB菌株能合成铁载体与土壤中难溶性的氧化态高价铁螯合形成可溶性的铁-铁载体复合体,可满足植物生长对铁素的需求;另外PGPB菌株可通过分泌IAA来促使植物对土壤中养分的吸收,进而促进植物的生长[16-18]。本研究中的芽孢杆菌 T3菌株铁载体的合成量为5.5 μmol·L-1,IAA的分泌量为7.583 mg·L-1[11],相比单一Cd胁迫,蒌蒿地下部干重、地上部干重、总干重均有显著增加,说明芽孢杆菌 T3菌株可促进Cd胁迫环境中蒌蒿干物质的积累,并在一定程度上能增强蒌蒿植株对Cd胁迫的适应性反应。另外,本研究中蒌蒿地下部干物质重的增幅远大于地上部,可能是由于芽孢杆菌 T3菌株的作用促使Cd向蒌蒿地上部转运,减轻了其地下部Cd的胁迫伤害。
同时,Cd胁迫会影响植物的抗性生理[19]。叶绿素含量的高低通常作为植物干物质积累能力与抗性生理的评价指标[19-20]。Cd胁迫会影响叶绿体的结构与功能,从而抑制其生物合成[19]。接种PGPB菌株或施入PGPB菌肥能有效提高植物叶绿素酶的催化能力,从而可显著提高植物叶绿素a、叶绿素b和总叶绿素的含量,提高其干物质积累并增强其抗逆性[21-22]。在本研究中,接种芽孢杆菌 T3菌株后,Cd胁迫环境中的蒌蒿植株叶绿素a、叶绿素b和总叶绿素含量均显著增加,说明芽孢杆菌 T3菌株在一定程度上可提高蒌蒿植株的光合能力并可促进其干物质的积累,这一结论与表1的结果是相吻合的。
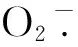
BCF和TF是表征植物从土壤中富集重金属并向地上部转运的重要指标[1,15]。据报道,PGPB菌株①可通过分泌低分子量有机酸来降低土壤的pH,从而增加土壤中重金属的植物有效性;②可通过产生铁载体来增加土壤中重金属离子的流动性,从而促进植物的吸收;③可通过分泌有机配位体来与重金属螯合,从而促进重金属向植物地上部的转运[18]。在本研究中,与对照(CK)相比,芽孢杆菌 T3菌株作用后,蒌蒿地上部Cd和总Cd含量明显增加,而地下部Cd含量显著减少,与此同时,蒌蒿地上部BCF和TF值均明显增加,表明芽孢杆菌 T3菌株可促进蒌蒿对Cd的富集与转运。另外,蒌蒿地下部BCF显著减少,说明在Cd胁迫环境中,芽孢杆菌 T3菌株可减轻蒌蒿地下部受到的伤害程度,这也说明了为什么在芽孢杆菌 T3菌株的作用下蒌蒿地下部干物质重的增幅要远大于地上部。
另外,土壤微生物数量和结构的变化可作为植物根际土壤质量评价的重要指标[26]。重金属胁迫会导致植物根际土壤环境质量的下降[27]。接种PGPB菌株可增强植物根际土壤微生物活性,增加根际土壤细菌数量和微生物总量,明显降低真菌数量,促使土壤由真菌型向细菌型转变,可有效改善植物根际土壤的微生物环境[28-29]。本研究中,相比单一Cd(CK)胁迫,蒌蒿根际土壤细菌、放线菌数量和微生物总数均显著增加,而真菌数量略有减少。原因可能是由于芽孢杆菌 T3菌株作用后促进了蒌蒿根系的生长,为细菌和放线菌的大量繁殖提供了营养[9]。这也表明芽孢杆菌 T3菌株有改善受损土壤生态系统的可能,为蒌蒿植株的生长提供一个较健康的生长环境,进而促进其干物质积累。
综上所述,与对照(CK)相比,芽孢杆菌 T3菌株显著增强了蒌蒿植物的抗逆性,促进Cd向蒌蒿地上部的转运并有效改善其根际土壤微生物环境,进而促进其干物质积累。该研究为洞庭湖湿地Cd污染土壤构建有效的生态修复技术奠定了理论基础。
[1] 梁泰帅,刘昌欣,康靖全,等.硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J].农业环境科学学报,2015,34(8):1 455-1 463.
LIANG T S,LIU C X,KANG J Q,etal.Effects of sulfur on cadmium accumulation, photosynthesis and some other physiological characteristics of pakchoi(BrassicachinensisL.)under cadmium stress[J].JournalofAgro-EnvironmentScience,2015,34(8):1 455-1 463.
[2] 周小梅,赵运林,库文珍,等.荧光假单胞菌对洞庭湖湿地镉污染土壤碳氮生理类群和微生物活性的影响[J]. 地球与环境,2015,43(6):637-641.
ZHOU X M,ZHAO Y L,KU W Z,etal.Effects ofPseudomonasfluorescenson carbon and nitrogen physiological groups and microbial activity of cadmium contaminated soil from Dongting Lake wetland[J].EarthandEnviromnent,2015,43(6):637-641.
[3] 董 萌,赵运林,库文珍,等.蒌蒿对镉的富集特征及亚细胞分布特点[J].植物学报,2013,48(4):381-388.
DONG M,ZHAO Y L,KU W Z,etal.Cadmium accumulation and subcellular distribution in different organs ofArtemisiaselengensis[J].ChineseBulletinofBotany,2013,48(4):381-388.
[4] ZHANG X X,LI C J,NAN Z B.Effects of cadmium stress on growth and antioxidative systems inAchnatheruminebrianssymbiotic with Neotyphodium gansuense[J].JournalofHazardousMaterials,2010, 175:703-709.
[5] SHENG X F,SUN L N,HUANG Z,etal.Promotion of growth and Cu accumulation of bio-energy crop (Zeamays) by bacteria: implications for energy plant biomass production and phytoremediation[J].JournalofEnvironmentalManagement,2012,103:58-64.
[6] 赵青云,赵秋芳,王 辉,等.根际促生菌BacillussubtilisY-IVI 在香草兰上的应用效果研究[J].植物营养与肥料学报,2015,21(2):535-540.
ZHAO Q Y,ZHAO Q F,WANG H,etal.Beneficial effects of plant growth promoter rhizobacteria on vanilla (VanillaplanifoliaAmes.) growth[J].JournalofPlantNutritionandFertilizer,2015,21(2):535-540.
[7] MA Y,RAJKUMAR M,FREITAS H.Improvement of plant growth and nickel uptake by nickel resistant-plant growth promoting bacteria [J].JournalofHazardousMaterials,2009,166:1 154-1 161.
[8] SHENG X F,HE L Y,WANG Q Y,etal. Effects of inoculation of biosurfactant-producingBacillussp. J119 on plant growth and cadmium uptake in a cadmium-amended soil [J].JournalofHazardousMaterials, 2008, 155: 17-22.
[9] ZHANG B L,SHANG S H,ZHANG H T,etal.Sodium chloride enhances cadmium tolerance through reducing cadmium accumulation and increasing anti-oxidative enzyme activity in tobacco[J].EnvironmentalToxicologyandChemistry,2013,32(6):1 420-1 425.
[10] 韩 坤,田曾元,刘 珂,等.具有ACC脱氨酶活性的海滨锦葵(Kosteletzkyapentacarpos)内生细菌对小麦耐盐性的影响[J].植物生理学报,2015,51(2):212-220.
HAN K,TIAN Z Y,LIU K,etal.Effect of endophytic bacteria with ACC deaminase activity inKosteletzkyapentacarposon wheat salt tolerance[J].PlantPhysiologyJournal,2015,51(2):212-220.
[11] 周小梅,赵运林,胥正钢,等.蒌蒿(Artemisiaselengensis)根际耐镉产酸细菌的筛选鉴定及其生物学特性[J].环境工程学报,2014,8(11):5 010-5 014.
ZHOU X M,ZHAO Y L,XU Z G,etal.Screening,identification and biological characterization of cadmium-resistant producing acid rhizospheric bacteria fromArtemisiaselengensis[J].ChineseJournalofEnvironmentalEngineering,2014,8(11):5 010-5 014.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:165-170
[13] CAKMAK I,MARSCHNER H.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J].JournalofPlantPhysiology,1992,98:1 222-1 227.
[14] 李振高,骆永明,滕 应.土壤与环境微生物研究法[M].北京:科学出版社, 2008: 90-92.
[15] 顾翠花,王懿祥,白尚斌,等.四种园林植物对土壤镉污染耐受性研究[J].生态学报,2015,35(8):1-11.
GU C H,WANG Y X,BAI S B,etal.Tolerance and accumulation of four ornamental species seedlings to soil cadmium contamination[J].ActaEcologicaSinica,2015,35(8):1-11.
[16] RAJKUMAR M,FREITAS H.Effects of inoculation of plant-growth promoting bacteria on Ni uptake by Indian mustard[J].BioresourceTechnology,2008,99:3 491-3 498.
[17] XIE H,PASTERNAK J J,Glick B R. Isolation and characterization of mutants of the plant growth-promoting rhizobacteriumPseudomonasputidaGR12-2 that overproduce indoleacetic acid[J].CurrentMicrobiology,1996,32:67-71.
[18] MA Y,RAJKUMAR M,FREITAS H.Isolation and characterization of Ni mobilizing PGPB from serpentine soils and their potential in promoting plant growth and Ni accumulation byBrassicasp.[J].Chemosphere, 2009,75:719-725.
[19] 刘俊祥,孙振元,勾 萍,等.镉胁迫下多年生黑麦草的光合生理响应[J].草业学报,2012,21(3):191-197.
LIU J X,SUN Z Y,GOU P,etal.Response of photosynthetic physiology of perennial ryegrass (Loliumperenne) to Cd2+stress[J].ActaPrataculturaeSinica,2012,21(3):191-197.
[20] BARYLA A,CARRIER P,FRANCK F,etal. Leaf chlorosis in oil seed rape plant (Brassicanapus) grown on cadmium polluted soil:caused and consequences for photosynthesis and growth [J].Planta,2001, 212: 696-709.
[21] 张 晖,宋圆圆,吕 顺,等.香蕉根际促生菌的抑菌活性及对作物生长的促进作用[J].华南农业大学学报,2015,36(3):65-70.
ZHANG H,SONG Y Y,LÜ S,etal.The antifungal activity and crop growth stimulation of growth-promoting rhizobacteria from banana rhizosphere soil[J].JournalofSouthChinaAgriculturalUniversity,2015,36(3):65-70.
[22] 冯世鑫,莫长明,唐 其,等.枯草芽孢杆菌肥在罗汉果上应用的效应分析[J].广西植物,2015,35(6):807-811.
FENG S X,MO C M,TANG Q,etal.Effects of the bio-fertilizer ofBacillussubtilison the application ofSiraitiagrosvenorii[J].Guihaia,2015,35(6):807-811.
[23] 贾新平,邓衍明,孙晓波,等.盐胁迫对海滨雀稗生长和生理特性的影响[J].草业学报,2015,24(12):204-212.
JIA X P,DENG Y M,SUN X B,etal. Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum[J].ActaPrataculturaeSinica,2015,24(12):204-212.
[24] 李良博,张连根,唐天向,等.UV-B辐射增强对紫茎泽兰和艾草抗性生理特性的影响[J].西北植物学报,2016,36(2):343-352.
LI L B,ZHANG L G,TANG T X,etal. Influence of enhanced UV-B on physiological characteristics ofEupatoriumadenophorumL. andArtemisiaargyiLevl.[J].ActaBotanicaBoreali-OccidentaliaSinica,2016,36(2):343-352.
[25] 张怀山,赵桂琴,栗孟飞,等.中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J].草业学报,2014,23(2):180-188.
ZHANG H S,ZHAO G Q,LI M F,etal. Physiological responses ofPennisetumlongissimumvar.intermediumseedlings to PEG,low temperature and salt stress treatments[J].ActaPrataculturaeSinica, 2014,23(2):180-188.
[26] YUAN B C,YUE D X. Soil microbial and enzymatic activities across a chronosequence of Chinese pine plantation development on the loess plateau of China[J].Pedosphere,2012,22(1):1-12.
[27] MIKANOVA O. Effects of heavy metals on some soil biological parameters [J].JournalofGeochemicalExploration,2006,88(1-3):220-223.
[28] 麻耀华,尹淑丽,张丽萍,等.复合微生态制剂对黄瓜根际土壤微生物数量和酶活性的影响[J].植物保护,2012,38(2):46-50.
MA Y H,YIN S L,ZHANG L P,etal.Effects of complex microbial agent on microorganism population and soil enzyme activity in the cucumber rhizosphere soil[J].PlantProtection,2012,38(2):46-50.
[29] 刘方春,邢尚军,马海林,等.根际促生细菌(PGPR)对冬枣根际土壤微生物数量及细菌多样性影响[J].林业科学,2013,49(8):75-80.
LIU F C,XING S J,MA H L,etal.Effect of plant growth-promoting rhizobacteria(PGPR)on the microorganism population and bacterial diversity inZiziphusjujubarhizosphere soil[J].ScientiaSilvaeSinicae,2013,49(8):75-80.
(编辑:裴阿卫)
Effect of Bacillus sp. T3 on Growth,Physiology and Rhizosphere Microorganisms of Artemisia selengensis under Cadmium Stress
ZHOU Xiaomei1, ZHAO Yunlin2*, DONG Meng3, KU Wenzhen3
(1 College of Architecture and Urban Planning,Hunan City University,Yiyang ,Hu’nan 413000, China; 2 Central South University of Forestry Science and Technology, Changsha 410004, China;3 College of Chemistry and Environment Engineering, Hunan City University, Yiyang,Hu’nan 413000, China)
To explore response mechanism ofArtemisiaselengensison plant growth-promoting bacteria (PGPB) under cadmium stress, this study examined the effects of strain T3 on growth, physiology characteristics, cadmium concentration and translocation and rhizosphere microorganisms ofA.selengensisunder different concentrations of cadmium by pot experiment. The results indicated that (1)Bacillussp.T3 could distinctly promote the accumulation of shoot,root and total dry weight, but had no significant difference in plant height and root-shoot ratio ofA.selengensisunder cadmium stress. (2)Bacillussp.T3 could distinctly increaseA.selengensisto cadmium concentration and translocation, bioconcentration factors (BCF) of cadmium in shoot increased by 8.3%-29.3%, translocation factors(TF) increased by 20.8%-38.3%, but BCF in root reduced by 6.6%-11.1% compared with the single cadmium stress. (3) Under the joint action of cadmium stress andBacillussp.T3,A.selengensischlorophyll a, chlorophyll b and total chlorophyll contents significantly enhanced compared with the single cadmium stress. (4)Bacillussp.T3 could significantly enhance the activities of superoxide dismutase(SOD), peroxidase(POD) and catalase(CAT), whereas significantly reduced the malondialdehyde(MDA) content ofA.selengensis. Therefore it could effectively strengthenA.selengensisto resist oxidation damage produced by cadmium stress. (5) Under cadmium stress,Bacillussp.T3 could significantly improve the number of bacteria, actinomyces and the total number of microorganisms ofA.selengensisrhizosphere soil, but could not distinctly reduce the number of fungi compared with CK. The study suggested thatBacillussp.T3 was conducive to improve growth, physiology and rhizosphere microorganisms environment ofA.selengensisand then strengthenA.selengensisadaptability to cadmium stress environment as well as tolerance.
plant growth-promoting bacteria;cadmium stress;Artemisiaselengensis;growth and physiology; rhizosphere microorganisms
1000-4025(2016)10-2030-08
10.7606/j.issn.1000-4025.2016.10.2030
2016-03-30;修改稿收到日期:2016-10-03
湖南省自然科学基金(2015JJ4012,2016JJ4015);湖南省教育厅优秀青年项目(15B045)
周小梅(1977-),女,博士,副教授,主要从事土壤污染生态修复研究。E-mail:864759100@qq.com
*通信作者:赵运林,教授,博士生导师,主要从事湿地生态研究。E-mail:zyl8291290@163.com
Q945.79
A
