三苯基锡对雄性SD大鼠性腺发育的影响
2016-12-16张自强朱雪敏
位 兰,张自强,朱雪敏,柴 磊
(1.河南科技大学动物科技学院,河南洛阳 471003;2.河南省焦作市畜产品质量安全监测中心,河南焦作 454003)
三苯基锡对雄性SD大鼠性腺发育的影响
位 兰1,张自强1,朱雪敏1,柴 磊2
(1.河南科技大学动物科技学院,河南洛阳 471003;2.河南省焦作市畜产品质量安全监测中心,河南焦作 454003)
为研究三苯基锡(TPT)对雄性哺乳动物生殖的毒性作用,将20只雄性青春期Sparague Dawley(SD)大鼠随机分为3个不同剂量的试验组(0.5、5、50μg/kg)和1个对照组(生理盐水)。每3d灌胃1次,暴露54d,末次灌胃24h后用100g/L水合氯醛麻醉并处死大鼠,取其睾丸和附睾。采用石蜡切片和HE染色方法观察睾丸和附睾组织学;采用分光光度法测定睾丸中碱性磷酸酶(AKP)、总抗氧化能力(T-AOC)和γ-谷氨酰转肽酶(γ-GT)水平。结果显示,大鼠睾丸内曲精小管直径随药物剂量的增加而减小,曲精小管生精细胞和管腔内精子数量均有不同程度减少;低、中剂量组AKP高于对照组,高剂量组低于对照组,但差异不显著(P>0.05);低剂量组γ-GT活力和T-AOC显著高于对照组,中剂量组与对照组相比变化不明显,高剂量组显著低于对照组(P<0.05)。试验证实了TPT在一定程度上影响了雄性大鼠性腺生长发育与精子发生,推测TPT对雄性哺乳动物具有生殖毒性。
三苯基锡;雄性大鼠;生殖毒性
有机锡主要是三丁基锡(tributyltin,TBT) 和三苯基锡(triphenyltin,TPT) ,广泛应用于海洋船只防污涂料的添加剂,由于其对海洋生物的毒性作用,特别是生殖毒性而被高度关注。尽管TPT 和TBT 在环境中经常同时存在,但相对于TBT,对TPT 的毒性研究还较少[1]。TPT为无色或白色的固体或液体,通常几乎不溶于水,广泛用于催化化学、药物化学、聚氯乙烯稳定剂、木材及纺织品防腐剂、工农业杀虫剂和杀菌剂及日常用品的涂料和防霉剂等,除了对海洋生物造成毒性作用,其对陆生物种也具有毒性作用,因为其广泛存在于人们的生活环境中。
有机锡化合物可导致海洋动物性畸变,致使其性别比例失调,威胁到它们的族群生存[2]。林春芳等[3]报道鱼类生命早期阶段暴露于TBT和TPT可引起胚胎发育畸形、孵化延迟或抑制、生育力下降、精子减少等生殖问题。另有报道TPT对细胞增殖具有一定影响[4],而且环境水平的TPT可以调节海马区神经兴奋传导[5]。有研究表明,6mg/kg TPT影响青春期雄性大鼠性发育[6];但是针对环境水平下的三苯基锡含量对雄性动物生殖的影响及机制还没有比较全面的研究报道。因此本研究以青春期雄性SD大鼠为研究对象,采用经口灌胃的方式进行染毒,从TPT对大鼠睾丸组织标志性酶的影响和组织结构的变化特征的角度探讨其生殖毒性作用机制,为分析预测环境水平的TPT污染对动物以及人类健康的影响提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 选用健康的SPF级青春期SD雄性大鼠20只,约20日龄,体重约200g,购于郑州大学实验动物中心。在正常实验环境下,每日连续光照12h,室温20℃±1℃,自由取食饮水,饲养10d后随机分为4组:3个不同剂量(TPT0.5、5、50μg/kg)处理组和对照组(生理盐水),每组5只。
1.1.2 主要试剂 三苯基锡(TPT)纯度97%为Fluka公司产品,先用无水乙醇配置成一定浓度的储备液,4℃避光保存;考马斯亮蓝蛋白测定试剂盒(批号20100409)、γ-谷氨酰转肽酶(γ-GT)测定试剂盒(批号20100926)、总抗氧化能力(T-AOC)测定试剂盒(批号20100409)、碱性磷酸酶(AKP)测定试剂盒(批号20101220)均为南京建成生物工程研究所产品。
1.1.3 主要仪器设备 手摇式组织切片机(202-1)为上海医疗器械四厂产品;Beckman高速离心机(J2-MC)为美国贝克曼库尔特有限公司产品;奥林巴斯显微镜(BH-1)购自杭州汇尔仪器设备有限公司;MIE显微图像处理软件为山东易创电子有限公司产品;UV 300紫外分光光度计,202-AD电热恒温干燥箱,单孔六列恒温水浴锅,电子天平,数显水浴恒温振荡器,M2SPECTRAMAX酶标仪,移液枪,烤片台等。
1.2 方法
1.2.1 实验动物处理与取材 各TPT处理组均用配好的浓度液灌胃,对照组给予等量溶剂(生理盐水和无水乙醇),每3日1次,暴露54d。末次染毒24h后用100g/L的水合氯醛麻醉动物,眼眶采血后处死,取双侧睾丸和附睾。将一侧睾丸和附睾放入多聚甲醛固定液中固定以制作石蜡切片用于组织学检查;另一侧睾丸和附睾放入-20℃冰箱中冻存,用于标志性酶活性的测定。
1.2.2 血液生化指标的测定 准确称取睾丸和附睾分别放入匀浆器中,加入9倍体积生理盐水制成10%的匀浆液,3000r/min离心10min,取上清液放入4℃冰箱中备用。γ谷氨酰转肽酶(γ-GT)、碱性磷酸酶(AKP)和总抗氧化能力(T-AOC)测定均按照试剂盒说明书进行。原理:γ-GT催化底物反应,游离出对硝基苯胺,与受体作用。酶促反应产物对硝基苯胺在410nm处有强吸收峰,可直接比色测定吸光度值,从而计算出γ-GT的活力。AKP分解磷酸苯二钠,产出游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,根据红色深浅可以测定酶活力的高低。机体中有许多抗氧化物质,能使Fe3+还原成Fe2+,后者可与菲林类物质形成稳固的络合物,通过比色法可测出其抗氧化能力的高低。
2 结果
2.1 TPT暴露SD大鼠与对照组大鼠睾丸和附睾组织结构
TPT暴露组和对照组SD雄性大鼠睾丸和附睾组织学研究结果见图1。对照组睾丸精曲小管结构清晰,基膜完整,支持细胞、生精细胞排列整齐,各级生精细胞由外到内依次为精原细胞、初级精母细胞、次级精母细胞、生精细胞、精子,腔内可见较多精子。支持细胞呈不规则的高柱状或锥状,细胞底部附着在基膜上,顶部伸达腔面。睾丸间质疏松,组织结构正常,间质组织内血管周围可见散在的间质细胞,细胞较大,呈圆形或不规则状,核圆形(图1A1、图1A2);TPT暴露组大鼠睾丸组织均有不同程度的损伤,主要表现为曲细精管内大量生精细胞出现不同程度坏死,细胞核固缩凝聚,并出现空泡现象,基膜脱落不完整。低剂量组大多数曲精小管排列正常,基膜完整,支持细胞结构正常,少数曲精小管内生精细胞数量与对照组组相比有所减少(图1B1、图1B2);中剂量组大多数曲精小管内生精细胞排列较稀疏,且发生轻度肿胀、变形现象,管腔内精子数量明显减少(图1C1、图1C2);高剂量组曲精小管的基膜脱落,结构不完整,生精细胞排列稀疏,且严重变形、肿胀,间质结构不清晰(图1D1、图1D2)。对照组大鼠的附睾管排列整齐,结构完整,腔内精子丰富,分布均匀,管周结缔组织丰富(图1a);TPT暴露组出现附睾管管壁变薄,管腔变得不规则,输出小管和附睾管上皮明显变薄,管间组织与对照组相比较稀疏,且组织间隙增大,对附睾损伤程度随TPT暴露剂量的增加而逐渐加重,呈现剂量依赖效应(图1b、图1c、图1d)。
2.2 TPT暴露后SD大鼠睾丸标志性酶的变化
TPT暴露后,比较各暴露组与对照组标志性酶结果发现,低剂量组大鼠睾丸γ-GT活力较对照组显著增高,高剂量组大鼠睾丸γ-GT活力较对照组显著降低,中剂量组与对照组无显著差异(P<0.05)(图2A)。低剂量组大鼠睾丸T-AOC较对照组显著增高,高剂量组大鼠睾丸T-AOC较对照组显著降低,中剂量组与对照组无显著差异(P<0.05)(图2B)。高剂量组大鼠睾丸AKP较对照组低,低、中剂量组较对照组没有明显变化,统计学分析均无显著差异(P<0.05)(图2C)。
3 讨论
3.1 TPT对SD大鼠睾丸和附睾生长发育及精子发生的影响
有研究报道,在1.4mg/(kg·d)~20mg/(kg·d)的剂量范围内,TPT就能对大鼠生殖功能和性腺形态结构产生不良影响。较高剂量时,睾丸和卵巢组织均发生病理学变化,并能导致大鼠不育[2]。体重是综合反映动物全身健康状况的最基本指标之一。本试验结果表明,随着TPT剂量的增加,雄性大鼠体重先升高后降低。染毒组体重的变化说明低剂量的TPT对大鼠生长有促进作用,而高剂量的TPT对大鼠的生长会产生抑制作用。动物在不同年龄段,其脏器系数值有一定规律,当受到有害物质影响时,该比值将发生改变。本试验中,低剂量和中剂量组的体重及睾丸系数较对照组大,高剂量组低于对照组;附睾系数变化不明显。
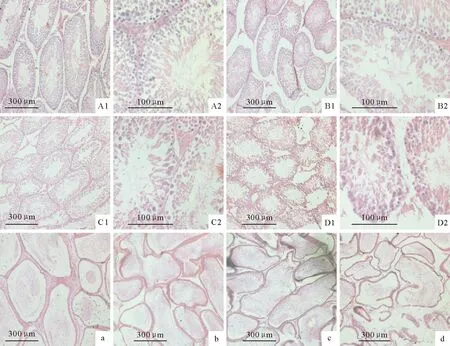
A1.对照组睾丸组织(HE 100×);A2.对照组睾丸组织(HE 400×);B1.低剂量组睾丸组织(HE 100×);B2.低剂量组睾丸组织(HE 400×);C1.中剂量组睾丸组织(HE 100×);C2.中剂量组睾丸组织(HE 400×);D1.高剂量组睾丸组织(HE 100×);D2.高剂量组睾丸组织(HE 400×);a.对照组附睾组织(HE 400×);b.低剂量组附睾组织(HE 400×);c.中剂量组附睾组织(HE 400×);d.高剂量组附睾组织(HE 400×)
A1.Testis tissue in control group(HE 100×);A2.Testis tissue in control group(HE 400×);B1.Testis tissue in low-dose group(HE 100×);B2.Testis tissue in low-dose group(HE 400×);C1.Testis tissue in middle-dose group(HE 100×);C2.Testis tissue in middle-dose group(HE 400×);D1.Testis tissue in high-dose group(HE 100×);D2.Testis tissue in high-dose group( HE 400×);a.Epididymis tissue in control group(HE 400×);b.Epididymis tissue in low-dose group(HE 400×);c.Epididymis tissue in middle-dose group(HE 400×);d.Epididymis tissue in high-dose group(HE 400×)
图1 TPT暴露后SD大鼠睾丸和附睾组织学变化
Fig.1 Histological changes in the testis and epididymis of SD rats exposed to TPT
精子发生包括从精原细胞到精子形成这一连续增殖分化的过程,对有害因素的作用十分敏感,环境化学物可在不同的阶段干扰精子的发生过程。因此,评价精子的数量、活动能力和形态可以反映环境因素对雄性生殖最终的毒性效应,是雄性生殖毒性评价不可缺少的观察终点。环境中影响生殖的因素很多,有研究表明环境雌激素辛基酚可导致小鼠附睾管萎缩,管腔内少见或没有成熟的精子[7]。另有报道,乙烯雌酚处理后小鼠的曲精小管排列疏松、无规则,各种生精细胞的数量减少,有2层~3层细胞,精原细胞与初级精母细胞之间出现裂隙[8]。足够的精子数量是维持正常生育力的重要前提,精子数量的减少常常是各种化学物质对各级生精细胞生长与发育产生毒性作用的结果。精子形态是评价化学物质对精子遗传物质产生不良的潜在性影响的间接指标。精子形态的改变反映雄性生殖细胞的遗传损伤,精子畸形率的高低,可反映该化学毒物的生殖毒性和对生殖细胞潜在的致突变性[9]。附睾是哺乳动物修饰来自睾丸的精子,使之达到生理和功能的成熟并贮存精子的器官。其结构和功能发生异常变化将会影响精子品质,甚至造成不育。本试验结果表明TPT暴露后SD大鼠附睾管管壁变薄,管腔不规则,输出小管和附睾管上皮明显变薄,且附睾内精子的畸形率呈上升趋势,并且与TPT剂量有严格的依赖性,精子数量随着药物剂量的增加明显减少,表明TPT干扰精子正常生长与成熟,对精子生成具有潜在的不利影响。
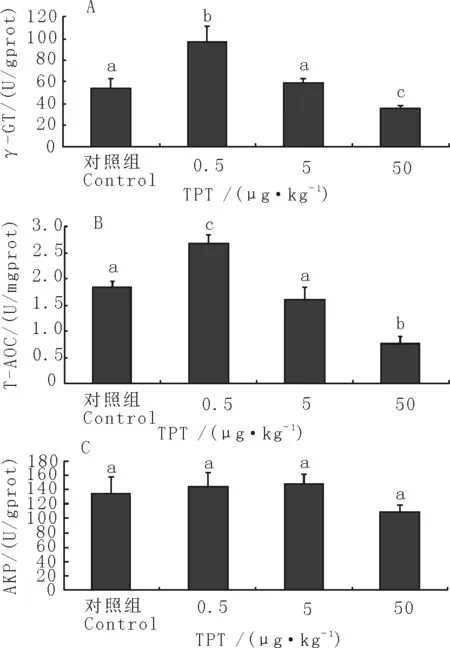
A.TPT暴露后睾丸内γ-GT的变化;B.TPT暴露后睾丸内T-AOC的变化;C.TPT暴露后睾丸内AKP的变化
A.The change of γ-GT in SD rats exposed to TPT;B.The change of T-AOC in SD rats exposed to TPT;C.The change of AKP in SD rats exposed to TPT
上标不同字母的组间示差异显著(P<0.05)。
There is significant difference between groups with different letters(P<0.05).
图2 TPT暴露后SD大鼠睾丸标志性酶的变化
Fig.2 The changes of testicular marker enzymes in SD rats exposed to TPT
睾丸曲细精小管的支持细胞有多种功能,包括支持、营养生精细胞,参与血睾屏障的形成,分泌少量液体,有助于精子的运动等,而各级生精细胞是精子形成的前提。本试验结果表明,随着TPT染毒剂量的增加,曲精小管萎缩,间质组织不同程度的增宽,各级生精细胞减少,管腔内精子数降低,部分管腔内精子缺失。有研究报道有机砷、有机铅和有机汞等有机金属化合物对小鼠精子的毒性很强,能明显降低小鼠精子质量。有机锡能引起小鼠睾丸萎缩,降低精子质量,毒性强度与有机金属化合物相似。其影响机理可能与其抑制实验动物的生殖生理功能、酶系活性以及破坏生殖系统结构有密切关系。因此推测TPT产生毒性效应的作用机制之一可能是TPT透过血睾屏障而作用于生精细胞,雄性生殖器官是TPT毒性作用的主要靶器官,通过影响睾丸正常的生精过程,从而干扰精子的生长、发育和能量代谢过程。
3.2 TPT对SD大鼠睾丸组织标志性酶的影响
精子发生需要经历一系列复杂的变化过程,每个阶段都依赖于能量的供应。由于酶的催化是能量产生不可缺少的重要条件,因此正常的精子数量和质量有赖于生精过程中各种酶活性的维持。阐明化学物质对睾丸各类细胞标志酶的影响,有助于解释靶细胞的定位和精子发生障碍的机制。AKP主要存在于精原细胞、胚胎期初级精母细胞及各级生精细胞与支持细胞的交界面上,参与睾丸生殖细胞增殖、分裂与分化时的营养物质的运输,生精细胞的分裂活动密切相关,并参与营养物质向各级生精细胞的转运,因此通过检测AKP水平的变化可以反应污染物对睾丸的损伤和毒性作用[10],AKP活性下降势必干扰各级生精细胞的营养和能量供应,其活力在精原细胞和早期发育时期的初级精母细胞较强[11]。本试验结果显示,各暴露组AKP的活力与对照组相比变化不明显。
γ-GT是睾丸支持细胞的特异标志酶,主要存在于支持细胞上,它的活性与支持细胞的功能息息相关。支持细胞在精子发生过程中具有提供营养、支持和保护的作用,有利于生殖细胞顺利发育成为成熟的精子,γ-GT活性的降低表明支持细胞机能受到了损伤[12-13]。本研究结果表明,低剂量暴露组γ-GT的活力出现代偿性升高,高剂量组明显降低,说明高剂量组对支持细胞受到了严重损伤。
抗氧化物是指与可氧化的底物相比以低剂量存在时,能显著地延缓或阻止对底物氧化性损伤的物质。正常机体内存在一套有效的抗氧化防御系统,可以清除氧自由基及其代谢产物。组织T-AOC既可以反映机体清除氧自由基的能力,也容易测其含量[14]。有研究通过检测T-AOC的水平作为评价葡萄籽原花青素减轻砷致生殖毒性的能力[15]。本试验表明低剂量处理组大鼠睾丸T-AOC较对照组高,中、高剂量组大鼠睾丸T-AOC低于对照组。通过以上睾丸内酶含量的变化,表明TPT干扰了各级生精细胞的能量代谢过程,导致精子的发育和成熟过程中能量供应障碍。
本试验通过对不同剂量TPT暴露后SD大鼠的精子形态、睾丸和附睾组织形态和标志性酶水平变化的研究,显示了中、高剂量(5μg/kg和50μg/kg)TPT影响了睾丸正常的生精过程,干扰了精子的生长、发育和能量代谢过程,导致大鼠精子数量和活力下降,精子畸形率增加,对雄性大鼠的生精功能已经产生了损害作用,提示一定剂量的TPT对雄性哺乳动物的生殖具有毒性作用。
[1] 孔 皓,韦国利,蒋淑丽,等.三苯基锡对大鼠肥胖发生的影响[J].生态毒理学报,2012,7(4):429-433.
[2] 安立会,张燕强,宋双双,等.渤海湾有机锡污染对野生脉红螺的生态风险[J].环境科学,2013,34(4):1369-1373.
[3] 林春芳,吕华芳.有机锡的生殖毒性和遗传毒性研究进展[J].海峡预防医学杂志,2008,14(1):23-25.
[4] Fickova M,Macho L,Brtko J.A comparison of the effects of tributyltin chloride and triphenyltin chloride on cell proliferation,proapoptotic p53,Bax,and antiapoptotic Bcl-2protein levels in human breast cancer MCF-7cell line[J].ToxicolInVitro,2015,29(4): 727-731.
[5] Wakita M,Oyama Y,Takase Y,et al.Modulation of excitatory synaptic transmission in rat hippocampal CA3neurons by triphenyltin,an environmental pollutant[J].Chemosphere,2015,120: 598-607.
[6] Grote K,Stahlschmidt B,Talsness C E,et al,Chahoud I.Effects of organotin compounds on pubertal male rats[J].Toxicology,2004,202(3):145-158.
[7] 黄春阳,司丽芳,位 兰,等.辛基酚对小鼠附睾、精囊腺和前列腺发育及组织结构的影响[J].动物医学进展,2013,34(2):48-51.
[8] 其力根,阿拉坦敖其尔,武 飞,等.黄芪多糖对己烯雌酚诱导的小鼠睾丸损伤保护作用研究[J].动物医学进展,2013,34(6):47-50.
[9] 许重洁,张艳芬,杨保胜,等.阿霉素对雄性小鼠生殖毒性影响的研究[J].现代预防医学,2010,37(10):1923-1927.
[10] Song Y,Jia Z C,Chen J Y,et al.Toxic effects of atrazine on reproductive system of male rats[J].Biomed Environ Sci,2014,27(4):281-288.
[11] 季宇彬,蒋 晖,郎 朗,等.甲苯二异氰酸酯致小鼠睾丸脂质过氧化损伤及标志酶活力的变化[J].毒理学杂志,2005,19(3):225-226.
[12] Yakubu M T,Oyeyipo T O,Quadri A L,et al.Effects of aqueous extract ofMusaparadisiacaroot on testicular function parameters of male rats[J].J Basic Clin Physiol Pharmacol,2013,24(2): 151-157.
[13] Geng X,Shao H,Zhang Z,et al.Malathion-induced testicular toxicity is associated with spermatogenic apoptosis and alterations in testicular enzymes and hormone levels in male Wistar rats[J].Environ Toxicol Pharmacol,2015,39(2): 659-667.
[14] Xu M,Wei Q,Zheng K,et al.Protective effects of Big-leaf mulberry and physiological roles of nitric oxide synthases in the testis of mice following water immersion and restraint stress[J].Acta Histochem,2014,116(8): 1323-1330.
[15] Li S G,Ding Y S,Niu Q,et al.Grape seed proanthocyanidin extract alleviates arsenic-induced oxidative reproductive toxicity in male mce[J].Biomed Environ Sci,2015,28(4): 272-280.
Influence of Triphenyltin Exposure on Gonad in Male SD Rats
WEI Lan1,ZHANG Zi-qiang1,ZHU Xue-min1,CHAI Lei2
(1.CollegeofAnimalScienceandTechnology,HenanUniversityofScienceandTechnology,Luoyang,Henan,471003,China;2.SurveillanceCenterofAnimalProducts,Jiaozuo,Henan,454003,China)
To study the effects of environment level triphenyltin (TPT) on mammalian male reproductive toxicity,20healthy SD adult male rats were randomly divided into four groups.Different doses of triphenyltin (TPT) (0,0.5,5and 50μg/kg) and a control group were administrated to the rats every 3days for 54days.The rats were killed when they were anesthetized with 10% chloral hydrate after the last test substance given for 24h.The changes of the testis and epididymis were observed by paraffin sections and HE staining; the level of alkaline phosphatase (AKP),total antioxidant capacity (T-AOC) and γ-glutamyl GGT (γ-GT) in testicular enzymes were determined by spectrophotometion.Compared with the control group,it showed that,rat testis seminiferous tubule diameter increased with increasing TPT,but seminiferous tubule germ cells and sperms decreased varying degrees; compared with the control group,the levels of AKP in testis of rats in low and middle dose groups increased but that decreased in high dose group,the difference was not significant (P>0.05); the levels of γ-GT and T-AOC in testis of rats in low dose increased significantly,that in middle dose group did not change significantly,that in high dose group was significantly decreased (P<0.05).This experiment confirmed TPT influences the growth and development of gonad and sperms,we presumed TPT may have reproduction toxicity to male mammals.
triphenyltin; male rat; reproductive toxicity
2015-07-06
位 兰(1980-),女,河南项城人,博士,主要从事畜禽解剖学及组织胚胎学研究。
S857.2;O614.32
A
1007-5038(2016)01-0047-05
