3种金属有机骨架材料用于开管毛细管电色谱手性固定相分离外消旋体
2016-12-14朱鹏静章俊辉袁黎明
朱鹏静, 陶 勇, 章俊辉, 字 敏, 袁黎明*
(1. 云南师范大学化学化工学院, 云南 昆明 650500; 2. 上海皓锋医药科技有限公司, 上海 201210)
3种金属有机骨架材料用于开管毛细管电色谱手性固定相分离外消旋体
朱鹏静1, 陶 勇2, 章俊辉1, 字 敏1, 袁黎明1*
(1. 云南师范大学化学化工学院, 云南 昆明 650500; 2. 上海皓锋医药科技有限公司, 上海 201210)
金属有机骨架(MOFs)材料因具有丰富的拓扑结构、高比表面积、良好的稳定性、持久的孔结构以及可修饰的孔道表面等特点,在对映选择性催化和手性分离方面备受关注。该文通过水热法合成了3种具有手性的MOFs晶体,分别为Co2(D-cam)2(TMDPy)(简称为MOF 1)、[Cd(D-cam)(tmdpy)]52H2O(简称为MOF 2)和[Co0.5Zn0.5(L-Tyr)]n(L-tyrCo/Zn)(简称为MOF 3),并把它们用作固定相分别制成MOFs手性柱进行开管毛细管电色谱(OT-CEC)研究。在磷酸二氢钠-乙腈的流动相体系下,考察了3根MOFs手性柱对手性化合物的拆分性能。实验结果表明,这3种MOFs手性毛细管柱对部分外消旋体具有较好的拆分效果。目前将手性MOFs作为毛细管电色谱手性分离的研究正处在起步阶段并且具有良好的应用前景。
金属有机骨架;手性开管毛细管柱;毛细管电色谱;手性分离
金属有机骨架(metal organic frameworks, MOFs)材料通常是由氧、氮等的多齿有机配体与过渡金属离子通过自组装过程形成的具有重复性网络结构的类沸石材料,是近十年来配位化学领域中发展非常快的新型多功能材料[1]。相对于其他多孔材料,MOFs材料具有高比表面积、均一且可调控的孔结构、易于功能化的骨架金属离子和有机配体、良好的热稳定性,因此在吸附分离、催化研究、气体储存、离子交换、磁性材料、传感器和光学材料等领域具有潜在的应用价值。MOFs材料由于其结构多样、性能独特,非常适合用作吸附材料和分离介质,在色谱分离领域颇受青睐[2]。
迄今为止,已有不少文献报道了MOFs材料用作色谱固定相分离多种有机化合物。2006年,Chen等[3]把MOF-508用作固定相,制备了气相色谱填充柱,并在一定程度上分离了多组烷烃混合物。2007年,Yoon等[4]把合成的CUK1用作固定相,制备了气相色谱填充柱,并用于分离轻质气体混合物。2010年,Yan等[5]首次将MOFs材料用作毛细管气相色谱固定相,在短时间内实现了多组邻、对、间异构体的基线分离。2011年,Xie等[6]将左手螺旋手性MOFs材料[{Cu(asla)n}]用于高分辨气相色谱固定相中,并快速拆分了多种外消旋体。
Alaerts等[7,8]将MIL-47和MIL-53用作液相色谱固定相分离了一些苯衍生化的异构体、二氯苯、烯烃和烷基萘等化合物。2011年,Yan课题组[9]用MIL-101(Cr)作为液相色谱固定相,成功分离了位置异构体二甲苯、二氯苯、氯苯和乙苯、苯乙烯混合物。2012年,Tannaka等[10]通过硅胶与MOFs的简单混合合成了一种单一手性的R-MOF-silica复合材料,将其作为液相色谱固定相,拆分了一系列亚砜类外消旋体。2013年,Zhang等[11]将手性纳米多孔MOFs材料[(CH3)2NH2][Cd(bpdc)1.5]52DMA用于高效液相色谱,对多种手性化合物进行了拆分。
MOFs材料在毛细管电色谱中的应用虽然没有在液相色谱和气相色谱中那么广泛,但近年来也取得了一定的进展。2012年,Yan课题组[12]将ZIF-8型MOFs晶体用于毛细管电动色谱实验中作为假固定相(pseudostationary phase),结果表明,该材料有助于硝基苯酚和苯二酚两种位置异构体的拆分。2013年,Huang等[13]用MIL-101(Cr)作为固定相制备了毛细管电色谱填充柱,成功分离了位置异构体二甲苯和氯甲苯。2013年,Yan课题组[14]将金属有机骨架CAU-l掺杂的聚合物聚合在毛细管电色谱柱的内壁,并很好地拆分了两组芳香族羧酸化合物。该工作将MOFs的复合材料作为电色谱开管柱的固定相,研究了MOFs复合材料作为电色谱开管柱固定相的优势,进一步拓宽了MOFs的应用领域。2014年,Fei等[15]用一种均一手性Zn-MOFs作为毛细管电色谱开管柱的手性固定相,实验结果表明Zn-MOFs作为毛细管电色谱手性固定相对外消旋体和位置异构体具有较好的拆分效果。目前将手性MOFs作为毛细管电色谱手性分离的研究正处在起步阶段并且具有良好的应用前景[16]。本实验旨在进一步探索新型手性MOFs用作开管柱毛细管电色谱固定相对手性化合物拆分的研究,从而拓展MOFs在手性毛细管电色谱领域的应用。
1 实验部分
1.1 仪器与试剂
CL1020高效毛细管电泳仪(北京华阳利民仪器有限公司); XL30ES-EM-TEP型扫描电子显微镜(SEM)(荷兰飞利浦公司); DX-2700型X-射线粉末衍射仪(丹东方圆仪器公司); P230Ⅱ高压恒流泵(大连依利特公司); TGA-101型热重分析仪(南京大展机电技术研究所);纯水器(英国ELGA公司)。
四水合醋酸钴[Co(CH3COO)254H2O]、4,4′-(1,3-丙二基)双吡啶(4,4′-trimethylenedipyridine, TMDPy)、D-樟脑酸(D-(+)-camphoric acid, D-cam)、四水合乙酸钴和二水合乙酸锌,纯度均≥99%,购于上海Adamas-Beta公司;碳酸钾、碳酸钠、硫脲、硅酸钠、氢氧化钠和磷酸二氢钠,纯度均≥99%,购于上海Aladdin公司;外消旋体华法林购于日本TCI公司,联糠醛和奥美拉唑购于美国Sigma-Aldrich公司,1,2-二苯乙醇酮、反-1,2-二苯环氧乙烷、阿普洛尔、1-(1-萘基)-乙醇和1,2-二苯基乙二醇均购于比利时Acros公司,苯丙氨酸、色氨酸和酪氨酸购于美国Alfa Aesar公司,1-(9-蒽基)-2,2,2-三氟乙醇和二氢黄酮购于美国Fluka公司,外消旋体的纯度均≥98%;甲醇、乙腈(ACN)、盐酸、无水乙醇均为国产分析纯,购于天津风船化学试剂有限公司;弹性石英毛细管柱(50 μm i. d.)购于河北永年锐沣器件有限公司。
1.2 3种MOFs晶体的合成
1.2.1 Co2(D-cam)2(TMDPy)(简称MOF 1)的合成
参照文献[17]合成MOF 1:称取0.125 3 g Co(CH3COO)254H2O、0.100 0 g TMDPy和0.101 8 g D-cam,混合后加入4.260 7 g高纯水,室温搅拌30 min,溶解后放入反应釜中,于160 ℃的烘箱中反应6 d,冷至室温。将得到的红色晶体分别用乙醇和乙醚洗涤,干燥,备用。
1.2.2 [Cd(D-cam)(tmdpy)]52H2O(简称MOF 2)的合成
参照文献[18]合成MOF 2:将0.151 0 g Cd(NO3)254H2O、0.025 8 g Na2CO3和0.057 0 g D-cam用5 mL的高纯水溶解,室温搅拌30 min至全溶。称取0.051 0 g TMDPy溶于4 mL乙醇,均匀加入上述水溶液中,烧杯密封7 d。将得到的无色针状晶体分别用乙醇和乙醚洗涤,干燥,备用。
1.2.3 [Co0.5Zn0.5(L-Tyr)]n(L-tyrCo/Zn)(简称MOF 3)的合成
参照文献[19]合成MOF 3:称取0.362 3 g L-酪氨酸、0.124 5 g四水合乙酸钴和0.109 8 g二水合乙酸锌放入20 mL水中,室温搅拌30 min,待完全溶解后用1 mol/L的NaOH调节pH至9.5,转移到反应釜中,于140 ℃反应2 d,冷却至室温。将得到的紫色晶体分别用乙醇和乙醚洗涤,干燥,备用。
1.3 毛细管柱的预处理
将1 mol/L NaOH溶液充入毛细管柱中,停留2 h,用去离子水冲洗1 h,再用0.1 mol/L HCl冲洗2 h,蒸馏水冲至中性,于120 ℃ N2吹6 h,备用。
1.4 毛细管电色谱手性开管柱的制备
参照文献[15,20]将饱和硅酸钠溶液灌入空毛细管中,两端封口静置1 h,再用0.1 mol/L盐酸和甲醇冲洗毛细管,然后按动态涂渍法[6]将磨细的MOFs乙醇悬浮液在N2推动下通过毛细管柱,从而在管内壁形成一层湿的涂层,之后再用高纯N2吹毛细管柱20 min以使管内溶剂挥干。最后将制备好的色谱柱放入气相色谱柱温箱中进行老化,从30 ℃开始升温,以1 ℃/min的速率升至200 ℃,并保持5 h。
1.5 毛细管电色谱实验条件
毛细管有效长度43 cm,总长50 cm。所用电渗流标记物均为2 g/L的硫脲,缓冲溶液均为磷酸二氢钠缓冲溶液,用NaOH或磷酸溶液调节其pH值。流动相由磷酸二氢钠缓冲溶液和乙腈按一定比例配制,使用前分别经0.45 μm孔径的滤膜过滤,超声脱气。MOFs开管柱在使用前先用高纯水和流动相分别冲洗10 min,以除去管中杂质,然后再用电色谱实验所用电压平衡基线至稳定。每次连续测样间用高纯水冲洗2 min,再用流动相冲洗3 min。进样方式为虹吸进样,进样高差为5 cm,进样时间为2 s。样品紫外检测波长为254 nm。
1.6 毛细管电色谱实验结果计算
分离因子(α)、分离度(Rs)以及理论塔板数(N,理论塔板数/米)分别使用公式(1)、(2)和(3)计算。
(1)
(2)
(3)
tR1和tR2分别为两个对映体的保留时间(min),W1/2(1)和W1/2(2)分别为两个对映体的半峰宽(min),L为色谱柱的有效长度(m),tR为对映体的迁移时间(min),W1/2为对映体的半峰宽(min)。
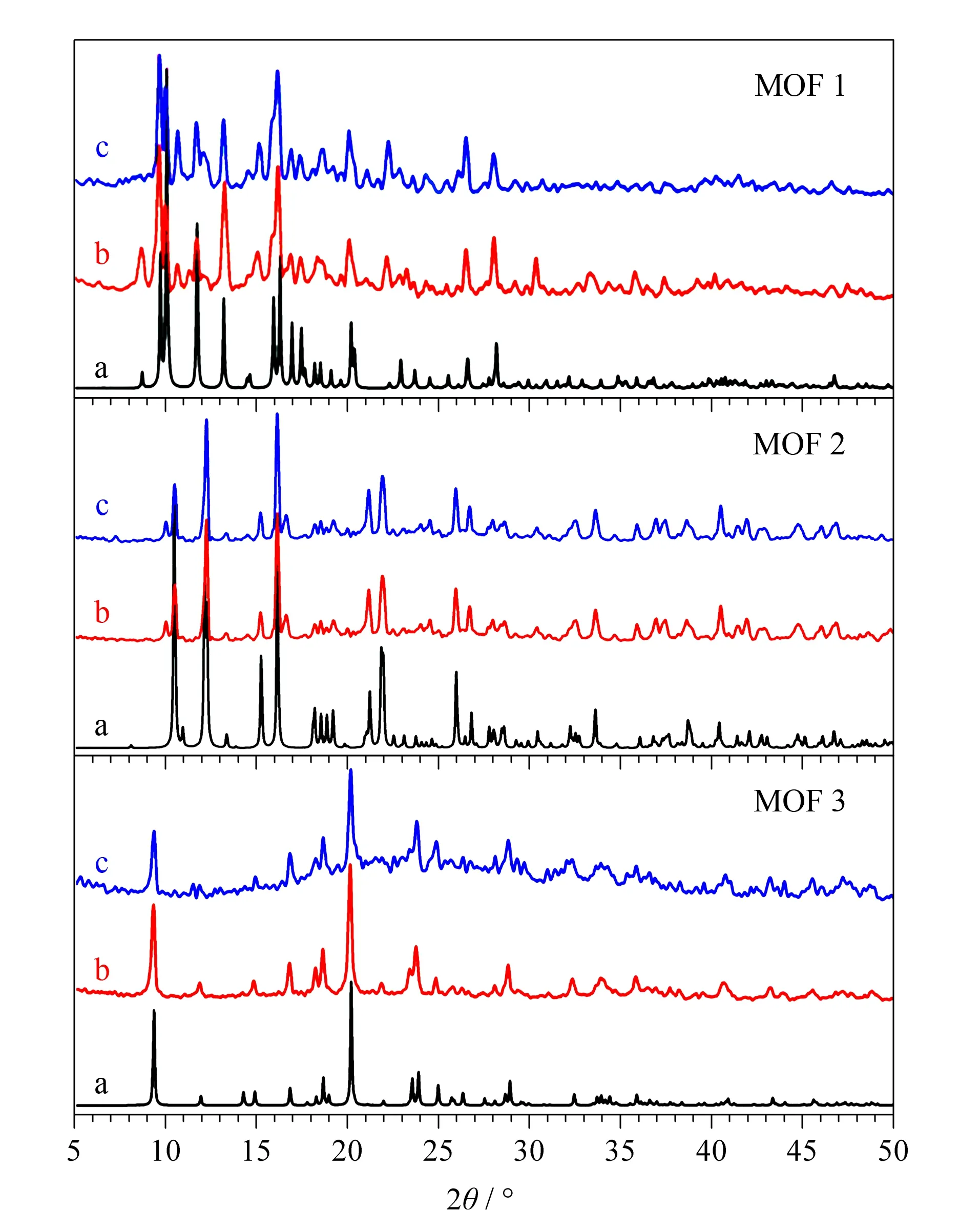
图 1 合成的3种MOFs与对应的单晶模拟值以及缓冲 溶液浸泡后的X射线衍射对比图Fig. 1 Comparison of the X-ray diffraction (XRD) patterns of the three synthesized, simulated and treated in buffer solution metal organic frameworks (MOFs) a. simulated from single-crystal; b. synthesized; c. treated in phosphate buffer solution for 48 h.
2 结果与讨论
2.1 3种MOFs的表征
图1分别为所合成的3种晶体的X射线衍射(XRD)图,由图可知MOF 1、MOF 2和MOF 3粉末主要的衍射峰位置等信息能和由单晶数据模拟的谱图很好地吻合,表明所合成的晶体与文献报道[17-19]的晶体基本一致。经过缓冲溶液中处理48 h后的晶体XRD谱图与模拟结果也一致,表明MOF 1、MOF 2和MOF 3在流动相中稳定,其在缓冲溶液中不会溶解或发生结构变化,可以进行下一步的电色谱试验。合成出的3种晶体的热重曲线(见图2)显示:3种晶体在200 ℃以内不会分解,具有很好的热稳定性,故在制柱过程中的老化热处理(200 ℃)不会对晶体结构产生影响。另外,为了考察固定相在毛细管内壁的涂渍情况,分别对空管柱、只涂覆硅酸钠柱和MOFs晶体涂覆柱进行扫描电镜分析。由图3c、图3d与图3a、图3b对比可以看出,硅酸钠涂层很好地覆盖了刻蚀过的石英毛细管内壁,由图3e~图3j可看出MOF 1、MOF 2和MOF 3都较好地涂覆在毛细管内壁上。
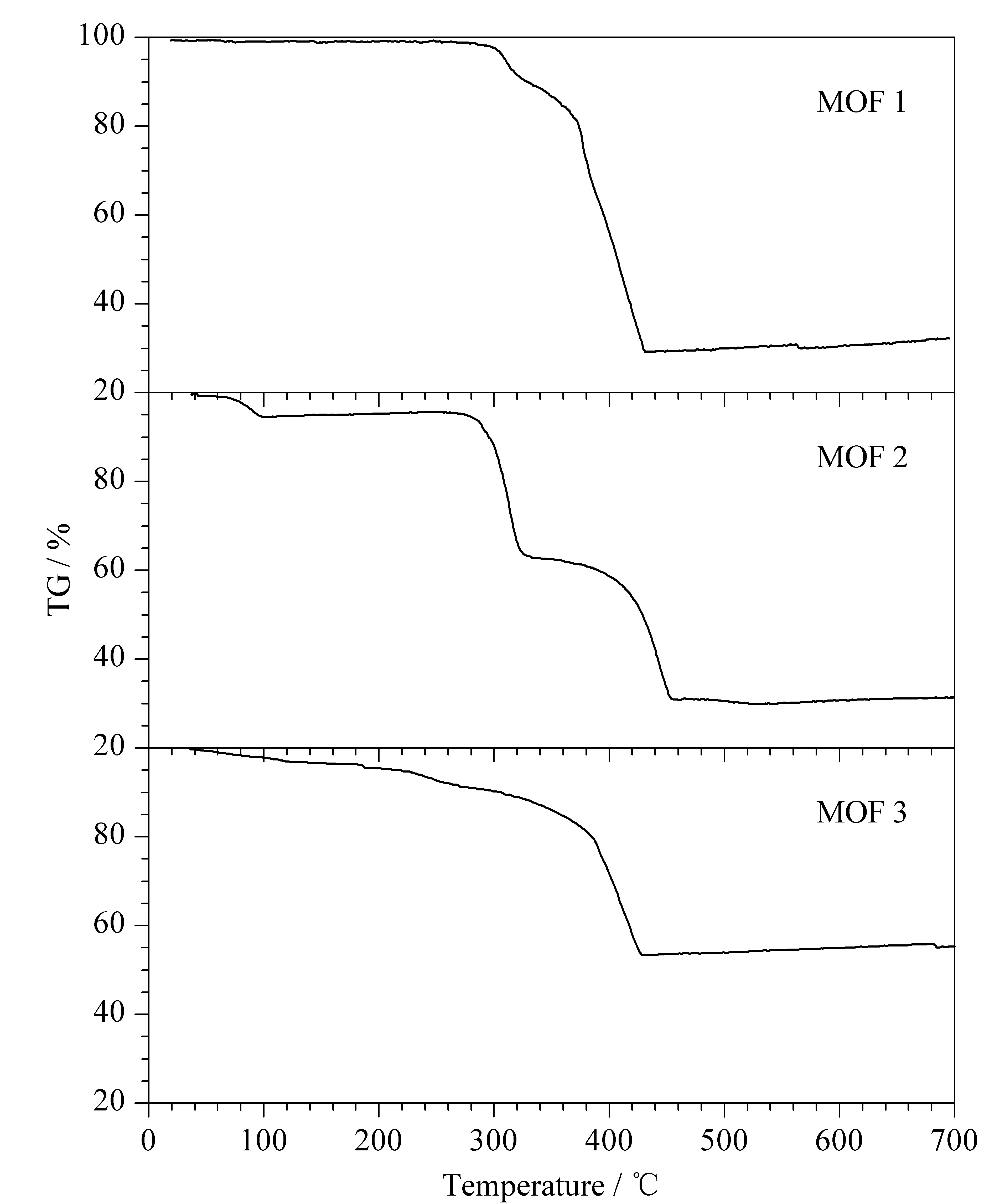
图 2 合成的3种MOFs的热重曲线图Fig. 2 Thermogravimetric analysis (TGA) curves of the three synthesized MOFs

图 3 开管毛细管柱的SEM图Fig. 3 Scanning electron microscope (SEM) images of the open tubular capillary columns a and b: bare capillary columns; c and d: sodium silicate coated capillary columns; e and f: MOF 1 coated capillary columns; g and h: MOF 2 coated capillary columns; i and j: MOF 3 coated capillary columns.
2.2 3种手性开管毛细管柱对外消旋体的拆分情况
2.2.1 MOF 1涂覆的手性开管毛细管柱A对外消旋体的拆分
为了考察MOF 1作为毛细管电色谱固定相对外消旋体的拆分性能,按1.4节方法用该晶体制得手性开管毛细管柱A。采用乙腈-磷酸盐溶液作为缓冲溶液,发现其对联糠醛、奥美拉唑、华法林、1,2-二苯乙醇酮、反-1,2-二苯环氧乙烷以及阿普洛尔6种外消旋体有不同程度的手性识别作用,其中联康醛的分离度最大(2.10),同时也获得了超过9×104理论塔板数/米的高柱效。从这6种手性化合物的拆分结果看,其柱效均高于1×104理论塔板数/米,说明MOF 1涂覆的手性开管毛细管柱的柱效较高。表1列出了6种外消旋体在MOF 1涂覆的开管毛细管柱A上的手性分离因子(α)、分离度(Rs)、两个对映体的保留时间(tR1、tR2)以及两个对映体的理论塔板数(N1、N2)的数值。6种外消旋体相应的拆分谱图见图4。
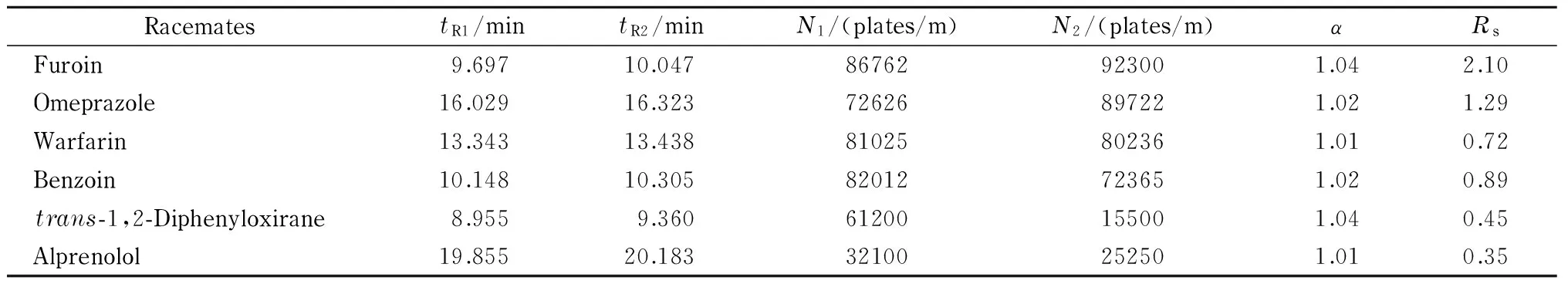
表 1 外消旋体在MOF 1涂覆的手性开管毛细管柱A上的拆分情况
*tR1andtR2are the retention times of the first and second eluted enantiomers;N1andN2are the numbers of theoretical plates of the first and second eluted enantiomers, respectively;αis the separation factor;Rsis the resolution.
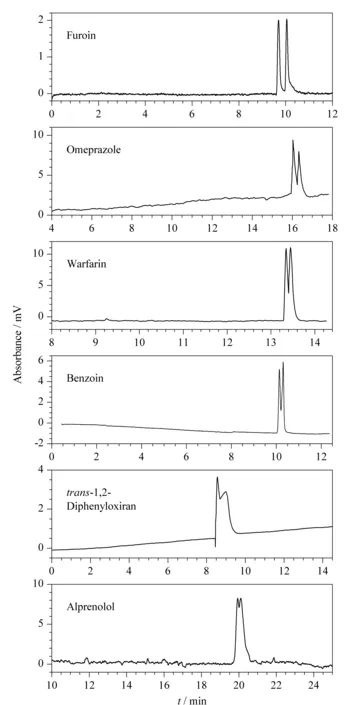
图 4 外消旋体在MOF 1涂覆的手性开管毛细管柱A 上的电色谱图Fig. 4 Electrochromatograms of the racemates on the MOF 1 coated chiral open tubular capillary column A Mobile phase: 25 mmol/L phosphate buffer (pH=5.5)-ACN (90∶10, v/v); capillary: 50 cm×50 μm (effective length 43 cm); applied voltage: 14 kV; temperature: 25 ℃; UV detection wavelength: 254 nm; injection: 5 cm height for 2 s.
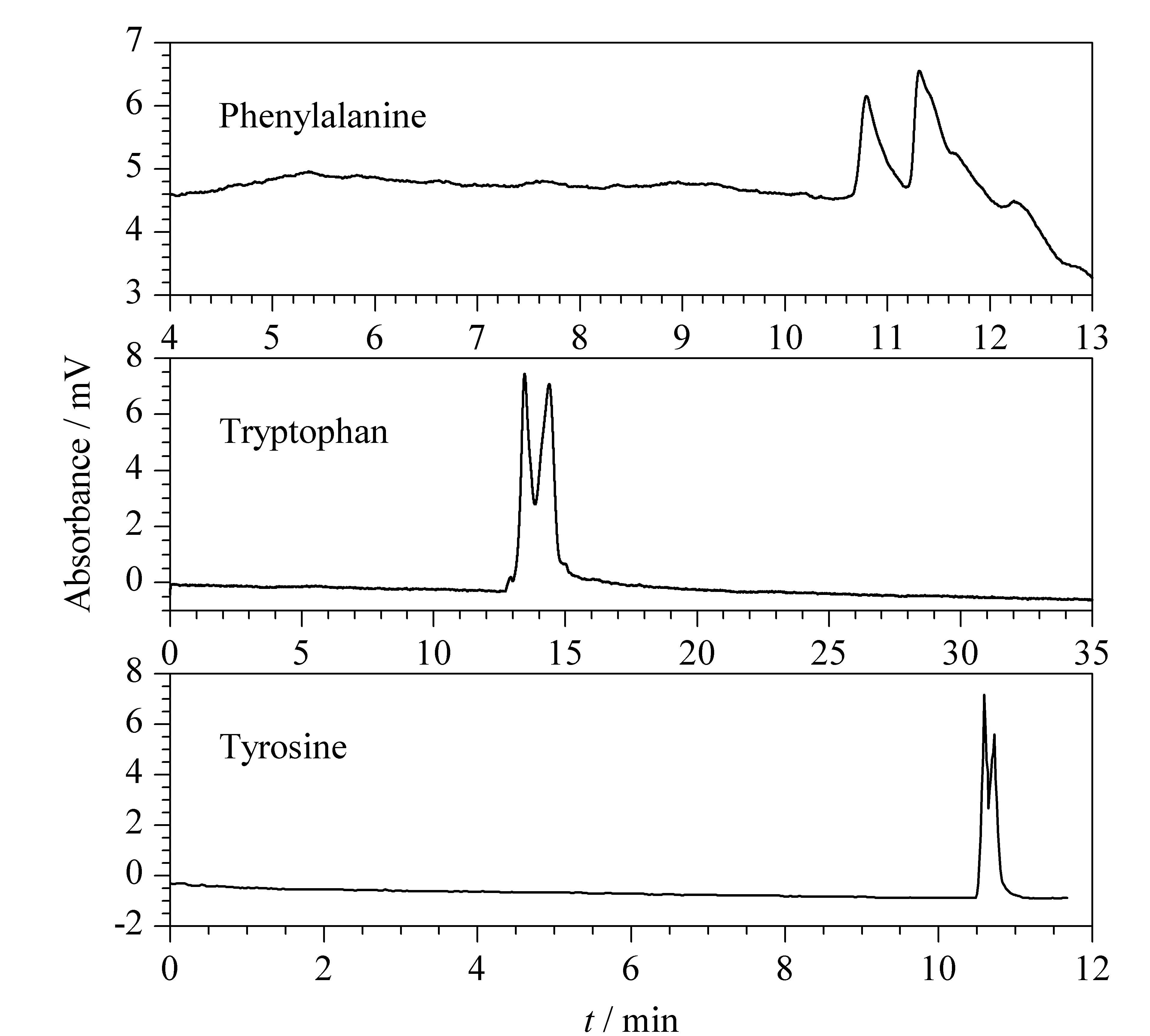
图 5 外消旋体在MOF 2涂覆的手性开管毛细管柱B 上的电色谱图Fig. 5 Electrochromatograms of the racemates on the MOF 2 coated chiral open tubular capillary column B Separation conditions were the same as those in Fig. 4.
2.2.2 MOF 2涂覆的手性开管毛细管柱B对外消旋体的拆分
手性开管毛细管柱B按1.4节方法用MOF 2涂覆制得,并用来考察该柱的分离性能。实验结果表明该手性开管毛细管柱对3种手性氨基酸有识别作用,其中苯丙氨酸的分离度为1.21,酪氨酸获得了超过1×105理论塔板数/米的高柱效。色谱分离数据见表2,拆分谱图见图5。
2.2.3 MOF 3涂覆的手性开管毛细管柱C对外消旋体的拆分
手性开管毛细管柱C按1.4节方法用MOF 3涂覆制得,其对4种外消旋体1-(9-蒽基)-2,2,2-三氟乙醇、二氢黄酮、1,2-二苯基乙二醇和1-(1-萘基)-乙醇具有一定的手性识别效果。其中二氢黄酮在中性条件下达到了基线分离且获得了近9×104理论塔板数/米的高柱效。其他3种醇类手性化合物在此条件下也获得了一定的拆分效果。分离色谱数据见表3,拆分谱图见图6。

表 2 外消旋体在MOF 2涂覆的手性开管毛细管柱B上的拆分情况
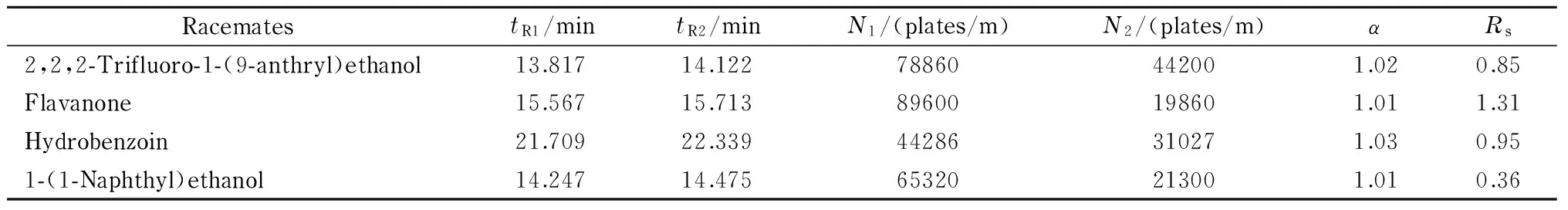
表 3 外消旋体在MOF 3涂覆的手性开管毛细管柱C上的拆分情况
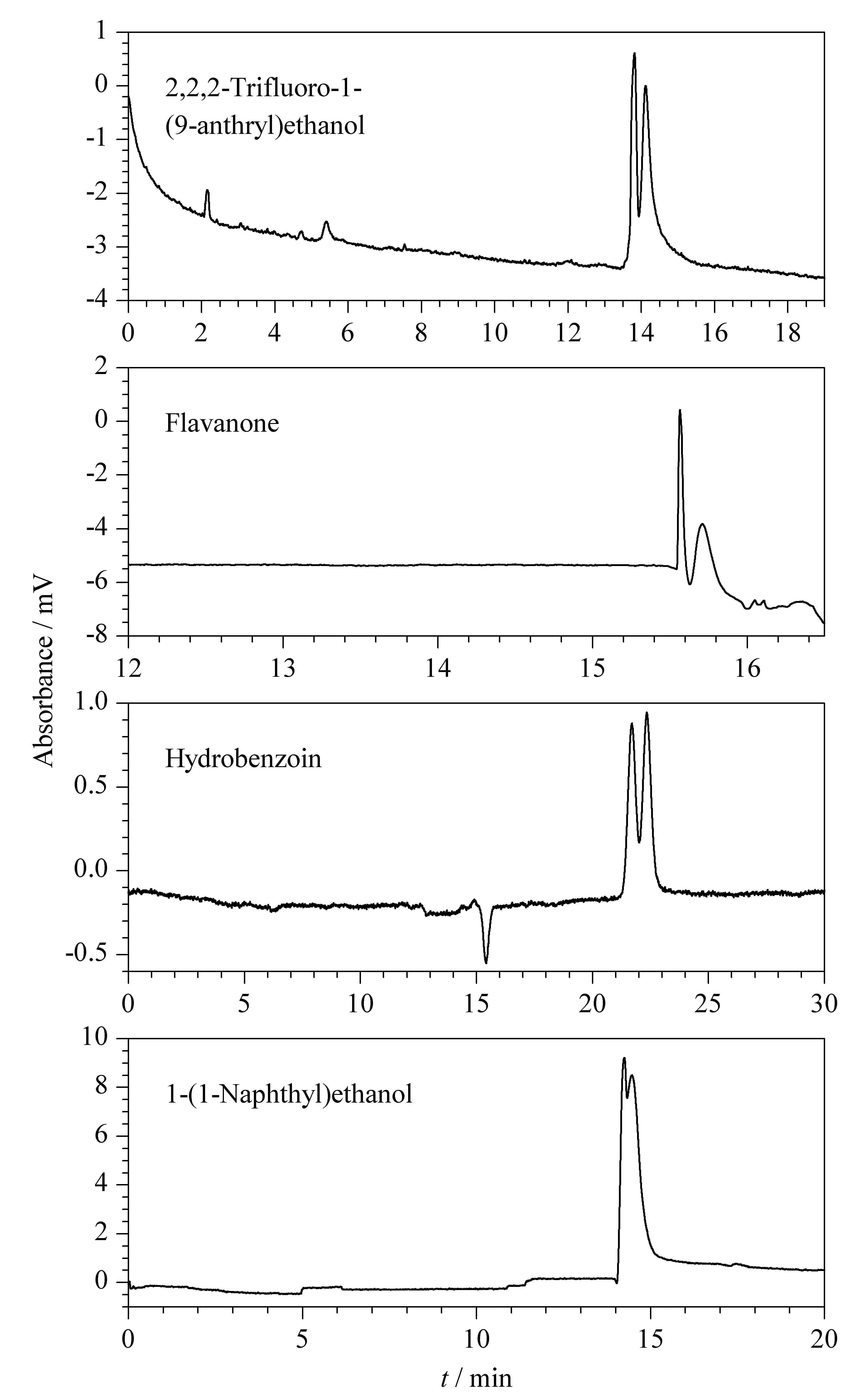
图 6 外消旋体在MOF 3涂敷的手性开管毛细管柱C 上的电色谱图Fig. 6 Electrochromatograms of the racemates on the MOF 3 coated chiral open tubular capillary column C Phosphate buffer pH: 6.5. Other conditions were the same as those in Fig. 4.
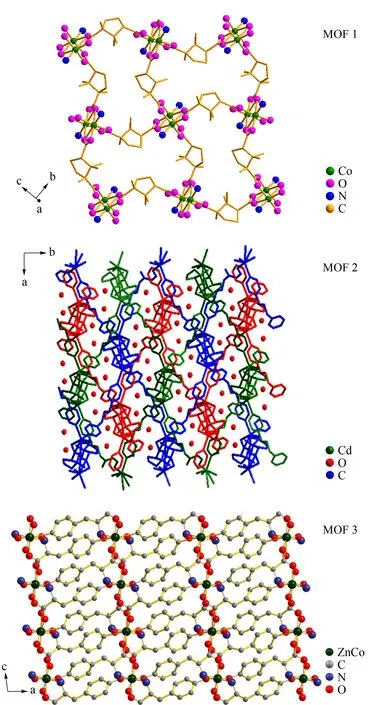
图 7 3种MOFs晶体结构示意图Fig. 7 Schematic of the crystal structures of the three MOFs MOF 1: the homochiral 2-D layer; MOF 2: the topological structure of the rhombic-shaped grid composed of three interpenetrating diamond mesh; MOF 2: the mesh structure composed of metal two polymer and flexible ligand.
在色谱手性分离研究中,固定相微观的手性环境对手性识别影响比较复杂[19]。MOF 1是一种新的单一手性二维(4,4)层面化合物(见图7a),构成配位化合物的配体D-cam和TMDPy在晶体骨架结构中起着重要的作用。其结构特点是基于六连接的[Co2-(COO)4N2]叶轮所组成的结构,其中钴二聚体是由4个双齿羧酸组和4个D-cam柔性配体通过桥连接而成。由D-cam配体交联相邻的钴二聚体构成了均一手性格栅状的(4,4)层状结构[17]。MOF 2的晶体结构特点是每个金属原子是呈八面体协调的四连接,其每个金属离子(M2+)键合两个tmdpy配体和两个D-cam配体,每个D-cam配体桥连接两个金属位点,这种结构特点类似分子筛的拓扑结构,每格都可以和表示菱形网状的拓扑结构组成三互穿的钻石网(见图7b),这就为分离过程提供了更大的接触表面[18]。MOF 3的三维骨架材料是由平行阶梯组成的金属二聚体和酪氨酸连接而成,梯子状连接形式是由酪氨酸基团形成的羧酸基团连接的金属二聚体,它是一个新的配位模式,并且其配位数高(见图7c)。虽然文献中报道了很多钴金属的连接方式,但这种由金属二聚体组成的边缘共享八面体和四面体所形成的配位结构是一种新的发现[21]。所以有关手性识别的效果可能是和这些晶体的特殊微观结构有关,与此同时,来自流动相和固定相间各种分子间作用力也可能对手性分离起到作用。总之,手性识别的机理较为复杂,只能根据实验结构来推测其可能的原因,还需要进一步的深入研究。
2.3 缓冲溶液pH、流动相组成以及缓冲溶液浓度对手性化合物拆分的影响
在上述3种手性MOFs晶体中,选择以MOF 1制成的柱A为例,讨论并分析缓冲溶液pH(影响因素1)、流动相组成(影响因素2)以及缓冲溶液浓度(影响因素3)对手性化合物拆分的影响。
在毛细管电色谱中既有电泳分离又有色谱分离过程,电泳作用是使样品尽快流出色谱柱,而色谱作用则是对样品具有保留作用,所以二者作用的结果决定了样品的保留和分离情况。在电解质溶液中,影响因素1、2和3的改变都会影响电渗流大小,从而影响溶质的迁移速度,最终表现为样品保留值的改变和分析效果的改变。所以为了获得最佳的外消旋体拆分效果,以拆分效果比较理想的联糠醛为例,考查影响因素1、2和3的变化对外消旋体分离效果的影响。
在对影响因素1的考察试验中,考察了缓冲溶液pH值为3.5、4.5、5.5和6.5时对联糠醛拆分的影响。表4列出了在不同pH值下联糠醛的分离情况。分析物的保留时间随pH值的增大而减少。随着pH值的增大,分离度呈现增加的趋势,并在pH=5.5时达到最大;但随着pH值的进一步增大,其分离度呈减小趋势。这种现象可能是因为过小的pH值影响了色谱固定相活性,从而减少了样品与活性位点的作用,而过大的pH值造成过多的硅醇基,增加电渗流而缩短了分析物的保留时间,这也就等于减小了和色谱固定相作用的时间,进而影响了分析物的拆分效果。分离谱图见图8。
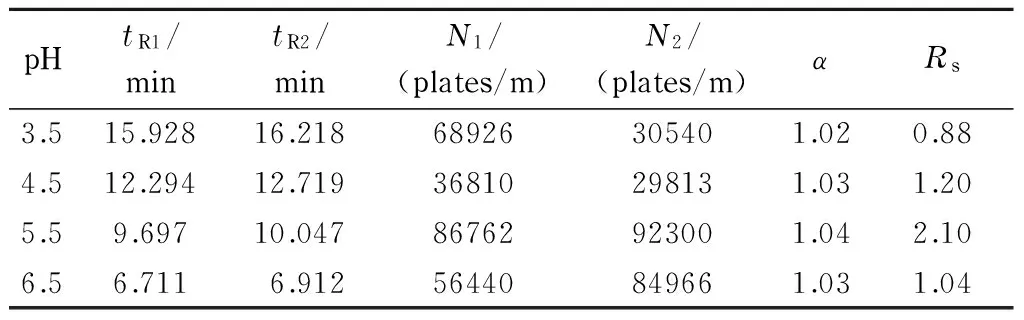
表 4 联糠醛在不同pH值的缓冲溶液中的保留时间、
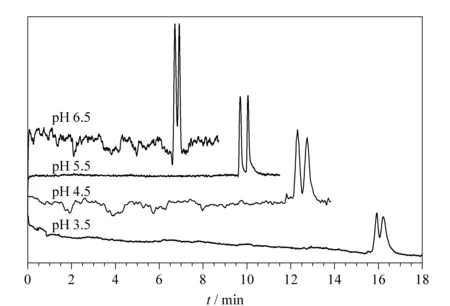
图 8 不同pH值的缓冲溶液对联糠醛拆分效果的影响对比图Fig. 8 Comparison diagrams of the effects of buffer solution with different pH on the separation of the furoin Mobile phase: different pH (3.5-6.5) of phosphate buffer containing 10% (v/v) ACN. Other conditions were the same as those in Fig. 4.
在毛细管电色谱中,乙腈通常被用作有机改性剂。在对影响因素2的考察中,改变缓冲溶液中乙腈的含量,考察了不同乙腈含量(0%~30%,体积分数,下同)下联糠醛的拆分情况,结果见表5。当使用不含有机溶剂的磷酸盐缓冲溶液做流动相,运行时间超过60 min时,分析物还未被洗脱(见图9),可能是在不含有机添加剂的流动相中,手性固定相中基团对溶质有强保留作用。当加入乙腈时,分析物保留时间明显缩短,但是分离度明显降低。在含10%乙腈的缓冲溶液中联糠醛获得了最大分离度(2.10)。因此,在使用MOFs手性柱进行分离时,在缓冲液中应加入适量的有机化合物以利于外消旋体的洗脱拆分。

表 5 联糠醛在不同乙腈含量的缓冲溶液中的保留时间、 理论塔板数、分离因子和分离度
-: not detected.
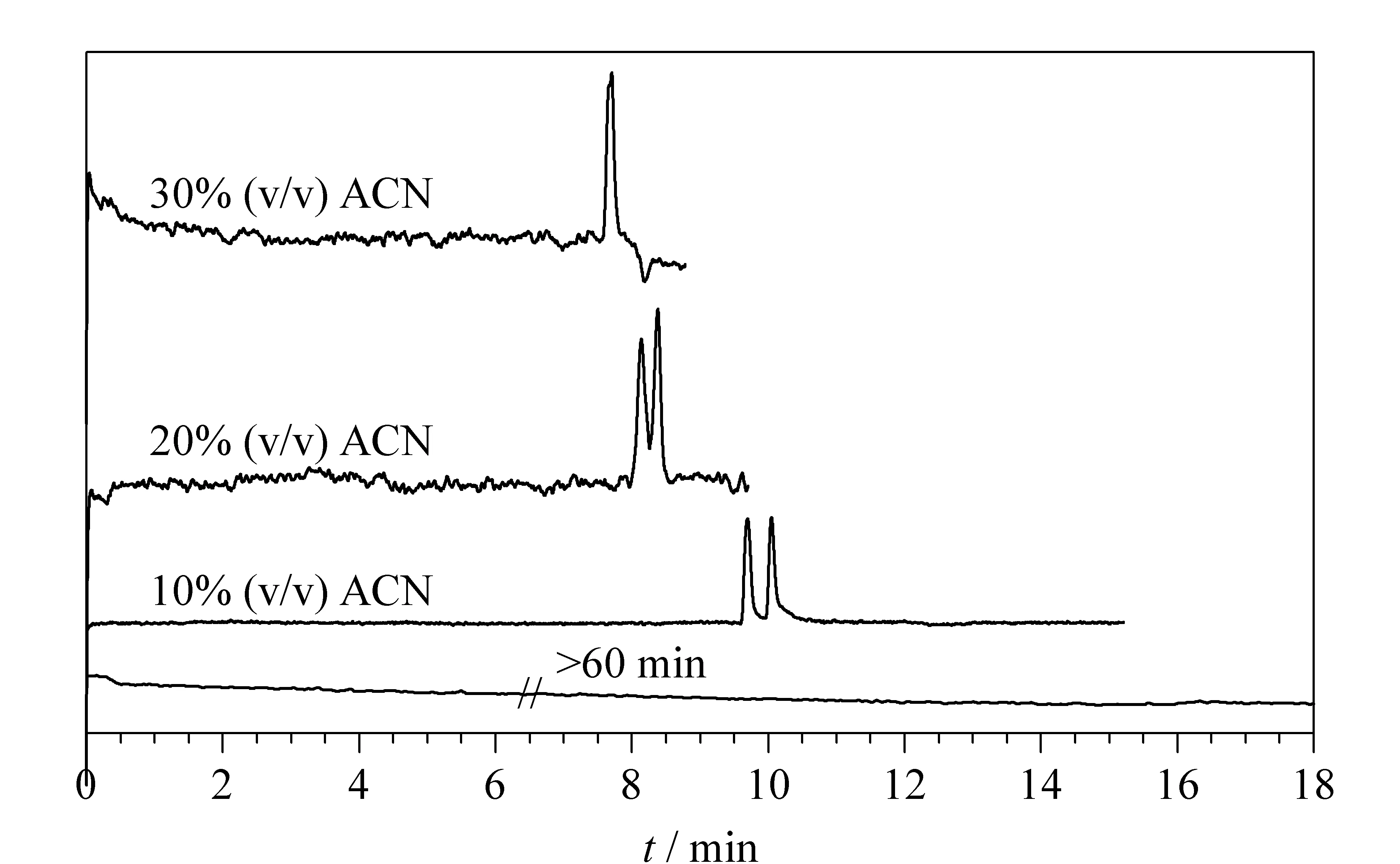
图 9 不同乙腈含量的缓冲溶液对联糠醛 拆分效果的影响对比图Fig. 9 Comparison diagrams of the effects of the buffer solution with different ACN contents on the separation of the furoin Mobile phase: 25 mmol/L phosphate buffer with different contents of ACN at pH 5.5. Other conditions were the same as those in Fig. 4.
在对影响因素3的考察试验中,考察了不同缓冲溶液浓度(15、25、35、45 mmol/L)下联糠醛的拆分情况(见表6)。随着缓冲溶液浓度的增大,分析物的保留时间增加,分离效果在25 mmol/L时达到最大,之后明显降低。分离谱图见图10。
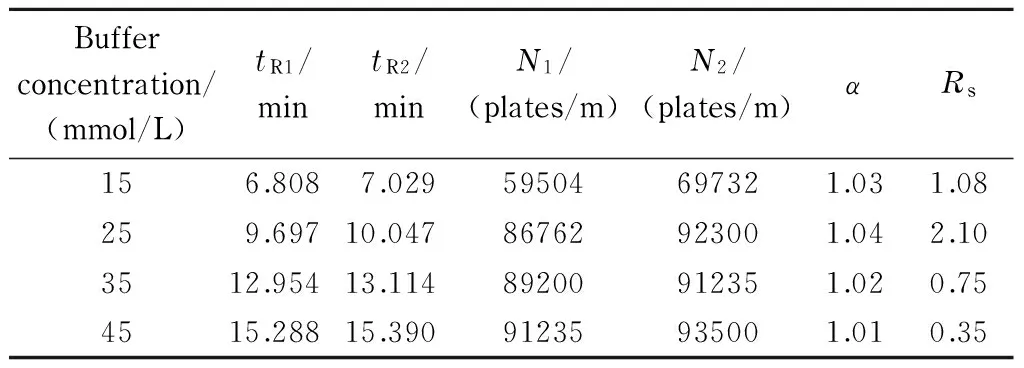
表 6 联糠醛在不同浓度的缓冲溶液中的保留时间、
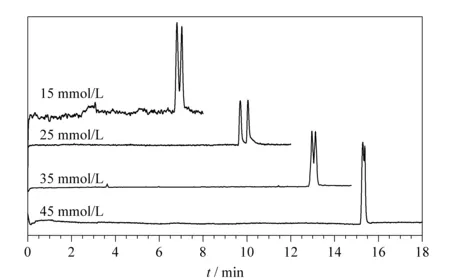
图 10 不同浓度的缓冲溶液对联糠醛拆分效果的影响对比图Fig. 10 Comparison diagrams of the effects of the buffer concentration on the separation of the furoin Mobile phase: different concentrations of the phosphate buffer containing 10% (v/v) ACN. Other conditions were the same as those in Fig. 4.
综合以上3个影响因素来看,当运行电压为14 kV、磷酸盐缓冲溶液的浓度为25 mmol/L、pH为5.5并且加入10%的乙腈时,联糠醛获得了最好的分离效果,分离度为2.10。
3 结论
本实验中将3种手性MOFs用作高效毛细管电色谱固定相进行外消旋体分离。在检测样品中,MOF 1对6个外消旋体具有较好的识别能力;MOF 2和MOF 3也表现出了一定的手性识别能力,分别拆分了3个和4个手性化合物。实验表明,不同的MOFs对外消旋体的手性识别具有一定的差异,但多数都具有手性识别能力。同时还以联糠醛为代表探讨了缓冲溶液的pH值、浓度以及其中乙腈的含量对手性化合物拆分的影响,得到了联糠醛在3个影响因素下获得最大分离度(2.10)的条件。由于手性MOFs在高效毛细管电色谱固定相中的应用还处于初始阶段,在以后的工作中可以通过寻找其他更好的方法来改善晶体的涂敷效果以提高柱效,同时也可对手性MOFs材料的功能基团进行修饰以提高材料本身的手性识别能力[22],进一步开发手性MOFs在高效毛细管电色谱手性分离领域的应用潜能。
[1] Zhai R, Jiao F L, Lin H J, et al. Chinese Journal of Chromatography, 2014, 32(2): 107
翟睿, 焦丰龙, 林虹君, 等. 色谱, 2014, 32(2): 107
[2] Xie S M, Liu H, Yang J R, et al. Chinese Journal of Chromatography, 2016, 34(1): 113
谢生明, 刘虹, 杨江蓉, 等. 色谱, 2016, 34(1): 113
[3] Chen B L, Liang C D, Yang J, et al. Angew Chem Int Ed, 2006, 45(9): 1390
[4] Jhung S H, Lee J H, Yoon J W. Adv Mater, 2007, 19(1): 121
[5] Gu Z Y, Yan X P. Angew Chem Int Ed, 2010, 49(8): 1477
[6] Xie S M, Zhang Z J, Wang Z Y, et al. J Am Chem Soc, 2011, 133(31): 11892
[7] Alaerts L, Kirschhock C E A, Maes M, et al. Angew Chem Int Ed, 2007, 46(23): 4293
[8] Alaerts L, Maes M, Giebeler L, et al. J Am Chem Soc, 2008, 130(43): 14170
[9] Yang C X, Yan X P. Anal Chem, 2011, 83(18): 7144
[10] Tanaka K, Muraoka T, Hirayama D, et al. Chem Commun, 2012, 48(68): 8577
[11] Zhang M, Pu Z J, Chen X L, et al. Chem Comm, 2013, 49(45): 5201
[12] Li L M, Wang H F, Yan X P. Electrophoresis, 2012, 33: 2896
[13] Huang H Y, Lin C L, Cheng Y J, et al. Anal Chim Acta, 2013, 779: 96
[14] Li L M, Yang F, Wang H F, et al. J Chromatogr A, 2013, 1316: 97
[15] Fei Z X, Zhang M, Zhang J H, et al. Anal Chim Acta, 2014, 830: 49
[16] Xuan W, Zhu C, Liu Y, et al. Chem Soc Rev, 2012, 41(5): 1677
[17] Zhang J, Chew E, Chen S M, et al. Inorg Chem, 2008, 47: 3495
[18] Zhang J, Xian H B. Angew Chem Int Ed, 2007, 46: 6115
[19] Zhang M, Xue X D, Zhang J H, et al. Anal Methods, 2014, 6(24): 341
[20] Fei Z X, Zhang M, Xie S M, et al. Electrophoresis, 2014, 35: 3541
[21] Zhou B, Silva Nuno J O, Fa N S, et al. Eur J Inorg Chem, 2012, 32: 5259
[22] Qi X Y, Li X J, Bai Y, et al. Chinese Journal of Chromatography, 2016, 34(1): 10
祁晓月, 李先江, 白玉, 等. 色谱, 2016, 34(1): 10
Three chiral metal organic frameworks used as stationary phases for the separation of racemates by open tubular capillary electrochromatography
ZHU Pengjing1, TAO Yong2, ZHANG Junhui1, ZI Min1, YUAN Liming1*
(1.SchoolofChemistryandChemicalEngineering,YunnanNormalUniversity,Kunming650500,China;2.ShanghaiHaoFengPharmaceuticalTechnologyCompanyLimited,Shanghai201210,China)
Metal organic frameworks (MOFs) have attracted a tremendous attention in enantioselective catalysis and separation due to their unusual properties such as rich topologies, high surface area, good stability, permanent micropocity, availability of outer-surface modification and so on. In this study, three chiral MOFs, Co2(D-cam)2(TMDPy) (abbreviated as MOF 1), [Cd(D-cam)(tmdpy)]52H2O (abbreviated as MOF 2) and [Co0.5Zn0.5(L-Tyr)]n(L-tyrCo/Zn) (abbreviated as MOF 3) were synthesized and respectively used as chiral stationary phases in open tubular capillary electrochromatography (OT-CEC). The three MOFs were characterized by powder X-ray diffraction (XRD) and scanning electron microscope (SEM). The three MOFs coated columns were developed using a simple procedure via MOFs post-coated on the sodium silicate layer. The experimental results showed that the three MOFs based chiral columns had better recognition ability toward some racemates. The baseline separation of furoin was achieved on the MOF 1 coated column with high resolution of more than 2.10. The influences of pH, organic modifier content and buffer concentration on the separation were investigated. The results demonstrated that chiral MOFs were promising for enantioseparation in CEC.
metal organic frameworks (MOFs); chiral open tubular capillary column; capillary electrochromatography (CEC); chiral separation
10.3724/SP.J.1123.2016.06040
2016-06-24
国家自然科学基金项目(21275126).
Foundation item: National Natural Science Foundation of China (No. 21275126).
O658
A
1000-8713(2016)12-1219-09
邹汉法研究员纪念专辑(上)·研究论文
* 通讯联系人.Tel:(0871)65941088,E-mail:yuan_limingpd@126.com,yuan_limingpd@aliyun.com.
