酶法制备南瓜籽壳纤维低聚糖
2016-12-14张珍林
张珍林
(皖西学院 生物与制药工程学院,安徽 六安 237012)
酶法制备南瓜籽壳纤维低聚糖
张珍林
(皖西学院 生物与制药工程学院,安徽 六安 237012)
以南瓜籽壳纤维为原料,采用酶法制备纤维低聚糖,并结合高效液相色谱法(HPLC)进行定量测定。结果表明:利用β-葡聚糖酶在酶解温度50 ℃、酶解时间2.5 h、酶用量4 U/g的情况下酶解,可以得到较高比例的葡萄糖、纤维二糖、纤维三糖和纤维四糖,最终计算纤维低聚糖得率为12.2 g/100 g。
南瓜籽壳纤维;纤维低聚糖;β-葡聚糖酶
南瓜一种葫芦科植物的果实,具有全面而又丰富的营养;南瓜的种籽同样是国内外医药界公认的功能性食品[1],这种功能性食物目前的利用形式往往都是取籽弃壳。查文献知道,正常状态下,壳占整个南瓜籽的重量的60%,假若某地一年产南瓜籽5万吨,那就相当于约3万吨的壳可能被遗弃,据医学研究报告,南瓜籽壳能作为某些特殊功能药剂的原料,使糖尿病患者和高血压患者有明显的医疗康复作用和缓解作用[2-4],这块巨大的资源能尽快地开发和利用,不仅可以避免环境污染,又可以增加种植者的收益。
纤维低聚糖亦称纤维寡糖(cello-oligosaccharide),文字描述指具有2~10个葡萄糖单体通过β-1,4糖苷键链接而成的线性低聚糖,具有一定功能性的低聚糖;这种寡糖能促进人和动物体肠道双歧杆菌增殖,利于肠道蠕动,同时肠道也不会吸收[5-7]。另外,由于纤维低聚糖带有甜味,甜度约为蔗糖的30%~40%,可以作为食品的甜味添加剂,代替蔗糖用于糖尿病患者的食品(如纤维二糖、纤维三糖)。β-1,4糖苷键的链接使得纤维低聚糖产生了如下的特性:结构刚性强、分子质量小、稳定性好等[8-10],加大了应用范围,提高了应用前景。
现在测定纤维低聚糖的方法有很多,考虑本实验测定物料的要求,选用高效液相色谱法(HPLC)是最简单、最快速、最精确;运用HPLC法,以紫外检测器对南瓜籽壳粉中的纤维低聚糖组分进行测定。结合酶法制备纤维低聚糖,为南瓜籽壳纤维低聚糖的定向制备提供理论依据。
1 材料与方法
1.1 材料与试剂
南瓜籽壳粉,自制;β-葡聚糖酶,武汉宏信康精细化工有限恭喜;葡萄糖、纤维二糖、纤维三糖、纤维四糖标准品,美国AccuStandard公司;氢氧化钠与乙酸钠为优级纯;其他药品及试剂均为市售分析纯。
1.2 仪器与设备
Waters Breeze高效液相色谱系统(配有可变波长紫外检测器和Rev.A.06.03色谱工作站);HMBTO1型超微粉碎机;DZF-6050型真空干燥箱;UV-2102C型紫外-可见分光光度计。
1.3 方法
1.3.1 原料预处理
选择外表光滑、无病虫害南瓜籽壳洗涤数次,去除杂质,80 ℃烘干后超微粉碎过220目筛备用。采用硝酸-乙醇法[11]测定南瓜籽壳粉的纤维素含量为 44.83%。
1.3.2 纤维低聚糖的制备
1.3.2.1 工艺流程
预处理的南瓜籽壳粉→一定浓度的南瓜籽壳粉悬浊液(加入pH 5.0 柠檬酸缓冲溶液)→酶解(β-葡聚糖酶)→灭酶(100 ℃ 12 min)→抽滤,滤液即为纤维低聚糖溶液。
1.3.2.2 单因素实验
选择对酶解南瓜籽壳粉纤维低聚糖影响较大的三个因素,酶解温度、酶解时间、酶用量,进行单因素实验。选取不同的单因素条件,酶解温度(35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃),酶解时间(1 h、2 h、3 h、4 h、5 h、6 h、7 h)和酶用量(3 U/g、4 U/g、5 U/g、6 U/g、7 U/g、8 U/g、9 U/g),进行酶解,得到的酶解产物通过HPLC法定量显示,观察图谱发现不同的单因素条件下,纤维低聚糖各组分的质量浓度和比例都不一样,读取峰值带入公式,从而确定最佳的各单因素条件。
1.3.3 纤维低聚糖的HPLC检测
1.3.3.1 色谱条件
色谱柱:CarboPac 18-100分析柱(4.6 mm×250 mm),检测器:紫外检测器,流动相:3.0 mmol/L 甲醇水溶液,柱温:40 ℃,进样量:10 μL,流速:0.8 mL/min。
1.3.3.2 标准溶液的配制及检测
精确称取1 mg葡萄糖、纤维二糖、纤维三糖和纤维四糖标准品,溶于10 mL去离子水中,配制成浓度为100 μg/mL的标准品溶液,冷藏保存待测。
1.3.3.3 南瓜籽壳粉样品检测
精确称取0.1 mg经过酶解的南瓜籽壳粉样液,用200 mL去离子水稀释,得到0.5 μg/mL的稀释样液,进样前需经0.45 μm水系滤膜过滤后,用微孔进样器注入仪器。
1.3.4 纤维低聚糖得率计算
纤维低聚糖得率/%=
×100
2 结果与分析
2.1 处理样品的酶制剂选择
样品南瓜籽壳粉经过一系列的前处理后,组分也就很简单,基本都是大分子的纤维素,由于纤维素酶的酶系复杂性,酶解时断开糖苷键比较凌乱,得到的酶解产物也不只是低聚糖,增加检测的复杂性,从根本出发考虑纤维素是由β-1,4-糖苷键连接一系列葡萄糖分子构成[12-14],因此本实验决定利用β-葡聚糖酶进行酶解,结合HPLC的定量分析发现β-葡聚糖酶,能准确地切断链接葡萄糖的β-1,4糖苷键,简便有效地分解出纤维低聚糖的各组分,使得定量更加准确。
2.2 测纤维低聚糖的色谱条件
HPLC法测定含有极性基团的大分子时一般选用水作为流动相,实验过程发现,简单的水流动相不能很好分离纤维低聚糖各组分;通过使用混合流动相甲醇水溶液不仅可以使分离度提高,而且还可以明显降低分离时间,加入3.0 mmol/L 的甲醇效果最佳。考虑实验样品的本身性质,在进行流速设定时,分别为0.5 mL/min、0.8 mL/min、1 mL/min进行预实验,结果发现,流速为0.8 mL/min时,峰形保留时间恰当,分离效果最佳。
2.3 纤维低聚糖色谱分析

图1 标准品HPLC图(注:1纤维四糖;2纤维三糖;3纤维二糖;4葡萄糖)

图2 样品HPLC图(注:1纤维四糖;2纤维三糖;3纤维二糖;4葡萄糖)
标准品及南瓜籽壳粉样品图谱如图1和图2。通过分析样品测定图谱发现,在色谱图中通过与标准品单糖保留时间比较后判断该样品用β-葡聚糖酶可以酶解出葡萄糖、纤维二糖、纤维三糖和纤维四糖,在样品图中除了和单糖图谱相对应的峰形,距离纤维四糖附近保留6 min处有一明显色谱峰,通过查资料初步判断可能是纤维五糖[15]。因此,对进一步分离南瓜籽壳粉中的纤维低聚糖组分提供了一定的基础。
2.4 标准回归方程
稀释标准品溶液按照10、20、40、60、80、100 μg/mL的梯度,经0.45 μm水系滤膜过滤后,用微量进样器分别进样分析,根据结果计算以质量浓度为横坐标,峰面积为纵坐标得标准曲线回归方程见表1。读取表1数据可以明显看出,四种糖的线性相关系数R2均大于0.99,这是四个线性特征非常明显的实验模型,可以作为定量的依据。

表1 标准回归方程
2.5 最佳酶解温度
观察图3发现,最佳的酶解温度应为50 ℃,在50 ℃之前,随着温度的升高,产物的质量浓度是逐渐增加,达到50 ℃葡萄糖、纤维二糖、纤维三糖和纤维四糖的质量浓度最大,继续升温,产物的质量浓度又开始下降,说明温度升高影响了酶的活力,降低了酶的酶解质量。因此,本实验最佳的酶解温度为50 ℃,通过峰面积计算各组分所占比例,纤维二糖(31.8%)、葡萄糖(26.8%)、纤维三糖(9.45%)、纤维四糖(4.12%)。

图3 酶解温度对酶解南瓜籽壳粉纤维低聚糖的影响
2.6 最佳酶解时间
观察图4发现,最佳的酶解时间应为2.5 h,在2.5 h之前,酶解产物各组分的质量浓度都是增加状态,在2.5 h之后,聚合度小的葡萄糖、纤维二糖浓度继续增加,但很慢,聚合度稍大的纤维三糖、纤维四糖浓度则呈现下降的趋势。分析此原因主要是由于随着时间的增加β-葡聚糖酶也会随机切断聚合度稍大的纤维三糖和纤维四糖,成为聚合度小的纤维二糖和葡萄糖[16]。因此本实验最佳的酶解时间为2.5 h,通过峰面积计算各组分所占比例,纤维二糖(40.9%)、葡萄糖(32.3%)、纤维三糖(6.21%)、纤维四糖(3.33%)。
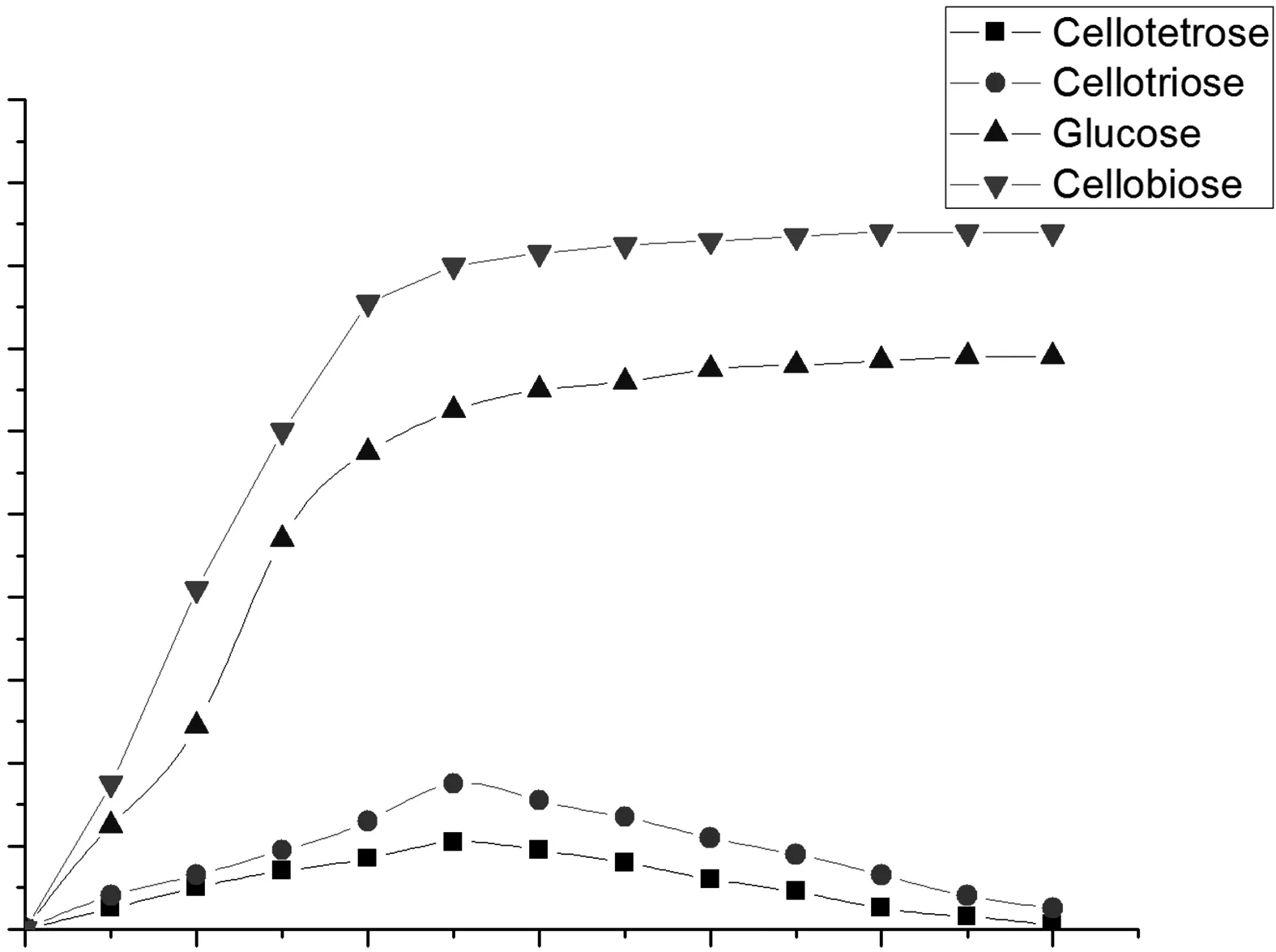
图4 酶解时间对酶解南瓜籽壳粉纤维低聚糖的影响
2.7 最佳酶用量
观察图5发现,最佳的酶用量应为4 U/g,在4 U/g之前,增加酶量,各组分质量浓度都是大幅度的增加状态,在4 U/g之后,葡萄糖和纤维二糖继续增加,纤维三糖稍有下降趋势,但纤维四糖的量却在5 U/g时达到最大,此后随着酶量的加大,纤维三糖和纤维四糖开始减少;分析是由于酶量的加大,体系中游离酶增加,一方面积极酶解大分子低聚糖,另一方面在反应中又进一步酶解了聚合度大的纤维三糖和纤维四糖。因此,综合考虑本实验最佳的酶用量4 U/g,通过峰面积计算各组分所占比例,纤维二糖(31.25%)、葡萄糖(22.8%)、纤维三糖(7.75%)、纤维四糖(4.23%)。

图5 酶用量对酶解南瓜籽壳粉纤维低聚糖的影响
3 结论
选用β-葡聚糖酶酶解,通过单因素确定了酶解温度、酶解时间、酶用量三个主要实验因素的取值范围,配合HPLC法定量分析,以CarboPac 18-100分析柱(4.6 mm×250 mm),3.0 mmol/L甲醇水溶液流动相,0.8 mL/min流速检测南瓜籽壳粉中的纤维低聚糖,同时以标准品的外标法进一步确定了定量的准确性,线性相关系数R2>0.99,说明该实验模型很好。质量浓度的最大值确定了最佳酶解条件:酶解温度50 ℃、酶解时间2.5 h、酶用量4 U/g,在此最佳条件上计算纤维低聚糖为12.2 g/100 g。 实验结果显示此法简便、准确,为后续开发南瓜籽壳粉深加工食品提供了一定的基础资料。
通过HPLC样品图谱发现酶解产物中除了存在葡萄糖、纤维二糖、纤维三糖和纤维四糖外,还可能存在丰富的纤维五糖,但由于标准品的不具备,没有进一步进行认证实验,这样的一个实验结果也为继续研发南瓜籽壳的功能特性提供了依据。
[1]刘宜生.南瓜的开发利用[J].中国食物与营养,2001(5):19-20.
[2]李新峥,周俊国,杨鹏鸣,等.南瓜的多样性与开发利用[J].河南职业技术师范学院学报,2004,32(1):35-38.
[3]陈智民,王修梅.南瓜粉降血糖降血压作用的人体研究[J].江西中药,1994,25(2):23.
[4]张永军,沈晓春,朱龙华.天然降糖食品——南瓜的最新研究进展[J].食品科技,2002(9):68.
[5]郑建仙.功能性低聚糖[M].北京:化学工业出版社,2004.395.
[6]Cheikhyouseef A, Pogori N, Chen W, et al. Antimicrobial Proteinaceous Compounds Obtained from Bifidobacteria: From production to Their Application[J]. International Journal of Food Microbiology, 2008, 125(3):215-222.
[7]Cheikhyouseef A, Pogori N, CHEN H, et al. Antimicrobial Activity and Partial Characterization of Bacteriocin-like Inhibitory Substances (BLIS) Produced by Bifidobacterium infantis BCRC 14602[J]. Food Control, 2009, 20(6):553-555.
[8]彭红,林鹿,刘玉环,等.纤维低聚糖的热稳定性研究[J].食品与发酵工业,2008,34(12):110-112.
[9]沈雪亮.功能性纤维低聚糖的研究现状及发展前景[J].食品与发酵工业,2009,35(8):100-104.
[10]夏黎明,岑沛霖.酶法制备活性纤维寡糖的研究[J].浙江大学学报,1999,33(4):381-385.
[11]王林风,程远超.硝酸乙醇法测定纤维素含量[J].化学研究,2011,22(4):53-55.
[12]余兴莲,王丽,徐伟民.纤维素酶降解纤维素机理的研究进展[J].宁波大学学报,2007,20(1):79-81.
[13]刘树立,王华,王春艳,等.纤维素酶分子结构及作用机理的研究进展[J].食品科技,2007,32(7):12-15.
[14]陈育如,陈志芳,刘媛.酶法水解麦麸制取功能性低聚糖[J].南京师范大学学报(工程技术版),2003,3(4):21-23.
[15]彭红,林鹿,吴真,等.纤维低聚糖的分离纯化研究[J].食品工业科技,2007,12(8):69-71.
[16]彭红,林鹿,刘玉环,等.纤维素酶水解纤维低聚糖的研究[J].食品科学,2009,30(13):218-222.
Preparation of Cello-oligosaccharides from Pumpkin Seeds Shell Fiber by Enzymatic Method
ZHANG Zhenlin
(CollegeofBiologicalandpharmaceuticalEngineering,WestAnhuiUniversity,Lu’an237012,China)
An enzymatic method for the preparation of cello-oligosaccharides from pumpkin seeds shell fiber was developed, and HPLC was used for quantitative determination. The results showed that the hydrolysis obtained after 50 ℃ of hydrolysis with 2.5 h of hydrolysis with 4 U/g β-glucanase contained a high proportion of glucose, cellobiose, cellotriose and cellotetrose, and the yield of cello-oligosaccharides was 12.2 g/100 g under these conditions.
pumpkin seeds shell fiber; cello-oligosaccharides; β-glucanase
2016-05-06
六安市定向委托皖西学院市级研究项目(2013LW020)。
张珍林(1985-),女,安徽霍邱人,助教,硕士,研究方向:食品研究与开发。
TS241
A
1009-9735(2016)05-0075-04
