琼玉膏抗皮肤自然老化作用的实验研究
2016-12-14钱昕妤魏跃钢
钱昕妤, 魏跃钢
(1.江苏省无锡市惠山区人民医院皮肤科, 江苏 无锡 214000 2.南京中医药大学第一临床医学院中医皮肤教研室, 江苏 南京 210023)
琼玉膏抗皮肤自然老化作用的实验研究
钱昕妤1, 魏跃钢2
(1.江苏省无锡市惠山区人民医院皮肤科, 江苏 无锡 214000 2.南京中医药大学第一临床医学院中医皮肤教研室, 江苏 南京 210023)
目的:探讨琼玉膏抗皮肤自然老化的作用机理。方法:50只18个月龄大鼠随机分为空白对照组、琼玉膏大剂量组(14g/kg)、琼玉膏中剂量组(7g/kg)、琼玉膏小剂量组(3.5g/kg)和维生素E组(2g/kg),各组大鼠均连续灌胃给药4周,测定皮肤组织SOD活性、羟脯氨酸、丙二醛含量和透明质酸水平,比较皮肤厚度和皮肤血管化程度;测定皮肤组织中VEGF和BFGF蛋白的表达。结果:琼玉膏可增加大鼠皮肤组织SOD活性、羟脯氨酸和透明质酸含量,降低丙二醛含量,并且呈剂量依赖性;琼玉膏可剂量依赖性增加大鼠皮肤真皮层厚度和血管数目;琼玉膏可剂量依赖性增加大鼠皮肤组织VEGF和BFGF蛋白含量。结论:琼玉膏可增加皮肤组织SOD活性及丙二醛含量而提高皮肤组织的抗氧化防御能力,增加VEGF和BFGF蛋白表达而提高皮肤血管化程度,增加胶原蛋白和透明质酸的含量而提高皮肤厚度而具有较好的抗皮肤老化作用。
皮 肤; 自然老化; 琼玉膏
本课题研究琼玉膏抗皮肤自然老化作用,现报告如下。
1 资料与方法
1.1实验动物:选用18月龄SPF级SD雄性大鼠50只,体重300~500g,SPF级层流柜内分笼饲养,实验正式开始前适应性喂养1周,整个实验中大鼠自由摄食饮水和进食标准颗粒饲料。
1.2实验药品:琼玉膏由本实验自制:取地黄500g、茯苓100g,水提2h×3次,合并滤液;将人参50g切片,适量水浸泡24h,文火水提2h×2次,合并滤液;混合两种滤液,静置,取上清液,水浴浓缩至1000mL(比重1.2l~1.25 kg/L),加入炼蜜350mL,继续浓缩至1000mL,收膏过滤(比重1.40kg/L)。维生素E软胶囊(0.1g/粒),上海信谊药业延安药业提供,注册证号为国药准字H31020237。
1.3主要试剂:超氧化物歧化酶(Superoxide Dismutase,SOD)检测试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒、羟脯氨酸(hydroxyproline,HYP)检测试剂盒、透明质酸(Hyaluronic Acid,HA)检测试剂盒(南京建成生物工程研究所),兔抗鼠八因子相关抗原(Ⅷ-Rag)多克隆抗体(北京中山生物技术有限公司),SP免疫组织化学试剂盒、DAB显色试剂(福州迈新生物技术公司),蛋白抽提试剂(美国Thermo公司),BCA蛋白定量试剂盒(美国Pierce公司),PVDF膜(美国Millipore公司),血管内皮生长因子抗体(Vascular endothelial Growth Factor,VEGF)、碱性成纤维细胞生长因子(Basic Fibroblast Growth Factor,BFGF)抗体、兔抗鼠GAPDH单抗、辣根过氧化物酶标记二抗(美国CST公司),ECL Prime蛋白印迹试剂(美国Thermo公司)。
1.4主要仪器:BX52型光学显微镜(日本Olympus公司),核酸蛋白分析仪(美国BECKMAN公司),电泳仪、制胶板、转膜仪(美国Bio-Red公司),电泳槽(美国Bio-Red公司),凝胶成像系统(以色列Minilumi公司)
1.5分组与造模:将大鼠按随机数字表法随机分为5组,分别为空白对照组、琼玉膏大剂量组(14g/kg)、琼玉膏中剂量组(7g/kg)、琼玉膏小剂量组(3.5g/kg)和维生素E组(2g/kg)。琼玉膏大剂量、中剂量和小剂量组大鼠分别给予琼玉膏原液以及用纯净水按1:1或1:3稀释后进行灌胃,维生素E组大鼠灌胃给予维生素E2g/kg,空白对照组大鼠灌胃给予等体积纯净水。各组大鼠均连续灌胃给药4周。
1.6观察指标:各组大鼠给药4周后分别测定皮肤组织SOD活性、羟脯氨酸、丙二醛含量和透明质酸水平,比较各组大鼠皮肤厚度和皮肤血管化程度;并且测定各组大鼠皮肤组织中VEGF和BFGF蛋白的表达。
1.6.1皮肤组织SOD活性、MDA、HYP及HA含量的测定:各组大鼠处死后立即脱毛后取颈背部皮肤组织约2cm×3cm,制备10%皮肤组织匀浆,离心,取上清液进行测定。SOD活性测定采用黄嘌呤氧化酶法,HYP及MDA含量测定分别采用二甲氨基苯甲醛法及硫代巴比妥酸法,HA含量测定采用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)测定。
1.6.2皮肤厚度的测定:皮肤样本均被切成0.5cm×0. 5cm大小的组织块进行HE染色,具体步骤如下:多聚甲醛浸泡,乙醇脱水,二甲苯透明,石蜡包埋,连续切片,贴于载玻片,烘干。二甲苯脱去石蜡,乙醇水化,最后入蒸馏水。苏木精染色,经酸水及氨水中分色,蒸馏水冲洗,乙醇脱水,入乙醇伊红染色液染色,脱水,透明,封固。光镜下观察皮肤病理学形态观察。使用Image-Pro Plus显微分析系统,形态计量表皮厚度(μm)。
1.6.3皮肤血管化程度的测定:石蜡标本连续切片后进行SP免疫组化染色,具体步骤如下:常规脱蜡、水化,胃蛋白酶抗原修复,PBS冲洗。滴加兔抗人八因子相关抗原(Ⅷ-Rag)多克隆抗体(1:100),37℃孵育60min,4℃下过夜,室温下孵育20min;PBS冲洗。滴加二抗,37℃孵育30min;PBS冲洗;3,3-二氨基联苯胺(DAB)显色,自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗;梯度乙醇脱水干燥,中性树脂封片,显微镜下观察老化皮肤组织血管化程度(放大倍数200×)。
1.6.4皮肤组织VEGF和bFGF含量测定:称取组织重量,提取蛋白并进行蛋白定量,调整蛋白浓度为4. 0mg/mL,煮沸5min变性。按蛋白量40μg/孔进行10%SDS-PAGE凝胶电泳(80V20min,150V约1.5h),转膜(400mA2h)至0.45μm的PVDF膜,于5%脱脂奶粉室温封闭1h,分别加入一抗,4℃过夜,TBST缓冲液洗膜,滴加二抗,室温孵育,洗膜,显色,显影,对条带进行定量分析。
1.7统计学方法:采用SPSS 19.0进行数据统计,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(One-way ANOVA),多重比较采用LSD法多重比较采用什么方法。以P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠皮肤组织SOD活性、HYP、MDA和HA含量的比较:治疗后琼玉膏小剂量组大鼠皮肤组织SOD活性、HYP、MDA和HA含量与空白对照组差异均无统计学意义(P>0.05);琼玉膏中剂量组大鼠皮肤组织SOD活性、HYP和HA含量较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01),MDA含量较琼玉膏小剂量组大鼠显著降低(P<0.01);琼玉膏大剂量组大鼠皮肤组织SOD活性、HYP和HA含量较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01),MDA含量较琼玉膏中剂量组大鼠降低,差异具有统计学意义(P<0.01)。维生素E组大鼠皮肤组织SOD活性、MDA和HA含量较空白对照组增加,差异具有统计学意义(P<0.01),MDA含量较空白对照组大鼠降低,差异具有统计学意义(P<0.01),具体见表1。
表1 各组大鼠皮肤组织SOD活性、HYP、MDA和HA含量的比较(±s)
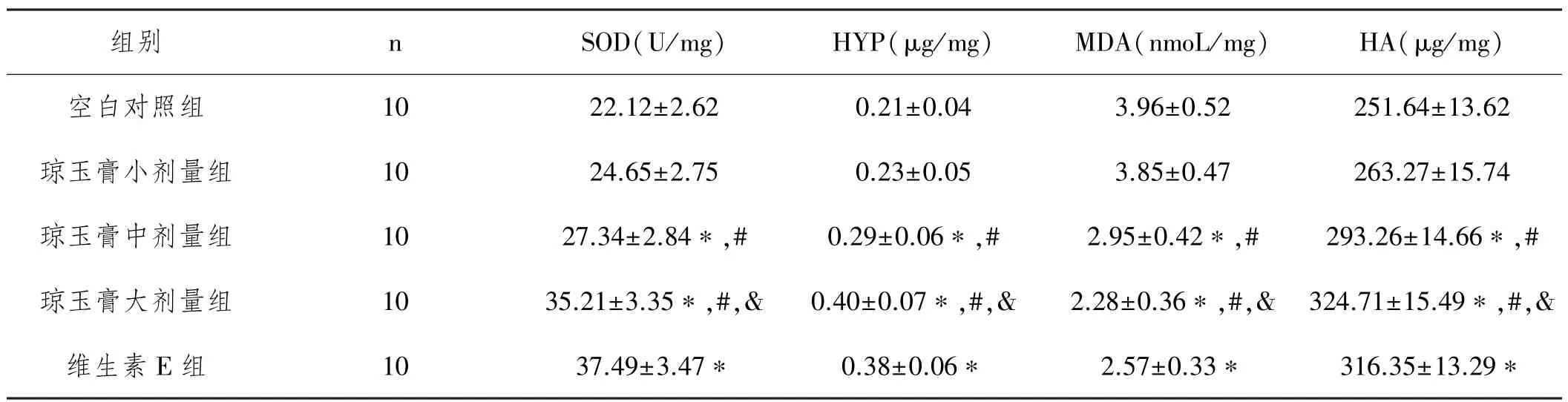
表1 各组大鼠皮肤组织SOD活性、HYP、MDA和HA含量的比较(±s)
与空白对照组比较,∗P<0.01;与玉膏小剂量组组比较,#P<0.01;与琼玉膏中剂量组比较,&P<0.01
组别nSOD(U/mg)HYP(μg/mg)MDA(nmoL/mg)HA(μg/mg)空白对照组1022.12±2.620.21±0.043.96±0.52251.64±13.62琼玉膏小剂量组1024.65±2.750.23±0.053.85±0.47263.27±15.74琼玉膏中剂量组1027.34±2.84∗,#0.29±0.06∗,#2.95±0.42∗,#293.26±14.66∗,#琼玉膏大剂量组1035.21±3.35∗,#,&0.40±0.07∗,#,&2.28±0.36∗,#,&324.71±15.49∗,#,&维生素E组1037.49±3.47∗0.38±0.06∗2.57±0.33∗316.35±13.29∗

图1 皮肤组织HE染色结果 A:空白对照组;B:琼玉膏小剂量组;C:琼玉膏中剂量组;D:琼玉膏大剂量组;E:维生素E组

图2 皮肤组织免疫组化分析结果 A:空白对照组;B:琼玉膏小剂量组;C:琼玉膏中剂量组;D:琼玉膏大剂量组;E:维生素E组
2.2各组大鼠皮肤真皮层厚度和血管化程度的比较:治疗后琼玉膏小剂量组大鼠皮肤真皮层厚度和血管数目与空白对照组差异均无统计学意义(P>0.05),琼玉膏中剂量组大鼠皮肤真皮层厚度和血管数目较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01),琼玉膏大剂量组大鼠皮肤真皮层厚度和血管数目较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01)。维生素E组大鼠皮肤真皮层厚度和血管数目较空白对照组增加,差异具有统计学意义(P<0.01),具体见表2。
2.3各组大鼠皮肤组织VEGF和BFGF蛋白含量的比较:治疗后琼玉膏小剂量组大鼠皮肤组织VEGF和BFGF蛋白含量与空白对照组差异均无统计学意义(P>0. 05),琼玉膏中剂量组大鼠皮肤组织VEGF和BFGF蛋白含量较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01),琼玉膏大剂量组大鼠皮肤组织VEGF和BFGF蛋白含量较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01)。维生素E组大鼠皮肤组织VEGF和BFGF蛋白含量较空白对照组增加,差异具有统计学意义(P<0.01),具体见表3。
表2 各组大鼠皮肤真皮层厚度和皮肤血管数目的比较(±s)

表2 各组大鼠皮肤真皮层厚度和皮肤血管数目的比较(±s)
与空白对照组比较,∗P<0.01;与玉膏小剂量组组比较,#P<0.01;与琼玉膏中剂量组比较,&P<0.01
组别n真皮层厚度(μm)血管数目(个/高倍视野)空白对照组10424.12±25.363.65±1.54琼玉膏小剂量组10436.45±23.744.74±1.60琼玉膏中剂量组10477.27±25.29∗#7.82±2.47∗#琼玉膏大剂量组10524.65±29.66∗#&12.35±2.54∗#&维生素E组10494.38±28.42∗11.57±2.76∗
表3 各组大鼠皮肤组织VEGF和BFGF蛋白的比较(±s)

表3 各组大鼠皮肤组织VEGF和BFGF蛋白的比较(±s)
与空白对照组比较,∗P<0.01;与玉膏小剂量组组比较,#P<0.01;与琼玉膏中剂量组比较,&P<0.01
组别nVEGFBFGF空白对照组100.24±0.040.32±0.05琼玉膏小剂量组100.26±0.050.35±0.04琼玉膏中剂量组100.38±0.06∗#0.44±0.06∗#琼玉膏大剂量组100.48±0.05∗#&0.54±0.07∗#&维生素E组100.42±0.06∗0.48±0.05∗
3 讨 论
活性氧自由基造成基因损伤是细胞老化的一项重要机制。自由基是一类能独立存在的具有活泼不成对电子的特殊物质,是人体生命活动中多种生化反应的中间代谢产物,介导了许多疾病和老化的发生,与组织过氧化、DNA损伤、蛋白质交联变性、细胞信号转导都有重要联系。超氧阴离子自由基(O2·-)是生物活性最离的活性氧自由基之一,可对生物膜、蛋白质和核酸造成损伤,诱发细胞老化。SOD是机体主要抗氧化酶之一,参与清除活性氧自由基[1]。MDA是自由基脂质过氧化的分解产物,其水平的变化间接反映了组织中自由基的变化。本研究结果显示,琼玉膏中剂量组大鼠皮肤组织SOD活性较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01),丙二醛含量较琼玉膏小剂量组大鼠降低,差异具有统计学意义(P<0.01);琼玉膏大剂量组大鼠皮肤组织SOD活性较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01),丙二醛含量较琼玉膏中剂量组大鼠降低,差异具有统计学意义(P<0. 01),说明琼玉膏可以剂量依赖性提高老化皮肤组织的抗氧化防御能力。
真皮组织结构的改变是皮肤老化的主要原因,皮肤老化时出现的皱纹、弹性下降等均与真皮中胶原蛋白和胶原纤维的含量下降有关。本研究结果显示,琼玉膏中剂量组大鼠皮肤真皮层厚度和血管数目较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01),琼玉膏大剂量组大鼠皮肤真皮层厚度和血管数目较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01)。维生素E组大鼠皮肤真皮层厚度和血管数目较空白对照组增加,差异具有统计学意义(P<0.01),说明琼玉膏可剂量依赖性增加老化皮肤真皮层厚度及血管数目。
胶原蛋白是哺乳动物皮肤的组成成分,其肽链氨基酸中占主要成分的是羟脯氨酸[2],因此羟脯氨酸的含量可以反映皮肤中胶原蛋白的含量。粘多糖足构成细胞间结缔组织的主要成分,其中透明质酸是一种直链酸性粘多糖,可结成凝胶将细胞紧密地粘合在一起,能保持组织间的水分,并使皮肤具有一定的坚韧性、弹性和返回性。本研究结果显示,琼玉膏中剂量组大鼠皮肤组织羟脯氨酸和透明质酸含量较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01);琼玉膏大剂量组大鼠皮肤组织羟脯氨酸和透明质酸含量较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01),说明琼玉膏可以剂量提高老化皮肤组织胶原蛋白和透明质酸的表达。
VEGF是血管内皮细胞特异性的肝素结合生长因子,具有维持血管正常形态和完整性、提高血管通透性、促进内皮细胞迁移和增殖等作用,还可诱导多种组织蛋白酶,降解细胞外基质以利于血管生成。BFGF是成纤维细胞生长因子家族原型,可刺激成纤维细胞增殖和迁移、诱导或促进胶原的形成,增加胶原酶及纤维蛋白酶原激活剂的产生释放等作用[3]。本研究结果显示,琼玉膏中剂量组大鼠皮肤组织VEGF和BFGF蛋白含量较琼玉膏小剂量组增加,差异具有统计学意义(P<0.01),并且琼玉膏大剂量组大鼠皮肤组织VEGF和BFGF蛋白含量较琼玉膏中剂量组增加,差异具有统计学意义(P<0.01),说明琼玉膏可以剂量依赖性增加大鼠老化皮肤组织VEGF和BFGF蛋白的表达。
[1] 刘甜甜,张微,彭金娥,等.延寿液对大鼠吸人臭氧诱导皮肤衰老的延缓作用[J].中国实验方剂学杂志,2015,21 (7):142~145.
[2] 夏锦明,张颖,康廷国,等.活性磷脂抗皮肤老化的实验研究[J].实用药物与临床,2007,10(1):7~8.
[3] 农晓琳,邓凌,李佳荃,等.bFGF、TGFt3,在人皮肤病理性瘢痕不同时期的表达及意义[J].广西医科大学学报,2010,27(2):180~183.
1006-6233(2016)11-1888-04
A 【doi】10.3969/j.issn.1006-6233.2016.11.058
江苏省中医药局科技项目,(编号:LZ11180)
魏跃钢
