雷帕霉素对慢性阻塞性肺疾病大鼠气道重塑中血管内皮生长因子表达作用的研究
2016-12-14童卫泉杨宏宽夏婷婷刘贤忠
童卫泉,杨宏宽,夏婷婷,刘贤忠,陈 彬,陈 芳
·论著·
雷帕霉素对慢性阻塞性肺疾病大鼠气道重塑中血管内皮生长因子表达作用的研究
童卫泉,杨宏宽,夏婷婷,刘贤忠,陈 彬,陈 芳
目的 探讨雷帕霉素对慢性阻塞性肺疾病(COPD)大鼠气道重塑中血管内皮生长因子(VEGF)表达的作用。方法 2015年6月—2016年3月,采用随机数字表法将30只SPF级健康雄性Wistar大鼠分为正常组、模型组、雷帕霉素组,每组10只。模型组与雷帕霉素组采用气道内滴入脂多糖(LPS)加烟熏双重刺激法建立COPD气道重塑大鼠模型,正常组不予任何干预。雷帕霉素组给予雷帕霉素治疗,模型组、正常组给予等量的0.9%氯化钠溶液。干预治疗14 d后,收集各组大鼠血清、肺泡灌洗液(BALF)、肺组织标本;取部分右侧肺组织行HE染色,剩余右侧肺组织行Masson染色与免疫组化染色,分别计算小气道基底膜单位长度的胶原厚度(WAc/Pbm)、细支气管VEGF阳性表达面积占气管管壁总面积的百分比(Aim/WAt);采用酶联免疫吸附实验(ELISA)法检测血清、BALF及肺组织中VEGF水平。结果 HE染色结果显示,与模型组比较,雷帕霉素组大鼠细支气管、肌性动脉形态及肺组织病理改变有所改善;Masson染色结果显示,模型组、雷帕霉素组大鼠WAc/Pbm大于正常组,雷帕霉素组大鼠WAc/Pbm小于模型组(P<0.05)。免疫组化染色结果显示,模型组、雷帕霉素组大鼠Aim/WAt大于正常组,雷帕霉素组大鼠Aim/WAt小于模型组(P<0.05)。ELISA法检测结果显示,模型组、雷帕霉素组大鼠血清、BALF、肺组织中VEGF水平高于正常组,雷帕霉素组大鼠血清、BALF、肺组织中VEGF水平低于模型组(P<0.05)。结论 雷帕霉素可以改善COPD大鼠气道重塑,这可能与雷帕霉素干预治疗减少了COPD大鼠气道重塑中VEGF水平,进而抑制血管新生有关。
肺疾病,慢性阻塞性;气道重塑;雷帕霉素;血管内皮生长因子A
童卫泉,杨宏宽,夏婷婷,等.雷帕霉素对慢性阻塞性肺疾病大鼠气道重塑中血管内皮生长因子表达作用的研究[J].中国全科医学,2016,19(36):4484-4488,4494.[www.chinagp.net]
TONG W Q,YANG H K,XIA T T,et al.Effect of rapamycin on the expression of vascular endothelial growth factor in airway remodeling of rats with chronic obstructive pulmonary disease[J].Chinese General Practice,2016,19(36):4484-4488,4494.
慢性阻塞性肺疾病(COPD)是一种以气流受限为特征的疾病,其气流受限不完全可逆,呈进行性发展,与肺部对香烟烟雾等有害气体或有害颗粒物的异常炎性反应有关[1]。气道重塑是COPD的主要病理特征,以气道壁组织结构改变、管腔狭窄、气流受限等为主要表现。近年来,血管内皮生长因子(VEGF)在COPD气道重塑中的作用日益受到关注[2]。VEGF又名血管通透性因子,是目前研究最深入、作用最强的促血管生长因子,在生理、病理性血管增生中具有重要的调节作用,其在气道和血管平滑肌细胞、气道与肺泡上皮细胞、间质细胞、巨噬细胞、中性粒细胞中等均有表达[3]。VEGF合成增多能促进内皮细胞增生和迁移,诱导气道血管增殖,加重气道纤维化[4],最终导致气道壁增厚,气流受限。已有研究表明,COPD气道重塑的形成与气道血管体积增加使气道壁增厚有关,所以通过抑制VEGF表达从而干预血管新生对延缓和改善COPD气道重塑有积极作用[5]。本研究采用气道内滴入脂多糖(LPS)加烟熏双重刺激法建立COPD气道重塑大鼠模型,并进行雷帕霉素干预治疗,检测血清、肺泡灌洗液(BALF)及肺组织中VEGF水平,初步探讨雷帕霉素在COPD大鼠气道重塑过程中抑制血管新生的作用。
1 材料与方法
1.1 实验动物与分组 SPF级健康雄性Wistar大鼠30只,体质量(200±20)g,由上海斯莱克实验动物有限责任公司提供,生产许可证号SCXK(沪):2012-0002,由浙江中医药大学动物实验中心饲养。采用随机数字表法将大鼠分为正常组、模型组、雷帕霉素组,每组10只。本研究经浙江中医药大学动物实验伦理委员会审批通过。
1.2 实验药物 雷帕霉素购于美国Sigma公司。
1.3 实验试剂 雄狮牌香烟购于浙江中烟工业有限责任公司(焦油量8 mg/支,烟气烟碱量0.7 mg/支,一氧化碳量10 mg/支);LPS购于美国Sigma公司;酶联免疫吸附实验(ELISA)试剂盒购于武汉新启迪生物科技有限公司;免疫组化VEGF检测试剂盒购于丹麦DAKO公司。
1.4 方法
1.4.1 建立COPD气道重塑大鼠模型 2015年6月—2016年3月,采用气道内滴入LPS加烟熏双重刺激法建立COPD气道重塑大鼠模型,即模型组与雷帕霉素组在第1天与第28天气道内滴入LPS,除当日不予烟熏外,余时间在自制烟熏箱内烟熏24周,早晚各1次,每次点燃香烟30支,烟熏40 min,间隔8 h;正常组不予任何干预。通过观察肺组织病理变化判断造模是否成功[6]。
1.4.2 干预治疗 烟熏24周确定造模成功后开始进行雷帕霉素干预治疗,共14 d。雷帕霉素组腹腔注射雷帕霉素0.2 mg·kg-1·d-1;模型组、正常组腹腔注射等量的0.9%氯化钠溶液。
1.4.3 标本收集 干预治疗14 d后,腹腔注射10%水合氯醛溶液(0.3 ml/100 g)麻醉大鼠,取腹主动脉血8 ml,静置30 min,3 000 r/min离心15 min(离心半径6 cm),取上清液(血清)分装到EP管中,-20 ℃冰箱保存。结扎大鼠右肺,对其左肺进行肺泡灌洗3次,回收BALF,3 000 r/min离心10 min(离心半径6 cm),去细胞沉淀后分装,-80 ℃保存。取下右肺,灌注4%甲醛溶液固定24 h,分别行HE染色、Masson染色和免疫组化染色;取左肺,一分为二放入冻存管液氮速冻,-80 ℃保存,用于ELISA检测。
1.4.4 病理分析 取部分右侧肺组织行HE染色,观察小气道及周围小动脉病理改变;剩余右肺组织行Masson染色与免疫组化染色,采用Image-pro-plus 6.0图像分析软件分别计算小气道基底膜单位长度的胶原厚度(WAc/Pbm)、细支气管VEGF阳性表达面积占气管管壁总面积的百分比(Aim/WAt),以评估气道重塑情况和VEGF表达情况。其中Masson染色阳性胶原纤维呈蓝色,肌纤维呈红色;免疫组化染色阳性VEGF呈棕黄色,表达在气道上皮及肺血管内皮细胞胞质。
1.4.5 ELISA法检测血清、BALF及肺组织中VEGF水平 按ELISA试剂盒说明书要求,将保存的血清、BALF、部分左肺组织标本常温解冻后置于超净台上,采用ELISA试剂盒检测各组大鼠血清、BALF及肺组织中VEGF水平。

2 结果
2.1 病理结果
2.1.1HE染色结果 正常组大鼠肺组织细支气管、血管及肺泡结构完整,细支气管与血管管壁未见明显组织学改变;模型组大鼠肺组织结构紊乱,肺泡壁扩张、破裂,融合形成肺大泡,细支气管管壁增厚明显且周围有大量炎性细胞浸润,伴小动脉平滑肌增厚;雷帕霉素组大鼠较模型组肺泡壁仍有扩张,部分肺泡腔融合,细支气管与血管周围可见少量炎性细胞,气管及血管壁略有增厚,肺组织结构改变有所改善(见图1,本文图1~3彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.1.2Masson染色结果 正常组大鼠肺组织含有少量胶原纤维,是细胞外基质的主要成分;模型组大鼠肺组织可见炎性细胞浸润,肺泡壁增厚纤维化,气道壁胶原纤维增多;雷帕霉素组大鼠肺组织胶原纤维略有增多,但比模型组有所减少(见图2)。3组大鼠WAc/Pbm比较,差异有统计学意义(P<0.001);其中模型组、雷帕霉素组大鼠WAc/Pbm大于正常组,雷帕霉素组大鼠WAc/Pbm小于模型组,差异有统计学意义(P<0.05,见表1)。
2.1.3 免疫组化染色结果 正常组大鼠气道及周围仅见少量VEGF阳性颗粒;模型组大鼠气道及周围有大量VEGF阳性颗粒浸润;雷帕霉素组大鼠气道及周围VEGF阳性颗粒较模型组有所减少(见图3)。3组大鼠Aim/WAt比较,差异有统计学意义(P<0.001);其中模型组、雷帕霉素组大鼠Aim/WAt大于正常组,雷帕霉素组大鼠Aim/WAt小于模型组,差异有统计学意义(P<0.05,见表2)。
2.2 血清、BALF及肺组织中VEGF水平 3组大鼠血清、BALF及肺组织中VEGF水平比较,差异均有统计学意义(P<0.001);其中模型组、雷帕霉素组大鼠血清、BALF、肺组织中VEGF水平高于正常组,雷帕霉素组大鼠血清、BALF、肺组织中VEGF水平低于模型组,差异有统计学意义(P<0.05,见表3)。
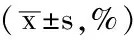
表1 各组大鼠WAc/Pbm比较
注:WAc/Pbm=胶原厚度;与正常组比较,aP<0.05;与模型组比较,bP<0.05
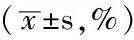
表2 各组大鼠Aim/WAt比较
注:Aim/WAt=细支气管VEGF阳性表达面积占气管管壁总面积的百分比;与正常组比较,aP<0.05;与模型组比较,bP<0.05

Table 3 Comparison of VEGF level in serum,BALF and lung tissues of rats in each groups

组别只数血清BALF肺组织正常组108358±28210529±52812358±413模型组109450±266a12601±531a15002±507a雷帕霉素组108889±220ab11024±389ab14396±673abF值450504929965313P值<0001<0001<0001
注:BALF=肺泡灌洗液;与正常组比较,aP<0.05;与模型组比较,bP<0.05

注:A为正常组,B为模型组,C为雷帕霉素组
图1 各组大鼠肺组织病理HE染色结果(×100)
Figure 1 Pathological results of HE staining of lung tissue of rats in each group

注:A为正常组,B为模型组,C为雷帕霉素组
图2 各组大鼠肺组织病理Masson染色结果(×100)
Figure 2 Pathological results of Masson staining of lung tissue of rats in each group
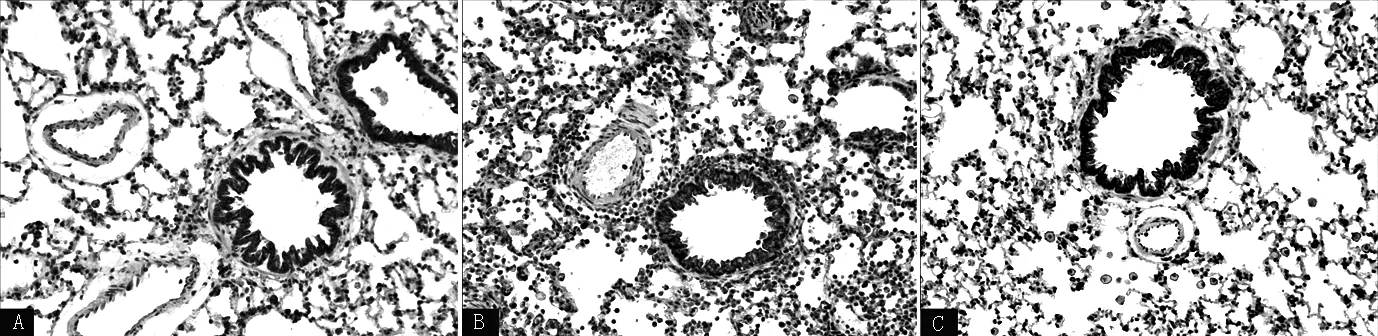
注:A为正常组,B为模型组,C为雷帕霉素组
图3 各组大鼠肺组织免疫组化染色结果(×100)
Figure 3 Immunohistochemical staining results of lung tissue of rats in each group
3 讨论
COPD气道重塑是一个复杂的病理生理过程,多种因素参与其中,目前的主要观点认为,气道的慢性炎症是诱发COPD气道重塑的主要原因,气道在慢性致炎因素的反复刺激下,气道上皮充血、水肿、脱落,气道壁血管裸露,血管内容物渗漏,血管生成,气道上皮化生,管壁纤维组织增生,气道壁增厚,气道重塑,管腔狭窄,最终导致不可逆的气流受限[7]。近年来,血管新生在COPD气道重塑中的作用日益受到重视[8]。气道的血管系统具有较强的可塑性和扩展能力,在致炎因素的作用下,出现血管壁的通透性增加、体液渗出、气道壁水肿、黏膜下新生血管形成、血管增多等改变,进而使得气道壁组织结构改变,气道重塑[9-10]。
VEGF是有效的作用于血管内皮细胞的生长因子,通过与血管内皮上的特异性受体结合,具有促进内皮细胞增殖、增加微血管通透性、诱导血管生成的功能[11],并且VEGF还能诱导内皮细胞生长、移位及血管渗漏,参与血管生成,在气道重塑中起重要作用。既往研究表明,VEGF与COPD关系密切[12]。SOLTANI等[13]研究显示,在COPD患者及正在吸烟的人群中存在VEGF的高表达,且COPD患者在戒烟后仍存在血管生成活跃的现象。另外,KRANENBURG等[14]研究表明,COPD患者细支气管、气道平滑肌细胞VEGF及其受体表达水平明显增加,同时指出VEGF及其受体参与COPD气道重塑并与气流受限的形成有关。此外,FARID等[15]采用ELISA法检测发现,COPD患者血清中VEGF水平明显高于正常对照组,且血清VEGF可以作为评估COPD严重程度及预后的指标。PAVLISA等[16]提出,上调VEGF水平可改善组织灌注和氧合,进而刺激血管新生。因而可以通过观察气道VEGF的阳性表达面积及检测血清、BALF、肺组织中的VEGF水平来评价COPD气道重塑过程中血管新生的情况。本研究HE染色结果显示,与正常组相比,模型组大鼠肺组织结构紊乱,肺泡壁扩张、破裂,融合形成肺大泡,细支气管管壁明显增厚且周围有大量炎性细胞浸润,伴行小动脉平滑肌亦有显著增厚;Masson染色结果显示,模型组大鼠肺组织可见炎性细胞浸润,肺泡壁增厚纤维化,气道壁胶原纤维增多,模型组WAc/Pbm大于正常组;免疫组化染色结果显示,模型组大鼠气道及周围有大量VEGF阳性颗粒浸润,模型组Aim/WAt大于正常组;ELISA检测结果显示,模型组大鼠血清、BALF、肺组织中VEGF水平高于正常组。说明VEGF在COPD气道重塑大鼠的肺部高表达,表明COPD气道重塑组大鼠存在血管新生活跃的现象。
雷帕霉素是从链酶素培养液中提取的三烯大环内酯抗生素,能抑制T淋巴细胞分化,抑制气道平滑肌细胞、血管内皮细胞的增殖[17],兼有免疫抑制和抗新生血管增生的作用。有研究显示,雷帕霉素可以显著减少VEGF的分泌,抑制血管新生[18];对脐静脉内皮细胞增殖的研究表明,雷帕霉素能降低VEGF水平,减少血管内皮细胞增殖,进而抑制新生血管的生成[19]。因而,本研究采用雷帕霉素干预COPD大鼠气道重塑中的血管新生,HE染色结果显示,雷帕霉素组大鼠较模型组肺泡壁仍有扩张,部分肺泡腔融合,细支气管与血管周围可见少量炎性细胞,气管及血管壁略有增厚,肺组织结构改变有所改善;Masson染色结果显示,雷帕霉素组大鼠肺组织胶原纤维略有增多,但比模型组有所减少,雷帕霉素组大鼠WAc/Pbm大于正常组,小于模型组;免疫组化染色结果显示,雷帕霉素组大鼠气道及周围VEGF阳性颗粒较模型组有所减少,雷帕霉素组大鼠Aim/WAt大于正常组,小于模型组;ELISA检测结果显示,雷帕霉素组大鼠血清、BALF、肺组织中VEGF水平高于正常组,低于模型组。表明雷帕霉素能通过降低COPD气道重塑大鼠VEGF水平抑制血管新生,缓解气道重塑。
综上所述,雷帕霉素能降低COPD大鼠气道重塑中VEGF水平,抑制血管新生、改善COPD气道重塑。当然,本研究仍有许多不完善之处,如未能对VEGF的受体进行检测;再者,促进血管新生的因子众多,VEGF仅是其中之一,雷帕霉素是否通过其他途径抑制血管新生尚待今后进一步研究。
作者贡献:童卫泉、陈芳进行文章的构思与设计、数据整理、统计学处理、撰写论文;陈芳进行研究的实施与可行性分析;杨宏宽、夏婷婷、陈彬进行数据收集;童卫泉、陈芳进行结果的分析与解释;夏婷婷、刘贤忠、陈芳进行论文的修订;陈芳负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]RABE K F,HURD S,ANZUETO A,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2007,176(6):532-555.
[2]HARKNESS L M,KANABAR V,SHARMA H S,et al.Pulmonary vascular changes in asthma and COPD[J].Pulm Pharmacol Ther,2014,29(2):144-155.
[3]TRIPP D A,CURTIS NICKEL J,LANDIS J R,et al.Predictors of quality of life and pain in chronic prostatitis/chronic pelvic pain syndrome:findings from the National Institutes of Health Chronic Prostatitis Cohort Study[J].BJU Int,2004,94(9):1279-1282.
[5]王璐,陈芳,徐志波,等.保肺定喘汤对COPD大鼠气道重塑中VEGF及受体R1、R2的影响[J].中华中医药杂志,2015,30(10):3647-3650. WANG L,CHEN F,XU Z B,et al.Influence of Baofei Dingchuan Decoction on VEGF,VEGFR-1 and VEGFR-2 in airway remodeling of COPD rats[J].China Journal of Traditional Chinese Medicine and Pharmacy,2015,30(10):3647-3650.
[6]贺芳,梁景长,李俊玲.两种不同染色方法对慢性阻塞性肺病大鼠模型的染色观察[J].生物技术世界,2015(11):20-21. HE F,LIANG J C,LI J L,et al.Staining and observation of two different staining methods for rat model of chronic obstructive pulmonary disease[J].Biotech World,2015(11):20-21.
[7]JONES R L,NOBLE P B,ELLIOT J G,et al.Airway remodelling in COPD:it′s not asthma![J].Respirology,2016,21(8):1347-1356.[8]WALTERS E H,REID D,SOLTANI A,et al.Angiogenesis:a potentially critical part of remodelling in chronic airway diseases?[J].Pharmacol Ther,2008,118(1):128-137.
[9]MATARESE A,SANTULLI G.Angiogenesis in chronic obstructive pulmonary disease:a translational appraisal[J].Transl Med UniSa,2012,3:49-56.
[10]KRISTAN S S,MARC M M,KERN I,et al.Airway angiogenesis in stable and exacerbated chronic obstructive pulmonary disease[J].Scand J Immunol,2012,75(1):109-114.
[11]HASANEEN N A,ZUCKER S,LIN R Z,et al.Angiogenesis is induced by airway smooth muscle strain[J].Am J Physiol Lung Cell Mol Physiol,2007,293(4):L1059-1068.
[12] ALAGAPPAN V K,DE BOER W I,MISRA V K,et al.Angiogenesis and vascular remodeling in chronic airway diseases[J].Cell Biochem Biophys,2013,67(2):219-234.
[13]SOLTANI A,REID D W,SOHAL S S,et al.Basement membrane and vascular remodelling in smokers and chronic obstructive pulmonary disease:a cross-sectional study[J].Respir Res,2010,11:105.
[14]KRANENBURG A R,DE BOER W I,ALAGAPPAN V K,et al.Enhanced bronchial expression of vascular endothelial growth factor and receptors (Flk-1 and Flt-1) in patients with chronic obstructive pulmonary disease[J].Thorax,2005,60(2):106-113.
[15]FARID HOSSEINI R,JABBARI AZAD F,YOUSEFZADEH H,et al.Serum levels of vascular endothelial growth factor in chronic obstructive pulmonary disease[J].Med J Islam Repub Iran,2014,28:85.
[16]PAVLISA G,PAVLISA G,KUSEC V,et al.Serum levels of VEGF and bFGF in hypoxic patients with exacerbated COPD[J].Eur Cytokine Netw,2010,21(2):92-98.
[17]GONCHAROVA E A,LIM P N,CHISOLM A,et al.Interferons modulate mitogen-induced protein synthesis in airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2010,299(1):L25-35.
[18]KWON Y S,KIM J C.Inhibition of corneal neovascularization by rapamycin[J].Exp Mol Med,2006,38(2):173-179.
[19]管丽丽,吴伟,李平华,等.雷帕霉素对人脐静脉内皮细胞增殖的影响[J].激光杂志,2010,31(2):75-76. GUAN L L,WU W,LI P H,et al.Effect of rapamycin on proliferated human umbilical vein endothelial cell[J].Laser Journal,2010,31(2):75-76.
(本文编辑:崔丽红)
Effect of Rapamycin on the Expression of Vascular Endothelial Growth Factor in Airway Remodeling of Rats with Chronic Obstructive Pulmonary Disease
TONG Wei-quan,YANG Hong-kuan,XIA Ting-ting,LIU Xian-zhong,CHEN Bin,CHEN Fang.
The First Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou 310053,China
CHEN Fang,Respiratory Physiology Laboratory,Zhejiang Provincial Hospital of TCM,the First Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou 310006,China;E-mail:funchen@163.com
Objective To explore the role of rapamycin on the expression of vascular endothelial growth factor (VEGF) in airway remodeling of rats with chronic obstructive pulmonary disease (COPD).Methods From June 2015 to March 2016,30 SPF grade male Wistar rats were randomly divided into three groups (normal group,model group and rapamycin group) by random number table method,and each group had 10 rats.The dual stimulation way of lipopolysaccharide (LPS) through the airway plus fumigation was conducted to rats in model group and rapamycin group to construct COPD rats′ model of airway remodeling,while no intervention was given to rats in normal group.Rats in rapamycin group received treatment of rapamycin,while rats in model group and normal group received the same amount of 0.9% solution of sodium chloride.After 14-day intervention,the serum,bronchial alveolar lavage fluid (BALF) and lung tissue specimens of rats in each group were collected;part of the right lung tissue was taken to perform HE staining and Masson staining and immunohistochemical staining were given to the remaining tissue,collagen thickness(WAc/Pbm) per unit length of small airway basement membrame,and the percentage of bronchioles VEGF positive expression area in the total area of the corresponding tracheal tube wall (Aim/WAt) were calculated respectively;the enzyme-linked immunosorbent assay (ELISA) was used to detect VEGF expression level in serum,BALF and lung tissue.Results The HE staining results showed that compared with model group,the pathologic change of bronchiole,muscular artery morphology and lung tissue of rats in rapamycin group had improved;Masson staining results showed that the WAc/Pbm of rats in model group and rapamycin group was greater than that in normal group,while WAc/Pbm of rats in rapamycin group was less than that in model group (P<0.05).Immunohistochemical staining results showed that Aim/WAt of rats in model group and rapamycin group was greater than that in normal group,while Aim/WAt of rats in rapamycin group was less than that in model group (P<0.05).ELISA testing results showed that the VEGF expression level of serum,BALF and lung tissue in rapamycin group and model group was higher than that in normal group,while the VEGF expression level of serum,BALF and lung tissue in rapamycin group was lower than that in model group (P<0.05).Conclusion Rapamycin can improve the airway remodeling of COPD rats,which may be related to the intervention treatment of rapamycin on decreasing of VEGF level in airway remodeling of COPD rats and thus inhibiting angiogenesis in rats.
Pulmonary disease,chronic obstructive;Airway remodeling;Rapamycin;Vascular endothelial growth factor A
国家自然科学基金资助项目(81302934);浙江省博士后科研项目(BSH1402070)
310053 浙江省杭州市,浙江中医药大学第一临床医学院(童卫泉,杨宏宽,夏婷婷,刘贤忠);浙江省中医院 浙江中医药大学第一临床医学院呼吸生理研究室(陈彬,陈芳)
陈芳,310006 浙江省杭州市,浙江省中医院 浙江中医药大学第一临床医学院呼吸生理研究室;E-mail:funchen@163.com
R 563.9
A
10.3969/j.issn.1007-9572.2016.36.016
2016-04-25;
2016-10-26)
