阿司匹林抑制血小板源性生长因子BB引起的主动脉血管平滑肌细胞增殖和迁移研究
2016-12-14朱晋坤尹扬光黎姗姗邓梦扬
朱晋坤,毛 华,尹扬光,董 文,杜 峰,黎姗姗,邓梦扬
·论著·
阿司匹林抑制血小板源性生长因子BB引起的主动脉血管平滑肌细胞增殖和迁移研究
朱晋坤,毛 华,尹扬光,董 文,杜 峰,黎姗姗,邓梦扬
目的 探讨阿司匹林对由血小板源性生长因子BB(PDGF-BB)引起的主动脉血管平滑肌细胞增殖和迁移的影响及其机制。方法 2014年8月—2015年9月,选取人主动脉血管平滑肌细胞株(T/G HA-VSMC),分为对照组(不添加任何试剂)、PDGF-BB组(添加10 ng/ml PDGF-BB)、阿司匹林组(添加5 mmol/L阿司匹林)、PDGF-BB+阿司匹林组(添加10 ng/ml PDGF-BB和5 mmol/L阿司匹林),采用CCK-8法检测4组不同培养时间(0、24、48、72 h)T/G HA-VSMC增殖吸光度(OD值),Western blotting法检测p21waf1、p27kip1相对表达量,流式细胞仪检测细胞周期,细胞划痕实验检测细胞迁移率,Western blotting法检测基质金属蛋白酶1(MMP-1)相对表达量。结果 培养0 h时,4组T/G HA-VSMC增殖OD值比较,差异无统计学意义(P>0.05)。培养24、48、72 h时,PDGF-BB组T/G HA-VSMC增殖OD值较对照组升高,阿司匹林组T/G HA-VSMC增殖OD值较对照组降低(P<0.05);培养48、72 h时,PDGF-BB+阿司匹林组T/G HA-VSMC增殖OD值较对照组降低(P<0.05);培养24、48、72 h时,阿司匹林组和PDGF-BB+阿司匹林组T/G HA-VSMC增殖OD值较PDGF-BB组降低(P<0.05);培养24、48、72 h时,PDGF-BB+阿司匹林组T/G HA-VSMC增殖OD值较阿司匹林组升高(P<0.05)。PDGF-BB组培养24、48 h时p21waf1、p27kip1相对表达量较培养0 h时升高(P<0.05);培养72 h时p21waf1、p27kip1相对表达量较培养0、24、48 h时降低(P<0.05)。培养24 h时,PDGF-BB组p21waf1、p27kip1相对表达量较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低(P<0.05)。PDGF-BB组G0/G1期细胞所占比例较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低,S期细胞所占比例较对照组、阿司匹林组和PDGF-BB+阿司匹林组升高(P<0.05)。细胞划痕实验结果显示,培养24 h时,PDGF-BB组细胞迁移率较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低(P<0.05)。PDGF-BB组MMP-1相对表达量较对照组、阿司匹林组和PDGF-BB+阿司匹林组升高(P<0.05);阿司匹林组和PDGF-BB+阿司匹林组MMP-1相对表达量较对照组降低(P<0.05)。结论 阿司匹林通过上调p21waf1、p27kip1,下调MMP-1而抑制由PDGF-BB引起的主动脉血管平滑肌细胞的增殖和迁移。
阿司匹林;血小板源性生长因子;主动脉;肌细胞,平滑肌;细胞增殖;细胞运动
朱晋坤,毛华,尹扬光,等.阿司匹林抑制血小板源性生长因子BB引起的主动脉血管平滑肌细胞增殖和迁移研究[J].中国全科医学,2016,19(36):4467-4473.[www.chinagp.net]
ZHU J K,MAO H,YIN Y G,et al.Aspirin inhibition of PDGF-BB-induced proliferation and migration of vascular smooth muscle cells[J].Chinese General Practice,2016,19(36):4467-4473.
血小板源性生长因子(platelet derived growth factor,PDGF)最初在血清和血小板中被发现,能在体外诱导血管平滑肌细胞(VSMC)和成纤维细胞的分裂,因此被认为是一种分裂素[1-2]。PDGF有5种二聚体形式,分别为:PDGF-AA、PDGF-BB、PDGF-CC、PDGF-DD和PDGF-AB,其中PDGF-BB在促进细胞增殖、迁移以及血管外周细胞重建中起重要作用[3]。血管受到损伤后,血小板细胞被激活释放PDGF-BB,进而加速血管内皮细胞和VSMC增殖、迁移,达到加速血管重塑的目的。另一方面,有研究指出,PDGF-BB能加速VSMC增殖和迁移[4],而VSMC过度增殖是血管再狭窄的主要原因[5]。血管再狭窄是影响心血管手术效果及预后的重要因素,这就意味着抑制PDGF-BB诱导的VSMC过度增殖是提高心脑血管手术疗效的重要保证。阿司匹林能抑制损伤血管释放的细胞因子对血小板的激活作用[6],因此阿司匹林是防止血栓形成、预防经皮冠状动脉介入术(PCI)和经皮冠状动脉腔内血管成形术(PTCA)后靶血管再狭窄的常用药物。有研究证实,阿司匹林能抑制VSMC增殖及迁移[7-8]。本研究旨在利用外源性PDGF-BB研究PDGF-BB对体外人主动脉血管平滑肌细胞(T/G HA-VSMC)增殖和迁移的影响,同时观察PCI后常用药物阿司匹林对PDGF-BB引起的VSMC增殖和迁移的影响。
1 材料与方法
1.1 抗体与试剂 细胞周期蛋白抑制因子p21waf1(3733-1,1∶1 000)、p27kip1(1591-1,1∶1 000)抗体购自Epitomics 公司;基质金属蛋白酶1(matrix metalloproteinases,MMP-1)(BM 1270,1∶500)抗体购自武汉博士德生物工程有限公司;羊抗兔二抗-辣根过氧化物酶(HRP)由Epitomics公司赠送;八肽胆囊收缩素(CCK-8)购自日本株式会社同仁化学研究所;细胞周期检测试剂盒购自上海碧云天生物技术有限公司;人重组PDGF-BB(CYT-501)购自ProSpec公司;阿司匹林购自德国拜耳股份有限公司(药品批号BJ16177)。
1.2 细胞培养 2014年8月—2015年9月,T/G HA-VSMC购自中国科学院典型培养物保藏委员会细胞库,由本院实验室冻存。将T/G HA-VSMC接种于50 ml细胞培养瓶中,置于含10%胎牛血清(life technology,美国)、100 U/ml青霉素和100 μg/ml链霉素(hyclone,美国)的RPMI 1640完全培养基(life technology,美国)中,于37 ℃、5%CO2环境下培养,饱和湿度,贴壁生长。
1.3 CCK-8法检测T/G HA-VSMC增殖 将T/G HA-VSMC接种在96孔板中,4 000个/孔,每组4个复孔;在RPMI 1640完全培养基中培养约24 h后分为4组,对照组、PDGF-BB组、阿司匹林组、PDGF-BB+阿司匹林组,对照组不添加任何试剂、PDGF-BB组添加10 ng/ml PDGF-BB、阿司匹林组添加5 mmol/L阿司匹林、PDGF-BB+阿司匹林组添加10 ng/ml PDGF-BB和5 mmol/L阿司匹林,培养24 h后,CCK-8和培养液1∶10混合溶液加入到各孔中,100 μl/孔,37 ℃温育2~4 h,在酶标仪中490 nm处读取吸光度(OD值)。磷酸盐缓冲液(PBS)清洗3次后,换成新鲜RPMI 1640完全培养基继续培养。在48、72 h后重复以上实验。
1.4 Western blotting法检测p21waf1、p27kip1相对表达量 收集PDGF-BB组培养0、24、48、72 h时细胞,采用BCA蛋白浓度检测试剂盒和分光光度计测定p21waf1、p27kip1相对表达量,并加入上样缓冲液备用。将30 μg总蛋白于预先配制好的10%聚丙烯酰胺凝胶上样孔中进行分离,每个样本至少用2块平行胶进行分离。通过“三明治”湿法转印将已经分离好的蛋白转印于预先活化好的聚偏氟乙烯(PVDF)膜(merck-millipore,美国)上。转印完成后的PVDF膜用5%脱脂奶粉(Thermofisher,美国)封闭过夜。一抗(p21waf1、p27kip1抗体)室温孵育2~4 h,PBST洗涤3×15 min,二抗-HRP室温孵育1~2 h,PBST洗涤3×10 min后,显色观察,使用chemidoc XRS+影像系统(美国Bio-Rad公司)采集蛋白条带图像,测定相对光密度进行蛋白表达分析,通过校准β-actin作为内参进行内部控制。实验重复6次。PDGF-BB组培养24 h时p21waf1、p27kip1相对表达量明显升高,采用Western blotting法检测4组培养24 h时p21waf1、p27kip1相对表达量,方法同上,实验重复6次。
1.5 流式细胞仪检测细胞周期 将6×104个T/G HA-VSMC接种于6孔板,贴壁后分为对照组、PDGF-BB组、阿司匹林组、PDGF-BB+阿司匹林组,72 h后用胰酶消化收集细胞,PBS洗涤2次,弃上清液;加入1 ml 70%预冷乙醇,吹打均匀,4 ℃固定12 h以上。PBS洗涤去乙醇,0.5 ml PBS重悬细胞,加入碘化丙啶(PI)和核糖核酸酶A(RNaseA)至终浓度50 g/ml,37 ℃温浴30 min。流式细胞仪测定细胞周期。实验重复6次。
1.6 细胞划痕实验检测细胞迁移率 用标记笔在6孔板底部均匀划上3~4条横线,将适量T/G HA-VSMC〔(1~2)×105个/孔〕种植于6孔板内,分为对照组、PDGF-BB组、阿司匹林组、PDGF-BB+阿司匹林组,贴壁转染24 h或未转染48 h后蓝色无菌1 ml枪尖在6孔板内划线;PBS清洗,除去漂浮细胞后用低血清培养基,并加入1 nmol丝裂霉素C(sigma公司,美国)抑制细胞分裂。以横线为参照物,显微镜下观察照相,在横线上下取景,作为0 h图;24 h后观察细胞迁移情况,细胞迁移使用Image Pro Plus软件进行处理,细胞迁移率=边缘距离(0 h)-边缘距离(24 h)/边缘距离(0 h)。实验重复6次。
1.7 Western blotting法检测MMP-1相对表达量 收集对照组、PDGF-BB组、阿司匹林组、PDGF-BB+阿司匹林组贴壁转染24 h的细胞,采用BCA蛋白浓度检测试剂盒和分光光度计测定MMP-1相对表达量,并加入上样缓冲液备用。将30 μg总蛋白于预先配制好的10%聚丙烯酰胺凝胶上样孔中进行分离,每个样本至少用两块平行胶进行分离。通过“三明治”湿法转印将已经分离好的蛋白转印于预先活化好的PVDF膜上。转印完成后的PVDF膜用5%的脱脂奶粉封闭过夜。一抗(MMP-1抗体)室温孵育2~4 h,PBST洗涤3×15 min,二抗-HRP室温孵育1~2 h,PBST洗涤3×10 min后,显色观察,使用chemidoc XRS+影像系统采集蛋白条带图像,测定相对光密度进行蛋白表达分析,通过校准β-actin作为内参进行内部控制。实验重复6次。

2 结果
2.1CCK-8法检测T/GHA-VSMC增殖 培养0h时,4组T/GHA-VSMC增殖OD值比较,差异无统计学意义(P>0.05)。培养24、48、72h时,4组T/GHA-VSMC增殖OD值比较,差异均有统计学意义(P<0.05)。其中培养24、48、72h时,PDGF-BB组T/GHA-VSMC增殖OD值较对照组升高,阿司匹林组T/GHA-VSMC增殖OD值较对照组降低,差异均有统计学意义(P<0.05);培养48、72h时,PDGF-BB+阿司匹林组T/GHA-VSMC增殖OD值较对照组降低,差异均有统计学意义(P<0.05);培养24、48、72h时,阿司匹林组和PDGF-BB+阿司匹林组T/GHA-VSMC增殖OD值较PDGF-BB组降低,差异均有统计学意义(P<0.05);培养24、48、72h时,PDGF-BB+阿司匹林组T/GHA-VSMC增殖OD值较阿司匹林组升高,差异均有统计学意义(P<0.05,见表1)。
2.2Westernblotting法检测PDGF-BB组不同培养时间p21waf1、p27kip1相对表达量PDGF-BB组培养0、24、48、72h时p21waf1、p27kip1相对表达量比较,差异均有统计学意义(P<0.05);其中,培养24、48h时p21waf1、p27kip1相对表达量较培养0h时升高,差异均有统计学意义(P<0.05);培养72h时p21waf1、p27kip1相对表达量较培养0、24、48h时降低,差异均有统计学意义(P<0.05,见表2、图1)。
2.3Westernblotting法检测4组培养24h时p21waf1、p27kip1相对表达量 培养24h时,4组p21waf1、p27kip1相对表达量比较,差异均有统计学意义(P<0.05);其中,PDGF-BB组p21waf1、p27kip1相对表达量较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低,差异均有统计学意义(P<0.05,见表3、图2)。
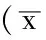
Table 1 Comparison of T/G HA-VSMC proliferation OD value among four groups in different culture time
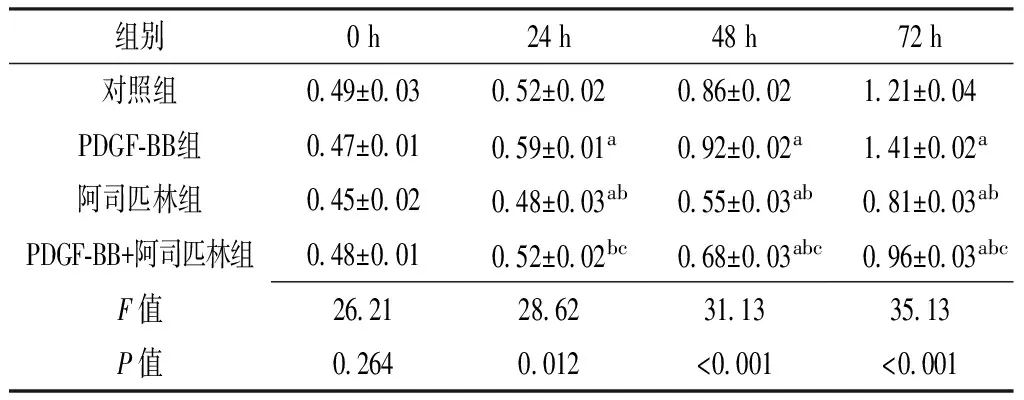
组别0h24h48h72h对照组049±003052±002086±002121±004PDGF⁃BB组047±001059±001a092±002a141±002a阿司匹林组045±002048±003ab055±003ab081±003abPDGF⁃BB+阿司匹林组048±001052±002bc068±003abc096±003abcF值2621286231133513P值02640012<0001<0001
注:PDGF-BB=血小板源性生长因子BB;与对照组比较,aP<0.05;与PDGF-BB组比较,bP<0.05;与阿司匹林组比较,cP<0.05
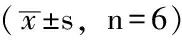
Table 2 Comparison of the relative expression of p21waf1and p27kip1at different cultivation times of PDGF-BB group

培养时间p21waf1p27kip10h034±003042±00224h052±005a058±005a48h056±007a051±003a72h013±006abc014±004abcF值761643P值00080012
注:与培养0 h时比较,aP<0.05;与培养24 h时比较,bP<0.05;与培养48 h时比较,cP<0.05
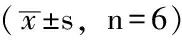
Table3Comparisonofrelativeexpressionofp21waf1andp27kip1aftercultivated24hamongfourgroups
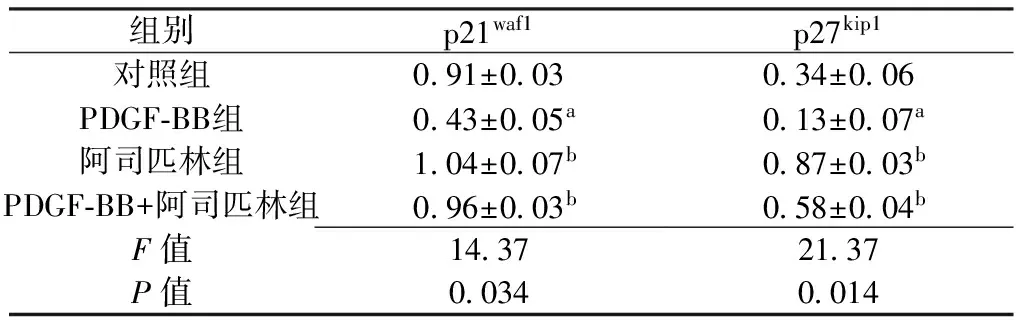
组别p21waf1p27kip1对照组091±003034±006PDGF⁃BB组043±005a013±007a阿司匹林组104±007b087±003bPDGF⁃BB+阿司匹林组096±003b058±004bF值14372137P值00340014
注:与对照组比较,aP<0.05;与PDGF-BB组比较,bP<0.05
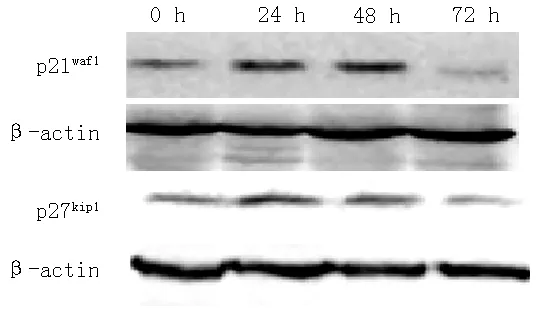
图1 Western blotting法检测PDGF-BB组不同培养时间p21waf1、p27kip1相对表达量
Figure 1 The relative expression of p21waf1and p27kip1detected by the Western blotting in PDGF-BB group

注:PDGF-BB=血小板源性生长因子BB
图2 Western blotting法检测4组培养24 h时p21waf1、p27kip1相对表达量
Figure 2 The relative expression of p21waf1and p27kip1after cultivated 24 h detected by the Western blotting in the four groups
2.4 流式细胞仪检测细胞周期 4组G2/M期细胞所占比例比较,差异无统计学意义(P>0.05);4组G0/G1、S期细胞所占比例比较,差异均有统计学意义(P<0.05)。其中PDGF-BB组G0/G1期细胞所占比例较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低,S期细胞所占比例较对照组、阿司匹林组和PDGF-BB+阿司匹林组升高,差异均有统计学意义(P<0.05,见表4、图3)。
2.5 细胞划痕实验检测细胞迁移率 细胞划痕实验结果显示,培养24 h时,4组细胞迁移率比较,差异有统计学意义(P<0.05)。其中,PDGF-BB组细胞迁移率较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低,差异均有统计学意义(P<0.05,见表5、图4)。
2.6 Western blotting法检测MMP-1相对表达量 4组MMP-1相对表达量比较,差异有统计学意义(P<0.05)。其中,PDGF-BB组MMP-1相对表达量较对照组、阿司匹林组和PDGF-BB+阿司匹林组升高,差异均有统计学意义(P<0.05);阿司匹林组和PDGF-BB+阿司匹林组MMP-1相对表达量较对照组降低,差异均有统计学意义(P<0.05,见表6、图5)。
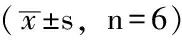
表4 4组细胞周期比较
注:与对照组比较,aP<0.05;与PDGF-BB组比较,bP<0.05
图3 流式细胞仪检测4组细胞周期
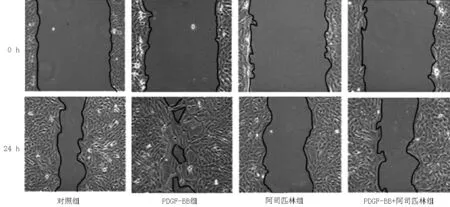
图4 细胞划痕实验检测4组细胞迁移

组别细胞迁移率对照组095±005PDGF⁃BB组017±007a阿司匹林组072±005bPDGF⁃BB+阿司匹林组076±004bF值1589P值0021
注:与对照组比较,aP<0.05;与PDGF-BB组比较,bP<0.05
Table6ComparisonoftherelativeexpressionofMMP-1amongthefourgroups

组别MMP⁃1相对表达量对照组043±005PDGF⁃BB组076±007a阿司匹林组009±003abPDGF⁃BB+阿司匹林组014±004abF值1045P值0001
注:MMP-1=基质金属蛋白酶1;与对照组比较,aP<0.05;与PDGF-BB组比较,bP<0.05
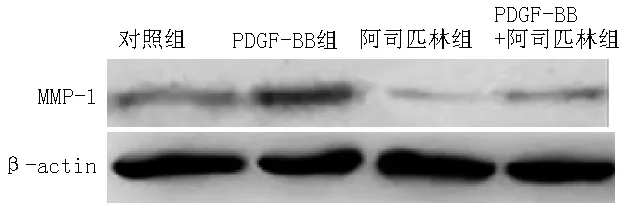
注:MMP-1=基质金属蛋白酶1
图5 Western blotting法检测4组MMP-1相对表达量
Figure 5 The relative expression of MMP-1 detected by Western blotting in the four groups
3 讨论
本研究首先利用CCK-8法检测PDGF-BB对T/G HA-VSMC增殖的影响,结果显示,培养0 h时,4组T/G HA-VSMC增殖OD值间无明显差异,培养24 h开始PDGF-BB组T/G HA-VSMC增殖OD值较对照组升高。利用Western blotting法检测周期蛋白抑制因子发现,PDGF-BB组p21waf1、p27kip1相对表达量在整个处理过程中呈现两个阶段:第一个阶段,培养24、48 h时,p21waf1、p27kip1相对表达量明显升高,培养72 h时p21waf1、p27kip1相对表达量明显降低。因此检测4组培养24 h时p21waf1、p27kip1相对表达量,显示PDGF-BB组p21waf1、p27kip1相对表达量较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低。随后利用流式细胞仪检测各组细胞周期变化,发现PDGF-BB组G0/G1期细胞所占比例较对照组、阿司匹林组和PDGF-BB+阿司匹林组降低,S期细胞所占比例较对照组、阿司匹林组和PDGF-BB+阿司匹林组升高。
p27是KIP家族成员,主要通过抑制周期蛋白D、周期蛋白E、周期蛋白A激酶相关的复合物来调控细胞周期进程[9]。p21waf1的最初报道是肿瘤抑制基因p53的下游因子,主要抑制周期蛋白激酶(CDK)[9]。p21waf1直接绑定在周期蛋白以及CDK复合物上,在G1末期抑制细胞进程[9]。p27kip1的功能和p21waf1相似,p21waf1和p27kip1的降低可释放二者绑定的细胞周期蛋白(cyclin)-E、cyclin-2复合物,释放的复合物能高度磷酸化成视网膜母细胞瘤蛋白(Rb蛋白),Rb蛋白启动细胞G1期向S期转化相关的基因转录[10]。许多研究证实,p21waf1和p27kip1在VSMC增殖和迁移中起着重要的作用[11-12];在球囊损伤实验动物模型中,p21waf1过表达能抑制VSMC的增殖,预防血管内壁增生[11-12]。本研究发现PDGF-BB处理72 h后的T/G HA-VSMC p21waf1和p27kip1相对表达量均有不同程度的降低;但短期的刺激(24~48 h)p21waf1和p27kip1相对表达量明显上调。前人研究对p21waf1和p27kip1的变化有不同的认定,有研究认为PDGF-BB处理后的VSMC p27kip1下调,但是p21waf1上调[13];同时也有研究认为PDGF-BB处理后的VSMC p21waf1和p27kip1均明显下调[7]。但这两项研究PDGF-BB刺激的时间不同,因此本研究发现PDGF-BB刺激的时间对p21waf1和p27kip1的表达有一定影响,长时间的刺激(>48 h)会上调p21waf1和p27kip1,但短时间的刺激能明显下调p21waf1和p27kip1。在24 h前空白对照组和PDGF-BB组的增殖速度无明显差异,24~72 h后PDGF-BB组的增殖速度明显快于空白对照组。流式细胞仪检测细胞周期发现PDGF-BB组的S期细胞所占比例较对照组增加而G0/G1期细胞所占比例较对照组降低。
高浓度水杨酸盐(>1 mmol/L)和多聚胶原通过诱导p21waf1和p27kip1表达抑制VSMC的增殖[7],同时,阿司匹林也能阻抑VSMC于G0/G1期而抑制细胞的增殖[14]。本研究发现5 mmol/L的阿司匹林能明显抑制由PDGF-BB引起的细胞增殖,阿司匹林能诱导p21waf1和p27kip1的表达,逆转由PDGF-BB引起的p21waf1和p27kip1的下调。流式细胞仪检测发现阿司匹林组G0/G1期细胞所占比例较对照组增加了0.13。
金属基质蛋白酶(MMPs)是一组同源的Zn2+依赖的肽链内切酶,目前为止已经发现18个不同的亚型。在细胞的迁移过程中细胞必须与相邻的细胞和周围的基质细胞分离,而分离的整个过程中MMPs起着不可替代的作用[15]。MMPs可以降解胶原,层粘连蛋白、蛋白多糖等帮助迁移的细胞从周围环境中分离出来。有研究指出PDGF-BB能通过上调MMPs促进VSMC的迁移[16-18]。其中MMP-1主要降解Ⅰ、Ⅱ、Ⅲ型胶原,研究表明MMP-1在多种肿瘤的侵袭和转移中起了重要的作用[19-20]。本研究发现PDGF-BB能通过上调MMP-1促进T/G HA-VSMC的增殖和迁移。阿司匹林能明显抑制MMP-1的表达,并拮抗由PDGF-BB诱导的T/G HA-VSMC的迁移。
PCI和PTCA后防止VSMC过度增殖,是手术成功的关键。前文提到,血管受损后血小板释放的PDGF-BB能诱导T/G HA-VSMC的增殖和迁移[16-18]。本研究从体外角度观察了PDGF-BB对T/G HA-VSMC的增殖和迁移的作用,并深入研究了PDGF-BB诱导T/G HA-VSMC增殖和迁移的机制。同时还发现了阿司匹林对PDGF -BB诱导的T/G HA-VSMC增殖和迁移的抑制作用。从研究结果来看,利用阿司匹林对周期蛋白抑制因子的上调,以及对MMP-1的表达抑制作用来治疗VSMC过度增殖,防止血管内壁增厚有着重要的意义。同理,本研究能对在已知机制的作用下开发新生药物,更好地治疗血管狭窄有一定的指导作用。
作者贡献:朱晋坤、毛华进行实验设计与实施、资料收集整理、撰写论文并对文章负责;朱晋坤、尹扬光、董文、杜峰、黎姗姗进行实验实施、评估、资料收集;毛华、邓梦扬进行质量控制及审校。
本文无利益冲突。
[1]VAN DIJK F,OLINGA P,POELSTRA K,et al. Targeted therapies in liver fibrosis:combining the best parts of platelet-derived growth factor BB and interferon gamma [J]. Front Med (Lausanne),2015,5(2):72.
[2]GIANNI-BARRERA R,BARTOLOMEO M,VOLLMAR B,et al. Split for the cure:VEGF,PDGF-BBand intussusception in therapeutic angiogenesis [J]. Biochem Soc Trans,2014,42(6):1637-1642.
[3]WANG H,YIN Y,LI W,et al.Over-expression of PDGFR-beta promotes PDGF-induced proliferation,migration,and angiogenesis of EPCs through PI3K/Akt signaling pathway[J]. PLoS One,2012,7(2):e30503.
[4]ITO I,FIXMAN E D,ASAI K,et al.Platelet-derived growth factor and transforming growth factor-beta modulate the expression of matrix metalloproteinases and migratory function of human airway smooth muscle cells[J]. Clin Exp Allergy,2009,39(9):1370-1380.
[5]DORAN A C,MELLER N,MCNAMARA C A.Role of smooth muscle cells in the initiation and early progression of atherosclerosis[J]. Arterioscler Thromb Vasc Biol,2008,28(5):812-819.
[6]PATRONO C.Aspirin as an antiplatelet drug[J]. N Engl J Med,1994,330(18):1287-1294.
[7]MARRA D E,SIMONCINI T,LIAO J K.Inhibition of vascular smooth muscle cell proliferation by sodium salicylate mediated by upregulation of p21(Waf1) and p27(Kip1)[J]. Circulation,2000,102(17):2124-2130.
[8]COOKE N M,SPILLANE C D,SHEILS O,et al. Aspirin and P2Y12 inhibition attenuate platelet-induced ovarian cancer cell invasion [J].BMC Cancer,2015,9:627.
[9]聂伟,周洪伟,易永芬,等. Skp2、c-Myc和p27kip1蛋白在大肠癌组织中的表达及相关性研究[J].重庆医科大学学报,2006,31(4):556-560. NIE W,ZHOU H W,YI Y F,et al. Expression of Skp2,c-Myc and p27kip1protein in colorectal cancer tissue and their correlation[J]. Journal of Chongqing Medical University,2006,31(4):556-560.
[10]HARPER J W,ADAMI G R,WEI N,et al.The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases[J].Cell,1993,75(4):805-816.
[11]WOODS T C.Dysregulation of the mammalian target of rapamycin and p27kip1promotes intimal hyperplasia in diabetes mellitus[J]. Pharmaceuticals(Basel),2013,6(6):716-727.
[12]BORIN T F,MIYAKAWA A A,CARDOSO L,et al.Apoptosis,cell proliferation and modulation of cyclin-dependent kinase inhibitor p21(cip1) in vascular remodelling during vein arterialization in the rat[J]. Int J Exp Pathol,2009,90(3):328-337.
[13]BESSON A,GURIAN-WEST M,SCHMIDT A,et al.p27kip1modulates cell migration through the regulation of RhoA activation[J]. Genes Dev,2004,18(8):862-876.
[14]ZHAN Y,KIM S,IZUMI Y,et al.Role of JNK,p38,and ERK in platelet-derived growth factor-induced vascular proliferation,migration,and gene expression[J]. Arterioscler Thromb Vasc Biol,2003,23(5):795-801.
[15]BROOKS G,YU X M,WANG Y,et al.Non-steroidal anti-inflammatory drugs (NSAIDs) inhibit vascular smooth muscle cell proliferation via differential effects on the cell cycle[J]. J Pharm Pharmacol,2003,55(4):519-526.
[16]YODKEEREE S,WONGSIRISIN P,POMPIMON W,et al.Anti-invasion effect of crebanine and O-methylbulbocapnine from Stephania venosa via down-regulated matrix metalloproteinases and urokinase plasminogen activator[J]. Chem Pharm Bull (Tokyo),2013,61(11):1156-1165.
[17]GUO J,LI L,WU Y J,et al.Inhibitory effects of Brazilin on the vascular smooth muscle cell proliferation and migration induced by PDGF-BB[J]. Am J Chin Med,2013,41(6):1283-1296.
[18]SEO K W,LEE S J,KIM Y H,et al.Mechanical stretch increases MMP-2 production in vascular smooth muscle cells via activation of PDGFR-beta/Akt signaling pathway[J]. PLoS One,2013,8(8):e70437.
[19]PARK E S,LEE K P,JUNG S H,et al.Compound K,an intestinal metabolite of ginsenosides,inhibits PDGF-BB-induced VSMC proliferation and migration through G1 arrest and attenuates neointimal hyperplasia after arterial injury[J]. Atherosclerosis,2013,228(1):53-60.
[20]KALLAKURY B V,KARIKEHALLI S,HAHOLU A,et al.Increased expression of matrix metalloproteinases 2 and 9 and tissue inhibitors of metalloproteinases 1 and 2 correlate with poor prognostic variables in renal cell carcinoma[J]. Clin Cancer Res,2001,7(10):3113-3119.
(本文编辑:陈素芳)
Aspirin Inhibition of PDGF-BB-induced Proliferation and Migration of Vascular Smooth Muscle Cells
ZHU Jin-kun,MAO Hua,YIN Yang-guang,DONG Wen,DU Feng,LI Shan-shan,DENG Meng-yang.
Department of Cardiovascular Medicine,the First People′s Hospital of Guiyang,Guiyang 550002,China
ZHU Jin-kun,Department of Cardiovascular Medicine,the First People′s Hospital of Guiyang,Guiyang 550002,China;E-mail:zjk369@sohu.com
Objective To explore the influence and mechanism of aspirin on proliferation and migration of aortic vascular smooth muscle cells caused by platelet-derived growth factor BB(PDGF-BB). Methods From August 2014 to September 2015,aortic vascular smooth muscle cell strains (T/G HA-VSMC) were selected and divided into four groups:control group (no other reagent),PDGF-BB group (with 10 ng/ml PDGF-BB),aspirin group (with 5 mmol/L aspirin),and PDGF-BB+aspirin group (with 10 ng/ml PDGF-BB and 5 mmol/L aspirin). OD value of T/G HA-VSMC proliferation at different cultivation times (0,24,48,and 72 h) was tested by CCK-8 method,and relative expression quantity of p21waf1and p27kip1was tested by Western blotting. Cell cycles were tested by flow cytometry,and cell migration was tested by wound-healing assay. Relative expression quantity of matrix metalloproteinase 1 (MMP-1) in four groups was tested by Western blotting. Results When cultivated at 0 h,differences of OD value of T/G HA-VSMC proliferation in four groups showed no statistical significance (P>0.05). When cultivated at 24,48,and 72 h,OD value of T/G HA-VSMC proliferation in PDGF-BB group was higher than that in control group(P<0.05). In aspirin group,OD value of T/G HA-VSMC proliferation was lower than that in control group (P<0.05);when cultivated at 48 and 72 h,OD value of T/G HA-VSMC proliferation in PDGF-BB+aspirin group was lower than that in control group (P<0.05);when cultivated at 24,48,and 72 h,OD value of T/G HA-VSMC proliferation in aspirin group and PDGF-BB+aspirin group was lower than that in PDGF-BB group (P<0.05);when cultivated at 24,48,and 72 h,OD value of T/G HA-VSMC proliferation in PDGF-BB+aspirin group was higher than that in aspirin group (P<0.05). Relative expression quantities of p21waf1and p27kip1in PDGF-BB group at 24 and 48 h were higher than those at 0 h (P<0.05);when cultivated at 72 h,relative expression quantities of p21waf1and p27kip1were lower than those at 0,24,and 48 h (P<0.05). When cultivated at 24 h,relative expression quantities of p21waf1and p27kip1in PDGF-BB group were lower than those in other three groups (P<0.05). G0/G1ratio of PDGF-BB group was lower than that in control group,aspirin group,and PDGF-BB+aspirin group,while ratio of S period was higher than that in other three groups (P<0.05). Wound-healing assay showed that,when cultivated at 24 h,cell migration rate in PDGF-BB group was lower than that in other three groups (P<0.05). MMP-1relative expression quantity in PDGF-BB group was higher than that in other three groups (P<0.05);MMP-1relative expression quantitiy in aspirin group and PDGF-BB+aspirin group was lower than that in control group (P<0.05). Conclusion Aspirin inhibits proliferation and migration of aortic vascular smooth muscle cells caused by PDGF-BB via increasing p21waf1and p27kip1and reducing MMP-1 expression.
Aspirin;Platelet-derived growth factor;Aorta;Myocytes,smooth muscle;Cell proliferation;Cell movement
贵州省科技厅社会发展资助项目(黔科合SY[2010]3087号)
550002贵州省贵阳市第一人民医院心血管内科(朱晋坤,毛华,董文,杜峰,黎姗姗);第三军医大学附属新桥医院心血管内科(尹扬光,邓梦扬)
朱晋坤,550002贵州省贵阳市第一人民医院心血管内科;E-mail:zjk369@sohu.com
R 329.28
A
10.3969/j.issn.1007-9572.2016.36.013
2016-06-06;
2016-10-05)
