小鼠急性肺损伤后肺内CFTR和ENaC的表达变化
2016-12-14蒋进军
蒋进军, 高 磊
复旦大学附属中山医院呼吸科, 上海 200032
·论 著·
小鼠急性肺损伤后肺内CFTR和ENaC的表达变化
蒋进军, 高 磊
复旦大学附属中山医院呼吸科, 上海 200032
目的: 探讨囊性纤维化跨膜调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)氯离子通道和上皮细胞钠通道(epithelial sodium channel,ENaC)蛋白在内毒素诱发急性肺损伤小鼠肺内的表达变化。方法: 将内毒素经小鼠气管注入肺内后诱发急性肺损伤,24 h、48 h、72 h后取肺组织,检测其CFTR和ENaC的mRNA浓度变化、肺泡液体清除率、湿干重比。结果: 小鼠急性肺损伤后24 h、48 h、72 h,CFTR在肺内的表达均降低(P<0.05)。小鼠急性肺损伤后24 h、48 h、72 h,α-ENaC在肺内表达均降低(P<0.05);β-ENaC、γ-ENaC在急性肺损伤后24 h、48 h表达降低(P<0.05),而在急性肺损伤后72 h恢复正常。小鼠急性肺损伤后24 h、48 h、72 h,肺泡液体清除率和肺湿干重比出现类似的改变。结论: 内毒素诱发的小鼠急性肺损伤组织中,CFTR和ENaC的表达均下降,肺泡液体清除率与其一致,肺湿干重的变化与其相反。
急性肺损伤; 囊性纤维化跨膜调节因子; 上皮细胞钠通道; 内毒素; 肺泡液体清除率
生理状态下肺泡上皮细胞具有主动吸收肺泡内液体的功能,从而保持肺泡腔内干燥。急性肺损伤时,肺泡上皮细胞主动吸收液体能力下降,导致肺水肿持续存在。我们以往的研究提示,小鼠肺泡内液体吸收主要是通过肺泡Ⅰ型上皮细胞钠通道(epithelial sodium channel,ENaC)主动吸收肺泡腔内的钠离子实现的[1]。囊性纤维化跨膜调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)是一种氯离子通道,其通过调节上述钠离子通道的离子转运来影响跨肺泡上皮的液体吸收和清除过程[2]。急性肺损伤时,肺泡液体清除功能受到抑制,主要原因可能是肺泡上皮细胞膜上这两种离子通道功能受到抑制。因此,在急性肺损伤肺泡上皮清除水肿时,ENaC和CFTR是重要的离子通道。本研究通过内毒素诱发的小鼠急性肺损伤模型,研究其肺损伤组织中ENaC和CFTR mRNA的表达变化。
1 材料和方法
1.1 实验动物 清洁级昆明小鼠,6~8周龄,(23±2) g,由复旦大学上海医学院动物实验中心提供并协助饲养。
1.2 动物模型的建立 实验小鼠于固定容器内给予吸入异氟烷麻醉,然后将其仰卧位固定于小鼠操作平台,常规消毒切开皮肤,逐层钝性分离直至暴露气管,在吸气相用1 mL注射器将脂多糖(lipopolysaccharide,LPS,Sigma公司)经小鼠气管快速注入肺内(2 mg/mL ,50 μL),注射完后立即将小鼠翻转直立1 min,缝合切口。气管内注射LPS后 24 h、48 h、72 h,将小鼠麻醉处死,取肺组织。另选择正常小鼠作为对照组。每组纳入5只小鼠。通过苏木精-伊红(H-E)染色切片确认急性肺损伤小鼠模型建立。
1.3 ENaC和CFTR mRNA表达的分析 小鼠肺组织匀浆后,抽提总RNA,采用分光光度仪(721型,上海精科仪器有限公司)分别在260 和280 nm波长处测定其光密度(D),根据公式计算总RNA浓度及总量。
取总RNA进行RT-PCR, CFTR和ENaC的PCR引物由上海生工生物工程有限公司合成,引物设计见表1。取1 μL反转录产物(cDNA)进行PCR(Perkin Elmer GeneAmp PCR system 2400),建立PCR反应体系(表2)。每个样本取10 μL PCR产物进行电泳分析,获取电泳图,测得条带的量化值,计算与相应看家基因条带的相对比值,以此进行分析。每个数据取标本扩增3次的平均值。

表1 ENaC、CFTR和GAPDH引物设计

表2 RT-PCR反应体系
1.4 肺泡液体清除率(alveolar fluid clearance,AFC)的测定 AFC的测定方法参照既往文献[1]。麻醉处死小鼠后,置于恒温37℃的操作台,迅速气管切开插管,在30 s内将10 mL/kg肺灌注溶液缓慢注入肺内,导管末端连接纯氧装置,并通过PEEP阀全程予以5 cm H2O的气道内正压。将灌注液注入小鼠气管内30 min后,通过气管导管抽取液体50 μL,测量同位素浓度,根据下列公式计算AFC:
AFC=(Vi-Vf)/Vi×100
Vf=(Vi×TPi)/TPf
其中,TPi为注入气管内液体的初始蛋白浓度,TPf为实验结束时气管内收集液体的蛋白浓度。
1.5 肺湿干重比 急性肺损伤后24 h、48 h、72 h,取小鼠肺,获取的质量为湿重;随后放入60℃烘箱内3~5 d,质量不变后获取的质量即为干重。湿重除以干重的值即为肺湿干重比。

2 结 果
2.1 小鼠急性肺损伤后ENaC的α、β、γ亚型mRNA水平变化
2.1.1 α亚型(α-ENaC) 急性肺损伤后24 h、48 h、72 h,小鼠肺内α-ENaC mRNA浓度均降低(P<0.05),其中损伤后72 h降低最明显(图1)。
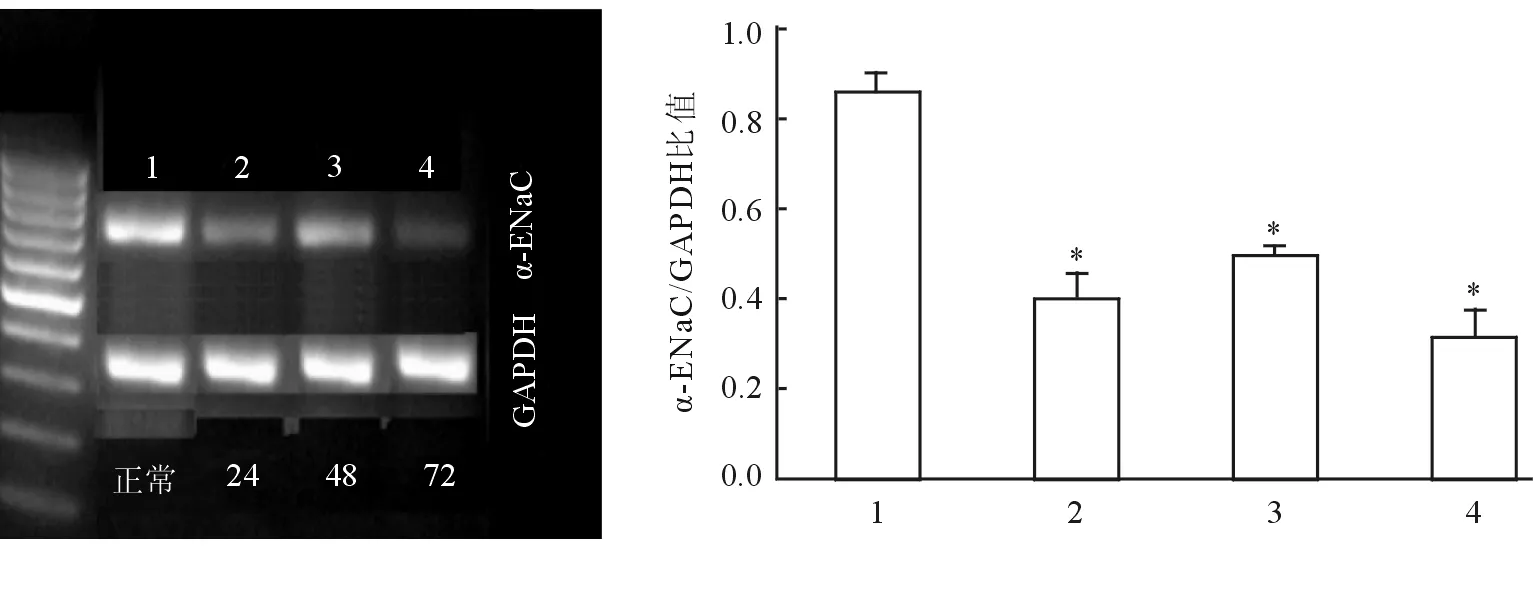
图1 急性肺损伤后肺内ENaC的α亚型(α-ENaC)浓度的变化
2.1.2 β亚型(β-ENaC) 急性肺损伤后24 h、48 h,β-ENaC mRNA浓度明显降低(P<0.05);急性肺损伤后72 h恢复正常水平,但差异无统计学意义(图2)。
2.1.3 γ亚型(γ-ENaC) 急性肺损伤后24 h、48 h,γ-ENaCmRNA浓度明显降低(P<0.05);急性肺损伤后72 h恢复正常,但差异无统计学意义(图3)。
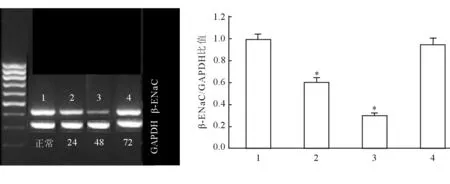
图2 急性肺损伤后肺内ENaC的β亚型(β-ENaC)浓度的变化
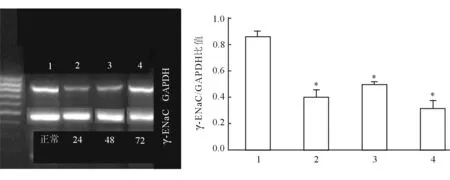
图3 急性肺损伤后肺内ENaC的γ亚型(γ-ENaC)浓度的变化
2.2 小鼠急性肺损伤后CFTR mRNA表达 急性肺损伤后,CFTR的表达较正常水平明显降低,24 h最低,48 h、72 h略有回升,但仍比正常水平低(P<0.05,图4)。这提示,急性肺损伤小鼠模型中,肺内CFTR表达被抑制。
2.3 急性肺损伤后AFC和肺湿干重比的变化 急性肺损伤后24 h,肺湿干重比由正常时的4增加到5.1(P<0.05),同时AFC由12.5%降至9.85%(P<0.05);急性肺损伤后48 h,肺湿干重比升至6.6(P<0.05),同时AFC降至最低点7.5%(P<0.05);急性肺损伤后72 h,肺湿干重比下降到5.5,但是仍较正常值高(P<0.05),同时AFC上升至10.9%(P<0.05)。这说明小鼠LPS诱发急性肺损伤后48 h,肺损伤最为严重。
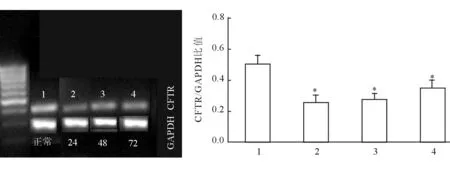
图4 急性肺损伤后肺内CFTR mRNA浓度的变化

图5 急性肺损伤后AFC和肺湿干重比的变化
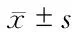
3 讨 论
新生儿出生前,肺泡内充满羊水,而出生后数分钟内肺泡上皮能迅速清除肺泡内的所有液体,使肺泡内充满气体,新生儿即可呼吸。肺泡上皮细胞通过主动吸收肺泡腔内的钠离子和氯离子而实现肺泡液体清除的功能。
研究[3]表明,哺乳动物的各级支气管和肺泡上皮细胞膜上ENaC的3个亚型均表达;气管支气管黏膜下腺体上也有少量ENaC表达。如果将ENaC的1个亚型基因敲除,小鼠出生后会很快死于急性呼吸衰竭,原因是:肺泡上皮ENaC功能不全,小鼠在出生时肺泡上皮细胞不能将肺泡腔内的液体完全清除,从而形成肺水肿,导致氧弥散障碍[4]。因此,ENaC在肺泡液体清除中起非常重要的作用。ENaC调节剂可以促进或抑制AFC,在正常小鼠模型中,ENaC抑制剂氨氯吡脒能明显降低AFC,激动剂特布他林则能增加AFC;而在急性肺损伤模型中,特布他林促进肺泡液体吸收[5]。
由于ENaC和CFTR的特异性抗体纯度均不佳,因此很难直接检测上皮钠通道ENaC和氯离子通道蛋白CFTR在气道和肺组织内的表达。因此,本研究通过检测其mRNA浓度来间接反映蛋白的表达情况。本研究显示,小鼠急性肺损伤后24 h、48 h,肺内ENaC的α、β、γ亚型的mRNA表达显著下降,同时AFC降低;急性肺损伤后72 h,β、γ亚型的表达基本恢复正常,AFC也基本接近正常。这说明肺内ENaC的表达变化与AFC的变化趋势基本一致。研究[1-2,6]提示,急性肺损伤时小鼠AFC的下降原因之一是肺泡上皮正常结构破坏,导致正常肺泡上皮细胞数量明显减少;或者肺泡上皮细胞ENaC的mRNA产生下降,导致ENaC蛋白表达降低,使肺泡上皮钠通道缺乏,从而引起液体清除功能下降。
在整个气道上皮和肺泡上皮细胞膜上均有CFTR表达[7]。而我们之前的研究[1]也显示,cAMP依赖性肺泡上皮液体转运必须依靠CFTR通道,CFTR在肺泡液体吸收中有一定作用。本实验结果表明,LPS诱发小鼠急性肺损伤后,CFTR的mRNA表达显著降低,提示CFTR蛋白在肺上皮细胞膜的表达可能随之减少,从而对急性肺损伤应激导致的cAMP刺激性的液体吸收的增加起抑制作用;而且CFTR的表达变化与AFC的变化趋势较一致,说明急性肺损伤时肺上皮细胞CFTR表达减少可能是AFC降低的原因之一。
目前,还少有研究报道小鼠急性肺损伤时,ENaC和CFTR mRNA在肺内的表达变化。急性肺损伤(依据柏林定义,将其称为急性呼吸窘迫综合征[8])时,患者AFC越低,则相应的生存率也就越低[3,9-10]。如果通过相应的药物来增加急性肺损伤时肺内ENaC和CFTR的表达,就可以增加这些离子通道的数量,最终提高AFC,改善急性肺损伤患者的预后。既往研究[11-12]表明,糖皮质激素、角化细胞生长因子等可以增加ENaC和CFTR在大鼠肺内的表达,从而增加急性肺损伤时的AFC。
综上所述,本研究发现,在内毒素诱发的小鼠急性肺损伤模型中,ENaC 3种亚型和CFTR mRNA损伤后短期内(24~48 h)在肺内的表达水平都明显降低,与AFC和肺湿干重的变化基本同步。因此认为,急性肺损伤时肺内离子通道蛋白的表达下降可能导致AFC的下降,这是治疗急性肺损伤的一个潜在靶点。
[ 1 ] Jiang J, Song Y, Bai C, et al. Pleural surface fluorescence measurement of Na+and Cl-transport across the air space-capillary barrier [J]. J Appl Physiol(1985), 2003,94(1):343-352.
[ 2 ] Jin W, Song Y, Bai C, et al. Novel role for cystic fibrosis transmembrane conductance regulator in alveolar fluid clearance in lipopolysaccharide-induced acute lung injury in mice[J]. Respirology, 2013,18(6):978-982.
[ 3 ] Rochelle LG, Li DC, Ye H, et al. Distribution of ion transport mRNAs throughout murine nose and lung[J]. Am J Physiol Lung Cell Mol Physiol, 2000,279(1):L14-L24.
[ 4 ] Hummler E, Barker P, Gatzy J, et al. Early death due to defective neonatal lung liquid clearance in alpha-ENaC-deficient mice[J]. Nat Genet,1996,12(3):325-328.
[ 5 ] Crandall ED, Matthay MA. Alveolar epithelial transport. Basic science to clinical medicine[J]. Am J Respir Crit Care Med, 2001,163(4):1021-1029.
[ 6 ] Deng W, Li CY, Tong J, et al. Regulation of ENaC-mediated alveolar fluid clearance by insulinviaPI3K/Akt pathway in LPS-induced acute lung injury[J]. Respir Res,2012,13:29.
[ 7 ] Nordin SL, Jovic S, Kurut A, et al. High expression of midkine in the airways of patients with cystic fibrosis[J]. Am J Respir Cell Mol Biol, 2013,49(6):935-942.
[ 8 ] ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012,307(23):2526-2533.
[ 9 ] Zhao RZ, Nie HG, Su XF, et al. Characterization of a novel splice variant of δ ENaC subunit in human lungs[J]. Am J Physiol Lung Cell Mol Physiol,2012,302(12):L1262-L1272.
[10] Zeyed YF, Bastarache JA, Matthay MA, et al. The severity of shock is associated with impaired rates of net alveolar fluid clearance in clinical acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2012,303(6):L550-L555.
[11] Schmidt C, Klammt J, Thome UH, et al. The interaction of glucocorticoids and progesterone distinctively affects epithelial sodium transport[J]. Lung,2014,192(6):935-946.
[12] Watt GB, Ismail NA, Caballero AG, et al. Epithelial Na+channel activity in human airway epithelial cells: the role of serum and glucocorticoid-inducible kinase 1[J]. Br J Pharmacol,2012,166(4):1272-1289.
[本文编辑] 姬静芳
Changes of expression of CFTR and ENaC in lung of mice after acute lung injury
JIANG Jin-jun, GAO Lei
Department of Respiratory Medicine, Zhongshan Hospital,Fudan University, Shanghai 200032, China
Objective: To investigate the changes in the expression of cystic fibrosis transmembrane conductance regulator (CFTR) chloride channel and epithelial sodium channel (ENaC) protein in lung of mice with acute lung injury induced by endotoxin. Methods: Lipopolysaccharide (LPS) was instilled into the tracheas of the mice to induce acute lung injury. After 24 h, 48 h and 72 h, the lung tissue was taken to detect the changes in the mRNA levels of ENaC and CFTR, alveolar fluid clearance (AFC) and wet/dry ratio. Results: 24 h, 48 h, and 72 h after acute lung injury in mice, the expression of CFTR all decreased in the lung (P<0.05). 24 h, 48 h, and 72 h after acute lung injury in mice, the expression of α-ENaC all decreased in the lung (P<0.05). 24 h and 48 h after acute lung injury in mice, the expression of β-ENaC and γ-ENaC both decreased in the lung (P<0.05), but at 72 h, the level returned to normal. 24 h, 48 h, and 72 h after acute lung injury in mice, the same change occurred in alveolar fluid clearance, but the lung wet/dry ratio increased. Conclusions: In endotoxin-induced acute lung injury in mice, the expression of CFTR and ENaC both decreased, alveolar fluid clearance also decreased but the wet/dry ratio increased.
acute lung injury; cystic fibrosis transmembrane conductance regulator;epithelial sodium channel; endotoxin; alveolar fluid clearance
2016-06-12 [接受日期] 2016-10-16
上海市科学技术委员会重点项目(15DZ1930602), 上海市卫生局应用研究项目(20134056).Supported by Shanghai Municipal Science and Technology Commission Program(15DZ1930602),and Shanghai Municipal Public Health Bureau Program(20134056).
蒋进军, 博士,副主任医师. E-mail:jiang.jinjun@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2016.20160520
R 73-76+2
A
