成体小鼠心脏Sca-1+细胞体外分化潜能的实验研究
2016-12-14张海波周春霞
王 浩, 陈 浩, 张海波, 周春霞
上海交通大学医学院附属上海儿童医学中心心脏外科,上海 200127
·论 著·
成体小鼠心脏Sca-1+细胞体外分化潜能的实验研究
王 浩, 陈 浩, 张海波, 周春霞*
上海交通大学医学院附属上海儿童医学中心心脏外科,上海 200127
目的: 研究成体小鼠心脏Sca-1+细胞体外诱导分化的潜能。方法: 利用免疫磁珠分选法分离成体小鼠心脏Sca-1+细胞,通过BMP-2/FGF-4,TGF-β1及VEGF165等三种不同的体外诱导方法使其向心脏“三系”分化,并从细胞形态的变化、RT-PCR和免疫荧光染色等方面鉴定其分化潜能。结果: 经BMP-2/FGF-4诱导,小鼠心脏Sca-1+细胞发生形态改变,上调心肌细胞特征基因α-MHC、β-MHC、MLC-2a和MLC-2v的mRNA表达,同时表达心肌特征性蛋白cTNT和cMHC。经TGF-β1诱导,小鼠心脏Sca-1+细胞亦发生形态改变,上调平滑肌特征基因α-SMA和Calponin的mRNA表达,同时表达平滑肌特征性蛋白SMA、sMHC和Calponin的表达。经VEGF165诱导,小鼠心脏Sca-1+细胞同样发生了形态改变,上调内皮细胞特征基因CD31、vWF和VE-Cadherin的mRNA表达,同时表达内皮细胞特征性抗原CD31。结论: 成体小鼠心脏Sca-1+细胞在体外多种因素的分别作用下,能向心肌样细胞、平滑肌样细胞和内皮样细胞分化,具有心脏干细胞特性的多向分化潜能。
Sca-1;心脏;干细胞;诱导分化
成体心脏干细胞(cardiac stem cells,CSCs)或心肌前体细胞(cardiomyocytes progenitor cells,CMPCs)的发现,拉开了人类心脏组织再生或修复的新序幕。利用自体或同种异体CSCs来修复缺血坏死心肌组织成为近年来研究的热点[1-3],也无疑为先天性心脏病患儿构建所需的组织工程心脏补片提供良好的种子细胞[4]。研究发现,作为CSCs家族的重要成员, Sca-1+CSCs是成体心脏组织中居于优势地位的干细胞,其含量是c-kit+CSCs的100~700倍[5-6]。然另有文献表明,心脏组织中的Sca-1+细胞多数是内皮细胞[7],而非CSCs。前期研究中,我们通过免疫磁珠分选法从小鼠心脏组织中成功分离出较高纯度的Sca-1+细胞[8],然而,该群Sca-1+细胞是否就是真正意义上的CSCs或CMPCs呢?我们将通过系列体外诱导分化的实验来探讨其分化潜能,从而判定其细胞学特性,为后期组织工程心脏补片的研究提供理论和实践基础。
1 材料与方法
1.1 一般材料
1.1.1 实验动物 SPF级野生型ICR小鼠,3~4周龄,由上海斯莱克实验动物有限责任公司提供。
1.1.2 仪器与试剂 MiniMACS磁珠分选器(Miltenyi Biotech),MiniMACS磁珠分选柱(Miltenyi Biotech),荧光倒置显微镜(Leica),PCR仪(BioRad)。小鼠抗Sca-1-FITC 单克隆磁珠抗体(Miltenyi Biotech);重组人骨形态发生蛋白-2(BMP2),重组人成纤维细胞生长因子-4(FGF4),重组人转化生长因子-β1(TGF-β1),重组小鼠血管内皮细胞生长因子-165(VEGF165)均购自PeproTech;小鼠抗心肌MHC单克隆一抗,兔抗小鼠平滑肌MHC多克隆一抗,兔抗小鼠Calponin-1单克隆一抗均购自Abcam;大鼠抗小鼠CD31-生物素,链霉亲和素-PE购自eBioscience;山羊抗小鼠心肌Troponin T多克隆一抗(Santa Cruz);兔抗小鼠平滑肌α-Actin单克隆一抗(Epitomics);TRIzol(Invitrogen);PrimeScript RT reagent Kit,TaKaRaTaq试剂盒购自TaKaRa。
1.2 实验方法
1.2.1 小鼠心脏Sca-1+细胞的分离提取和原代培养 利用胶原酶A消化小鼠心脏组织成单细胞悬液,再用免疫磁珠分选法筛选提取其中的Sca-1+细胞,按1×104/cm2将Sca-1+细胞接种于0.1%明胶包被的24孔培养板,加入生长培养液[9],37℃、5%CO2中静置培养3 d。此后每3 d换培养液一次,待细胞生长至80%~90%汇合时消化传代。
1.2.2 小鼠心脏Sca-1+细胞体外诱导分化 经传代扩增的P4代Sca-1+细胞按1×104/cm2接种于6孔培养板中,37℃,5% CO2中静置培养,达70%~80%融合时开始诱导分化。
向心肌样细胞分化:弃原培养液,加入BMP2/FGF4(浓度100 ng/mL)诱导分化液, 37℃,5%CO2中避光培养;设立对照组(仅不含BMP-2/FGF-4)。诱导24 h,更换为普通培养液继续培养,每3 d换液一次,培养2周。
向平滑肌样细胞分化:弃原培养液,加入TGF-β1(浓度10 ng/mL)诱导分化液,37℃,5% CO2中培养;设立对照组(仅不含TGF-β1)。诱导组每3 d更换诱导液1次,对照组每3 d更换培养液1次,培养10 d。
向内皮样细胞分化:弃原培养液,加入VEGF165(浓度20 ng/mL)诱导分化液,37℃,5% CO2中培养;设立对照组(仅不含VEGF165)。诱导组每3 d更换诱导液1次,对照组每3 d更换培养液1次,培养2周。

表1 PCR引物序列
1.2.3 诱导分化后鉴定 细胞免疫荧光染色:诱导后,诱导组和对照组细胞予以PBS漂洗5 min×3次,4%多聚甲醛固定20 min,PBS漂洗5 min×3次,0.3%TritonX-100透壁处理20 min(CD31染色除外),血清封闭30 min,去封闭血清,添加一抗,4℃孵育过夜,PBS漂洗5 min×3次,添加二抗,室温避光孵育60 min,PBS漂洗5 min×3次,1∶1 000的DAPI染核1~2 min,PBS漂洗5 min×3次,镜下观察拍照。
RT-PCT检测:诱导后,用TRIzol法抽提总RNA,同型小鼠的心肌组织设为阳性对照。利用PrimeScript反转录试剂盒逆转录合成cDNA;利用Takara Taq PCR试剂盒行PCR扩增。PCR反应条件:95℃预变性5 min,94℃变性1 min,退火40 s,72℃延伸50 s,30~32 cycles,72℃终末延伸7 min。使用2%的琼脂糖凝胶电泳30~35 min后,凝胶成像系统检测拍照。GAPDH为内参。
2 结 果
2.1 小鼠心脏Sca-1+细胞体外向心肌样细胞分化 镜下显示,P4代成体小鼠心脏Sca-1+细胞在BMP-2/FGF-4作用24 h后虽然细胞大小形态相仿,但折光性增强,并开始呈一定趋向性排列(图1B)。诱导1周后,大部分细胞呈长梭形,折光性强,明显的趋向性排列(图1C)。诱导2周后,细胞生长甚密,仍表现出较强折光性,但未见自发跳动的细胞(图1D)。而同期对照组细胞,形态梭形改变,无趋向性排列,折光性较弱(图1E-G)。免疫荧光染色发现,经诱导后部分Sca-1+细胞表达心肌特征性结构蛋白cTNT和cMHC,而对照组没有表达(图2)。RT-PCR结果同样发现,与对照组相比,经诱导的Sca-1+细胞明显上调α-MHC、β-MHC、MLC-2a和MLC-2v等成熟心肌特异基因的mRNA表达(图3)。虽然在诱导分化2周后仍然没有发现这些细胞发生自发的有节律搏动或者是简单的搏动,但上述结果仍然提示我们,BMP-2/FGF-4能诱导成体小鼠心脏Sca-1+细胞向心肌样细胞分化,反过来也说明成体小鼠心脏Sca-1+细胞具有向心肌细胞分化的潜能。
2.2 小鼠心脏Sca-1+细胞体外向平滑肌样细胞分化 镜下发现,P4代成体小鼠心脏Sca-1+细胞在TGF-β1作用24 h后发生了形态学的改变,细胞变长呈梭形,折光性明显增强,且具明显的趋向性排列,类似于“波峰-波谷”样特征(图4A)。诱导10 d后,细胞重叠生长,仍呈梭形改变,折光性强,但排列不规律(图4B)。而同期对照组细胞形态上没有明显改变(图4C、4D)。免疫荧光染色同样发现,经诱导的Sca-1+细胞表达平滑肌细胞特征性蛋白SMA、sMHC和Calponin较对照组明显增强(图5)。RT-PCR结果亦显示,与对照组相比,经诱导的Sca-1+细胞明显上调平滑肌特异基因α-SMA和Calponin的mRNA表达(图6)。上述结果提示,TGF-β1能有效诱导成体小鼠心脏Sca-1+细胞向平滑肌样细胞分化。换言之,成体小鼠心脏Sca-1+细胞具有向平滑肌细胞分化的潜能。

图1 BMP-2/FGF-4诱导P4代成体小鼠心脏Sca-1+ 细胞成心肌细胞分化的光镜下形态
A: 诱导前Sca-1+细胞的形态;B-D: BMP-2/FGF-4诱导后细胞在不同时间点的形态特征;E-G: 对照组在上述不同时间点同期的细胞形态。放大倍率 ×100

图2 BMP-2/FGF-4诱导P4代成体小鼠心脏Sca-1+ 细胞成心肌细胞分化的免疫荧光染色鉴定
A: cTNT荧光染色结果(cTNT,绿色;DAPI,蓝色);B: cMHC荧光染色结果(cMHC,绿色;DAPI,蓝色). 白色箭头所指为特异的阳性染色,放大倍率 ×400

图3 BMP-2/FGF-4诱导P4代成体小鼠心脏Sca-1+
RT-PCR检测心肌特异性转录因子GATA4、Nkx2.5和MEF2C,心肌细胞特征基因α-MHC、β-MHC、MLC-2a和MLC-2v的mRNA表达. GAPDH为内参
2.3 小鼠心脏Sca-1+细胞体外向内皮样细胞分化 镜下观察,P4代成体小鼠心脏Sca-1+细胞在VEGF165诱导24 h后亦发生了改变,细胞生长缓慢,大部分伸出伪足,但胞体大小形态没有明显改变,折光性有增强(图7B)。诱导1周后,细胞生长密集,伪足渐退,形态以梭形为主,折光性强(图7C)。诱导2周后,细胞生长甚密,仍表现出较强折光性,伪足消失,形态以卵圆形为主(图7D)。而对照组细胞无明显改变,无伪足形成(图7E-G)。免疫荧光染色显示,经诱导后部分Sca-1+细胞能够表达内皮细胞特征性抗原CD31,而对照组没有表达(图8)。RT-PCR结果同样发现,与对照组相比,经诱导的Sca-1+细胞能明显上调内皮细胞特异性基因CD31、vWF和VE-Cadherin的mRNA表达(图9)。上述结果提示,成体小鼠心脏Sca-1+细胞在VEGF165的诱导下具有向内皮细胞分化的潜能。

图4 TGF-β1诱导P4代成体小鼠心脏Sca-1+细胞成平滑肌细胞分化的光镜下形态
A-B: TGF-β1诱导后细胞在不同时间点的形态特征;C-D: 对照组在上述不同时间点同期的细胞形态. 放大倍率 ×100
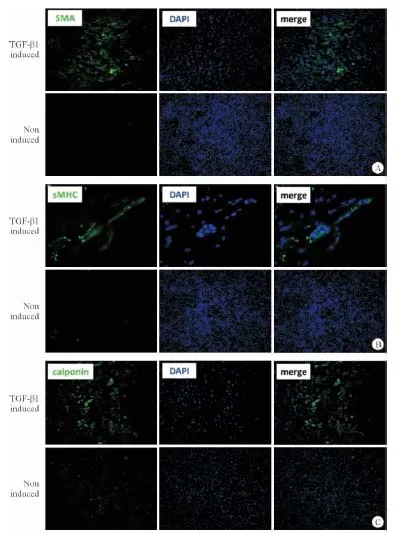
图5 TGF-β1诱导P4代成体小鼠心脏Sca-1+ 细胞成平滑肌细胞分化的免疫荧光染色鉴定
A: SMA荧光染色结果(SMA,绿色;DAPI,蓝色);B: sMHC荧光染色结果(sMHC,绿色;DAPI,蓝色);C: Calponin荧光染色结果(Calponin,绿色;DAPI,蓝色). 放大倍率 ×100

图6 TGF-β1诱导P4代成体小鼠心脏Sca-1+细胞成平滑肌细胞分化的特异基因表达
RT-PCR检测平滑肌细胞特征基因SMA、Calponin的mRNA表达. Induced:TGF-β1诱导组;Control:非诱导对照组;GAPDH为内参;mH:mouse heart

图7 VEGF165诱导P4代成体小鼠心脏Sca-1+细胞成内皮细胞分化的光镜下形态
A: 诱导前Sca-1+细胞的形态;B-D: VEGF165诱导后细胞在不同时间点的形态特征;E-G: 对照组在上述不同时间点同期的细胞形态. 放大倍率 ×100
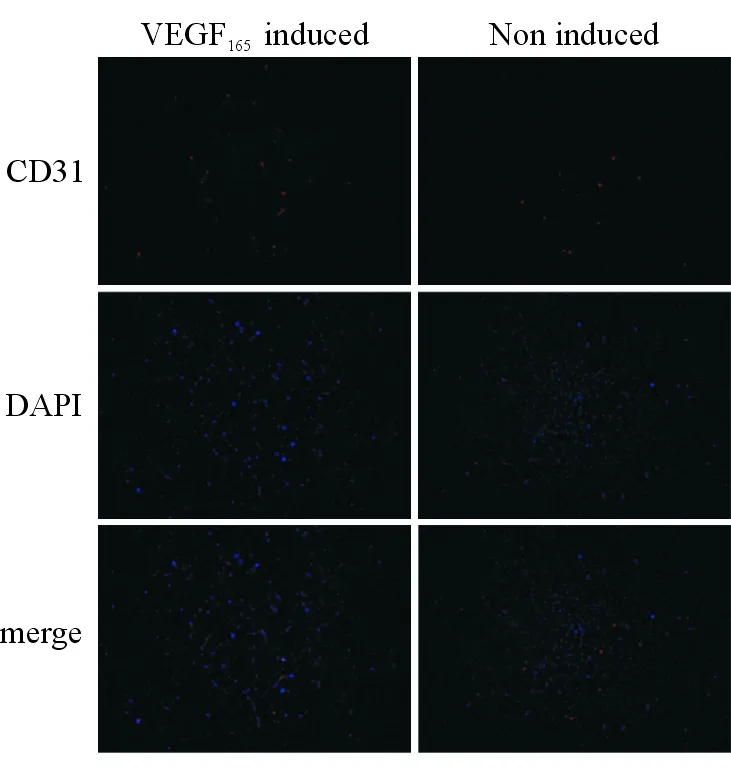
图8 VEGF165诱导P4代成体小鼠心脏Sca-1+细胞成内皮细胞分化的免疫荧光染色鉴定
CD31荧光染色结果(CD31,红色;DAPI,蓝色). 放大倍率 ×100

图9 VEGF165诱导P4代成体小鼠Sca-1+细胞成内皮细胞分化的基因表达检测
RT-PCR检测内皮前体标志Flk-1,内皮细胞特征基因CD31、vWF和VE-Cadherin的mRNA表达. GAPDH为内参
3 讨 论
经过体外诱导分化实验我们发现,在BMP-2/FGF-4的联合作用下,成体小鼠心脏组织来源的Sca-1+细胞能够表达成熟心肌的特征基因α-MHC、β-MHC、MLC-2a及MLC-2v,而且还表达心肌特征性结构蛋白cTNT和cMHC。在TGF-β1的作用下,该群细胞能够上调平滑肌特征基因α-SMA和Calponin的表达,而且还表达平滑肌特征性蛋白SMA、sMHC和Calponin。同时,在VEGF165的作用下,内皮细胞特征基因CD31、VE-cadherin、vWF及表面抗原CD31都有明显表达。因此,我们可以基本判定从成体小鼠心脏组织中筛选出来的Sca-1+细胞为CSCs,具有向心肌、平滑肌、内皮等心脏“三系”分化的多向分化潜能。这与Wang等人的研究发现是一致的,他们通过建立小鼠心肌梗死模型发现,在心梗发生的早期,梗死周边区域的Sca-1+细胞数量显著上升,而骨髓和血液中的Sca-1+细胞数量无论在心梗早期还是晚期都没有明显变化[10],这说明在成体心脏组织中可能驻守着自身固有的Sca-1+细胞。研究还发现,Sca-1+细胞可以在心梗的环境中向内皮和心肌细胞分化,通过促进局部血管和心肌的再生来改善心梗后的心脏功能。
实验的结果是可喜的,但也存有遗憾与不足,我们在心肌的诱导效率方面还不满意。Sca-1+CSCs不仅未能分化为有收缩功能的成熟心肌细胞,而且表达心肌特征蛋白cMHC或cTNT的细胞比例也很少。寻找高效的诱导方法一直是干细胞再生医学领域里的热点之一。考虑到干细胞实际分化成熟过程中的复杂性,仅依靠某一诱导因子或多个因子的简单联合,往往很难实现向心肌细胞这类具有复杂结构和特殊生理功能的细胞去成熟分化,即使可能,效率也是极低的[11]。有研究人员为了模拟心肌分化成熟过程中所需的复杂条件,先在体外分离培养心肌细胞,再与干细胞或前体细胞共培养,利用前者可能分泌的细胞因子来促使后者向成熟心肌分化。然而,这也不一定能实现干细胞向自发搏动的成熟心肌细胞转变[12-14]。也有研究将CMPCs或CSCs直接移植到梗死心肌的缺血区域,虽然有向成熟心肌分化的可能,但是移植细胞的留存率低[15-16],从而使得总体的转化率下降。
当然,除了给予的诱导条件和生长环境外,干细胞自身的特性可能也是影响分化效率的重要因素之一。就CMPCs来说,van等人研究发现,相比胚胎期CMPCs的多向分化能力,成体CMPCs更倾向于定向心肌的分化,而且由后者分化而来的心肌样细胞具有更好的电生理功能[17],说明虽然胚胎期CMPCs具有多向分化的能力,但其成心肌分化的效率可能反不如定向心肌分化的成体CMPCs。另有文献表明,具有多向分化能力的干细胞更接近于原始细胞,从而远离分化成熟的细胞[18]。同样,我们实验中的Sca-1+CSCs亦具有多向分化的潜能,可能相比定向心肌分化的成体CMPCs更具原始特性,从而向成熟心肌的分化亦相对困难。当然,对于心肌梗死的治疗或组织工程心脏的构建而言,绝不仅仅是成熟心肌细胞的堆砌,CSCs因其具有向心脏“三系”的多向分化潜能而拥有巨大的临床应用价值,目前已经被全球多个中心运用到Ⅰ期的临床试验中[1-3]。然而,要真正实现对梗死心肌组织结构和功能的生理修复,最重要的还是要找到合适的体外培养体系和高效的诱导条件,使CSCs或CMPCs能够朝着具有完全生理功能的成熟心肌或心脏细胞去分化,这也是我们未来工作中所需探讨和深入研究的问题。
[ 1 ] Bolli R, Chugh AR, D’Amario D, et al. Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial[J]. Lancet, 2011, 378(9806):1847-1857.
[ 2 ] Makkar R, Schatz R, Traverse JH, et al. ALLogeneic Heart STem cells to Achieve myocardial Regeneration (ALLSTAR): the six month phase I safety results[J]. J Am Coll Cardiol, 2014, 64(11_S):TCT-152.
[ 3 ] Makkar R, Schatz R, Traverse JH, et al. ALLogeneic Heart STem cells to Achieve myocardial Regeneration (ALLSTAR): the one year phase I results[J]. Circulation, 2014, 130(Suppl 2):A20536.
[ 4 ] Gao Y, Jacot JG. Stem Cells and Progenitor Cells for Tissue-Engineered Solutions to Congenital Heart Defects[J]. Biomark Insights, 2015,10(Suppl 1):139-146.
[ 5 ] Beltrami AP, Barlucchi L, Torella D, et al. Adult cardiac stem cell are multipotent and surpport myocardial regeneration[J]. Cell, 2003, 114(6):763-776.
[ 6 ] Leri A, Kajstura J, Anversa P. Cardiac stem cells and mechanisms of myocardial regeneration[J]. Physiol Rev, 2005, 85(4):1373-1416.
[ 7 ] Valente M, Nascimento DS, Cumano A, et al. Sca-1+cardiac progenitor cells and heart-making: a critical synopsis[J]. Stem Cell Dev, 2014,23(19):2263-2273.
[ 8 ] 周春霞,张海波,陈 皓,等.小鼠Sca-1阳性心脏干细胞的分离提取和表型鉴定[J].医学临床研究,2015,32(6):1072-1077.
[ 9 ] Smits AM, van Vliet P, Metz CH, et al. Human cardiomyocyte progenitor cells differentiate into functional mature cardiomyocytes: an in vitro model for studying human cardiac physiology and pathophysiology[J]. Nat Protoc, 2009, 4(2):232-243.
[10] Wang X, Hu Q, Nakamura Y, et al. The role of the Sca-1+/CD31- cardiac progenitor cell population in post infarction left ventricular remodeling[J]. Stem Cells, 2006, 24(7): 1779-1788.
[11] Matsuura K, Nagai T, Nishigaki N, et al. Adult cardiac Sca-1-positive cells differentiate into beating cardiomyocytes[J]. J Biol Chem, 2004, 279(12):11384-11391.
[12] Pfister O, Mouquet F, Jain M, et al. CD31- but Not CD31+ cardiac side population cells exhibit functional cardiomyogenic differentiation[J]. Circ Res, 2005, 97(1):52-61.
[13] Rose RA, Jiang H, Wang X, et al. Bone marrow-derived mesenchymal stromal cells express cardiac-specific markers, retain the stromal phenotype, and do not become functional cardiomyocytes in vitro[J]. Stem Cells, 2008, 26(11):2884-2892.
[14] Gallo MP, Ramella R, Alloatti G, et al. Limited plasticity of mesenchymal stem cells cocultured with adult cardiomyocytes[J]. J Cell Biochem, 2007, 100(1):86-99.
[15] Khan M, Mohsin S, Avitabile D, et al. β-Adrenergic regulation of cardiac progenitor cell death versus survival and proliferation[J]. Circ Res, 2013, 112(3): 476-486.
[16] Li Z, Lee A, Huang M, et al. Imaging survival and function of transplanted cardiac resident stem cells[J]. J Am Coll Cardiol, 2009, 53(14):1229-1240.
[17] van Vliet P, Smits AM, de Boer TP, et al. Foetal and adult cardiomyocyte progenitor cells have different developmental potential[J]. J Cell Mol Med, 2010,14 (4):861-870.
[18] Wu SM, Fujiwara Y, Cibulsky SM, et al. Cibulsky, et al. Developmental Origin of a Bipotential Myocardial and Smooth Muscle Cell Precursor in the Mammalian Heart[J]. Cell, 2006, 127(6):1137-1150.
[本文编辑] 叶 婷, 贾泽军
Experimental study on the differentiation potential of Sca-1-positive cells from adult mouse heart in vitro
WANG Hao, CHEN Hao, ZHANG Hai-bo, ZHOU Chun-xia*
Department of Cardiac Surgery, Shanghai Children’s Medical Center, Shanghai 200127, China
Objective: To study the differentiation potential of Sca-1+cells from adult mouse heart in vitro. Methods: We isolate Sca-1+cells derived from mouse heart by means of immunomagnetic cell sorting. By using three different kinds of differentiation inducing factors, including BMP-2/FGF-4, TGF-β1 and VEGF165, to induce Sca-1+cells to differentiated into the heart "three lines"invitro. The differentiation potential of the cells was identified from the changes of cell morphology, RT-PCR and immunofluorescence staining. Results: After BMP-2/FGF-4 induction, the mouse cardiac Sca-1+cells underwent morphological changes, up regulation of the mRNA expression of α-MHC, β-MHC, MLC-2a and MLC-2v, and the protein expression of cTNT and cMHC, which were the specific markers of cardiomyocytes. After TGF-β1 induction, these Sca-1+cells also had morphological changes, up regulation of mRNA expression of α-SMA and Calponin, and the protein expression of SMA, sMHC, and Calponin, which were the specific markers of smooth muscle cells. After VEGF165induction, the Sca-1+cells also underwent morphological changes, up regulation of endothelial cell specific gene CD31, vWF, and VE-Cadherin expression, and the expression of endothelial cell specific antigen CD31. Conclusions: Adult mouse cardiac Sca-1+cells can differentiate into cardiomyocyte-like cells, smooth muscle-like cells and endothelial-like cells under different inducing factors in vitro,which suggest these cells have multi-lineage differentiation potential as cardiac stem cells.
Sca-1; heart; stem cells; induced differentiation
2016-09-07 [接受日期] 2016-10-15
上海市浦东新区科技发展基金创新资金资助项目(PKJ2013-Y64). Supported by Pudong New Area Science and Technology Development Fund Innovative Foundation Projects of Shanghai (PKJ2013-Y64).
王 浩,博士,主治医师. E-mail: haowang_nt@163.com
*通信作者(Corresponding author). Tel: 021-38626161, E-mail: zcxaparis@yahoo.com
10.12025/j.issn.1008-6358.2016.20160935
Q 28
A
