胃癌根治术中切缘肿瘤残留危险因素的分析
2016-12-14马立业韩一芳
李 勃, 李 妍, 蔡 慧, 张 杭, 马立业, 韩一芳
1.解放军郑州联保中心北戴河疗养院,秦皇岛 066100 2.第二军医大学卫生勤务学系军队健康管理学教研室,上海 200433 3.第二军医大学长海医院普通外科,上海 200433 4.南京军区军事医学研究所,南京 210002
·论 著·
胃癌根治术中切缘肿瘤残留危险因素的分析
李 勃1*, 李 妍2, 蔡 慧3, 张 杭3, 马立业3, 韩一芳4
1.解放军郑州联保中心北戴河疗养院,秦皇岛 066100 2.第二军医大学卫生勤务学系军队健康管理学教研室,上海 200433 3.第二军医大学长海医院普通外科,上海 200433 4.南京军区军事医学研究所,南京 210002
目的: 明确胃癌根治术 (D2)中切缘(resection margins,RM)肿瘤残留(R1)发生的独立危险因素。方法: 回顾性分析2008年1月至2009年11月长海医院普通外科收治的412例行胃癌根治术患者资料。对影响上切缘(proximal resection margins,PRM)/下切缘(distal resection margins,DRM)R1发生的相关因素进行单因素分析及Logistic多因素回归分析。利用ROC曲线评估PRM/DRM距离预测PRM/DRM R0的价值。结果: 单因素分析显示,影响PRM R1发生的因素包括肿瘤大小、肿瘤部位、Borrmann分型、血清肿瘤标志物、手术方式、PRM距离、T分期、N分期及TNM分期(均P<0.05);影响DRM R1发生的因素包括DRM距离、T分期及肿瘤浸润血管(均P<0.05)。多因素分析显示,N3(RR=2.677)和PRM距离(RR=0.423)是PRM R1发生的危险因素;DRM距离(RR=0.407)是DRM R1发生的危险因素。PRM距离用于预测PRM R0最佳界值为2.05 cm(敏感性为79.9%,特异性为75.0%)。DRM距离用于预测DRM R0最佳界值为1.65 cm(敏感性为88.6%,特异性为66.7%)。结论: N3期和PRM距离是PRM R1发生的独立危险因素,DRM距离是DRM R1发生的唯一独立危险因素。PRM/DRM距离最佳界值可用于指导实现RM R0。
胃癌;切缘距离;危险因素
胃癌是一种严重威胁人类生命健康的恶性肿瘤,每年新发胃癌约95 200例,其中70%以上新发病例和死亡病例在发展中国家,其发病率男性位于恶性肿瘤第4位,女性位于第5位;死亡率男性位于恶性肿瘤第3位,女性位于第4位[1]。我国是胃癌高发国家,目前胃癌根治术(D2)是治疗的主要方法之一。研究[2]发现,镜下切缘肿瘤残留(R1)是患者术后无病生存期(disease free survival,DFS)和总生存期(overall survival,OS)的独立危险因素,尤其是Ⅰ~Ⅱ期[3]和(或)肿瘤转移淋巴结数≤3枚者[4]。然而Kim等[5]通过术中冰冻病理检查发现,切缘(resection margins,RM)R1再次处理获得RM R0者与一次整体切除病灶达到R0者相比,前者中位OS较后者显著缩短(P=0.049),其可能原因是无法实现肿块en bloc切除,导致切端或者腹腔肿瘤残留。有研究[6]显示,RM R1与腹腔冲洗液脱落细胞阳性(CY1)生存分析结果类似,其佐证了上述假设,由此可知en bloc病灶切除在胃癌根治术(D2)中至关重要。RM R1与术中组织离断位置密切相关,RM距离过短需要术中病理检查残端或者面临再次手术的风险,RM距离过长则切除正常组织多,增加消化道重建难度,可能增加术后并发症的发生率而降低术后患者的生活质量。所以明确RM R1的危险因素有助于指导术者正确判断病灶en bloc切除的离断位置,改善患者的预后。本研究主要探讨影响胃癌患者RM R1发生的独立危险因素。
1 资料与方法
1.1 患者资料 回顾性分析2008年1月至2009年11月在长海医院普通外科行胃癌根治术患者的病历资料,其纳入本研究的标准为:(1)行胃癌根治术(D2)且病理诊断为腺癌,排除M1及残胃二次手术者;(2)术前未行新辅助放化疗;(3)未发生围术期并发症,术后生存期>1个月;(4)术前未合并其他器官恶性肿瘤;(5)具有完整规范的术后病理诊断报告(其中清扫淋巴结总数≥15枚)。共检索查阅相关病历596例,排除不符合纳入标准184例,412例纳入本研究,其中男性303例、女性109例;年龄20~86岁,平均(58.5±12.7)岁。RM R1者44例(10.6%),其中PRM R1者32例(7.8%),DRM R1者12例(2.9%),无上下切缘同时受累患者。
1.2 影响胃癌患者RM R1发生的相关因素检测 (1)手术方法。肿瘤部位以胃大弯和胃小弯三等分点的连线分为上1/3、中1/3和下1/3。(2)手术方式。分为全胃切除术、近端胃切除术和远端胃切除术。(3)术前血清肿瘤标志物。CEA、CA19-9和CA72-4中任何一项升高。(4)病灶大小,最大长径表示。PRM距离、DRM距离于切除大体标本后、未行福尔马林固定前测量。(5)TNM分期及G分期按照胃癌NCCN指南(2013版)标准执行,其中G1-3依次为肿瘤组织高中低分化。

2 结 果
2.1 影响RM R1发生的单因素分析 PRM R1患者与RM R0患者进行比较显示,两组间在肿瘤大小、肿瘤部位、胃镜下Borrmann分型、血清肿瘤标志物、手术方式、PRM距离、DRM 距离、T分期、N分期、TNM分期及血管浸润上的差异有统计学意义(P<0.05或P<0.01,表1)。进一步分析显示,相比于RM R0,PRM R1的肿块较大[(6.93±3.67)vs(4.30±2.69),P<0.001],在Borrmann分型Ⅲ+Ⅳ(21.9%vs9.5%,P=0.029)、T3-4期(90.6%vs61.9%,P=0.001)、N2-3期(71.9%vs44.6%,P=0.003)和Ⅱ~Ⅲ期(93.8%vs70.4%,P=0.005)的占比较高。PRM R1肿瘤多位于上1/3(71.9%vs14.1%,P<0.001),且行全胃切除术(59.4%vs20.4%,P<0.001)比例较高。PRM R1患者中血清肿瘤标志物升高者较多(40.6%vs23.4%,P=0.030),PRM 距离较小[(1.59±1.28)vs(4.51±2.74),P<0.001],而DRM 距离较大[(5.45±2.80)vs(3.98±2.23),P=0.007]。DRM R1患者与RM R0患者进行比较显示,DRM距离、T分期和肿瘤浸润血管情况的差异均有统计学意义(P<0.05或P<0.01,表2),且DRM R1中T3-4期(91.6%vs61.9%,P=0.036)占比较高。
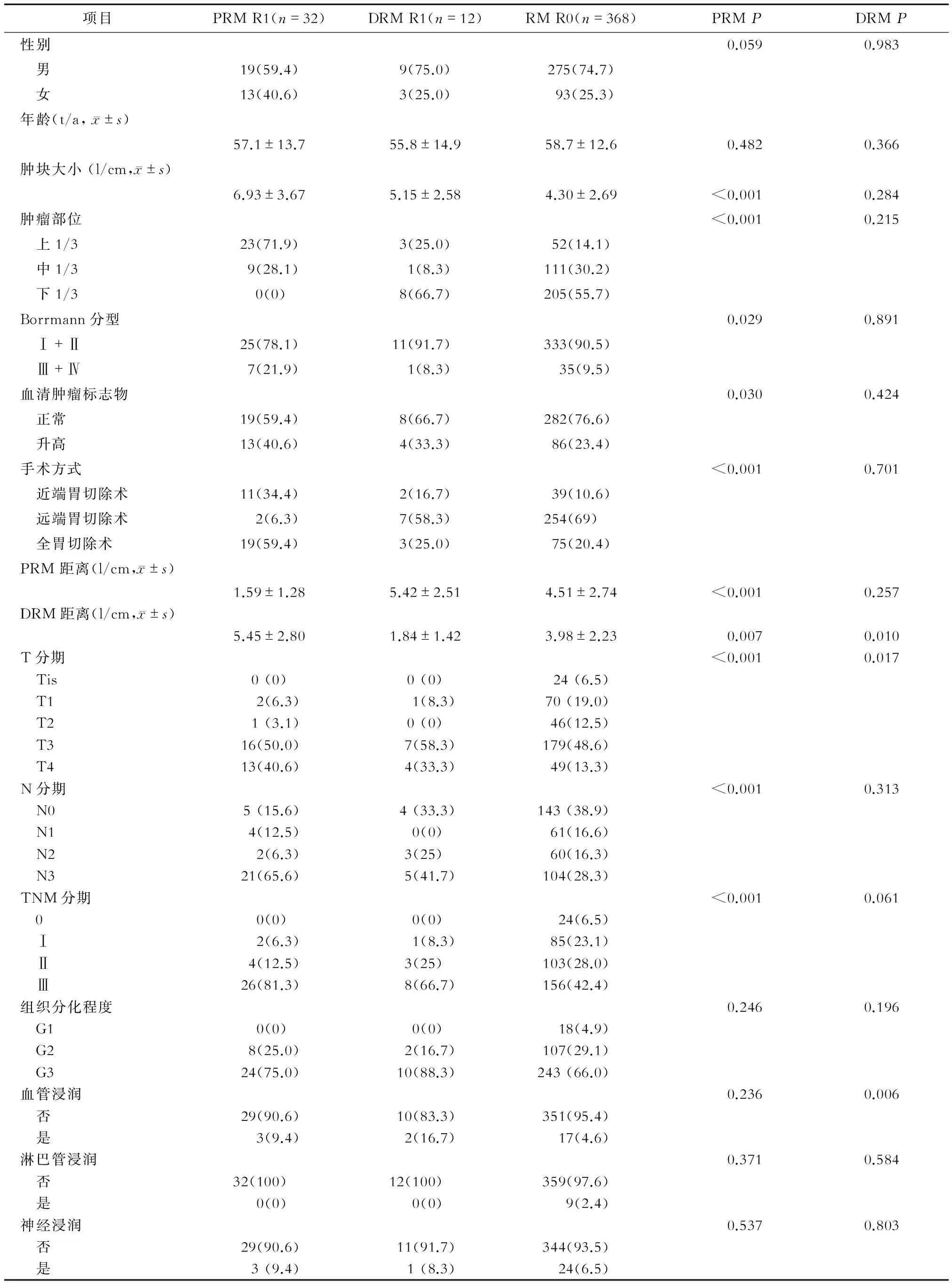
表1 影响切缘肿瘤残留发生的单因素分析结果 n(%)
2.2 影响RM R1发生的多因素分析 对单因素分析中有统计学意义的变量进行非条件二元Logistic回归分析显示,N3(RR=2.677)和PRM距离(RR=0.423)是PRM R1发生的独立危险因素;DRM距离(RR=0.407)是DRM R1发生的唯一独立危险因素(表2)。PRM距离ROC曲线(图1)下面积为0.854±0.031(95%可信区间为0.794~0.914),用于预测PRM R0具有统计学意义(P<0.001),其最佳界值为2.05 cm(敏感性为79.9%,特异性为75.0%)。DRM距离ROC曲线(图2)下面积为0.806±0.067(95%可信区间为0.675~0.936),用于预测DRM R0 具有统计学意义(P<0.001),最佳界值为1.65 cm(敏感性为88.6%,特异性为66.7%)。

表2 切缘肿瘤残留发生因素的Logistic 多因素回归分析结果

图1 PRM距离预测PRM R0的ROC曲线

图2 DRM距离预测DRM R0的ROC曲线
3 讨 论
目前研究提示,RM R1是影响胃癌患者预后的独立危险因素[7-8],RM R1患者5年生存率较RM R0明显降低(53%~60%vs13%~26%)[9]。虽然术中可行冰冻病理检查明确切缘肿瘤残留情况,可重新切除残端获得RM R0,但其中位DFS和OS与RM R1者比较,差异无统计学意义,提示肿块en bloc切除才能改善患者的预后[10]。由此可知术中冰冻检查可能获益不显著,所以术中准确判断胃腔(食管或十二指肠)离断位置,一次性实现肿块R0切除是手术的终极目标,所以有必要研究明确RM R1发生的危险因素。Liang等[11]研究1 025例Ⅰ~Ⅲ期胃癌患者发现,BorrmannⅢ~Ⅳ和淋巴结外转移是RM R1发生的独立危险因素。本研究发现,PRM距离和N3是PRM R1发生的独立危险因素;DRM距离是DRM R1发生的独立危险因素。本研究显示,PRM距离≥9 cm对PRM R1的发生无不利影响,然而能达到此标准病例较少(本研究中为7.25%),而且切除过多正常胃组织亦使患者获益减少。Lee等[12]研究发现,RM R0状态下增加切缘距离对预后无影响,可能增加术后并发症及营养不良概率。本研究发现,PRM距离2.05 cm预测PRM R0的敏感性及特异性均较高,可指导术者判断离断位置。此外,Bondar等[13]研究发现,保留贲门的胃切除术可减少术后并发症,所以在确保PRM R0时视情况保留贲门。目前,对于DRM距离研究较少,因为全胃或远端胃切除术中离断位置多为幽门环远端2~4 cm,增加DRM距离则增大损伤十二指肠乳头的风险。本研究中证实,DRM距离≥4 cm对DRM R1的发生无影响,由此可知肿瘤向DRM浸润距离较PRM短且变异较小,有助于术者对DRM距离的把握。本研究中DRM R1发生率为2.9%,而PRM R1发生率为7.8%,DRM R1发生率较低,分析其原因,可能与术者易于把握DRM距离有关。Fujita等[14]研究发现,位于胃中1/3的早期胃癌行幽门保留胃切除术较Billroth-I式远端胃切除术,患者的术后并发症少且生活质量高。本研究发现,DRM距离1.65 cm预测DRM R0的敏感性及特异性均较高,所以对于保留幽门及肿瘤可能浸润十二指肠乳头胃癌患者手术具有指导意义。
本研究中还显示,N3是PRM R1发生的独立危险因素,可知术前判断N分期较晚者可适当增大PRM距离以实现PRM R0;然而研究[15]发现,RM R1对≤N2进展期胃癌患者生存产生不利影响,所以对于术前判断≤N2分期的患者,尤其应当根据危险因素谨慎确定离断位置。
综上可知,术者应权衡手术获益情况后确定PRM距离,必要时胸腹联合手术获得PRM R0,尤其是N分期较早的患者。对于下切端的处理,DRM距离≥4 cm一般即可实现DRM R0,复杂情况可参考DRM距离1.65 cm,必要时根据切缘与十二指肠乳头的位置关系谨慎决定是否行Whipple术。
[ 1 ] World Health Organization.GLOBOCAN 2012:estimated cancer incidence,mortality and prevalence worldwide in 2012[EB/OL].http://globocan.iarc.fr/Pages/fact_sheets_population.aspx.
[ 2 ] Woo JW, Ryu KW, Park JY, et al. Prognostic impact of microscopic tumor involved resection margin in advanced gastric cancer patients after gastric resection[J]. World J Surg, 2014,38(2):439-446.
[ 3 ] Sun Z,Li DM,Wang ZN, et al. Prognostic significance of microscopic positive margins for gastric cancer patients with potentially curative resection[J]. Ann Surg Oncol, 2009,16(11):3028-3037.
[ 4 ] Bickenbach KA, Gonen M, Strong V, et al. Association of positive transection margins with gastric cancer survival and local recurrence[J]. Ann Surg Oncol, 2013,20(8):2663-2668.
[ 5 ] Kim SY, Hwang YS, Sohn TS, et al. The predictors and clinical impact of positive resection margins on frozen section in gastric cancer surgery[J]. J Gastric Cancer, 2012, 12(2):113-119.
[ 6 ] Songun I, Bonenkamp JJ, Hermans J, et al. Prognostic value of resection-line involvement in patients undergoing curative resections for gastric cancer[J]. Eur J Cancer, 1996,32A(3):433-437.
[ 7 ] Morgagni P, Garcea D, Marrelli D,et al.Resection line involvement after gastric cancer surgery: clinical outcome in nonsurgically retreated patients[J].World J Surg, 2008,32(12):2661-2667.
[ 8 ] Nagata T, Ichikawa D, Komatsu S,et al.Prognostic impact of microscopic positive margin in gastric cancer patients[J].J SurgOncol, 2011,104(6):592-597.
[ 9 ] Bissolati M, Desio M, Rosa F, et al. Risk factor analysis for involvement of resection margins in gastric and esophagogastric junction cancer: an Italian multicenter study[J]. Gastric Cancer, 2016 Jan 5. [Epub ahead of print]
[10] Squires MH, Kooby DA, Pawlik TM, et al. Utility of the proximal margin frozen section for resection of gastric adenocarcinoma: a 7-Institution Study of the US Gastric Cancer Collaborative[J]. Ann Surg Oncol, 2014,21(13):4202-4210.
[11] Liang Y, Ding X, Wang X, et al. Prognostic value of surgical margin status in gastric cancer patients[J]. ANZ J Surg, 2015,85(9):678-684.
[12] Lee CM, Jee YS, Lee JH, et al. Length of negative resection margin does not affect local recurrence and survival in the patients with gastric cancer[J]. World J Gastroenterol, 2014,20(30):10518-10524.
[13] Bondar VG, Baker I, Zaika AN.Subcardial resection for gastric cancer [J]. Klin Khir, 2005(7): 5-8.
[14] Fujita J, Takahashi M, Urushihara T, et al. Assessment of postoperative quality of life following pylorus-preserving gastrectomy and Billroth-I distal gastrectomy in gastric cancer patients: results of the nationwide postgastrectomy syndrome assessment study[J]. Gastric Cancer, 2016,19(1):302-311.
[15] Chen JD, Yang XP, Shen JG , et al. Prognostic improvement of reexcision for positive resection margins in patients with advanced gastric cancer[J]. Eur J Surg Oncol, 2013, 39(3):229-234.
[本文编辑] 叶 婷, 晓 璐
Study of the risk factors of resection-margin involvement in radical gastrectomy of gastric cancer patients
LI Bo1*,LI Yan2, CAI Hui3,ZHANG Hang3, MA Li-ye3, HAN Yi-fang4
1. Beidaihe Sanatorium of Zhengzhou Logistics Center of PLA, Qinhuangdao 066100, Hebei, China 2. Department of Health Management, Second Military Medical University, Shanghai 200433, China 3. Department of General Surgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China 4. Department of Epidemiology, Research Institute for Medicine of Nanjing Command, Nanjing 210002,China
Objective: To investigate the risk factors of resection-margin (RM)involvement(R1) in radical gastrectomy of gastric cancer patients.Methods: The clinical data of 412 cases of radical gastrectomy performed from January 2008 to November 2009 in Changhai Hospital were analyzed retrospectively. The potential risk factors of proximal resection margins(PRM)/distal resection margins(DRM)R1 were analyzed by univariate and multivariate Logistic regression analysis. Assess the value of PRM/DRM distance in the anticipating of PRM/DRM R0. Results: The univariate analysis showed that the risk factors of PRM R1 included tumor size,tumor location, Borrmann type,tumor marker in serum, operation method,PRM distance,T stage,N stage and TNM stage(allP<0.05), and the risk factors of DRM R1 included DRM distance, T stage and vascular invasion (allP<0.05). The multivariate Logistic regression analysis showed that the risk factors of PRM R1 included N3(RR=2.677)and PRM distance (RR=0.423), and the risk factors of DRM R1 was DRM distance (RR=0.407). The best cutoff value point of PRM distance in the anticipating of PRM R0 was 2.05 cm (sensitivity 79.9% and specificity 75.0%), the best cutoff value point of DRM distance in the anticipating of DRM R0 was 1.65 cm (sensitivity 88.6% and specificity 66.7%).Conclusions: N3 stage and PRM distance are independent risk factors of the incidence of PRM R1 and DRM distance is the only independent risk factors of the incidence of DRM R1. The best cutoff value point of PRM/DRM distance can be used to help the surgeons obtain PRM R0.
gastric cancer; resection-margin distance; risk factors
2016-06-06 [接受日期] 2016-08-06
国家自然科学基金青年科学基金(81402433),中国博士后科学基金(2015T81088). Supported by Youth Science Foundation of National Natural Science Foundation of China (81402433) and China Postdoctoral Science Foundation (2015T81088).
李 勃,硕士,主治医师.
*通信作者(Corresponding author). Tel: 0335-5360027, E-mail: percybob@sina.com
10.12025/j.issn.1008-6358.2016.20160672
R 656.6
A
