长叶红砂咖啡酸-O-甲基转移酶(RtCOMT)基因的克隆及蛋白纯化
2016-12-13张慧荣赵萍萍王迎春
张慧荣,冯 杰,赵萍萍,王迎春
(内蒙古大学 生命科学学院,呼和浩特 010021)
长叶红砂咖啡酸-O-甲基转移酶(RtCOMT)基因的克隆及蛋白纯化
张慧荣,冯 杰,赵萍萍,王迎春
(内蒙古大学 生命科学学院,呼和浩特 010021)
长叶红砂(Reaumuriatrigyna)是内蒙古东阿拉善-西鄂尔多斯地区特有双子叶盐生小灌木,有极强的耐盐抗旱性,入药可以治疗湿疹、皮炎等疾病,具有一定的药用价值。咖啡酸-O-甲基转移酶(RtCOMT)是一个重要的甲基化酶,主要调控木质素合成过程中中间产物及木质素的变化。基于高通量测序结果,利用RT-PCR技术克隆获得长叶红砂COMT(RtCOMT)基因,构建RtCOMT原核表达载pET32a-RtCOMT,并将其转化大肠杆菌,重组阳性菌经IPTG诱导和SDS-PAGE电泳检测。结果表明:RtCOMT基因开放阅读框长1 023 bp,编码340个氨基酸,推测蛋白分子质量37.24 ku,理论等电点(pI)6.71,发现该基因在大肠杆菌中正常表达得到与预期大小一致的融合蛋白。采用Ni-IDA His-Bind亲和层析方法对RtCOMT重组蛋白进行纯化,体外获得目的蛋白。
长叶红砂;COMT基因;原核表达;蛋白纯化
木质素是包围在维管束细胞和厚壁细胞壁外的一类聚合物, 主要由阿魏酸、 松柏醇和芥子醇3种单体组成,因组成单体不同,可将木质素分为紫丁香基木质素(S-木质素),愈创木基木质素(G-木质素)和对羟基苯基木质素(H-木质素) 3种类型[1]。木质素作为植物生长发育中的一种植物次生代谢产物,不仅能维持植物结构、输导水分和养料,同时对植物抗倒伏、抗病和抗逆性也有重要影响[2]。但木质素过高会增加工业污染, 降低动物对饲草的消化吸收率,同时也影响一些作物的品质[3]。因此,通过基因工程技术从分子水平调控木质素含量和成分的研究在生产实际中具有重大现实意义和产业前景。
木质素合成以苯丙酸起始,经过一系列羟基化、甲基化、连接、还原反应最终生成上述3种甲基化程度不同的木质素单体。木质素合成途径中的结构基因主要包括CAD(肉桂醇脱氢酶)、C4H(肉桂酸 4-羟化酶)、CCR(肉桂酰CoA还原酶)、COMT、CCoAOMT(咖啡酰CoA氧甲基转移酶)、PAL(苯丙氨酸解氨酶)、4CL(桂皮酰:辅酶A连接酶)等[4]。其中,咖啡酸-O-甲基转移酶(caffeic acid-O-methyltransferase,COMT; EC 2.1.1.68)是一种重要的甲基化酶,可催化咖啡酸、5-羟基松柏醛和5-羟基松柏醇甲基化分别生成阿魏酸、芥子醛和芥子醇,参与 S-木质素的合成[5-6]。目前,已经从拟南芥[7]、烟草[8]、柳枝稷[9]、豌豆[10]和银合欢[11]等不同植物中分离获得COMT基因,对其功能进行研究结果表明,COMT通过基因表达和酶活性变化,不仅调控木质素(主要是S-木质素)合成过程中中间产物及木质素含量的变化,而且可以影响酚类等其他植物次生代谢产物的生成,在植物生长发育过程中发挥着重要作用[12]。
长叶红砂 (Reaumuriatrigyna),又名黄花红砂、黄花琵琶柴,隶属于柽柳科(Tamaricaceae)琵琶柴属(ReaumuriaLinn. ),为古地中海残遗珍稀小灌木,是亚洲中部地区东阿拉善-西鄂尔多斯特有种,为该地区重要牧草之一[13]。该植株高10~30 cm,叶肉质,表皮内栅栏组织发达,保卫细胞细胞壁明显加厚,叶和幼茎上均布有盐腺,与外界进行离子交换,保持体内盐离子组分与生存土壤的离子组分一致,具有极强的耐盐性和抗旱性,并且其果实可以入药治疗湿疹、皮炎等疾病,具有一定的药用价值[14]。笔者利用Illumina测序技术,对长叶红砂进行转录组深度测序,搭建了长叶红砂转录组信息平台,获得351条与次生代谢途径相关的差异表达基因,通过基因注释,发现长叶红砂中黄酮类化合物的合成和代谢被显著激活[15]。
本试验从长叶红砂中克隆获得RtCOMT基因,对其序列及结构进行分析。在蛋白水平上研究RtCOMT基因功能,构建RtCOMT基因原核表达载体 pET-32a-RtCOMT,并将其转化大肠杆菌,进行体外蛋白诱导表达。用His-Tag 亲和层析柱纯化,获得目的蛋白,为进一步研究RtCOMT酶活性奠定基础。
1 材料与方法
1.1 长叶红砂幼苗的培养及胁迫处理
长叶红砂种子用w=10%次氯酸钠浸泡15 min,然后用灭菌水冲洗3次。消毒后的种子播种在MS培养基,在室温25 ℃,湿度70%,光周期为16 h光照/8 h黑暗,光强为3 000 lx条件下培养15 d。当幼苗长到约10 cm高度时,被转移到1/2 MS培养液中,培养15 d后收获材料迅速保存在液氮中备用。
1.2 长叶红砂RNA提取和cDNA合成
取0.1 g长叶红砂幼苗用液氮快速研磨,按MiniBEST Plant RNA Extraction Kit (TaKaRa,大连,中国)试剂盒说明书进行操作,提取的RNA沉淀室温晾干,用适量无RNase水溶解,采用超微量分光光度计检测总RNA浓度,电泳检测其完整性。质量好的总RNA参照Clontech公司的SMARTTM RACE cDNA Amplification试剂盒中First-Strand cDNA Synthesis步骤合成长叶红砂cDNA第一链。
1.3 长叶红砂RtCOMT基因克隆
从长叶红砂转录组数据库[15]中发现注释为COMT基因序列,设计开放阅读框引物RtCOMT-F(5′-ATGACACTGCTGAGCG-3′)和RtCOMT-R(5′-TCAATTCTTCAAAAATTCCAT-3′),以长叶红砂总cDNA为模板, 按照下列体系进行扩增:cDNA 1μL,10×TransTaq○R-T buffer 5 μL,dNTP (2.5 mol/L) 4 μL,TransTaq○R-T DNA Polymerase(2.5 U/μL) 1 μL,10 μmol 引物各 1μL,终体积为 50 μL。反应程序95 ℃ 5 min;90 ℃ 30 s;58 ℃ 30 s; 72 ℃ 90 s,反应30个循环,循环结束后 72 ℃ 延伸5 min。 经10 g/L 琼脂糖凝胶电泳检测后,回收目的片段与 pMD-19T 克隆载体连接,转化大肠杆菌感受态细胞Trans1-T1(全式金,北京)大肠杆菌中,经菌液PCR验证后选择阳性克隆载体送华大生物技术公司进行测序。
1.4 长叶红砂RtCOMT原核表达载体构建
利用带有BamHⅠ(5′-CGCGGATCCATGACACTGCTGAG-3′)和SalⅠ(5′-ACGCGT-CGACTCAATTCTTCAAAAATTC-3′)酶切位点的引物扩增RtCOMT序列,与pMD19T simple 载体连接,转化大肠杆菌。经酶切、测序验证,挑选阳性克隆载体。用BamHⅠ和SalⅠ酶切阳性克隆载体和表达载体pET-32a,产物经12 g/L琼脂糖凝胶电泳检测,回收纯化目的片段。将回收的RtCOMT目的片段分别与原核表达载体线性pET-32a进行连接获得重组质粒pET32a-RtCOMT,连接产物转入大肠杆菌细胞中,菌液PCR和双酶切筛选阳性表达载体后送测序。
1.5 长叶红砂RtCOMT蛋白诱导表达
重组质粒pET32a-RtCOMT转化E.coliROSETTA表达菌,挑选阳性单菌落在LB液体培养液中37 °C 、200 r/min过夜培养。新鲜的LB菌液按1∶100的体积比接种到50 mg/L Amp LB液体培养基中进行扩培,当 OD600到达0.6时,加入IPTG,终浓度到达0.8 mmol/L,在28 ℃恒温摇床,200 r/min下继续培养4 h进行外源蛋白诱导表达。诱导前后各取1 mL菌液,12 000 r/min离心1min,弃上清。用2×SDS上样缓冲液重悬菌体后100 ℃煮沸5 min,用质量分数为12%的SDS-PAGE 胶电泳检测结果。
1.6 长叶红砂RtCOMT蛋白纯化
选取阳性表达菌株经IPTG诱导RtCOMT蛋白表达,离心收集菌体。用Binding buffer(上海生工生物工程技术服务有限公司)重悬菌液,将重悬液用液氮反复冻融3次后加入溶菌酶(1 g/L),冰浴30 min。200~300 W超声波超声3 s,间歇5 s,重复2~3次,4 ℃、15 000 r/min,离心20 min收集上清。用2 mL Binding-buffer预洗Ni-IDA His-Bind Resin吸附柱(上海生工生物工程技术服务有限公司)然后将收集的上清液移入吸附柱中,流速0.5~1 mL/min进行柱层析。然后用Bind-buffer洗脱吸附柱3~5次,直到洗脱液OD280到达最初水平,然后用Elution-buffer洗脱吸附柱,收集洗脱液,12%的SDS-PAGE 胶电泳检测结果。
1.7 生物信息学分析
用NCBI-ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)找出RtCOMT基因开放阅读框,Primer primer 5设计引物。用clustalx软件和Mega 5.0软件比较长叶红砂与其他植物COMT蛋白质同源性,构建系统进化树。用ProtParam( http://web.expasy.org/protparam/)程序分析RtCOMT理化性质,用ExPASy中的SOPMA(http://www.ncbi.nlm.nih.gov)和Web-based SWISS-MODEL server(http://www.swissmodel.expasy.org)分析RtCOMT蛋白结构。
2 结果与分析
2.1 长叶红砂RtCOMT基因克隆
从长叶红砂转录组数据库中发现功能注释为COMT蛋白的基因序列(unigene22419),其长度为1 380 bp,通过ORF-Finder软件预测其开放阅读框,利用RT-PCR技术克隆获得长叶红砂RtCOMT基因编码区序列,该序列长1 023 bp,起始密码子ATG,终止密码子TGA,编码340个氨基酸。将RtCOMT与其他物种COMT蛋白进行系统进化树分析发现,RtCOMT和野茶树(ADN27527.1)、丹参、(AEO14870.1)、木本棉(KHG13754.1)、鹰嘴豆(XP004502769.1)、毛白杨(AFZ78575.1)和梅花(XP008234634.1)等植物COMTs序列有58%~65%同源性,其中,与野茶树同源性最高为65%(图1)。

图1 RtCOMT和其他植物COMT系统树进化分析
2.2 长叶红砂RtCOMT蛋白质理化性质及结构分析
经RtCOMT蛋白理化性质分析,推测其蛋白分子质量37.24 ku,理论等电点6.71。蛋白质二级结构分析显示,RtCOMT蛋白中有16 处α-螺旋,占序列全长的43.36%;有15 处β-转角,占序列全长的10.03%;27处无规则卷曲,占序列全长的28.32% ,另外还有18.29%的延伸结构(图2-A)。氨基酸序列比对发现RtCOMT的181-277氨基酸属于依赖S-腺苷甲硫氨酸甲基转移酶结构域(sadenosyllmethionine-dependent methy-trans-ferases,SAM),与其他植物COMT蛋白序列一致,RtCOMT蛋白包含COMT保守残基LVDVGGGTGA。与紫花苜蓿蛋白结构比对,推测RtCOMT催化残基为H246D274E305(图2-B)。

图2 长叶红砂RtCOMT蛋白序列及结构分析
2.3 长叶红砂RtCOMT基因原核表达载体的构建
RtCOMT基因阳性克隆载体经双酶切,得到与RtCOMT基因的开放阅读框核苷酸数相符,含有粘性末端的目的条带,将其与表达载体pET32a连接,构建原核表达载体pET32a-RtCOMT。将重组表达载体pET32a-RtCOMT转化E.coli感受态细胞中培养,挑选单克隆菌落,进行PCR 阳性单克隆鉴定,结果都扩增出约1 000 bp的基因片段,与预测大小相符。然后对阳性菌落进一步双酶切鉴定,结果发现载体pET32a-RtCOMT酶切后都产生2条片段,一条与目的基因大小相符,另外一条和载体大小相符(图3)。
2.4 长叶红砂RtCOMT蛋白诱导表达及纯化
将原核表达重组载体pET32a-RtCOMT导入E.coli表达菌中Rossetta(DE3)中,命名为pET32a-RtCOMT/Rosetta。经IPTG诱导处理,在分子质量约60 ku处检测到带有His标签的RtCOMT融合表达蛋白,除去23 ku的融合蛋白标签,其大小与理论值相符(图4,泳道2)。融合蛋白带有6×His标签,可与吸附柱中镍离子相互作用而结合到亲和介质上。本研究将裂解的上清菌液加样到Ni-IDA吸附柱中,蛋白充分结合到介质上,先用洗涤缓冲液洗涤杂蛋白(图4,泳道3和4),再用洗脱缓冲液将RtCOMT重组蛋白洗脱下来获得一条清晰的目的蛋白条带,与IPTG诱导后RtCOMT表达重组蛋白的条带大小一致(图4,泳道6和7)。
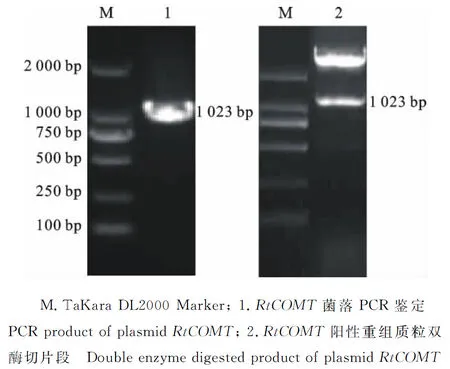
图3 阳性重组质粒的菌落PCR和双酶切鉴定
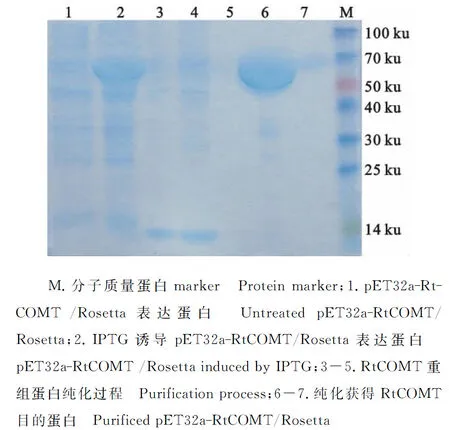
图4 SDS-PAGE 分析RtCOMT在大肠杆菌中过表达及纯化过程
3 讨 论
Joshi等[16]将甲基转移酶(OMTs,O-Methyltransferases)分为2种,一种低分子质量甲基转移酶 (23~27 ku), 催化活性依赖Mg2+,并且不能将咖啡酸作为催化底物。而另外一种恰恰相反,分子质量较高(36~43 ku), 催化活性不依赖Mg2+,可以甲基化多种底物包括咖啡酸。COMT属于后者,是苯丙烷代谢途径[phenyl propanoid (PP) pathway]中关键酶之一,不仅能调控木质素积累,而且能影响黄酮类、酚类和生物碱等化合物合成[17]。因此,在植物生长发育过程中,COMT对其木质化程度、组织颜色和果实成熟等生理活动都有影响。目前已经从多种植物中克隆获得COMT基因并且对其蛋白结构和催化功能进行深入研究[11]。紫花苜蓿中,已经通过晶体学分析MsCOMT蛋白结构,确定其保守序列、SAM结合位点和催化位点[18]。本研究通过序列分析和蛋白结构预测发现,RtCOMT包含S-腺苷甲硫氨酸甲基转移酶结构域、保守残基(LVDVGGGTGA)和催化位点等COMT蛋白关键结构。
大肠杆菌能高效、低廉且稳定表达外源蛋白,已经有多种植物基因转入大肠杆菌中正常表达,发挥其生物学功能[19]。研究证明,在烟草(38~43 ku)[8],苜蓿(41~43 ku)[20],山杨(40 ku)[21]和甘蔗(39 ku)[22]等植物中COMT是一种可溶性蛋白,能在大肠杆菌中功能表达。本研究证明长叶红砂COMT基因也可在大肠杆菌中正常表达,生成约37 ku的可溶性蛋白,与其他植物COMT蛋白大小相似。目前通过纯化模式植物和农作物中COMT蛋白,体外获得目的蛋白,对其蛋白晶体结构和催化能力有了深入了解[8, 18]。本研究采用pET32a(+)表达载体进行原核表达,得到的体外重组蛋白RtCOMT是带有6个His-Tag的融合蛋白。His-Tag序列的组氨酸与固定化金属离子(通常为Ni2+或Cu2+)具有亲和力,且不影响目的蛋白的天然结构和活性。因此,用Ni-IDA His-Bind方法对RtCOMT重组蛋白进行纯化,获得RtCOMT蛋白可直接用于功能检测,为深入探索RtCOMT蛋白功能奠定基础。
4 结 论
本研究从长叶红砂中克隆得到RtCOMT基因的编码区序列长1 023 bp,编码340个氨基酸,推测蛋白分子质量37.24 ku,理论等电点为 6.71。构建RtCOMT原核表达载pET32a-RtCOMT,并将其转化大肠杆菌。重组菌经IPTG诱导和SDS-PAGE电泳检测,观察到60 ku融合蛋白表达,与预期蛋白大小一致。采用Ni-IDA His-Bind亲和层析方法对RtCOMT重组蛋白进行纯化,体外获得目的蛋白。
Reference:
[1]CHEN F,DIXON R A.Lignin modification improves fermentable sugar yields for biofuel production[J].NatureBiotechnology,2007,25(7):759-761.
[2]DAVISON B H,DRESCHER S R,TUSKAN G A,etal.Variation of S/G ratio and lignin content in aPopulusfamily influences the release of xylose by dilute acid hydrolysis[C].Springer:Twenty-Seventh Symposium on Biotechnology for Fuels and Chemicals,2006:427-435.
[3]李云雁,彭亚勤,宋光森,等.从板栗壳中分离乙醇木质素[J].西北农业学报,2007,16(3):200-203.
LI Y Y,PENG Y Q,SONG G S,etal.Isolation of lignin from chestnut shell by ethanol[J].ActaAgricultureBoreali-occidentalisSinica,2007,16(3):200-203(in Chinese with English abstract).
[4]WHETTEN R W,MACKAY J J,SEDEROSS R R.Recent advances in understanding lignin biosynthesis[J].AnnualReviewofPlantBiology,1998,49(1):585-609.
[5]PARVATHI K,CHEN F,GUO D,etal.Substrate preferences of O-methyltransferases in alfalfa suggest new pathways for 3-O-methylation of monolignols[J].ThePlantJournal,2001,25(2):193-202.
[6]IBRAHIM R K,BRUNEAU A,BANTIGNIES B.Plant O-methyltransferases: molecular analysis,common signature and classification[J].PlantMolecularBiology,1998,36(1):1-10.
[7]VANHOLME R,RALPH J,AKIYAMA T,etal.Engineering traditional monolignols out of lignin by concomitant up-regulation of F5H1 and down-regulation of COMT in Arabidopsis[J].ThePlantJournal,2010,64(6):885-897.
[8]HERMANN C,LEGRAND M,GEOFFROY P,etal.Enzymatic synthesis of lignin: purification to homogeneity of the three O-methyltransferases of tobacco and production of specific antibodies[J].ArchivesofBiochemistryandBiophysics,1987,253(2):367-376.
[9]TSCHAPLINSKI T J,STANDAERT R F,ENGLE N L,etal.Down-regulation of the caffeic acid O-methyltransferase gene in switchgrass reveals a novel monolignol analog[J].BiotechnologyforBiofuels,2012,5(1):71.
[10]PREISIG C L,MATTHEWS D E,VANETTEN H D.Purification and characterization of S-adenosyl-L-methionine: 6a-hydroxymaackiain 3-O-methyltransferase fromPisumsativum[J].PlantPhysiology,1989,91(2):559-566.
[11]DWIVEDI U N,GUPTA P,PANDEY V P,etal.Caffeic acid O-methyltransferase fromLeucaenaleucocephala:cloning,expression,characterization and molecular docking analyses[J].JournalofMolecularCatalysisB:Enzymatic,2014,106:63-70.
[12]PALMER N A,SATTLER S E,SAATHOFF A J,etal.A continuous,quantitative fluorescent assay for plant caffeic acid O-methyltransferases[J].JournalofAgriculturalandFoodChemistry,2010,58(9):5220-5226.
[13]赵一之.内蒙古珍稀濒危植物图谱[M].北京:中国农业科技出版社; 1992.
ZHAO Y ZH.Vascular Plants in Ordos Plateau[M].Beijing:China Agriculture Science and Technique Press,1992(in Chinese).
[14] 薛 炎,王迎春.盐生植物长叶红砂泌盐特性研究[J].中国沙漠,2008,28(3):437-443.
XUE Y,WANG Y CH.Study on characters of ions secretion fromReaumuriatrigyna[J].JournalofDesertResearch,2008,28(3):437-443(in Chinese with English abstract).
[15]DANG Z,ZHENG L,WANG J,etal.Transcriptomic profiling of the salt-stress response in the wild recretohalophyteReaumuriatrigyna[J].BMCgenomics,2013,14(1):1-29.
[16]JOSHI C P,CHIANG V L.Conserved sequence motifs in plant S-adenosyl-L-methionine-dependent methyltransferases[J].PlantMolecularBiology,1998,37(4):663-674.
[17]SINGH R,GUPTA P,PANDEY V P,etal.Temporal expression of caffeic acid 3-O-methyltransferase (COMT) in mango (Mangiferaindicavar.Dashehari) fruit ripening[J].LWT-FoodScienceandTechnology,2011,44(8):1782-1785.
[18]ZUBIETA C,KOTA P,FERRER J L,etal.Structural basis for the modulation of lignin monomer methylation by caffeic acid/5-hydroxyferulic acid 3/5-O-methyltransferase[J].ThePlantCellOnline,2002,14(6):1265-1277.
[19]CHAURASIA N,MISHRA Y,RAI L C.Cloning expression and analysis of phytochelatin synthase (pcs) gene fromAnabaenasp.PCC 7120 offering multiple stress tolerance inEscherichiacoli[J].BiochemicalandBiophysicalResearchCommunications,2008,376(1):225-230.
[20]EDWARDS R,DIXON R A.Purification and characterization of S-adenosyl-L-methionine: caffeic acid 3-O-methyltransferase from suspension cultures of alfalfa (MedicagosativaL.)[J].ArchivesofBiochemistryandBiophysics,1991,287(2):372-379.
[21]BUGOS R C,CHIANG V L,CAMPBELL W H.Characterization of bispecific caffeic acid/5-hydroxyferulic acid O-methyltransferase from aspen[J].Phytochemistry,1992,31(5):1495-1498.
[22]SELMAN-HOUSEIN G,LPEZ MAA,HERNNDEZ D,etal.Molecular cloning of cDNAs coding for three sugarcane enzymes involved in lignification[J].PlantScience,1999,143(2):163-171.
(责任编辑:成 敏 Responsible editor:CHENG Min)
Cloning and Purification of Caffeic Acid O-methyltransferase (RtCOMT) fromReaumuriatrigyna
ZHANG Huirong, FENG Jie, ZHAO Pingping and WANG Yingchun
(College of Life Sciences, Inner Mongolia University, Hohhot 010021, China)
Reaumuriatrigynais a small shrub grown in the Eastern Alxa-Western Ordos area of Inner Mongolia.R.trigynahas a vital ecological function for its remarkable tolerance to salt and drought. Additionally,R.trigynais a traditional herb to cure eczema, dermatitis and other diseases. Caffeic acid O-methyltransferase (COMT) is an important methyltransferases which involved in synthesis of S-lignin, and plays significant roles in various physiological processes in plant life cycle. We isolated an open reading frame (ORF) ofRtCOMT, constructed expression vectors ofRtCOMTand transformed it intoE.colilines. The ORF ofRtCOMTwas 1 023 bp which encodes a protein with 340 amino acids and characterized predicted isoelectric point (pI) 6.71 and molecular mass 37.24 ku. The overexpression and purification recombinant protein were extracted and analyzed by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), the result showed that size of the recombinant protein was consistent with the predicted . The His-tagged recombinant proteins of RtCOMT were purified by Ni-IDA His-Bind to obtainRtCOMTin vitro, it is necessary for further study in protein structure and catalytic function ofRtCOMT.
Reaumuriatrigyna; Caffeic acid O-methyltransferase (COMT); Prokaryotic expression; Protein purification
ZHANG Huirong,female,Ph.D student.Research area:plant resistance and molecular biology, functional components.E-mail: 523537961@qq.com
WANG Yingchun, female,professor.Research area:plant resistance and molecular biology, functional components.E-mail: ycwang@imu.edu.cn
日期:2016-10-20
2015-06-10
2015-08-31
国家自然科学基金(31360063);内蒙古自治区高等学校创新团队发展计划(NMGIRT1401)。
张慧荣,女,在读博士,从事植物分子与抗逆生物学。E-mail:523537961@qq.com
王迎春,女,教授,从事植物分析与抗逆生物学。E-mail: ycwang@imu.edu.cn
Q943.2
A
1004-1389(2016)10-1529-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161020.1655.032.html
Received 2015-06-10 Returned 2015-08-31
Foundation item National Natural Science Foundation of China (No.31360063); Program for Innovative Research Team in Universities of Inner Mongolia Autonomous Region(No.NMGIRT1401).
