马鹿茸间充质干细胞软骨分化过程表面标志物的特征性变化
2016-12-13王姗姗郑永富马梦婷高庆华韩春梅
王姗姗,郑永富,马梦婷,高庆华,3,韩春梅,3
(1. 塔里木大学 动物科学学院,新疆阿拉尔 843300;2. 塔里木大学 生命科学学院,新疆阿拉尔 843300;3. 新疆生产建设兵团 塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
马鹿茸间充质干细胞软骨分化过程表面标志物的特征性变化
王姗姗1,郑永富1,马梦婷2,高庆华1,3,韩春梅1,3
(1. 塔里木大学 动物科学学院,新疆阿拉尔 843300;2. 塔里木大学 生命科学学院,新疆阿拉尔 843300;3. 新疆生产建设兵团 塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
利用阿利新蓝、甲苯胺蓝、茜素红染色和免疫组化法鉴定鹿茸间充质干细胞(MSCs)不同分化阶段蛋白多糖、Ca2+和Ⅱ型胶原蛋白3种软骨细胞表面标志物的分泌量。结果表明,诱导第14~21 天细胞蛋白多糖分泌逐渐增加,阿利新蓝和甲苯胺蓝染色结果逐渐达强阳性,至第28 天时蛋白多糖胞外积累量开始下降;茜素红染色与免疫组化结果显示,诱导第14~35 天,细胞阳性结果均逐渐上升,第35 天茜素红染色与免疫组化检测阳性结果显著高于前3个阶段。表明:体外诱导鹿茸MSCs至第14 天软骨细胞开始出现,并分泌蛋白多糖和少量Ⅱ型胶原蛋白,第21 天软骨细胞大量出现,开始分泌少量Ca2+,至第28 天时软骨开始向骨分化,蛋白多糖分泌下降,Ca2+在胞外积累,第35 天软骨细胞完成终末分化进入钙化期。
鹿茸;间充质干细胞;软骨分化;体外诱导;表面标记
成体间充质干细胞(MSCs)是目前备受关注的具有可塑性的成体干细胞。研究[1-2]表明MSCs具有可塑性好、永生化但癌变几率小、易定向诱导分化等优点,从组织分离的MSCs在体外定向诱导下可分化为靶组织细胞并维持其增殖能力,使其在应用领域发挥重要作用。鹿茸MSCs是新发现的一类成体干细胞,由角柄骨膜发育而来,细胞呈梭形,含有单个呈椭圆型的细胞核,细胞质含量较少,核较大,是软骨内骨化模式的细胞储备层[3-4]。鹿茸软骨细胞形态极不规则,细胞核仁不明显,其增殖、骨化与鹿茸的快速生长密切相关[5-7]。鹿茸从萌发到骨化的过程中伴随着2种成骨模式:膜内成骨和软骨内骨化。膜内成骨主要发生在初角茸形成和角柄萌发的阶段,软骨内骨化主要发生在鹿茸角纵向快速增长期[6-8]。鹿茸的软骨内骨化与人长骨发育模式十分相似,均是由间充质干细胞密集分化为软骨细胞进而分化成骨细胞[9]。因此,鹿茸是骨生理及骨医学研究的理想模型。
软骨细胞在形成的过程中,能够分泌Ⅱ型胶原(ColⅡ)和蛋白多糖2类细胞表面标志物。胶原纤维的生物成分是胶原蛋白,类型多达26种,其中ColⅡ仅分布于软骨组织。ColⅡ使软骨组织具有一定的张力和硬度,同时是软骨细胞分泌的特征性基质。研究[10-11]表明,体外培养数周的软骨细胞具备分泌ColⅡ基质的能力,但是在传代培养过程中细胞开始表达Ⅰ型和Ⅲ型胶原,并丧失分泌软骨基质的能力;蛋白多糖是一种黏性的胶冻分子,极亲水性,使软骨组织富含水分而具有高度的张力和弹性以抵抗压力,大多数蛋白多糖分子以高分子聚合体的形式存在,即以透明质酸为核心再连接多种成分而组成。软骨中的蛋白多糖以硫酸软骨素4、6和硫酸角质素为主。对猪不同组织的软骨细胞培养发现,第3代以后的细胞分泌蛋白多糖的量显著下降。软骨胶原蛋白和蛋白多糖作为软骨的连接蛋白和基质蛋白,是评价软骨细胞功能的重要指标[10]。目前,软骨细胞鉴定最简单可靠的方法是免疫组化法和甲苯胺蓝等染色法。免疫组化法是通过抗原抗体特异性结合检测软骨细胞分泌的ColⅡ;甲苯胺蓝和阿利新蓝染料可与细胞分泌的带有特殊化学基团的蛋白多糖结合而显色,因此可鉴定软骨细胞分泌的带有羧基(COOH)和硫酸基(OSO3H)的蛋白多糖;茜素红染料与细胞分泌的Ca2+螯合产生红色复合物,因此可检测细胞外Ca2+的沉积量。体外诱导软骨分化是骨生理代谢研究的主要方式。
本试验采用4种软骨鉴定方法(甲苯胺蓝、阿利新蓝、茜素红染色和ColⅡ免疫组化法),检测鹿茸MSCs软骨分化不同阶段的软骨细胞表面标志物,比较表面标志物的变化差异,观察分析鹿茸MSCs软骨分化过程中不同细胞的功能和生理特征,研究其软骨内骨化模式特点,为鹿茸软骨生化特性及鹿茸快速生长和再生的研究提供线索。
1 材料与方法
1.1 主要材料
马鹿茸MSCs(P2,塔里木畜牧科技兵团重点试验室提供),DMEM 低糖培养基(Thermo)、胎牛血清( FBS,Gibco)、青霉素钠(80万单位)、链霉素钠(100万单位)、TGF-β1(Peprotech)、阿利新蓝(Amresco)、甲苯胺蓝(Amresco)、茜素红S(Amresco) 、胶原蛋白Ⅱ型多克隆抗体(Boster)、免疫组化染色试剂盒(Boster)、DAB显色试剂盒(Boster)。
1.2 试验方法
1.2.1 细胞诱导 取冻存的第2代马鹿茸MSCs,37 ℃水浴融化后离心,调整密度后接种到6孔细胞板中培养。培养一定时间后,将培养MSCs的培养基(含双抗和φ=10%FBS的DMEM)换成诱导培养基(含有10 ng/mL TGF-β1、地塞米松、抗坏血酸的完全培养液)继续培养,每2 d半量换液1次。
1.2.2 诱导过程表面标志物的鉴定 分别取诱导组第7、14、21、28和35 天的细胞,每组3个重复孔。吸去培养基,加入PBS冲洗3次,最后加入φ=4%的多聚甲醛于4 ℃过夜固定,之后分别用阿利新蓝、甲苯胺蓝、茜素红染色法和免疫组化法进行鉴定。检测方法按试剂盒说明进行。显微镜下观察拍照后统计数据。
1.2.3 数据统计方法 染色和免疫组化结果根据许良中等[12]对免疫组织化学检测结果的判断标准进行统计。每个阶段每种检测法设置3个重复,每个重复选择6个显微镜视野进行观察。判断标准的评分采用H-seore法,H-score为染色强度得分与阳性细胞百分比得分的和。阳性细胞百分比分成5级:无阳性细胞为0分,阳性细胞≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。着色强度分4级:无色为0分,淡染色为1分,深染色为3分,介于两者之间为2分。最终H-score评分结果是:0分为阴性(-),2~3分为弱阳性(±),4~5分为阳性(+),6~7分为强阳性(++),其中阳性和强阳性均判为阳性。数据利用SPSS17.0统计分析,用“平均数±标准差”表示。
2 结果与分析
2.1 诱导分化不同阶段4种方法的检测
2.1.1 阿利新蓝染色 由图1可知,鹿茸MSCs体外诱导第7 天时,显微镜下观察细胞呈梭形,仅有细胞核发生蓝染,胞质未被染色,说明无阳性细胞(图1-A);诱导第14 天和21 天时,阳性细胞呈三角形,其细胞核、胞质及胞外基质均观察到明显蓝染(图1-B~1-C)。随着诱导天数至第28和35 天时,更多细胞呈三角形变化,可观察到蓝染的胞核,但胞质蓝染强度减弱,胞外基质完全不被染色(图1-D~1-E)。
2.1.2 甲苯胺蓝染色 诱导后细胞的甲苯胺蓝染色结果见图2。诱导第7 天细胞的胞核、胞质被蓝染未出现异染。在诱导第14 天时,阳性细胞呈区域化的异染,胞质呈蓝紫色。在诱导第21 天时,全部细胞呈阳性反应,胞质异染呈蓝紫色,异染效果较诱导14 d的细胞更为明显。观察诱导第28天和35 天的细胞,发现细胞密度降低,细胞不完整率增加,部分细胞发生胞质内异染。
2.1.3 茜素红染色 诱导后细胞的茜素红染色结果见图3。诱导第7 天细胞的胞质和胞外基质均未观察到阳性反应(图3-A)。在诱导第14 天时,仅在细胞外基质中观察到少量出现红色Ca2+结节物(图3-B)。此后,细胞质和胞外基质出现红色染色颗粒和结节物随诱导时间的延长而增多,且分布均匀广泛(图3-C~3-D)。在诱导第35 天时,在显微镜下可观察到细胞质和细胞外基质中大量的红色晶体颗粒和成片结节物,红色染色较深(图3-E)。
2.1.4 免疫组化 诱导后细胞的免疫组化结果见图4。诱导过程ColⅡ的阳性反应与茜苏红染色结果相似。诱导第7 天细胞的细胞质和胞外基质完全没有被染色,反应为阴性(图4-A)。随着诱导时间的延长,阳性细胞质和胞外基质中被染色强度增加。在诱导第14 天时,少量阳性细胞胞质和外基质均被染色呈淡黄色(图4-B)。诱导第21 、28和35 天,75%以上的细胞呈阳性反应,胞质内及外基质被染色呈棕黄色(图4-C~4-E)。

图1 阿利新蓝染色鉴定(×100)
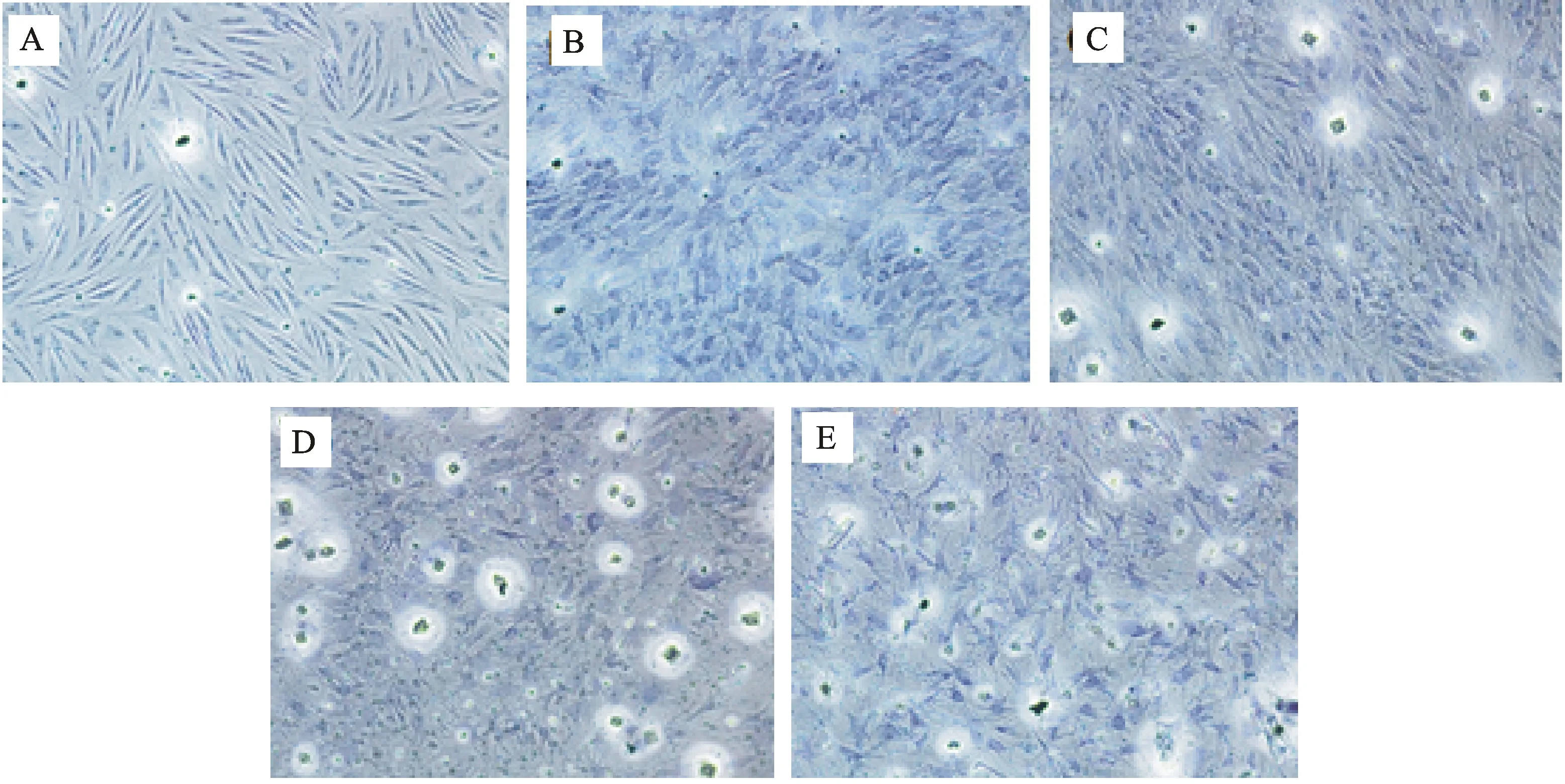
图2 甲苯胺蓝染色鉴定(×100)
2.2 软骨细胞表面标志物的鉴定
由表1可知,4种方法中阿利新蓝染色法最早检测到鹿茸MSCs软骨分化的表面标志物-硫酸软骨素蛋白多糖,甲苯胺蓝染色是鉴定诱导第14 天的细胞,检测到蛋白多糖。2种方法在第21 天阳性反应最强,硫酸软骨素等蛋白多糖分泌量达到最大。在随后的反应中阳性结果降低,说明随诱导阶段延长硫酸软骨素蛋白多糖的分泌量逐渐下降。
茜素红染色结果说明细胞在诱导第14 天后细胞开始分泌钙离子,且分泌量与细胞诱导的时间呈正比;免疫组化法检测结果显示,诱导第14 天的细胞反应结果呈弱阳性,表明细胞开始少量分泌Col Ⅱ。诱导第21、28和35 天的细胞反应结果呈阳性和强阳性,诱导第21 天后的细胞大量分泌Col Ⅱ,且分泌量随着诱导时间的增加而增加,在诱导第35 天时分泌量达到最大。

图3 茜素红染色鉴定(×100)

图4 免疫组化法鉴定(×100)
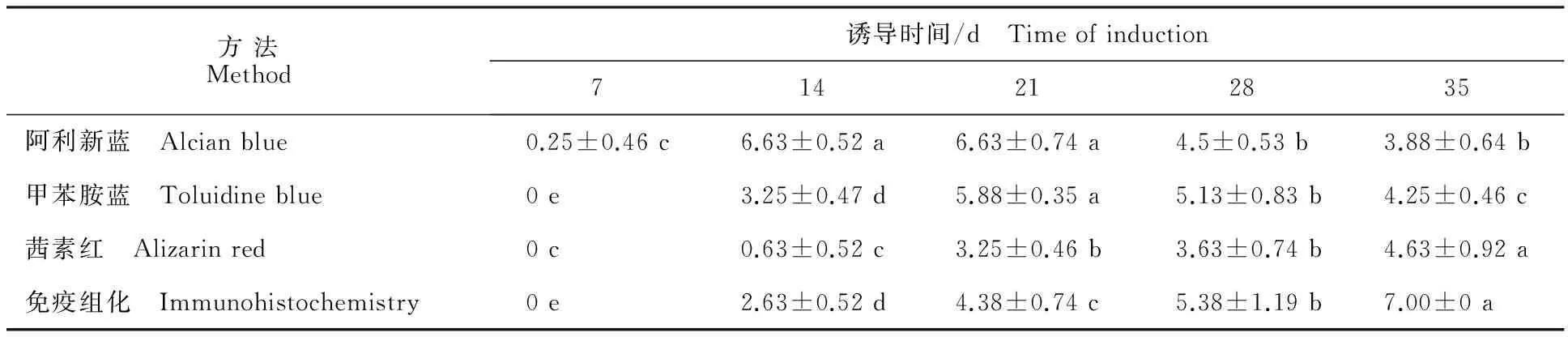
表1 4种方法检测不同诱导阶段细胞的阳性结果统计
3 结论与讨论
3.1 鹿茸MSCs软骨分化过程蛋白多糖分泌的变化特征
现已证实软骨细胞具有合成软骨蛋白多糖基质的能力。蛋白多糖由透明质酸和硫酸软骨素或硫酸角质素组成,为软骨的特征分泌物[13]。本试验结果表明,在鹿茸MSCs向软骨细胞分化的过程中,诱导第14天的细胞能够分泌少量的蛋白多糖。罗斯敏[14]利用人脂肪间充质干细胞(ADSCs)体外诱导软骨分化,通过Realtime PCR检测细胞蛋白多糖mRNA的表达量,发现诱导12 d细胞的表达量最大,这与本试验阿利新蓝染色结果相似;滕勇等[15]体外诱导人骨髓MSCs软骨分化时,使用甲苯胺蓝染色鉴定,发现诱导15 d的细胞染色呈阳性结果,与本试验第14天的鉴定结果一致。
试验结果得到关于蛋白多糖分泌量和胞外积累量的特点,诱导第14~21天细胞的阿利新蓝和甲苯胺蓝染色情况发现,呈阳性反应的细胞由之前的聚集区细胞扩大到全部细胞。且随分化形成软骨细胞数量的增多,细胞表面标志物的分泌量逐渐增加,且在胞外的积累量达到最大。该结果与谢永辉[16]研究兔骨髓间充质干细胞体外诱导软骨分化的试验结果一致。该过程完全符合人长骨软骨内骨化的特征:MSCs先发生聚集现象,之后再开始向软骨分化。
细胞在诱导28 d以后,显微镜下观察发现软骨细胞数量开始逐渐下降,细胞开始出现衰老、破损和死亡等现象。阿利新蓝和甲苯胺蓝染色的阳性结果也开始下降。一方面,胞外蛋白多糖的积累量下降可能与软骨细胞的生理变化有关。茜素红检测诱导28 d后细胞Ca2+的分泌,表示细胞开始进入骨分化期,此时软骨细胞分泌蛋白多糖的能力下降。此外透明质酸酶等降解酶对胞外基质中蛋白多糖有降解作用,也可导致细胞外蛋白多糖的量开始下降;另一方面,胞外蛋白多糖的积累量下降与细胞生长状况相关。诱导后期因为空间等外界因素的影响,细胞出现破损死亡,相应胞外基质中蛋白多糖会被加速降解[17-19]。
3.2 鹿茸MSCs软骨分化过程ColⅡ和Ca2+分泌变化特征
罗斯敏[14]通过Realtime PCR检测ADSCs成软骨分化,结果表明诱导至21 d细胞的Col Ⅱ mRNA的表达量达高峰,而后Col Ⅱ mRNA的表达量下降,且诱导21 d的细胞开始分泌Ca2+。本试验结果表示,在鹿茸MSCs诱导过程中14 d的细胞开始分泌Col Ⅱ,表示诱导14 d的细胞已是具有分泌基质功能的软骨细胞。该结果与阿利新蓝和甲苯胺蓝染色结果一致。诱导28 d的细胞外出现钙螯合物,表明28 d的细胞有肥大成熟向骨细胞分化的趋势,诱导35 d时完成终末分化进入钙化期,这与罗斯敏的研究结果十分相似。
本试验结果表明,鹿茸软骨胞外胶原的积累量与诱导时间呈正相关,该结果与其他研究成体MSCs软骨分化的试验结果一致[20-22]。研究表明胶原前体的分泌途径和腺细胞分泌蛋白质的细胞内途径完全一样,翻译后的新生肽在内质网上加工转运修饰,最后由高尔基体运送到胞外形成不溶性胶原。胶原是一种具有刚性的纤维状蛋白,其半衰期较长,正常情况下胶原在形成后不易降解,在软骨细胞外形成一定空间结构,既维持软骨组织结构又保护软骨组织,即使分泌量下降,但是胞外的积累量会持续增加[17-18]。只有在细胞处于异常情况,如软骨细胞或骨细胞死亡时,周围组成会产生胶原酶对胶原进行降解。
通过10 ng/mL TGF-β1体外诱导鹿茸MSCs,利用阿利新蓝、甲苯胺蓝、茜素红染色和免疫组化4种方法检测软骨表面标志物变化,认为诱导14 d的鹿茸MSCs进入鹿茸软骨细胞期,维持2周后软骨分化完成,至诱导第28 天时软骨细胞进入骨细胞分化。
Reference:
[1]FISCHER J,DICKHUT A,RICKERT M,etal.Human articular chondrocytes secrete parathyroid hormone-related protein and inhibit hypertrophy of mesenchymal stem cells in coculture during chondrogenesis[J].JournalofCasesonInformationTechnology,1996,16(2):58-71.
[2]陈克明,葛宝丰,刘兴炎,等.骨髓间充质干细胞复合纤维蛋白凝胶修复大面积关节软骨缺损[J].中国矫形外科杂志,2004,12(6):444-446.
CHEN K M,GE B F,LIU X Y,etal.Repair of large full-thickness defects of articular cartilage in rabbits by autologous mesenchymal stem cells suspended in fibrin gel[J].TheOrthopedicJournalofChina,2004,12(6):444-446(in Chinese with English abstract).
[3]李光凤.梅花鹿鹿茸的组织学及间充质层细胞体外诱导分化研究[D].长春:吉林大学,2008.
LI G F.Study on histological structure of sika deer antlers and differentiation of mesenchymal layer cells in vitro[D].Changchun:Jilin University,2008(in Chinese with English abstract).
[4]张霄蓓,王姗姗,孟 浩,等.塔里木马鹿茸间充质干细胞体外培养及细胞特性的研究[J].经济动物学报,2014,18(2):81-85.
ZHANG X B,WANG SH SH,MEN H,etal.Culture of Tarim red deer antler mesenchymal stem cells in vitro and biological characteristics[J].JournalofEconomicAnimal,2014,18(2):81-85(in Chinese with English abstract).
[5]LI C,CLARK D E,LORD E A,etal.Sampling technique to discriminate the different tissue layers of growing antler tips for gene discovery [J].TheAnatomicalRecord,2002,268(2):125-130.
[6]KIERDORF U,STOFFELS E,STOFFEL D,etal.Histological studies of bone formation during pedicle restoration and early antler regeneration in roe deer and fallow deer[J].TheAnatomicalRecordPartA:DiscoveriesinMolecular,Cellular,andEvolutionaryBiology,2003,273(2):741-751.
[7]KIERDORF U,KIERDORF H.Pedicle and first antler formation in deer:anatomical,histological,and developmental aspects[J].ZeitschriftFurJagdwissenschaft,2002,48(1):22-34.
[8]GYURJAN I,MOLNAR A,BORSY A,etal.Gene expression dynamics in deer antler:mesenchymal differentiation toward chondrogene sis[J].MolecularGeneticsandGenomics,2007,277 (3):221-235.
[9]郭 雄.软骨分子生物学基础与临床应用[M].西安:西安交通大学出版社,2012:1-35.
GUO X.Molecular Biology and Clinical Application of Cartilage[M].Xi’an:Xi’an Jiaotong University Press,2012:1-35 (in Chinese).
[10]曹谊林.组织工程学理论与实践[M].上海:上海科学技术出版社,2004:118-128.
CAO Y L.Tissue Engineering Theory and Practice[M].Shanghai:Shanghai Science and Technology Press,2004:118-128(in Chinese).
[11]DINSER R,KREPEL F,ZAUCKE F,etal.Comparison of long-trem transgene expression after non-viral and adenoviral genetransfer into primary articular chondrocytes[J].HistochemistryandCellBiology,2001,116(1):69-77.
[12]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
XU L ZH,YANG W T.Criteria for judging the results of the immunohistochemical reaction[J].ChinaonCology,1996,6(4):229-231(in Chinese).
[13]焦 俊.骨发育与骨龄测评[M].贵阳:贵州科技出版社,2004:6-8.
JIAO J.Bone Development and Bone Age Assessment[M].Guiyang:Guizhou Science and Technology Press,2004:6-8(in Chinese).
[14]罗斯敏.人脂肪间充质干细胞成软骨分化的可视化研究及Wnt/β-catenin信号通路在分化中的作用及机理研究[D].广州:暨南大学,2012.
LUO S M.Visualization of human adipose-derived stem cells into chondrocytes and roles of Wnt/β-catenin signaling in chondrogenic differentiation[D].Guangzhou:Jinan University,2012(in Chinese with English abstract).
[15]滕 勇,胡蕴玉,王 臻,等.成人骨髓基质干细胞体外定向诱导分化为软骨细胞的实验研究[J].中华实验外科杂志,2005,22(2):144-146.
TENG Y,HU Y Y,WANG ZH,etal.Differentiation of human bone marrow-derived mesenchymal stem cells into chon drocytes in vitro[J].ChineseJournalofExperimentalSurgery,2005,22(2):144-146(in Chinese with English abstract).
[16]谢永辉.兔脂肪源性干细胞的生物学特性及其向成骨成软骨诱导分化的实验研究[D].广州:南方医科大学,2013.
XIE Y H.A experimental study on basic biological characteristic and inducing to osteogenesis or chondrogenesis rabbit of adipose-derived stem cells[D].Guangzhou:Southern Medical University,2013(in Chinese with English abstract).
[17]李玉瑞.细胞外间质的生物化学及研究方法[M].北京:人民卫生出版社,1988:1-133.
LI Y R.Biochemistry and Research Methods Extracellular Matrix[M].Beijing:People’s Health Publishing House,1988:1-133(in Chinese).
[18]胡 敏,李劭伟,赵 钢.人体组织工程学[M].北京:军医出版社,2006:34-41.
HU M,LI SH W,ZHAO G.Human Tssue Engineering[M].Beijing:Medical Publishing House,2006:34-41(in Chinese).
[19]金 岩.组织工程学原理与技术[M].西安:第四军医大学出版社,2004:102-104.
JIN Y.Tissue Engineering Principles and Techniques[M].Xi’an:Fourth Military Medical University Press,2004:102-104(in Chinese).
[20]同志超,杨 镇,同志勤,等.骨髓间质干细胞体外定向诱导分化为软骨细胞的实验研究[J].中国骨伤,2008,21(5):362-364.
TONG ZH CH,YANG ZH,TONG ZH Q,etal.Study of inducing bone marrow derived mesenchymal stem cells into chondrocytes in vitro[J].ChineseOrthopedics,2008,21(5):362-364(in Chinese with English abstract).
[21]郭 璇.兔骨髓间充质干细胞培养及向成软骨细胞的诱导分化的实验研究[D].济南:山东大学,2011.
GUO X.The experimental study on culture and differentiate of rabbit bone marrow mesenchymal stem cells[D].Jinan:Shandong University,2011(in Chinese with English abstract).
[22]SON H M,YANG F H,CHU W H,etal.Lentiviral-mediated RNAi knockdown of cbfa1 gene inhibits endochondral ossification of antler stem cells in micro-mass culture[J].PloSOne,2012,7(10):47367.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Analysis of Cell Surface Markers in Differentiation of Antler Mesenchymal Stem Cells into Chondrocytes in Vitro
WANG Shanshan1,ZHENG Yongfu1,MA Mengting2,GAO Qinghua1,3and HAN Chunmei1,3
(1. Institute of Animal Science,Tarim University,Alar Xinjiang 843300,China; 2.College of Life Science,Tarim University,Alar Xinjiang 843300,China; 3.The Key Laboratory of Animal Science and Technology in Tarim Xinjiang Production and Construction Corps,Alar Xinjiang 843300,China)
Used four methods of alcian blue,toluidine blue,alizarin red staining and immunohistochemistry,three cells’ surface markers,including Proteoglycans,Ca2+and Col Ⅱ,were identified on the 14th,21st,28th and 35th d mesenchymal stem cells(MSCs) by stimulating using growth factor beta1 (TGF-β1,10 ng/mL) in vitro. Alcian blue staining and toluidne blue staining revealed heavy positive staining in the cellular matrix from the 21th d,while its accumulations decreased after 28th d. By two methods of alizarin red staining and immunohistochemical staining,the amount of positive cells increased gradually from the 14th d to 28th d in the cartilage differentiation process. While results of the other stages showed significant difference. In conclusion,during the cartilage differentiation process,antler MSCs began to differentiate to secrete protein polysaccharide and a small amount of Col Ⅱ after induction for 14th d. After the 28th d osteogenic differentiation of antler cartilage cells began to be detect when protein polysaccharide decreased. After 21th d the cartilage cells began to secrete a small amount of Ca2+,amount of Ca2+has accumulated in the extracellular along with the induction time. Antler MSCs were induced to terminally differentiate after 35th d.
Antle; Mesenchymal stem cells; Chondrogenesis; Induction in vitro; Surface markers
WANG Shanshan ,female,master student. Research area:animal genetics and breeding.E-mail: wangshan1801640@163.com
HAN Chunmei,female,Ph.D,professor. Research area:animal genetics and breeding. E-mail:chunmeihan224@163.com
2015-11-15
2016-03-13 基金项目:国家自然科学基金(31260541);新疆自治区研究生科研创新项目(XJGRI2014141)。
王姗姗,女,硕士研究生,研究方向为动物遗传育种与繁殖。E-mail:wangshan1801640@163.com
韩春梅,女,博士,教授,研究方向为动物遗传育种与繁殖。E-mail:chunmeihan224@163.com
日期:2016-10-20
S825
A
1004-1389(2016)10-1458-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161020.1653.012.html
Received 2015-11-15 Returned 2016-03-13
Foundation item The National Natural Science Foundation of China (No.31260541);Xinjiang Uygur Autonomous Region Graduate Research and Innovation Project(No.XJGRI2014141).
