外源NO对NaCl胁迫下红砂幼苗生长和生理特性的影响
2019-07-25贾向阳种培芳张玉洁苏世平
贾向阳, 种培芳, 张玉洁, 李 毅, 苏世平
(甘肃农业大学林学院, 甘肃 兰州 730070)
一氧化氮(Nitric Oxide,NO)是动植物体中一种普遍存在的生物活性分子[1],广泛参与植物对逆境胁迫的应答过程,如清理盐害[2]所引起的MDA和O2-积累减轻盐害作用、诱导植物体内的抗氧化酶活性来有效缓解极端温度[3]所导致损伤、改善植物的光合作用和生长发育来提高对干旱胁迫[4]的适应性等。植物在遭受逆境条件下自身会通过一氧化氮合酶和硝酸还原酶催化等途径产生NO。大量研究表明,NO在参与植物逆境应答中具有双重生理效应,高浓度NO具有协同加剧盐胁迫的作用,而处于低浓度状态时NO能够缓解盐害[2,5-7]。硝普钠(sodium nitroprusside,SNP)又名亚硝基铁氰化钠,是外源NO的直接供体,研究发现,0.5 mmol·L-1SNP在水中可释放约2.0 μmol·L-1NO[8]。当NO处于低浓度状态时(<0.10 mmol·L-1SNP)能够增强海边月见草(OenotheradrummondiiHook)的保水能力[5];促进玉竹(Polygonatumodoratum(Mill.) Druce)幼苗可溶性糖、可溶性蛋白和脯氨酸合成[7],延缓黄瓜(CucumissativusL)叶片中MDA和H2O2积累[9],减轻盐胁迫诱导的膜脂过氧化损伤[10],在玉米(Zeamays)幼苗对离子选择吸收方面表现促K+抑Na+的现象[11]等。同时,NO(<10 μmol·L-1SNP)可以通过增强日本晴水稻(OryzasativaL.japonica.cv.Nipponbare)幼苗的抗氧化系统进而提高植物的耐盐性[12]。可以看出,近年来应用NO调控植物逆境胁迫的研究比较广泛。
红砂(Reaumuriasoongorica)是我国荒漠地区分布最广泛的半灌木,主要分布在荒漠和半荒漠山前平原、山地丘陵和戈壁等环境下,是这一地带的优势种和建群种,在盐碱地改良、防风固沙及保护绿洲等方面具有重要的生态价值[13],同时在草原化荒漠和典型荒漠地区常被牧民作为牲畜的饲料[14-15]。红砂具有一定的耐盐性,其建群或共建群落主要分布在总盐量在0.5%~2.0%的荒漠地带盐渍化土壤上[16-17],盐分在一定程度上抑制了其生长,以初生代谢的生物量是评价其耐盐性的重要指标。近年来,利用可溶性小分子脯氨酸[18]对蛋白质的保护作用,信号分子水杨酸[19]诱导物体内相关蛋白基因表达,生长素[20]调控特定基因的表达等外源物质对植物耐盐机理的研究比较广泛,如牛宋芳等[21]发现生长素之一的赤霉素可以促进盐胁迫下红砂种子的萌发,而有关NO调控红砂耐盐机理方面的研究至今尚未报道。本研究以硝普钠(SNP)为NO供体,通过研究不同浓度梯度外源NO对盐胁迫下红砂生长、离子含量、有机渗透物质动态及质膜氧化程度的影响,来探讨NO对红砂在盐胁迫下的生理响应机制,以期为NO提高植物耐盐性提供理论依据。
1 材料与方法
1.1 材料与处理
本实验在甘肃农业大学校园科研基地四周通风顺畅且透光良好的人工遮雨棚内进行,红砂种子2016年10月采自武威民勤老虎口(102°58′E,38°44′N)以0.03% H2O2消毒30min,多次漂洗干净后播撒(2017年4月1日)于预先灭菌(防止病菌和虫害)处理的土壤(采自民勤红砂种源采集地灌木林生长的0~20 cm土层,土壤PH值为7.85,有机碳8.82 g·Kg-1,全氮含量为0.47 g·Kg-1,全磷0.25 g·Kg-1,全钾0.12 g·Kg-1,钠0.76 g·Kg-1,土壤去杂后同泥炭土和珍珠岩按3:1:1混合均匀进行改良,每盆称取干土重量1.300 Kg),花盆(口径17 cm,高15 cm,底径12 cm)中,在自然光照下幼苗顶部长至5-6枚簇生叶时疏苗,每盆保留3株。2017年7月2日选择株高为10±1cm的苗木用于实验处理,CK和盐溶液用1/2 Hoagland营养液配制,为防止盐分冲击,开始采取递增50 mmol·L-1的NaCl浇灌,每天19:00浇灌一次,每次浇灌量为盆内土壤持水量(21.67%)的3倍,约有2/3的溶液流出,以保持盆内盐分浓度的恒定[22]。7月7日到达溶液最终浇灌浓度后(300 mmol.L-1,此时土壤钠21.87 g·Kg-1,全钾0.15 g·Kg-1)在叶面喷施用提前用蒸馏水配置好的NO供体(硝普钠,SNP)进行处理,每天早晨7:00喷施一次,每次以液滴刚刚落下为止,对照和单独NaCl处理喷施等量蒸馏水,连续处理30天后在2017年8月7日采集红砂茎中部的功能叶片用液氮速冻后带回实验室—70℃保存,及时测定各项指标。其中1/2 Hoagland营养液购自成都市科隆化学药品有限公司,包括2 mmol·L-1KNO3,0.5 mmol·L-1NH4H2PO4,0.1 mmol·L-1Ca(NO3)2.4H2O,0.25 mmol·L-1MgSO4.H2O,0.5 mmol·L-1Fe-citrate,92 μmol·L-1H3BO3,10 μmol·L-1MnCl2.4H2O,1.6 μmol·L-1ZnSO4.7H2O,0.6 μmol·L-1CuSO4.5H2O,0.7 μmol·L-1(NH4)6Mo7O24.4H2O。每个处理6组重复,共42盆;遮雨棚内最高日温和最低夜温分别为(30~38℃)/(20~22℃),相对湿度约30%~50%;具体实验设计如表1。
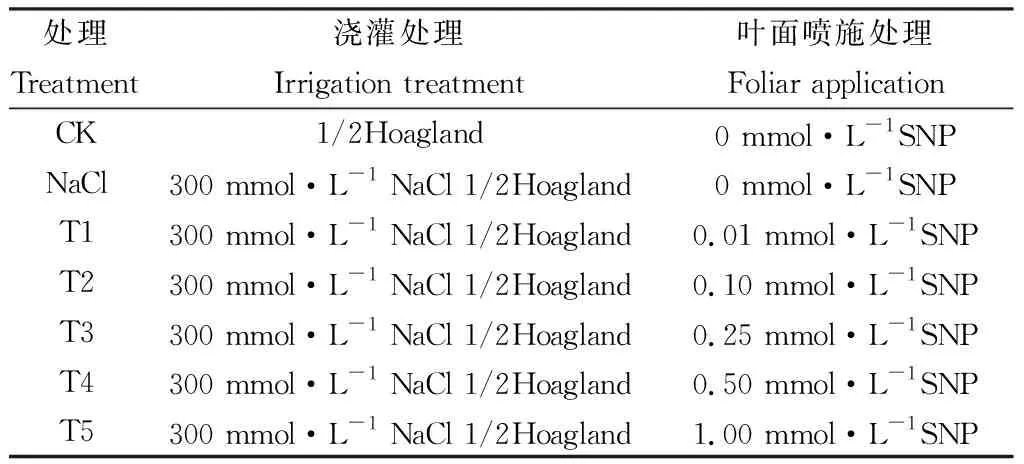
表1 盐分处理与对应的NO处理组合Table 1 Salt treatment combined with corresponding NO treatment
1.2 测定指标与方法
1.2.1 生长指标 在处理前t1和处理结束时t2分别量取红砂的株高H1和H2,平均株高生长速率(Average Height Growth Rate,AHGR)=(H2- H1)/(t2-t1),t2-t1的期限为30天。然后采用破坏性取样,用去离子水将整株红砂洗净,用滤纸吸干表面水分,110℃杀青10 min后于75℃烘干称重,得到每个处理下植株总干重。
1.2.2 离子含量的测定 采用H2SO4-H2O2法[23],将烘干的红砂植株地上和地下部分粉碎研磨后,过30目筛,称取0.5000 g样品放于消煮管后加入8 ml浓硫酸,盖上弯颈漏斗在消煮炉上文火消煮,管内大量冒白烟溶液成均匀的棕黑色时,逐滴加入10滴左右H2O2摇匀后继续消煮,煮沸5 min取下,再加入10滴左右H2O2后进行消煮,逐次逐滴减量加入H2O2,直至溶液呈无色。取下冷却至室温后用蒸馏水定容到100 ml容量瓶中,用烘干恒重的K2SO4和NaCl(标准纯)配制一系列K+和Na+的标准溶液,在FP640型火焰光度计上测定,做标准曲线并计算植物体Na+和K+离子含量。
植株对K+的选择性运输系数(STK+,Na+)参照郑青松[24]提出的公式计算:
离子选择性运输K+的系数STK+/Na+=根(Na+/K+)/地上部分(Na+/K+)
1.3 渗透物质及丙二醛(MDA)含量的测定
参照李合生[25]的方法测定,采用蒽酮比色法、考马斯亮蓝法和磺基水杨酸法测定可溶性糖(Soluble sugar,SS)、可溶性蛋白(Soluble protein,SP)和脯氨酸(Proline,Pro)含量,丙二醛(Malondialdehyde,MDA)采用硫代巴比妥酸法。
1.4 数据处理
利用Origin2017作图,SPSS19.0进行数据分析,不同浓度SNP处理之间采用非参数单因素方差分析,差异显著性分析采用Duncan检测法进行多重分析,采用皮尔逊法进行双变量相关性分析。
2 结果与分析
2.1 NO对盐胁迫下红砂生长的影响
由表2方差分析结果显示NO对NaCl胁迫下红砂幼苗平均株高生长速率影响显著(P<0.05)。与对照(CK)相比,单独盐分处理显著(P<0.05)抑制了红砂的株高生长速率(图1.A),NO与盐分作用后,红砂株高生长速率先降后升,其中0.10 mmol·L-1的SNP处理时效果最显著(P<0.05),为单独盐分处理的258.06%,在SNP高于0.5 mmol·L-1处理后红砂株高变化与单独盐分处理未达到显著差异。由表2方差分析结果显示NO对NaCl胁迫下红砂幼苗总生物量影响显著(P<0.05)。与对照(CK)相比,单独盐分处理显著(P<0.05)降低了红砂的总生物量积累(图1.B),NO与盐分作用后,红砂株高生长速率先降后升,其中0.10 mmol.L-1的SNP处理时效果最显著(P<0.05),为单独盐分处理的267.20%,在SNP高于1.00 mmol·L-1处理后红砂总生物量积累低于单独盐分处理,但并未达到显著差异。由此可见,低浓度的NO(<0.25 mmol·L-1SNP)作用可以缓解盐胁迫下红砂的株高生长和生物量累积,而高浓度的NO(>0.50 mmol·L-1SNP)作用未能缓解盐胁迫对红砂的限制作用。
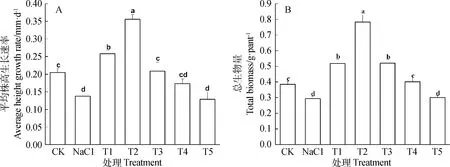
图1 NO对NaCl胁迫下红砂幼苗平均株高生长速率和总生物量的影响Fig.1 Effects of NO on average plant height growth rate and total biomass of R.soongorica seedings under salt stress注:不同小写字母表示处理之间差异显著(P<0.05),下同Note:Different lowercase letters indicate significant difference between treatments at the 0.05level,the same as below
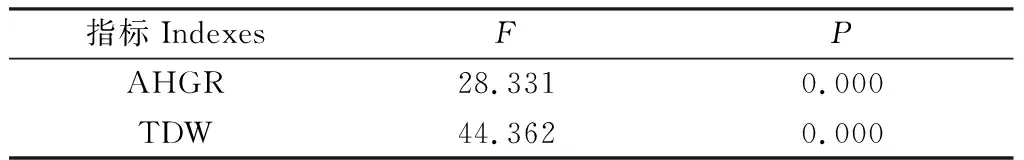
表2 NO对NaCl胁迫下红砂幼苗平均株高生长速率和总生物量的方差分析Table 2 Varianceanalysis of average plant height growth rate and total biomass of R.soongorica seedlings under NaCl stress
2.2 NO对盐胁迫下红砂可溶性糖(SS)、可溶性蛋白(SP)和脯氨酸(Pro)以及丙二醛(MDA)含量的影响
与对照相比,盐胁迫降低了红砂叶片中SS(图2.A)、SP(图2.B)和Pro(图2.C)含量,分别下降了19.05%,3.93%和1.62%,其中SS和SP均达到显著差异水平(P<0.05)。NO作用可显著改变盐胁迫下红砂叶片中的SS,SP和Pro含量,其中SS的含量呈现先上升后下降的趋势,在0.25 mmol·L-1的SNP处理下含量最高为单独盐分处理的142.86%,在1.00 mmol·L-1的SNP处理下SS含量最低为单独盐分处理的92.32%;而SP和Pro的变化趋势与SS相反,两者均在0.25 mmol·L-1的SNP处理下含量最低,分别为单独盐分处理下的90.37%和45.05%,高于0.25 mmol·L-1的SNP处理对红砂叶片中SP变化不显著,而对Pro变化显著并在1.00 mmol·L-1的SNP处理下取得极大值0.73 ug·g-1。与对照相比,单独盐胁迫处理下红砂叶片中MDA含量显著(P<0.05)上升了13.19%。不同浓度NO与盐分共同作用后红砂叶片中MDA含量呈先降后升的趋势,其中0.01~0.25 mmol·L-1的SNP作用显著降低了MDA的含量,在SNP浓度为0.10 mmol·L-1处理下MDA含量最低,为单独盐分处理下的52.17%,在1.00 mmol·L-1的SNP处理下MDA含量最高并且超过单独盐分处理21.02%(图2.D)。
2.3 红砂叶片SS、SP和Pro与MDA的相关性
表3所示外源NO对盐胁迫下红砂叶片SS、SP和Pro与MDA的相关性系数表明,MDA同SS和SP以及Pro分别极显著负相关(P<0.01)、相关和显著正相关(P<0.05);同时SS同SP、Pro分别显著负相关(P<0.05)或极显著负相关关系(P<0.01),而Pro和SP极显著正相关(P<0.01)。
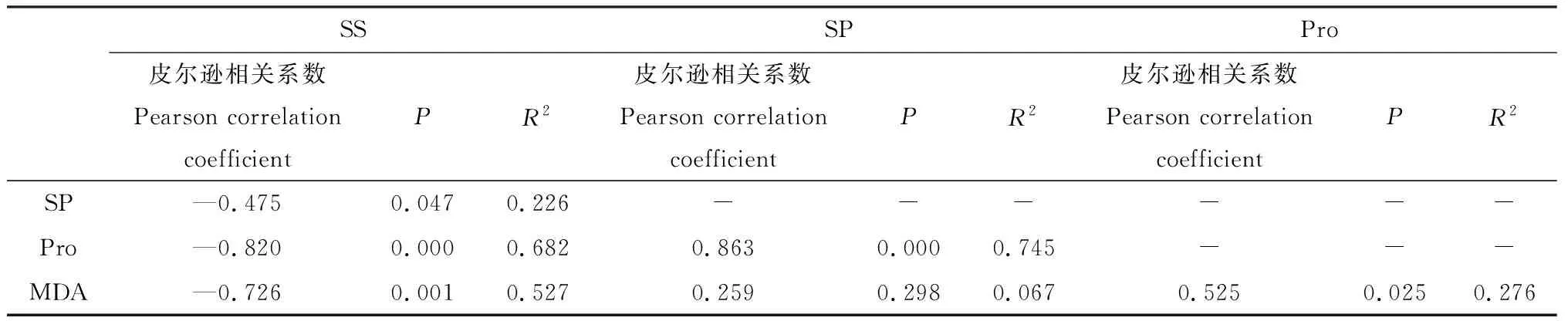
SSSPPro皮尔逊相关系数Pearson correlation coefficientPR2皮尔逊相关系数Pearson correlation coefficientPR2皮尔逊相关系数Pearson correlation coefficientPR2SP—0.4750.0470.226------Pro—0.8200.0000.6820.8630.0000.745---MDA—0.7260.0010.5270.2590.2980.0670.5250.0250.276
2.4 NO对NaCl胁迫下红砂Na+、K+含量的影响
如图3所示,与空白对照相比,单独盐分处理显著改变了红砂地上部分和地下部分中的Na+和K+含量(P<0.05),其中Na+和K+在地下部分中分别增加了83.69%和10.47%,地上部分中Na+含量增加了51.60%,而K+含量下降了28.25%。NO与盐分共同作用后,Na+和K+在各部分中保持了相同的变化趋势,其中Na+和K+在地上部分中除0.10 mmol·L-1的SNP处理上升之外呈先降后升的变化趋势,而在地下部分呈先降后升的变化趋势,最低点均出现在0.10 mmol·L-1的SNP处理下,并且与单独盐分处理差异显著(P<0.05)。
2.5 NO对NaCl胁迫下红砂Na+和K+选择性吸收与选择运输的影响
如图4所示,盐分处理显著提高了红砂地上和地下部分中Na+/K+比(P<0.05),NO与盐分共同作用下红砂各部分中Na+/K+比均呈先升后降再升变化趋势,其中在0.10 mmol·L-1的SNP处理下红砂地上部分和根部中的Na+/K+比最接近;红砂地上部分中Na+/K+比在0.10 mmol·L-1的SNP和1.00 mmol·L-1的SNP处理下出现极大值分别为5.53和6.62,最低值出现在0.25 mmol·L-1的SNP处理下为4.97;地下部分中Na+/K+比也在0.10 mmol·L-1SNP和1.00 mmol·L-1SNP处理下出现极大值,分别为5.35和4.43,而最低值出现在0.50 mmol·L-1SNP处理下为3.97。红砂地下部分限制Na+选择K+向上运输的能力(STK+/Na+值)始终小于1,盐分胁迫下红砂的STK+/Na+值降低为对照的79.67%,并且差异显著(P<0.05);NO和盐分共同作用后,红砂的STK+/Na+值呈先升后降的变化趋势,最高点出现在0.10 mmol·L-1SNP处,为盐分处理的1.23倍,最低点出现在1.00 mmol·L-1SNP处,为盐分处理的84.94%。
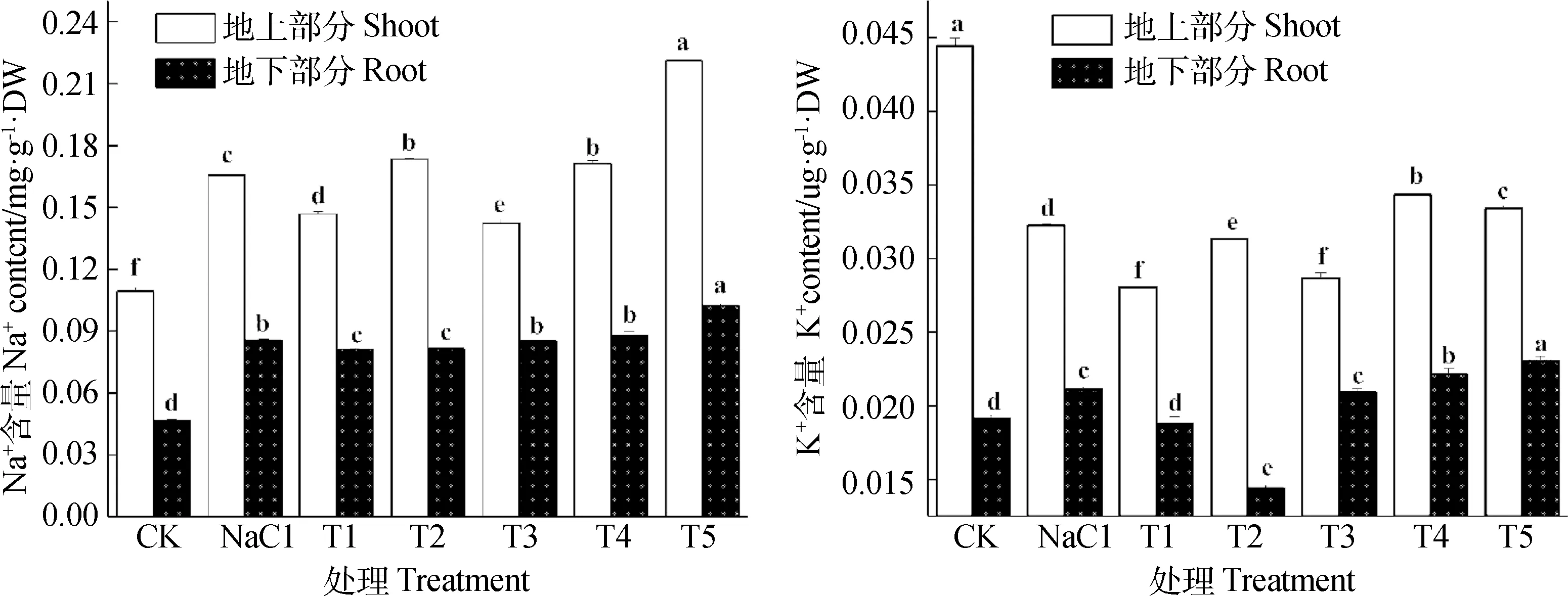
图3 NO对NaCl胁迫下红砂Na+和K+的影响Fig.3 Effects of NO on Na+ and K+content of R.soongorica under salt stress

图4 NO对NaCl胁迫下红砂Na+/K+和STK,Na的影响Fig.4 Effects of NO on Na+/K+ and STK+/Na+ of R.soongorica under salt stress
2.6 红砂Na+、K+、Na+/K+和ST K+/ Na+与红砂生长的相关性
NO对盐胁迫下红砂Na+、K+、Na+/K+和STK+/Na+与红砂生长指标之间的相关性表现出了一定的一致性(表4),其中红砂生长指标(平均株高生长速率和总生物量)与红砂地下部分中Na+、K+均成极显著负相关(P<0.01),与STK+/Na+和地下部分Na+/K+之间均成极显著正相关(P<0.01),而与红砂地上部分中Na+、K+和Na+/K+相关性较弱(P>0.05)。从相关性系数大小的角度看,STK+/Na+值> K+(地下部分)> Na+/K+值(地下部分)> Na+(地下部分)。
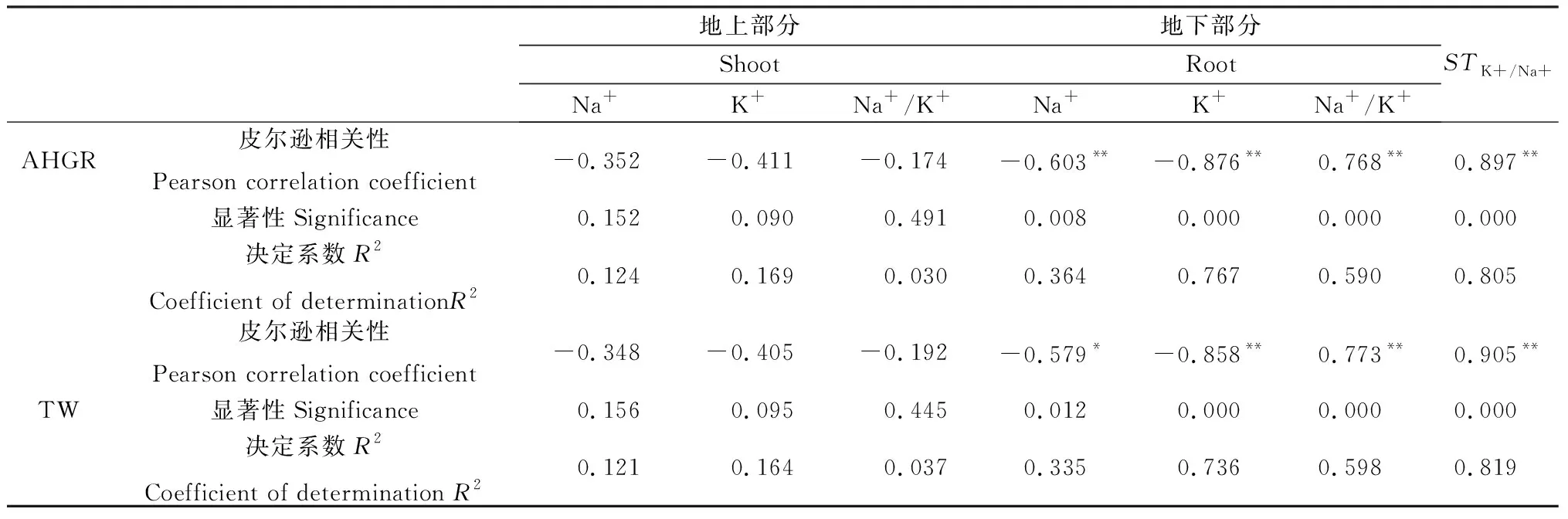
表4 NO对盐胁迫下红砂Na+、K+、Na+/K+和ST K+/Na+与红砂生长的相关性系数影响Table 4 Correlation analysis among Na+,K+,Na+/K+ and ST K+/Na+ in R.soongorica under salt stress with supplemental NO
注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)
Note:* indicate significant correlation at the 0.05 level;** indicate highly significant correlation at the 0.01 level
3 讨论
一般认为,盐胁迫通过离子毒害和渗透胁迫所引起的营养不平衡对植物个体造成伤害,引起植物代谢紊乱,影响植物的生长发育[26]。外源NO因可作用于细胞壁组分,使细胞壁松弛,增强膜的流动性,进而增强细胞扩展性,对与盐胁迫具有很好的调节性而备受关注[7,28]。本研究中,我们通过预实验发现红砂植株表现出了很强的耐盐性,当NaCl浓度达到300 mmol·L-1时才对红砂株高生长和生物量表现出显著影响(P<0.05),这一结果与赵书艺[27]以6周龄红砂幼苗处理1周后发现300 mmol·L-1的NaCl并未显著抑制红砂生长的研究结果不同,可能原因是高盐浓度且长时间处理下红砂体内集聚积累了大量的Na+破坏了红砂的稳态平衡。本研究显示,外源NO添加确实在一定程度上缓解了盐胁迫对红砂植物生物量下降的趋势,其中以0.10 mmol·L-1的SNP作用最显著,这与孙立荣[29]对黑麦草生长的研究结果相同。除此之外,NO还可能通过影响红砂幼苗的渗透调节和抗氧化系统的代谢来增强其对盐生环境的适应性[7,11-12]。
在盐胁迫环境下,植物可通过可溶性糖(SS)、脯氨酸(Pro)和可溶性蛋白(SP)等有机物质进行辅助调节。SS除了能为其它有机物的合成提供碳架和能量外[30,31],还可以通过提高SS的合成进而促进Pro的积累来调节细胞膜的稳定性[32]。而Pro除了参与渗透调节外,可被利用作为SP合成的材料[33],可发生甲基化使自身含量降低。赵奕翔,郑春芳等[7,34]分别对小麦和玉竹研究发现NO可以促进植物可溶性糖的合成;刘建新,杨双龙等[35,36]分别对黑麦草和玉米的研究发现NO通过调节Pro代谢过程不同途径中的关键酶活性来改变植物体Pro的含量提高植物的耐盐性。本研究中,300 mmol·L-1的NaCl胁迫下红砂叶片中三种物质含量均下降,低浓度NO作用可促进红砂叶片中SS的合成,降低Pro和SP含量,高浓度NO作用红砂叶片中SS含量下降,Pro和SP并未显著提高,始终低于盐胁迫处理。三者的相关关系表明Pro与SP和SS之间关系紧密,其中Pro与SP成正相关关系,而与SS成负相关关系,说明NO可以通过改变红砂叶片中利用SS合成Pro进而合成SP的方向来影响植物的生长,低浓度的NO具有反向调节促进植物生长,而高浓度的NO具有正向调节降低SS抑制生长的作用。
丙二醛(MDA)是具有细胞毒性的物质,能与膜结构上的蛋白质和酶结合、交联而使之失去活性,从而破坏膜结构,常作为植物遭受质膜过氧化损伤的指标之一[37]。研究发现,NO可以降低盐胁迫对植物膜系统的损伤[7]。红砂叶片SS、SP和Pro含量与MDA含量之间的相关关系表明,叶片MDA与SS和Pro含量之间有直接关系,其中SS和MDA成负相关关系,Pro与MDA成正相关关系。说明NO可以通过促进红砂叶片中SS的合成和Pro的降解来减轻盐胁迫对植物质膜过氧化的伤害。
植物的耐盐性在很大程度上取决于植物体内的离子平衡,红砂是典型的双子叶盐生植物。无机离子对双子叶盐生植物的渗透调节发挥了主要的作用[26],其中以Na+和K+占优势。盐离子在植物体内的有效分布和积累是植物提高其抗盐性的重要机制[38],本研究中,盐胁迫作用显著增加了红砂体内的Na+含量,这有利于提高植物的渗透调节能力[39]。Na+和K+具有相似的离子半径和水合能,两者可通过Na-K共转运蛋白相互竞争吸收位点及活性位点,盐胁迫下植物根部对Na+吸收增加的同时会抑制对K+的吸收,进而造成植物体内K+的亏缺[40]。在盐胁迫下对红砂叶片经NO处理后地上部分离子的动态受到影响,进而影响根部对离子的吸收,使得红砂地上部分和地下部分中保持了相同的离子和离子选择变化动态(图4)。离子的选择性吸收是植物耐盐性的重要方式之一[41],本研究发现,低浓度的NO作用可以缩小盐胁迫下红砂地上和地下Na+/K+值,而红砂Na+/K+值总体成升高趋势。这与张艳艳[9]对玉米的研究结果相反,主要原因可能是红砂属于盐生植物中的泌盐植物,盐生植物主要通过Na+的外排和区域化来减轻Na+在细胞质中累积所造成的毒害作用,而玉米是甜土植物,选择吸收K+有助于提高其抗盐能力。说明NO缓解红砂盐胁迫可能的机理之一是提高了红砂的泌盐性,产生的原因有待后期进一步研究。
红砂是盐生植物中的泌盐植物,在盐腺泌盐过程中存在主动的Na+、H+交换,质膜和液泡膜Na+/H+逆向转运蛋白协同作用,对红砂盐腺响应逆境的泌盐过程发挥着重要作用[28]。本研究中NO对红砂的耐盐性有一定的调节作用,但是是否通过Na+、H+交换,质膜和液泡膜Na+/H+逆向转运蛋白协同作用还有待进一步研究。另一方面,植物的抗盐能力取决于离子在植物体内的选择性运输能力[42],盐胁迫减弱了红砂控制Na+选择K+向地上部分运输的能力,一定的NO作用提高了红砂根部控制Na+选择K+向地上部分运输的能力,这可能与NO提高了植物在编码高亲和性钾离子运输系统和钾离子通道基因的表达量有关。红砂株高生长速率与体内Na+、K+、Na+/K+值和STK+,Na+之间的相关性表明,NO可以通过促进Na+在红砂根部大量积累,提高地下部分选择K+向地上部分的输送能力来适应盐生环境,而从相关性系数的大小可以看出红砂地下部分选择K+向地上部分的输送能力对红砂生长的贡献最大。
4 结论
综上所述,300 mmol·L-1的NaCl显著抑制了红砂植株的生长,改变了红砂叶片中SS、SP和Pro的含量,诱导了膜脂过氧化,影响了矿质营养元素的吸收和运输。外源NO能有效的缓解盐胁迫对红砂的抑制作用,其中低浓度具有缓解盐胁迫的作用。说明外源NO可显著改善红砂的耐盐生理特性,其通过选择性合成有机物质(增加SS的合成量,降低Pro和SP的合成量),降低膜脂过氧化程度,调控植物体对离子的选择性吸收和选择运输能力(提高植物体对Na+的选择吸收能力和地下部分选择K+向地上部分的输送能力),从而改善了红砂的生长性能。
