瘤胃4株纤维降解细菌的分离鉴定及其纤维降解特性
2016-12-13王卫云李大彪于永强邢媛媛李子健
王卫云 ,李大彪, 于永强,邢媛媛,李子健
(内蒙古农业大学动物科学学院,呼和浩特 010018)
瘤胃4株纤维降解细菌的分离鉴定及其纤维降解特性
王卫云 ,李大彪*, 于永强,邢媛媛,李子健
(内蒙古农业大学动物科学学院,呼和浩特 010018)
作者从蒙古绵羊瘤胃内容物中筛选出四株纤维素降解细菌并进行鉴定,将其编号为H1、H2、N1、N2,对菌株生长特性和纤维素酶活力进行测定,以期为后续试验提供试验材料。通过生理生化特征、DNA序列分析对分离菌株进行鉴定,比浊法测定细菌生长曲线,用还原糖法测定四株细菌的滤纸酶活、羧甲基纤维素酶活、水杨苷酶活和微晶纤维素酶活力。结果表明:经鉴定,四株菌中H1、H2为黄色瘤胃球菌(Ruminococcusflavefaciens),N1、N2为链球菌(Streptococcus);生长曲线测定表明菌株H1生长延迟期为4 h,H2、N1、N2均为3 h,黄色瘤胃球菌最大菌体浓度出现在28 h,链球菌为14 h;四株细菌均具有良好的纤维降解特性,其中H2滤纸酶活力、羧甲基纤维素酶活力、微晶纤维素酶活力显著高于菌株H1、N1、N2(P<0.05),H1滤纸酶活力最低,为0.08 μmol·(mL·min)-1。本试验利用hungate滚管法分离出4株具有纤维素酶活力的细菌,可以满足后续试验需要。
瘤胃纤维素降解细菌;筛选;鉴定;纤维素酶
瘤胃是牛、羊等反刍动物的重要消化器官,是自然界中具有很强纤维降解能力的微生态系统之一,其中栖息着大量的真菌、细菌、古菌、原虫和噬菌体等微生物,纤维性植物能够作为反刍动物主要能量来源,依靠的是瘤胃内存在的这些微生物,其中纤维分解菌在纤维素分解过程中发挥高达80%的作用[1]。反刍动物瘤胃对饲料结构变化具有极强的适应能力, 其本质是瘤胃微生物区系发生变化并且诱导相应酶系统发生重新配置。瘤胃内主要优势纤维分解菌包括黄色瘤胃球菌(Ruminococcusflavefaciens)、白色瘤胃球菌(Ruminococcusalbus)及产琥珀酸丝状杆菌(Fibrobactersuccinogenes)[2]。三种细菌在瘤胃中所占比例因动物饲料结构会发生改变,饲喂苜蓿干草的野牛瘤胃内, 产琥珀酸丝状杆菌的数量占到总纤维分解菌的58%, 远远高于饲喂秸秆饲料的杂交牛和家牛,这是由于野牛采食的饲草结构所决定的[3]。近年,除主要的三种降解纤维素分解细菌外,关于其他纤维素降解菌的研究也较多。张晓华[4]从瘤胃内容物中分离得到1株降解纤维素的厌氧瘤胃梭菌;刘玉承[5]等从绵羊的瘤胃内容物中分离到2株严格厌氧纤维降解细菌,其中1株为黄色瘤胃球菌,1株为丁酸弧菌;周非帆[6](2014)从蒙古绵羊瘤胃液中分离得到4株纤维分解细菌,分别为拜氏梭菌、丁酸梭菌、白色瘤胃球菌、粪肠球菌;孙美洲等[7]从荷斯坦奶牛瘤胃内容物中分离到 28 株厌氧真菌与甲烷菌共培养物共获得四种不同的厌氧真菌与甲烷菌组合,分别为Piromyces/类Methanobrevibacterolleyae菌株,Neocallimastix/类Methanobrevibacterolleyae菌株,Neocallimastix/类Methanobrevibacterthaueri菌株及Caecomyces/类Methanobrevibacterolleyae菌株。作者从绵羊瘤胃内容物中分离纤维素降解细菌,并对分离得到的纤维降解细菌纤维素酶活力进行了测定,旨在了解瘤胃纤维素降解细菌的生物学特性,为探究反刍动物营养物质消化利用机制提供试验材料。
1 材料与方法
1.1 材料
1.1.1 试验动物 瘤胃内容物采自体况良好的 1.5~2.0岁、体重 40 kg左右、安装永久性瘤胃瘘管的蒙古绵羊。试验动物按照维持需要的 1.2倍饲养[8]。试验动物统一驱虫,单笼饲养。
1.1.2 培养基的配制 参考高巍[9]的方法配制培养基。培养基分为初筛、富集、复筛以及冻存培养基。其中初筛培养基以1%羧甲基纤维素钠为唯一碳源并加入1%琼脂,每管8 mL分装到hungate滚管中;富集培养基中加入1%纤维二糖作为唯一碳源,每管分装9 mL到带塞试管中,滤纸发酵培养基中加入三片1 cm×5 cm的Whatman NO.1滤纸作为唯一碳源,每瓶分装60 mL到100 mL西林瓶中;冻存培养基是在富集培养基基础上添加1 mL浓度为16%的甘油,每瓶9 mL分装到25 mL西林瓶中。所有培养基分装前均通入CO2来排除氧气,并在严格厌氧情况下分装,所用滚管和西林瓶加盖胶塞和铝盖。
1.1.3 主要试剂及耗材 羧甲基纤维素、纤维二糖、纤维素、Whatman NO.1滤纸、蛋白酶K、DL2000Marker、PCR引物、 Premix TaqTM、胶回收试剂盒、pMDTM19-T Vector Cloning Kit、微生物微量生理生化鉴定管。
1.2 菌株分离方法
1.2.1 细菌的采集 将100 mL离心管提前充好CO2气体密封,迅速采集瘤胃液到100 mL离心管,经四层纱布过滤抽取1 mL滤液经梯度稀释(10-5、10-6、10-7)作为菌株来源备用。
1.2.2 细菌的培养及纯化 参考刘占英等的方法分离纯化细菌[10]。用1 mL无菌注射器吸取各浓度梯度的备用菌液0.1 mL接种到初筛培养基中,39 ℃培养36~48 h,至滚管中长出菌落。在Shellab厌氧培养箱中使用挑菌针挑取具有透明圈的单一菌落接入富集培养基中39 ℃培养16~24 h,吸取0.1 mL菌液接种到初筛培养基中39 ℃培养至滚管中菌落长全,在Shellab厌氧培养箱中挑取具有透明圈的菌落接种到富集培养基,重复这个过程直到滚管中菌落形态、大小基本一致,通过革兰染色结果初步确定滚管中菌株是否已经纯化,将已纯化的菌株冻存。若革兰染色结果不是纯化菌株则用以上方法继续分离纯化。
1.2.3 纤维降解细菌的滤纸发酵试验 将得到的纯化细菌按培养基体积的10%接入含滤纸的培养基中,39 ℃培养。观察滤纸降解情况,若滤纸出现明显的孔洞、分层或边缘溶解等现象,就可认为该菌株具有纤维降解能力,并将有滤纸降解能力的菌株保存备用。
1.3 瘤胃纤维降解细菌的鉴定
1.3.1 分离菌株的生理生化特征鉴定 根据《常见细菌系统鉴定手册》[11]和伯杰细菌鉴定手册(第9版)[12]结合微生物微量生理生化鉴定管进行生理生化鉴定。在Shellab厌氧培养箱中将生长到对数期的新鲜菌液吸取0.05~0.08 mL接种到每种微量西林瓶内[葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、山梨醇、阿拉伯糖、纤维二糖、七叶苷、半乳糖、木糖、水杨苷和硝酸盐(还原)],挑取新鲜菌落穿刺接种于硫化氢、明胶西林瓶内,将所有西林瓶置于37 ℃培养箱中培养24 h观察结果,明胶瓶培养48 h后置4 ℃冰箱10 min后观察结果,硝酸盐(还原)西林瓶培养24 h后滴加硝酸盐还原试剂甲液、乙液立刻观察结果。葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、山梨醇、阿拉伯糖、纤维二糖、半乳糖、木糖培养结束黄色为阳性,紫色为阴性;水杨苷棕黑色为阳性,不变色为阴性;硫化氢黑色为阳性,无黑色为阴性;明胶4 ℃液态为阳性,4 ℃固态为阴性;硝酸盐深红色为阳性,略带淡粉色为阴性。
1.3.2 菌株16S rDNA基因序列分析 按以下步骤进行操作。
1.3.2.1 细菌DNA的提取:采用氯化苄法[13]并作适当改动提取细菌DNA。收集1.5 mL培养到对数生长期的菌液12 000 r·min-1离心5 min,弃上清,加入1 mL 1×TE混匀,12 000 r·min-1离心5 min,用1×TE洗涤三次后提取基因组DNA。
1.3.2.2 DNA序列 PCR扩增:以细菌16S rDNA的通用引物[14]、白色瘤胃球菌引物[15]、黄色瘤胃球菌引物[16]和产琥珀酸丝状杆菌引物[17]对菌株的基因组DNA进行PCR扩增,引物由北京六合华大基因科技股份有限公司合成。PCR反应体系为25 μL,即DNA 2 μL,上、下游引物各1 μL,DNA连接酶12.5 μL,ddH2O(无酶水)8.5 μL。PCR反应的循环条件:94 ℃预变性3 min;94 ℃变性30 s,退火30 s,72 ℃延伸40 s,共35个循环;最后72 ℃延伸5 min。PCR扩增产物用1.5%琼脂糖凝胶电泳,使用Maker为DL2000 DNA maker,用凝胶成像分析系统成像,观察目的条带。
1.3.2.3 PCR扩增产物的切胶回收:PCR产物琼脂糖凝胶电泳后,将条带清晰明亮,无杂带并处于1 500和295 bp左右的条带在紫外灯照射下切胶回收,用普通琼脂糖凝胶DNA回收试剂盒(Axygen Biosciences)纯化PCR产物。
1.3.2.4 目的片段的克隆及测序:将纯化好的PCR产物用pMD-19T克隆试剂盒进行连接,连接产物用TOP10感受态细胞转化。将转化好的含重组质粒的基因工程菌进行菌落PCR扩增,扩增产物用1.5%琼脂糖凝胶电泳检验条带,若电泳条带符合目的片段长度,说明所筛选的阳性克隆含有目的片段。将筛选出来的含有阳性克隆的菌液送到北京六合华大基因科技股份有限公司进行基因序列测定。
1.4 菌株生长特性
配制富集培养基时去掉培养基中刃天青,接种菌液后39 ℃培养,每隔2~8 h取菌液用752型分光光度计在600 nm波长处测定吸光度值,以未接菌的富集培养基作为对照。
1.5 分离菌株的纤维素酶活力测定
测定纤维素酶活力培养基同富集培养基,其中碳源纤维二糖用纤维素(Sigmacell cellulose, Sigma公司生产)代替,纤维素添加量为每60 mL培养基加0.60 g。将菌液按培养基10%的接种量接种到含60 mL培养基的西林瓶中,39 ℃培养72 h,培养结束后取发酵液进行酶活力测定。纤维素酶是β-葡萄糖苷酶、外切-β-1,4-葡聚糖酶和内切-β-1,4-葡聚糖酶的总称,在测定这3种酶活力时分别以水杨苷、微晶纤维素和羧甲基纤维素(CMC)为底物。通过滤纸酶活力的测定反映总纤维素酶活力。酶活力的测定采用还原糖法[18-19]。
2 结 果
2.1 菌株形态观察与纤维降解特性
筛选出四株纤维降解细菌,在培养过程中发现菌株在固体培养基上厌氧培养24 h左右,菌落形态呈表面光滑边缘整齐的圆形,菌落起初为白色,随着纯化次数增多会变成黄色,且纯化后的菌落产生的透明圈变小,有的甚至不产生透明圈。导致这种现象的原因可能是菌株间存在复杂的互作关系。跟据四株细菌在固体培养基和富集培养基中生长速度快慢判断为不同的细菌,暂时将4株菌编号为H1、H2、N1、N2,并将菌株于-80 ℃冰箱冻存备用。4株菌在滤纸培养基中培养后经肉眼观察发现,西林瓶中的滤纸均出现明显的孔洞或絮状,而空白对照瓶的滤纸则无任何变化,说明试验菌株已对纤维滤纸有所降解。
2.2 菌株生理生化特性
菌株H1、H2、N1、N2的生理生化特性见表1。由表1可知,菌株H1、H2可发酵葡萄糖、麦芽糖、蔗糖、纤维二糖、七叶苷、半乳糖、水杨苷,不可发酵甘露醇、山梨醇、阿拉伯糖、木糖,不产硫化氢,不液化明胶,硝酸盐还原为阴性;菌株N1、N2除乳糖发酵与H1、H2结果不同外,其余均相同。
表1 4株瘤胃纤维降解菌的生理生化特征
Table 1 The physiological and biochemical characteristics of four cellulolytic ruminal bacteria strains
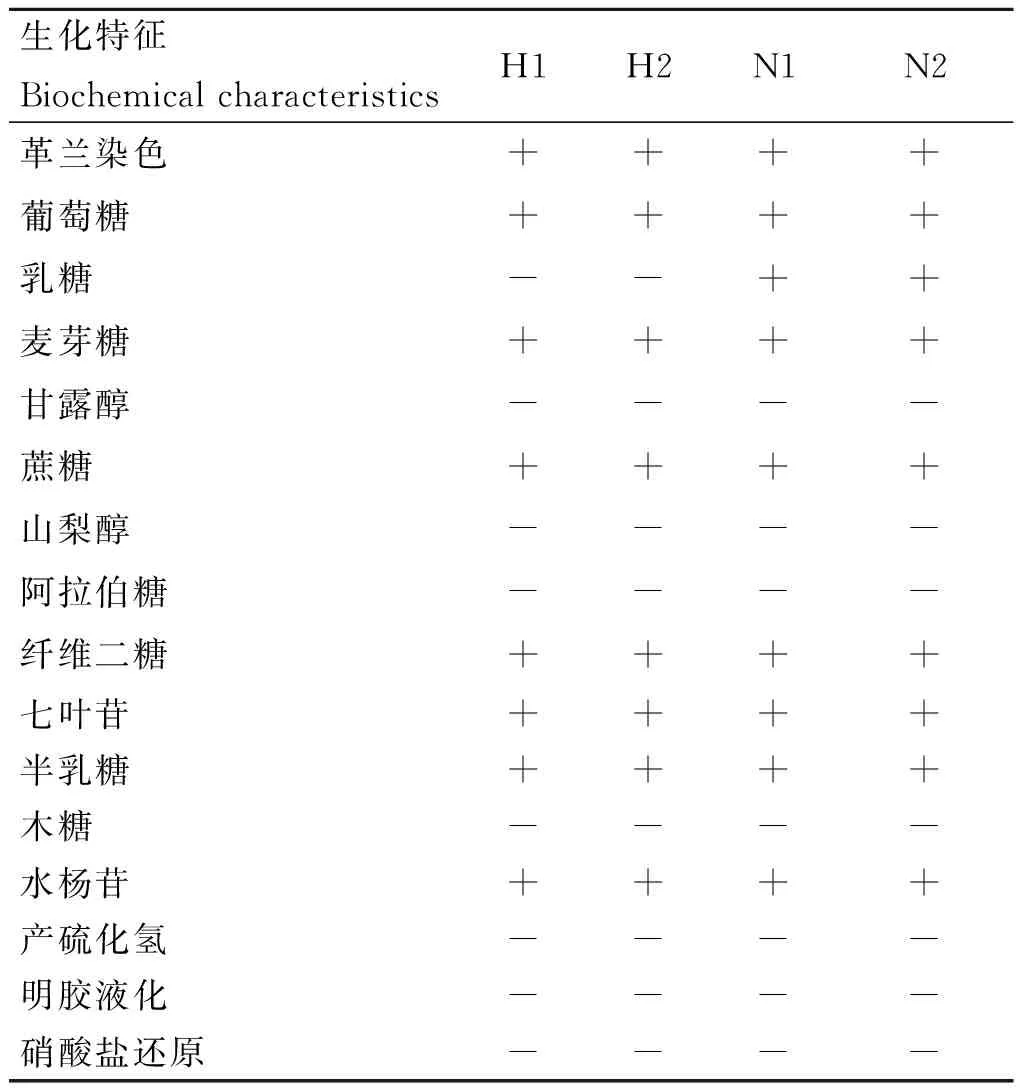
生化特征BiochemicalcharacteristicsH1H2N1N2革兰染色++++葡萄糖++++乳糖--++麦芽糖++++甘露醇----蔗糖++++山梨醇----阿拉伯糖----纤维二糖++++七叶苷++++半乳糖++++木糖----水杨苷++++产硫化氢----明胶液化----硝酸盐还原----
+.阳性;-.阴性
+.Positive; -.Negative
2.3 菌株基因序列分析
用细菌特异性引物和细菌16S rDNA通用引物扩增的目的片段经琼脂糖凝胶电泳结果见图1。如图1所示H1、H2在295 bp有明显的条带,N1、N2在1 500 bp左右有明显的条带。将所测得的16S rDNA序列用NCBI的Blast程序进行同源序列比对,再结合生理生化特性,可判定H1、H2为黄色瘤胃球菌,N1、N2为链球菌,各菌株的对比结果见表2。
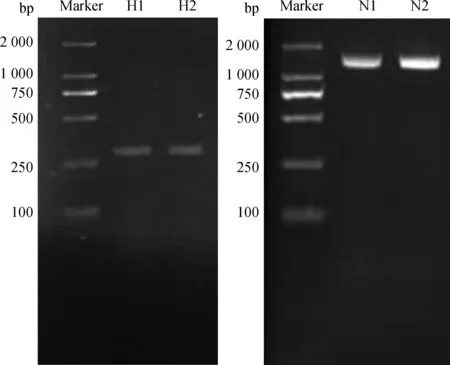
图1 PCR产物凝胶电泳照片Fig.1 Agarose gel electrophoresis of PCR-amplified 16S rDNA gene fragments
2.4 四株菌生长曲线的测定
测得四株菌生长曲线见图2。由图2可知,黄色瘤胃球菌H1、H2和链球菌N1、N2生长速度快且延迟期短,H1延迟期4 h,H2、N1、N2为3 h,四株菌经6 h达到生长平台期。黄色瘤胃球菌平台期菌体浓度大于链球菌,链球菌在20 h后出现菌体浓度下降的趋势。
表2 4株瘤胃纤维降解菌的DNA序列相似性比较
Table 2 DNA sequence homology comparison of four cellulolytic ruminal bacteria strains
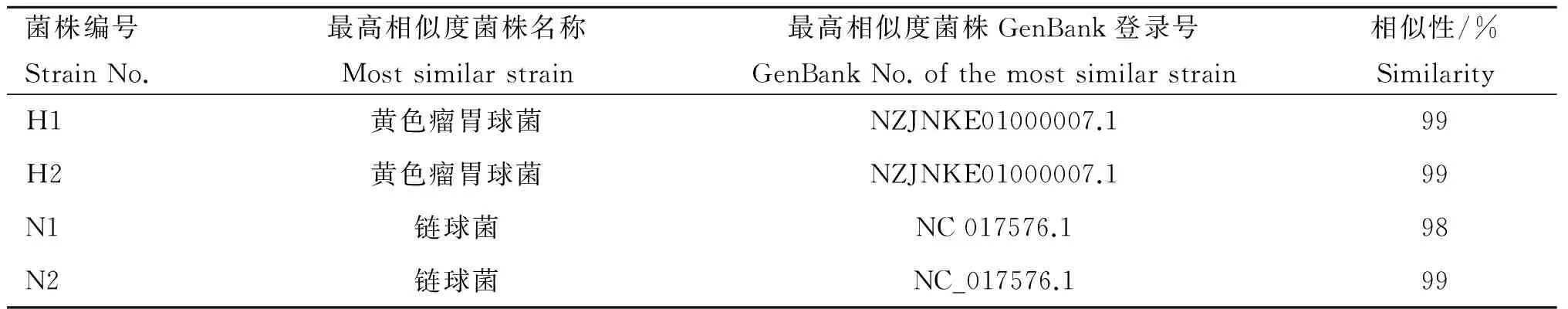
菌株编号StrainNo.最高相似度菌株名称Mostsimilarstrain最高相似度菌株GenBank登录号GenBankNo.ofthemostsimilarstrain相似性/%SimilarityH1黄色瘤胃球菌NZJNKE01000007.199H2黄色瘤胃球菌NZJNKE01000007.199N1链球菌NC017576.198N2链球菌NC_017576.199
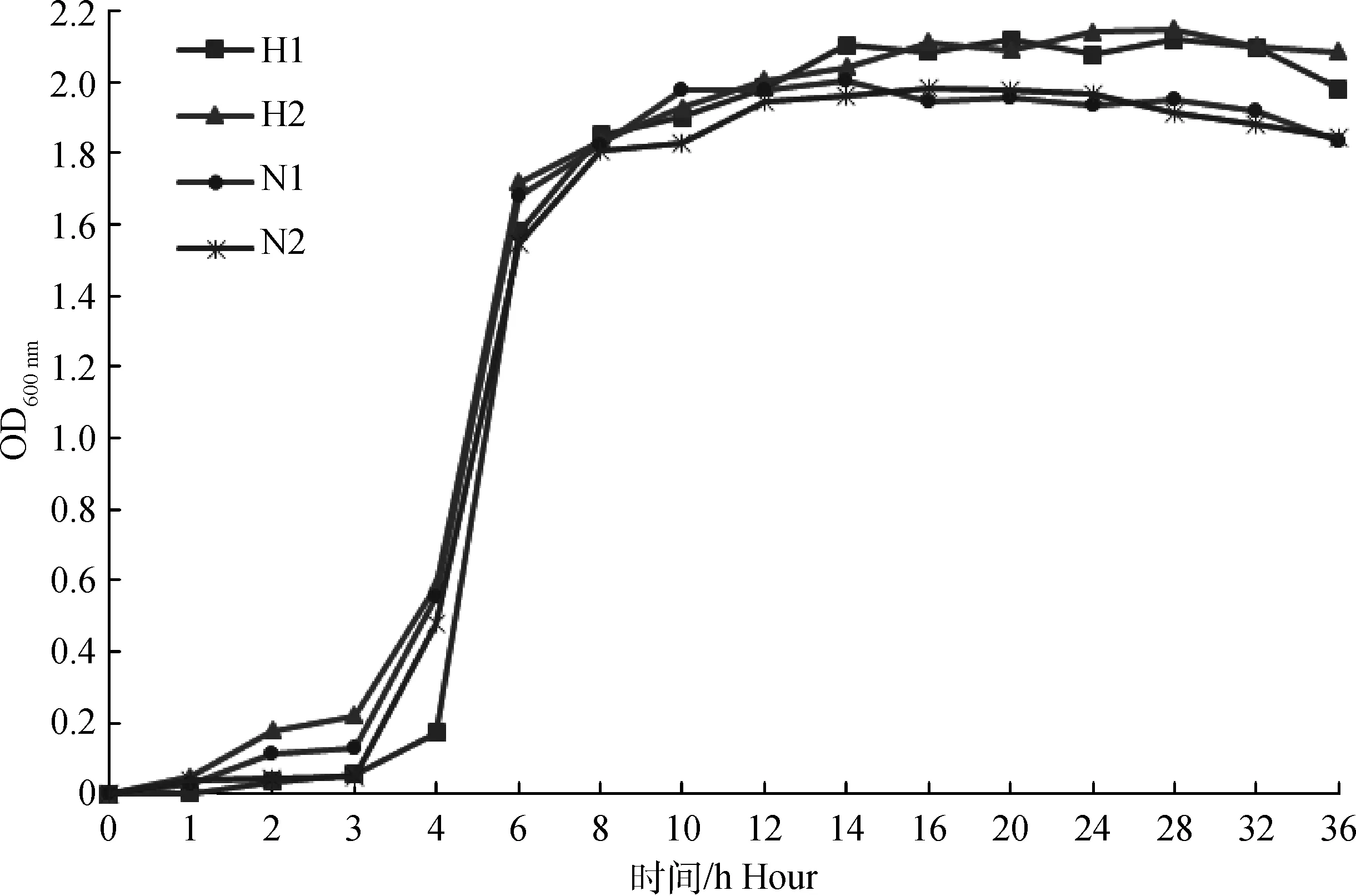
图2 黄色瘤胃球菌H1、H2和链球菌N1、N2生长曲线Fig.2 Growth curves for two Ruminococcus flavefaciens strains and two Streptococcus strains
2.5 四株菌纤维素酶活力的测定
4株菌纤维素酶活力结果见表3。由表3可以看出,四株菌均具有纤维素酶活力,但是同一种细菌测得的滤纸酶活力差异较大。四株细菌之间滤纸酶活力差异显著(P<0.05),其中菌株H2滤纸酶活力显著高于其他三株菌(P<0.05),N2滤纸酶活力显著高于H1和N1(P<0.05)。H1、H2羧甲基纤维素酶活力显著高于N1、N2(P<0.05);H2微晶纤维素酶活力显著高于其他三株菌(P<0.05);H2水杨苷酶活力显著低于其他三株菌(P<0.05)。
表3 4株菌纤维素酶活力
Table 3 The cellulose enzyme activity of four strains cellulolytic bacteria
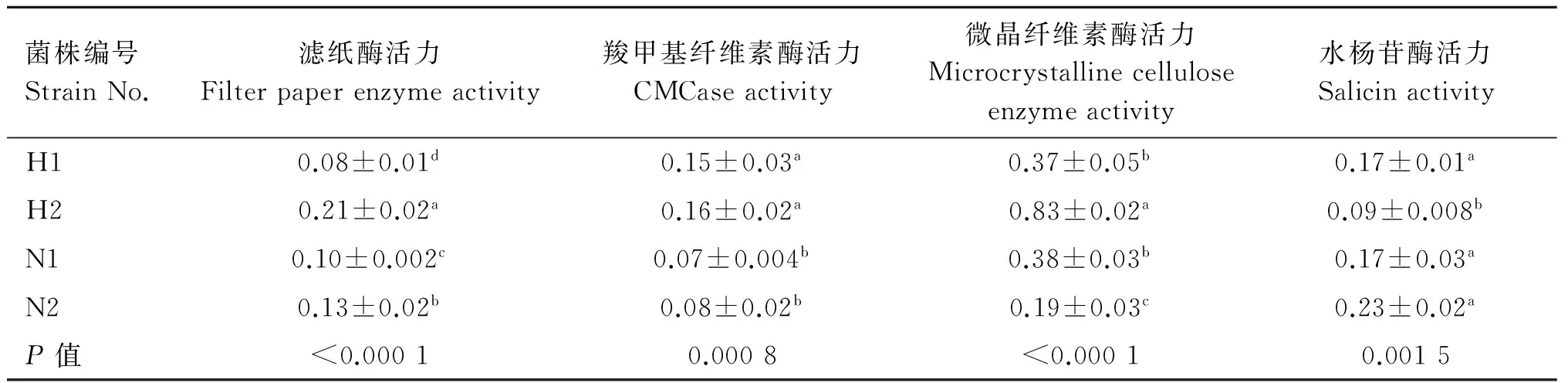
μmol·(mL·min)-1
同种酶活力不同菌株之间,同列肩注字母相同表示差异不显著(P>0.05),同列肩注字母不同表示差异显著(P<0.05)
Values with same superscript letters in the same column are of no significant difference (P>0.05), those with different letters are of significant or extreme difference (P<0.05)
3 讨 论
作者采用hungate滚管培养法从蒙古绵羊瘤胃内容物中分离出两株黄色瘤胃球菌和两株链球菌。黄色瘤胃球菌、白色瘤胃球菌和产琥珀酸丝状杆菌被认为是主要的瘤胃纤维素降解细菌[2],无论是数量还是降解纤维素能力,这三种细菌在瘤胃纤维降解细菌中都占有绝对优势,但是对于三种菌在瘤胃中的数量比例目前仍存在争议[20]。对于链球菌的分离鉴定在同类的研究中报道较少,娜仁图雅[21]在分离瘤胃纤维降解细菌时也分离到一株链球菌。瘤胃微生物的体外培养需要的环境条件和培养基均比较苛刻,而且瘤胃微生物对于营养需要的复杂性和不确定性更加限制了对瘤胃纤维素降解细菌的分离和体外培养。本次试验分离出的链球菌经滤纸降解试验发现这两株链球菌也具有纤维素酶活力,但是瘤胃链球菌具体作用和功能还有待进一步研究。
本试验测定了四株细菌的生长曲线,四株菌生长延迟期均为3~4 h,黄色瘤胃球菌最大菌体浓度出现在28 h,吸光值为2.1;链球菌最大菌体浓度出现在14、16 h,吸光值为2.0、1.9。刘占英[22]在研究黄色瘤胃球菌生长曲线时其生长延迟期为10 h,稳定期最大菌体浓度出现在25 h,吸光值为1.4。本试验筛选出的四株菌生长延迟期短可能是因为筛选菌株过程中所用液体培养基和测定生长曲线所用液体培养基相同,菌株对培养基已经适应,导致测定生长曲线时细菌生长速度很快,所以出现延迟期短的现象。
纤维素的有效降解需要由纤维素酶系中的外切葡聚糖酶活力、内切葡聚糖酶活力和β-葡萄糖苷酶活力发挥协同作用才能完成,每一种组分酶活力偏低都会限制滤纸酶活力。本研究在分离过程中采用透明圈法初筛和滤纸降解复筛结合的方法筛选出同时具有外切葡聚糖酶活力、内切葡聚糖酶活力和β-葡萄糖苷酶活力的菌株,试验结果表明所筛选菌株具有纤维素降解能力。许多研究表明纤维降解菌的纤维素降解能力大多用内切葡聚糖酶活力(羧甲基纤维素酶活力)来衡量,但是最终滤纸酶活力要结合羧甲基纤维素酶活、微晶纤维素酶活和水杨苷酶活来具体衡量。本研究测得黄色瘤胃球菌滤纸酶活力平均值为0.145 μmol·(mL·min)-1,链球菌为0.115 μmol·(mL·min)-1。关于链球菌纤维降解特性报道较少。周非帆[6]分离到3株瘤胃纤维降解细菌,经测定3株菌的滤纸酶活力平均值为0.028 μmol·(mL·min)-1。刘占英[22]测得黄色瘤胃球菌滤纸酶活力为0.18 μmol·(mL·min)-1。本试验中纤维素酶活力测定结果表明羧甲基纤维酶活力高的菌株滤纸酶活力不一定高,例如菌株H1的羧甲基纤维素酶活力显著高于N1、N2(P<0.01),滤纸酶活力却低于N1、N2。本试验测得同种细菌间的滤纸酶活力差异较大,黄色瘤胃球菌H2滤纸酶活力显著高于H1(P<0.01),这表明在瘤胃纤维降解细菌的同一种内存在纤维素降解能力差异较大的菌株[22]。
4 结 论
(1)本试验通过透明圈初筛滤纸降解复筛的方法分离得到四株纤维降解细菌,经鉴定H1、H2为黄色瘤胃球菌,N1、N2为链球菌。
(2)生长曲线测定结果表明菌株H1生长延迟期为4 h,H2、N1、N2 为3 h,四株菌6 h达到平台期。
(3)通过对4株菌纤维素酶活力测定结果可知黄色瘤胃球菌H2的滤纸酶、羧甲基纤维素酶和微晶纤维素酶活力在4株菌中最高。
[1] 孟 培,译.瘤胃内微生物降解饲料的生理与生态(上)[J].国外畜牧科技,1993,20(5):20-22.
MENG P (translate).Physiologycal aspects of digestion and metabolism in ruminants[J].AnimalScienceAbroad,1993, 20(5):20-22. (in Chinese)
[2] DEHORITY B A. Rumen microbiology[M].Nottingham University Press,2003:372.
[3] 张 迪,刘大程,卢德勋,等. 瘤胃内3 种主要纤维分解菌的研究进展[J].中国畜牧兽医,2008,35(1):16-19.
ZHANG D, LIU D C, LU D X, et al. Advances in three species of cellulolytic bacteria in rumen[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2008, 35(1):16-19. (in Chinese)
[4] 张晓华, 谭蓓英, 刘敏雄. 一个分解纤维素的瘤胃梭菌新种[J].微生物学报,1995,35(6): 397-399
ZHANG X H, TAN P Y, LIU M X. Isolation and characterization of aclostridiumrumenumsp.nov. from rumen[J].ActaMicrobiologicaSinica, 1995, 35(6): 397-399.(in Chinese)
[5] 刘玉承,侯先志,刘占英,等.2株瘤胃纤维降解细菌的分离鉴定[J] .微生物学杂志,2007, 27(6):1-4.
LIU Y C, HOU X Z, LIU Z Y, et al. Isolation and identification of two cellulose-degrading strains from rumen[J].JournalofMicrobiology, 2007,27(6):1-4. (in Chinese)
[6] 周非帆.瘤胃纤维降解细菌的分离鉴定及纤维降解特性研究[D].呼和浩特:内蒙古农业大学,2014.
ZHOU F F. Isolation, identification and cellulose-degrading characterization of rumen cellulolytic bacteria strains[D]. Hohhot :Inner Mongolia Agricultural University,2014. (in Chinese)
[7] 孙美洲,金 巍,李袁飞,等. 瘤胃降解粗纤维产甲烷的厌氧真菌与甲烷菌共培养物的分离鉴定[J].微生物学报,2014, 54(5): 563-571.
SUN M Z,JIN W,LI Y F, et al. Isolation and identification of cellulolytic anaerobic fungi and their associated methanogens from Holstein Cow[J].ActaMicrobiologicaSinica, 2014, 54(5): 563-571. (in Chinese)
[8] 张宏福.动物营养参数与饲养标准 [M]. 3 版.北京:中国农业出版社,2010.
ZHANG H F. Animal nutrition parameters and feeding standard [M]. 3rd ed. Beijing:China Agriculture Press, 2010. (in Chinese)
[9] 高 巍, 孟庆翔.白色瘤胃球菌对秸秆细胞壁和微晶纤维素的附着比较[J].中国畜牧杂志,2004, 40(6):17-19.
GAO W, MENG Q X. Comparison of adhesion ability of ruminococcus albus-7 to corn stalks cell wall and crystalline cellulose[J].ChineseJournalofAnimalScience,2004, 40(6):17-19. (in Chinese)
[10] 刘占英, 侯先志, 刘玉承, 等.一株分解纤维素的肠球菌的分离鉴定[J]. 内蒙古大学学报, 2008, 39(2): 166-171.
LIU Z Y,HOU X Z,LIU Y C, et al. Isolation and identification of a strain cellulolyticenterococcussp. CTB374-1[J].JournalofInnerMongoliaUniversity,2008, 39(2): 166-171. (in Chinese)
[11] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
DONG X Z,CAI M Y. Common bacterial systems identification manual [M].Beijing:Science Press,2001.(in Chinese)
[12] HOLT J G, KRIEG N R, SNEATH P H A, et al. Bergey′s manual of deteminative bacteriology[M]. Nith edition. Maryland:Williams&Witkins Baltimore,1994.
[13] 张莉莉,张苓花,史剑斐,等.利用氯化苄提取真菌基因组DNA及其分子生物学分析[J].大连轻工业学院学报,2000,19(1):36-39.
ZHANG L L,ZHANG L H,SHI J F, et al. Isolation and molecular biological analyses of genomic DNAs from fungi using benzyl chloride[J].JournalofDalianInstituteofLightIndustry, 2000,19(1):36-39. (in Chinese)
[14] WEISSBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J].JBacteriol, 1991, 173(2):697-703.
[15] KOIKE S, KOBAYASHI Y. Development and use of competitive PCR assays for the rumen cellulolytic bacteria:F.succinogenes,R.albusandR.flavefaciens[J].FEMSMicrobiolLett, 2001, 204(2):361-366.
[16] OHENE-ADJEI S,TEATHER R M,IVAN M, et al. Postinoculation protozoan establishment and association patterns of methanogenic archaea in the ovine rumen[J].ApplEnvironMicrobiol,2007,72(14):4609-4618
[17] DENMAN S E,MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J].FEMSMicrobiolEcol,2006,58(3):572-582.
[18] GHOSE T K. Measurement of cellulase activities[J].PureApplChem, 1987, 59(2): 257-268.
[19] ZHANG Y H, LYND L R. Toward an aggregated understanding of enzymatic hydrolysis of cellulase: noncomplexed cellulase systems[J].BiotechnolBioeng, 2004, 88(7):797-824.
[20] 焦金真,王芃芃,汤少勋,等.浏阳黑山羊胃肠道不同部位重要功能微生物的数量分布特征研究[J].畜牧兽医学报,2013,44(10):1590-1599.
JIAO J Z, WANG P P, TANG S X, et al. Quantity and distribution characteristice of function microoriganisms in gastrointestinal tract of liuyang black goats[J].ActaVeterinariaetZootechnicaSinica, 2013,44(10):1590-1599.(in Chinese)
[21] 娜仁图雅,周非帆,杨金丽,等.绵羊瘤胃内纤维降解细菌的分离鉴定[J].中国畜牧兽医,2014,41(5): 142-146.
NAREN T Y,ZHOU F F, YANG J L, et al. Isolation and identification of the cellulose-degrading bacteria strains from sheep rumen[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(5):142-146.(in Chinese)
[22] 刘占英.绵羊瘤胃主要纤维降解细菌的分离鉴定及不同氮源对其纤维降解能力的影响[D]. 呼和浩特:内蒙古农业大学,2008.
LIU Z Y. Isolation and identification of major cellulolytic bacteria in rumen of sheep and effects of nitrogen sources in their cellulolytic activities[D]. Hohhot: Inner Mongolia Agricultural University,2008.(in Chinese)
(编辑 白永平)
Isolation and Identification of Four Strain Cellulolytic Bacteria in Rumen of Sheep and Cellulose Degradation Characteristics
WANG Wei-yun, LI Da-biao*, YU Yong-qiang, XING Yuan-yuan, LI Zi-jian
(CollegeofAnimalScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China)
Four cellulose-degrading rumen bacteria strains were isolated from Mongolia sheep. The four strains bacteria were identified and numbered as H1, H2, N1 and N2. The growth characteristics and cellulose activity were measured to provide experimental material for subsequent experiments. Bacterial morphological, physiological and biochemical characterization, DNA sequence homology analysis were used for identification of isolated strains. Growth curve of strains were measured by using spectrophotometer. Filter paper enzyme activity, CMCase activity, salicin activity and microcrystalline cellulose enzyme activity of four strains of cellulolytic bacteria were measured by using reducing sugar method. Two strains of bacteria H1, H2 were identified asRuminococcusflavefaciensand N1, N2 wereStreptococcus. The growth curves of four strains showed that lag phase of H1, H2, N1, N2 were 3-4 h and the maximum cell concentration of H1, H2 appeared in 28 h and N1, N2 appeared in 14 h. Four strains of bacteria had high activity of filter paper enzyme. The activity of filter paper enzyme, CMCase and microcrystalline cellulose enzyme were significantly higher for H2 than for H1, N1 and N2 (P<0.05). Filter paper enzyme activity of H1 was 0.08 μmol·(mL·min)-1and was lowest among four strains. Four strains bacteria with cellulose enzyme activity were isolated by using the method of roll tube technique. These four cellulolytic bacteria strains can be used for subsequent study.
cellulolytic bacteria in rumen; isolation; identification; cellulase
10.11843/j.issn.0366-6964.2016.11.018
2016-05-19
国家自然科学基金项目(31201822);内蒙古自治区自然科学基金项目(2011BS0403)
王卫云(1991-),女,内蒙古赤峰人,硕士生,主要从事反刍动物营养与瘤胃微生态研究,E-mail: wangweiyun1991@126.com
*通信作者:李大彪,主要从事反刍动物营养研究,E-mail: dkyldb@imau.edu.cn
S826
A
0366-6964(2016)11-2294-07
