水貂阿留申病毒纳米PCR检测方法的建立与初步应用
2016-12-13杨瑞梅张传美张洪亮
杨瑞梅,张传美,张洪亮,单 虎
(青岛农业大学动物科技学院,山东省预防兽医重点实验室,青岛 266109)
水貂阿留申病毒纳米PCR检测方法的建立与初步应用
杨瑞梅,张传美,张洪亮,单 虎*
(青岛农业大学动物科技学院,山东省预防兽医重点实验室,青岛 266109)
为建立便捷、灵敏的水貂阿留申病病毒(AMDV)纳米PCR检测方法,根据AMDVNS1基因的保守序列设计一对特异性引物,对纳米PCR反应的退火温度、胶体金浓度进行了优化;测序检测扩增基因是否发生变异;对特异性和灵敏度进行了评估。结果表明,此纳米PCR的最佳退火温度为51 ℃,普通PCR为55 ℃;加入胶体金最佳浓度在0.2~0.8 nmol·L-1,纳米PCR与普通PCR产物测序相似性大于99%。特异性检测表明该纳米PCR方法只扩增AMDV而不能扩增犬瘟热病毒和水貂肠炎细小病毒。在粪尿样品检测中该纳米PCR敏感性比普通PCR高10倍。检测40份临床样品,结果表明该方法比对流免疫电泳检测敏感性提高,从而为用粪、尿等低病毒样品检测水貂阿留申病提供了一种新的有效方法。
水貂阿留申病病毒;纳米PCR;检测
水貂阿留申病病毒(Aleutian mink disease virus, AMDV)属于细小病毒科阿留申貂病病毒属,主要引起水貂慢性感染性疾病。该病特征为病程缓慢、血清中丙种球蛋白表达量过度升高和肾小球肾炎。临诊上主要表现为病貂被毛粗乱,失去光泽,母貂受孕率及仔貂成活率降低,给养貂业造成极大损失[1-2]。目前尚无有效预防该病的疫苗,在防制方面主要采取检疫阳性貂并且淘汰的办法[3]。对流免疫电泳(CIEP)是国际上公认的检测此病抗体的方法[4]。近年来,发展了ELISA检测抗体方法,比对流免疫电泳更为灵敏。这些方法均需采集水貂血液获得血清进行检测。水貂生性凶猛,保定困难,抓貂采血工作量大;而采血对水貂也有较大的刺激,成为该病血清学检测的主要困难。若能从粪、尿中检测该病毒,将会给该病的检测提供极大的便利。PCR检测病料中AMDV DNA操作简单,灵敏度较高。但由于粪尿中AMDV 病毒含量低、杂质多,影响普通PCR检出效率。有研究表明,攻毒第10天后,用普通PCR才可检测到水貂粪、尿中的AMDV[5],因此检测粪尿中的AMDV需要提高检测灵敏度。
纳米PCR是一种新型PCR技术,目前认为其原理是将1~100 nm胶体金颗粒加入到PCR体系中,由于纳米金具有良好的导热性和吸附DNA的作用,能更快达到目标温度,减少了非特异扩增,提高了特异性扩增产量,从而增强了反应灵敏度。研究表明,纳米PCR检测能极大提高PCR反应的敏感性,例如,Y. Cui等[6]报道在检测猪细小病毒时纳米PCR方法的敏感性是普通PCR的100倍;X. L. Wang等[7]成功建立了猪博卡病毒的纳米PCR方法,灵敏度是普通PCR的100倍;M. Li等[8]报道在PCR反应中加入胶体金颗粒可提高反应灵敏性5~10倍。纳米PCR在AMDV检测中的应用尚未见报道,本研究探讨nanoPCR对扩增AMDV的影响,以期提高检测灵敏性,探索从粪尿中检测AMDV的方法。
1 材料与方法
1.1 主要试剂
1.1.1 生化试剂 Trizol、dNTPs、ExTaqDNA聚合酶、DL2000 DNA Marker、基因组DNA提取试剂DNAiso Reagent均购自宝生物工程(大连)有限公司。胶体金颗粒(AuNPs),粒径30 nm,由青岛农业大学化学院提供。对流免疫电泳抗原购自吉林特产研究所。
1.1.2 毒株 水貂阿留申病标准毒株(AMDV-G)、犬瘟热病毒(CDV, Onderstepoort株)、水貂肠炎细小病毒(MPV)均为本实验室保存。
1.1.3 检测病料来源 2016.01—2016.03从山东荣成、威海采集疑似病貂共40只,临床表现为消瘦、食欲时好时坏,被毛光泽度差,喜饮水。采集粪尿作为检测样品;同时后肢中指趾尖采血1~2滴,脱脂棉压迫止血,置室温待血清自然析出后备用,取血清做对流免疫电泳。
1.2 引物设计
参照AMDV ADV-Utah 株NS1基因序列(GenBank 收录号X77083)设计引物,将引物在NCBI BLAST中比对;预期扩增大小为365 bp。引物由生工生物工程(上海)有限公司合成,其序列如下,AMDV-F: 5′-CAAGCAATCCAAACTTTCCATGGAC-3′;AMDV-R: 5′-GTGTTACTTACCAACGGCACTTA -3′。
1.3 AMDV NS1基因重组质粒模板的制备
以AMDV-G株CRFK细胞培养物的DNA为模板,以AMDV-F、AMDV-R为引物,使用exTaq酶扩增AMDVNS1基因365 bp片段。将扩增片段回收纯化,连入pMD18-T载体中,构建重组质粒pMD-N,将其测序正确者作为质粒阳性模板。
1.4 纳米PCR条件优化
参照文献的方法[8],PCR反应条件预先设为:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,进行30个循环;72 ℃延伸10 min。反应体系中预先设定为:10×PCR Buffer 2.5 μL,dNTP(浓度各2.5 mmol·L-1)混合液2 μL,exTaq酶1.5 U,引物各1 μL(浓度为20 pmol·L-1),DNA模板10 ng,胶体金0.3 nmol·L-1(根据文献报道[9],胶体金浓度在0.2~0.8 nmol·L-1之间,初步选择应用0.3 nmol·L-1),其余用水补齐。
用梯度PCR仪设置退火温度为43~61 ℃,间隔2 ℃,探索最佳退火温度、反应体系和其他反应条件均相同。
为确定胶体金最佳浓度,应用0、0.2、0.4、0.6、0.8和1.0 nmol·L-1胶体金加入PCR反应体系中进行扩增。
1.5 特异性试验
应用上述建立的纳米PCR方法分别对水貂肠炎细小病毒(MEV)的DNA和水貂犬瘟热(CDV)的cDNA进行检测,验证该方法的特异性,试验重复3 次。
1.6 测序分析纳米PCR 扩增片段
提取标准毒株AMDV-G的病毒DNA,用上述建立的纳米PCR和普通PCR方法分别进行扩增,胶回收扩增产物并测序。试验重复4次。
1.7 敏感性试验
阳性质粒模板用分光光度计测定浓度后,根据公式计算拷贝数。用灭菌三蒸水对阳性质粒10倍系列稀释,以每个稀释度为模板进行纳米PCR和普通PCR;同时从水貂粪尿中提取AMDV DNA,进行倍比稀释,用纳米PCR和普通PCR方法进行检测。
1.8 临诊病例样品检测
从山东荣成、威海采集40只疑似水貂AMD病例的新鲜粪尿样品,进行纳米PCR和普通PCR检测,同时用血清做对流免疫电泳,作为标准阳性,以此为对照进行分析。
2 结 果
2.1 阳性质粒模板的制备
以AMDV-G株接种的CRFK细胞第5天出现明显细胞病变时,细胞培养物提取的DNA作为模板,扩增AMDVNS1部分基因,获得365 bp目的片段。将其回收纯化、连接pMD-18T载体、转化入DH5α菌中。对阳性质粒测序,正确者命名为pMD-N,作为PCR的阳性质粒。
2.2 纳米PCR反应条件优化
2.2.1 退火温度条件优化结果 用梯度PCR仪设置退火温度为43~59 ℃,间隔2 ℃,测定最佳纳米PCR反应温度,结果表明,最佳退火温度为51 ℃(图1)。最终确定的PCR反应体系为:10×PCR Buffer 2.5 μL,dNTP(浓度各2.5 mmol·L-1) 2 μL,exTaq酶1.5 U,引物各1 μL(浓度为20 pmol·L-1),DNA模板10 ng,胶体金2 μL (0.3 nmol·L-1),ddH2O补至25 μL;反应条件:95 ℃ 5 min;94 ℃ 30 s,51 ℃ 30 s,72 ℃ 40 s, 30个循环;72 ℃ 10 min。普通PCR反应中最佳退火温度为55 ℃,其他条件同纳米PCR反应。

M. DNA 相对分子质量标准;1~9. 退火温度范围43~59 ℃(1. 43 ℃; 2. 45 ℃; 3. 47 ℃; 4. 49 ℃; 5. 51 ℃; 6. 53 ℃; 7. 55 ℃; 8. 57 ℃; 9. 59 ℃)M. DL2000 DNA Marker;1-9. The annealing temperature ranged from 43-59 ℃(1. 43 ℃; 2. 45 ℃; 3. 47 ℃; 4. 49 ℃; 5. 51 ℃; 6. 53 ℃; 7. 55 ℃; 8. 57 ℃; 9. 59 ℃)图1 纳米PCR退火温度条件优化Fig.1 Optimiztion of the annealing temperature of the AMDV nanoPCR
2.2.2 胶体金最佳浓度的确定 为确定胶体金最佳浓度,应用0、0.2、0.4、0.6、0.8和1.0 nmol·L-1胶体金加入PCR反应体系中,其中0.2~0.8 nmol·L-1胶体金有明显扩增条带,1.0 nmol·L-1浓度胶体金抑制了PCR特异性条带的产生,见图2。
2.3 纳米PCR 特异性试验
应用该纳米PCR扩增两种水貂主要病毒病CDV和MEV,均未扩增出目的条带,仅AMDV扩增出特异条带,见图3,表明该纳米PCR方法具有良好特异性。
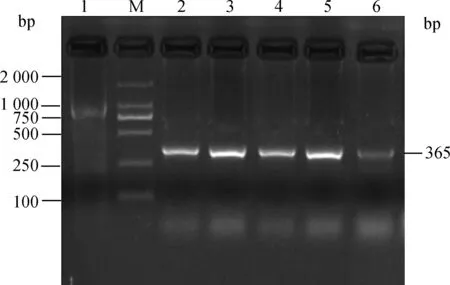
M. DNA 相对分子质量标准;1~6. 不同浓度胶体金。1. 0 nmol·L-1;2. 0.2 nmol·L-1;3. 0.4 nmol·L-1;4. 0.6 nmol·L-1;5. 0.8 nmol·L-1;6. 1.0 nmol·L-1M. DL2000 DNA marker;1-6. The different concentration of gold nanoparticles. 1. 0 nmol·L-1;2. 0.2 nmol·L-1;3. 0.4 nmol·L-1;4. 0.6 nmol·L-1;5. 0.8 nmol·L-1;6. 1.0 nmol·L-1图2 不同浓度胶体金在AMDV PCR扩增中的效果Fig.2 The effect of the concentration of gold nanoparticles on the AMDV specificity of PCR

M. DNA 相对分子质量标准;1、2. AMDV;3. CDV;4. MEVM. DL2000 DNA marker;1, 2. AMDV;3. CDV;4. MEV图3 纳米PCR 特异性试验结果Fig.3 Specificity of the AMDV nanoPCR assay
2.4 测序分析纳米PCR扩增产物
对AMDV-G株病毒用纳米PCR和普通PCR分别扩增目的片段,PCR产物胶回收后送宝生物工程(大连)有限公司测序,测序结果在GenBank上进行BLAST比对,扩增产物与AMDV相应区域相似性为100%。纳米PCR和普通PCR扩增产物的相似性大于99%,说明加入胶体金后,DNA聚合酶的保真度不受影响。
2.5 纳米PCR 敏感性试验
用超微量分光光度计测得重组质粒浓度为158 ng·μL-1,换算成拷贝数浓度为4×1011拷贝·μL-1。将重组质粒进行10倍梯度稀释,得到浓度梯度(4×1010~4×101拷贝·μL-1)模板标准品。应用优化后的纳米PCR和普通PCR方法对稀释质粒模板进行检测,结果表明,以质粒为模板,纳米PCR最低能够检测到4×102拷贝·μL-1,普通PCR最低能够检测到4×104拷贝·μL-1,纳米PCR是普通PCR敏感性的100倍(图4);从粪尿样品中提取病毒DNA进行扩增时,纳米PCR是普通PCR敏感性的10倍(图5)。表明纳米PCR灵敏度高于普通PCR。
2.6 临床检测中的应用
采集40只疑似AMD水貂的新鲜粪尿样品及相应血清,应用上述建立的纳米PCR和普通PCR方法检测,同时进行对流免疫电泳。结果表明,纳米PCR和普通PCR检测AMDV的阳性率分别为62.5%(25/40)和55%(21/40),对流免疫电泳结果为47.5%(19/40),AMDV 用CIEP 法检测为阳性的样品,经纳米PCR检测均为阳性,AMDV纳米PCR检测为阳性而CIEP为阴性的样品,经测序鉴定,结果均确认为AMDV阳性。表明纳米PCR最敏感,其次是普通PCR,对流免疫电泳敏感度最低。也说明该方法可用于AMDV低含量(粪尿)临床样品的检测。

M. DNA 相对分子质量标准;1~10. 产物。A. 质粒的普通PCR; B. 质粒的纳米PCR。1. 4×1010拷贝·μL-1,2. 4×109拷贝·μL-1,3. 4×108拷贝·μL-1,4. 4×107拷贝·μL-1,5. 4×106拷贝·μL-1,6. 4×105拷贝·μL-1,7. 4×104拷贝·μL-1,8. 4×103拷贝·μL-1,9. 4×102拷贝·μL-1,10. 4×101拷贝·μL-1M. DL2000 DNA marker;1-10. The products of PCR assays. A. Conventional PCR assays plasmid as template; B. NanoPCR assays plasmid as template. 1. 4×1010 copies·μL-1,2. 4×109 copies·μL-1,3. 4×108 copies·μL-1,4. 4×107 copies·μL-1,5. 4×106 copies·μL-1,6. 4×105 copies·μL-1,7. 4×104 copies·μL-1,8. 4×103 copies·μL-1,9. 4×102 copies·μL-1,10. 4×101 copies·μL-1图4 质粒模板纳米PCR 敏感性试验结果Fig.4 Sensitivity of the AMDV nanoPCR assay in plasmid template
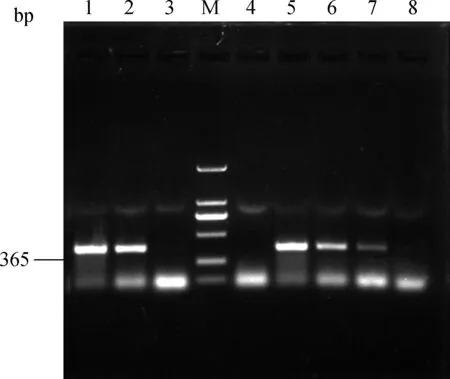
M. DNA 相对分子质量标准; 1~4. 普通PCR(1.原倍粪尿提取DNA;2. 10倍稀释提取DNA;3. 100倍稀释提取DNA;4. 1 000倍稀释提取DNA);5~8. 纳米PCR(5. 原倍粪尿提取DNA;6. 10倍稀释提取DNA;7. 100倍稀释提取DNA;8. 1 000倍稀释提取DNA)M. DL2000 DNA marker;1-4. Conventional PCR assays(1. DNA extraction from the urine and feces;2. DNA diluted 10-fold;3. DNA diluted 100-fold;4. DNA diluted 1 000-fold);5-8. NanoPCR assay(5. DNA extraction from the urine and feces;6. DNA diluted 10-fold;7. DNA diluted 100-fold;8. DNA diluted 1 000-fold)图5 粪尿样品中纳米PCR 敏感性试验结果Fig.5 Sensitivity of the AMDV nanoPCR assay in clinical diagnosis the urine and feces
3 讨 论
AMDV全长约4 800个碱基,主要编码非结构蛋白NS1、NS2和结构蛋白VP1、VP2。NS1长度1 932 bp,是最大的非结构蛋白,NS1在感染和病毒早期复制中起重要作用。A. A. Knuuttila等[10]对不同AMDV毒株的NS1基因进行比较,发现非结构蛋白序列非常相似,一致性高达86%~100%。NS1基因已用在普通PCR中检测AMDV[5],因此本研究针对NS1基因保守区设计特异性引物扩增目的片段,确保该方法的特异性。病毒分离鉴定是最准确的诊断方法,但由于耗时久,操作复杂,在本研究中没有采用此法,而是用PCR产物回收、测序,测序结果在GenBank上进行BLAST比对从而确定该方法的准确性。
水貂阿留申病的国际标准检测方法是使用对流免疫电泳法[11],即采取水貂的血液,获取血清后,用标准抗原做对流免疫电泳观察是否出现特异条带,该方法简便、快速、结果较为准确。但与普通PCR法相比,对流免疫电泳的灵敏度低[5,12]。检测水貂粪、尿这些病毒含量少的样品,需用灵敏度更高的方法。本研究首次建立了从粪尿样品中检测AMDV的灵敏、特异方法,应用纳米PCR检测水貂阿留申病,以质粒为模板,灵敏度较普通PCR提高100倍;以临床粪尿样品为模板,灵敏度较普通PCR提高10倍,能简便快速检测粪尿中AMDV。这与其他病毒病纳米PCR研究结果一致,如,X. J. Ma等[13]建立了纳米颗粒辅助的PCR,将猪伪狂犬病检测效率提高了100~1 000倍。袁万哲等[14]用纳米PCR检出新城疫病毒的效率提高10倍。本研究表明,质粒为模板的纳米PCR是普通PCR灵敏度的100倍,而在用粪尿样品提取DNA为模板时,纳米PCR是普通PCR灵敏度的10倍,分析原因可能是由于构建的质粒模板纯度高,成分更为单一,对PCR扩增的影响较小,而从粪尿样品中提取DNA浓度相对较低,仍含有微量蛋白质等杂质,影响了扩增效果。
胶体金制备简单,每次PCR扩增中用量少,因此成本低。加入PCR反应体系中扩增效率能够提高10倍,有利于临床上水貂阿留申病的大量检测。对加入胶体金后是否影响PCR保真度,本研究通过对纳米PCR产物测序,与普通PCR相似性在99%,表明加入纳米金后,在此PCR体系中DNA聚合酶仍能保持很高的保真度,保证了检测的特异性和灵敏性。除此以外,作者在试验中也发现胶体金的保存也极为重要,胶体金溶液应无菌冷藏,非无菌状态在4 ℃冷藏时间长(如超过10 d)易影响效果,胶体金的保存条件有待于下一步研究。
应用建立的AMDV纳米PCR方法和对流免疫电泳对貂场40头水貂的粪尿样品和相应的血清进行了平行检测,结果纳米PCR比CIEP的检出率高且测序后确认均为AMDV阳性,证明纳米PCR具有更高的敏感性,该方法可用于临床中粪尿样品的AMDV检测。
关于胶体金提高PCR反应的原理至今仍不是很清楚,主要认为是金属离子加强了导热性和吸附相关DNA而提高了反应速度和灵敏性,但有争议,具体原因仍在研究之中。B. V. Vu等研究表明[15],在进行纳米PCR设计引物时,扩增片段最好小于500 bp,小的片段灵敏度更高,胶体金通过吸附DNA扩增酶更易于扩增小片段目的产物。本研究中扩增片段为365 bp,具有较好扩增效果。
总之,本研究首次应用纳米PCR技术对AMDV病毒NS1基因进行检测,表明该方法具有良好的特异性较高的敏感性,为检测AMDV提供了新技术,可用水貂粪尿样品检出阳性病貂,从而用于该病的流行病学调查,为检测、预防水貂阿留申病奠定基础。
[1] PORTER D D, LARSEN A E, PORTER H G. Aleutian disease of mink[J].AdvImmunol, 1980, 29: 261-286.
[2] LARSEN A E, PORTER D D. Pathogenesis of aleutian disease of mink: identification of nonpersistent infections[J].InfectImmun, 1975, 11(1) : 92-94.
[3] 王廷鸿,祝 丽,魏 涛.水貂阿留申病净化研究[J].经济动物学报, 2014, 18(3):159-160,167.
WANG T H, ZHU L, WEI T. Purification of mink aleutian disease from farm[J].JournalofEconomicAnimal, 2014, 18(3):159-160,167. (in Chinese)
[4] AASTED B, COHN A. Inhibition of precipitation in counter current electrophoresis. A sensitive method for detection of mink antibodies to Aleutian disease virus[J].ActaPatholMicrobiolImmunolScandC, 1982, 90(1):15-19.
[5] JENSEN T H, CHRISTENSEN L S, CHRIÉL M, et al. Implementation and validation of a sensitive PCR detection method in the eradication campaign against Aleutian mink disease virus[J].JVirolMethods, 2011, 171(1): 81-85.
[6] CUI Y, WANG Z, MA X, et al. A sensitive and specific nanoparticle-assisted PCR assay for rapid detection of porcine parvovirus[J].LettApplMicrobiol, 2014, 58(2): 163-167.
[7] WANG X L, BAI A Q, ZHANG J, et al. A new nanoPCR molecular assay for detection of porcine bocavirus[J].JVirolMethods, 2014, 202: 106-111.
[8] LI M, LIN Y C, WU C C, et al. Enhancing the efficiency of a PCR using gold nanoparticles[J].NucleicAcidsRes, 2005, 33(21): e184.
[9] LI H, HUANG J, LV J, et al. Nanoparticle PCR : nanogold-assisted PCR with enhanced specificity[J].AngewChemIntEdEngl, 2005, 44(32) :5100-5103.
[10] KNUUTTILA A, UZCTEGUI N, KANKKONEN J, et al. Molecular epidemiology of Aleutian mink disease virus in Finland[J].VetMicrobiol, 2009, 133(3):229-238.
[11] 关中湘,王树志,向敬芝,等.水貂阿留申病对流免疫电泳用诊断抗原的制备和试用[J].畜牧兽医学报,1987,18(1):34-40.
GUAN Z X, WANG S Z, XIANG J Z, et al. Preparation and application of counter-immunoelectrophoresis antigen for the diagnosis of Aleutian disease in mink[J].ActaVeterinariaetZootechnicaSinica,1987,18(1):34-40.(in Chinese)
[12] MURAKAMI M, MATSUBA C, UNE Y, et al. Nucleotide sequence and polymerase chain reaction/restriction fragment length polymorphism analyses of Aleutian disease virus in ferrets in Japan[J].JVetDiagnInvest, 2001, 13(4):337-340.
[13] MA X J, CUI Y C, QIU Z Q, et al. A nanoparticle-assisted PCR assay to improve the sensitivity for rapid detection and differentiation of wild-type pseudorabies virus and gene-deleted vaccine strains[J].JVirolMethods, 2013, 193(2):374-378.
[14] 袁万哲,邹云婧,孙继国,等.检测新城疫病毒的纳米PCR技术建立与初步应用[J].畜牧与兽医,2016,48(1):104-106.
YUAN W Z,ZOU Y J,SUN J G,et al. Development of a nanoparticle-assisted PCR assay for detection of Newcastle disease virus[J].AnimalHusbandry&VeterinaryMedicine, 2016, 48(1):104-106. (in Chinese)
[15] VU B V, LITVINOV D, WILLSON R C. Gold nanoparticle effects in polymerase chain reaction: favoring of smaller products by polymerase adsorption[J].AnalChem, 2008, 80(14): 5462-5467.
(编辑 白永平)
The Establishment and Application of Nanoparticle PCR Molecular Assay for Detection of Aleutian Mink Disease Virus
YANG Rui-mei, ZHANG Chuan-mei, ZHANG Hong-liang, SHAN Hu*
(KeyLaboratoryofPreventiveVeterinaryMedicineofShandongProvince,CollegeofAnimalSciencesandTechnology,QingdaoAgriculturalUniversity,Qingdao266109,China)
Nanoparticle-assisted polymerase chain reaction (nanoPCR) is a novel method for the rapid amplification of DNA. This study was aimed to establish a simple and sensitive nanoPCR assay for detection of Aleutian mink disease virus (AMDV), primers were designed based on the conserved region of theNS1 gene sequences available in GenBank to amplify a 365 bp fragment. The optimized annealing temperature and the concentration of gold nanoparticles were studied. Whether or not the DNA replication fidelity compromised in nanoparticla-assisted PCR was detected by sequencing nanoPCR products. A nanoPCR assay was developed and its sensitivity and specificity were investigated. Under the optimized conditions of nanoPCR assay, annealing temperature was 51℃ but that of conventional PCR was 55 ℃. The best concentration of gold nanoparticles was in the range of 0.2-0.8 nmol·L-1. The 99% homology between the products obtained with the nanoPCR amplification and the conventional PCR showed that highly levels of DNA replication fidelity in this nanoPCR. In addition, the other mink viruses detected by the nanoPCR were all negative. Under the optimized conditions of the AMDV nanoPCR assay, the nanoPCR assay was 10-fold more sensitive than a conventional PCR assay in urine and feces samples. The lower detection limit of the nanoPCR assay was about 4.0×102copies. Furthermore, a total of 40 clinical samples were detected by this assay. The results showed that the nanoPCR is sensitive than counter immunoelectrophoresis (CIEP). The nanoPCR assay developed in this study can be applied widely in clinical diagnosis the urine and feces and field surveillance of AMDV-infection.
Aleutian mink disease virus; nanoparticle PCR; molecular assay
10.11843/j.issn.0366-6964.2016.11.017
2016-07-01
科技部科技基础性工作专项(2012FY111000);山东省自主创新及成果转化专项(2014ZZCX07105)
杨瑞梅(1975-),女,陕西长安人,副教授,博士,主要从事毛皮动物疫病研究, E-mail:yrm.cc@163.com
*通信作者:单 虎,教授,博士,主要从事动物传染病研究,E-mail:shanhu@163.com
S852.659.2
A
0366-6964(2016)11-2288-06
