胚蛋给养β-羟基-β-甲基丁酸对肉仔鸡孵化率、生长性能和骨骼肌发育的影响
2016-12-13马友彪张海军武书庚齐广海
马友彪,张海军,王 晶,武书庚,齐广海
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京 100081)
胚蛋给养β-羟基-β-甲基丁酸对肉仔鸡孵化率、生长性能和骨骼肌发育的影响
马友彪#,张海军#,王 晶,武书庚*,齐广海
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京 100081)
本试验旨在研究胚蛋给养(inovofeeding)β-羟基-β-甲基丁酸(beta-hydroxy-beta-methylbutyrate, HMB)对肉仔鸡孵化率、生长性能及骨骼肌发育的影响。选用540枚商品代AA肉仔鸡受精蛋,随机分为3个组:空白组(不注射)、生理盐水组(7胚龄气室注射1 mL 0.9% 生理盐水)、HMB组(7胚龄气室注射1 mL含0.1% HMB的生理盐水)。出壳后,每组选取72只体重相近健康公雏随机分成6个重复,每重复12只。结果表明:1)胚蛋给养对种蛋孵化率无显著性影响(P>0.05);2)HMB组出壳重、2l日龄体重、0~21日龄平均日增重均显著高于其他组(P<0.05);3)7日龄时,HMB组肉仔鸡胸肌率较生理盐水组提高了1.01%(P=0.019);21日龄时,HMB组胸肌率显著高于其他组(P<0.05),较空白组和生理盐水组分别提高了1.11%和1.04%;4)HMB组肉仔鸡的腹脂率最低,且在21日龄时显著低于空白组(P=0.018);5)与空白组和生理盐水组相比,HMB组肉仔鸡出壳当天和4日龄肌细胞直径显著增大(P<0.05)。6)出壳当天和7日龄肉仔鸡,HMB组胸肌卫星细胞有丝分裂活性指数较其他两组显著提高(P<0.05);7)7日龄肉仔鸡,HMB组血浆IGF-1含量显著高于空白组(P<0.05),与生理盐水组之间差异不显著(P>0.05)。结果提示,胚蛋给养HMB可提高肉仔鸡出壳重,增加卫星细胞有丝分裂活性,促进肉鸡胸肌发育,加快肉鸡前期生长;注射HMB不影响种蛋孵化率和肉鸡饲料转化效率;注射生理盐水与不注射处理结果相似,对肉仔鸡生长没有影响。
β-羟基-β-甲基丁酸;胚蛋给养;生长性能;胸肌;肉仔鸡
现代养禽业已经达到了较高生产水平,继续利用遗传选育、优化饲料配方和改善饲养管理等方法来促进肉禽生长的难度不断加大[1]。最大限度地提高家禽生产效率和增加经济效益,寻找新的途径来挖掘家禽的遗传潜能已成为研究的热点领域。胚蛋给养(inovofeeding)来源于鸡胚接种技术,是将特定外源营养物质注射到孵化期胚蛋中[2]。越来越多的研究表明,胚蛋给养是一种提高肉鸡生长速度和肌肉沉积的有效方法[3-5]。
β-羟基-β-甲基丁酸(HMB)是亮氨酸代谢的中间产物之一,与亮氨酸功能相似,在肌肉组织的蛋白质合成过程中起重要作用[6],可作为高强度运动者的营养补充剂。动物研究表明,日粮补充HMB或其钙盐能够提高不同动物(猪、牛、羊、肉鸡、火鸡)生长性能和产肉量,改善饲料转化效率和机体免疫功能[7-11]。目前关于胚蛋给养HMB在肉鸡上的应用研究较少,且主要关注于改善肠道发育和免疫机能。HMB对肌肉蛋白质的沉积有积极作用,本课题组前期研究表明,日粮添加0.1% HMB-Ca可显著提高42日龄肉仔鸡胸肌率[12],此外胚蛋给养HMB能够提高肉鸡前期平均日增重,降低料重比,并提高了胸肌率和腿肌率[5]。然而前期研究对HMB影响肌肉发育的机理均未深入探讨。禽类生长早期卫星细胞增殖活性直接影响生长期骨骼肌的生长潜能,火鸡出壳后立即饲喂含有HMB的日粮能够显著提高卫星细胞增殖活性[11],HMB对肌肉生长的影响可能与卫星细胞增殖潜力有关。
本试验旨在研究胚蛋给养HMB对肉仔鸡生长性能、骨骼肌细胞形态及早期卫星细胞增殖活性变化的影响,进一步探讨HMB影响肌肉发育的机理,以期为后续研究和生产应用提供理论依据。
1 材料与方法
1.1 试验材料
β-羟基-β-甲基丁酸(HMB,99%)购自北京中生瑞泰科技有限公司。爱拔益加(AA)鸡商品代受精蛋(种鸡33周龄)由北京华都肉鸡公司提供。采用K12SS-1-BO7型微电脑全自动孵化器(山东省德州市志诚孵化设备有限公司)进行孵化,孵化和饲养试验于中国农业科学院中试基地进行。
1.2 试验动物与处理
孵化阶段:选用540枚种蛋(平均蛋重(68.5±0.5) g)随机分成3个处理、处理Ⅰ,不注射作为空白对照组;处理Ⅱ,7胚龄注射1 mL 0.9%的生理盐水;处理Ⅲ,在孵化第7胚龄注射1 mL含0.1% HMB的生理盐水。注射前用75%酒精浸润的脱脂棉球在注射点附近擦拭消毒,注射器针头长度1 cm,注射完立即用石蜡封口。孵化条件:温度37.8 ℃,相对湿度60%,每1.5 h翻蛋一次,第19天停止翻蛋,每隔4 h记录一次孵化温度和相对湿度。孵化第10天照蛋,去除未受精蛋和死胚蛋。
饲养阶段:肉鸡出壳后,从每个处理中各选取健康、接近平均体重72只公雏(羽速鉴别法)分配于6个笼子((100×90×65) cm3)饲养,每笼12只鸡,3层笼养,各重复均匀分布于鸡舍,饲养期为42 d,分为前期(0~21 d)和后期(22~42 d)两个阶段。试验饲粮参照NRC(1994)和NY/T 33-2004,并结合AA肉鸡的饲养管理手册配制(表1)。按照《AA肉鸡饲养管理手册》进行日常管理,自由采食和饮水。
表1 试验饲粮组成及营养水平(风干基础)
Table 1 Composition and nutrient level of experimental diets(air-dry basis)%
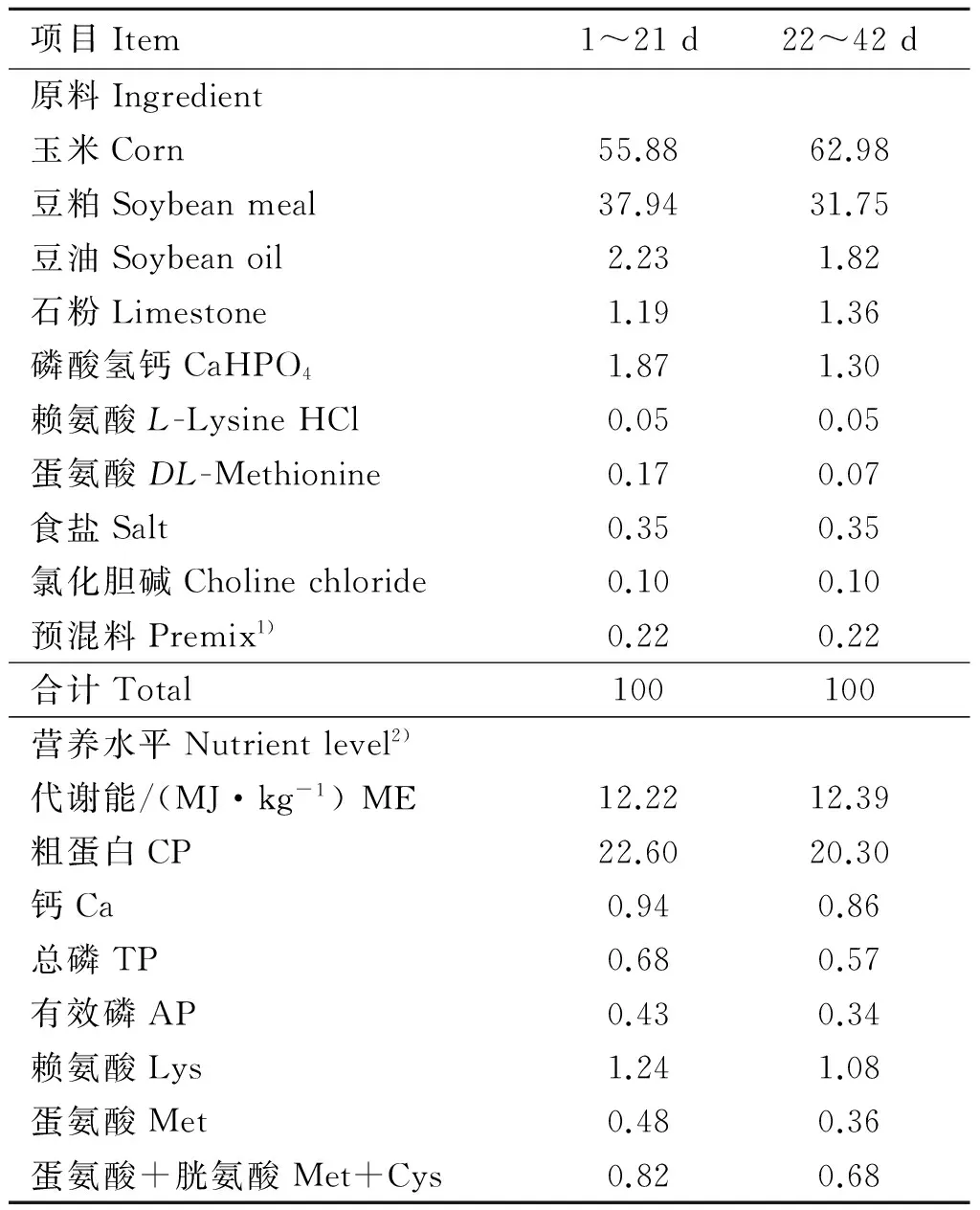
项目Item1~21d22~42d原料Ingredient玉米Corn55.8862.98豆粕Soybeanmeal37.9431.75豆油Soybeanoil2.231.82石粉Limestone1.191.36磷酸氢钙CaHPO41.871.30赖氨酸L-LysineHCl0.050.05蛋氨酸DL-Methionine0.170.07食盐Salt0.350.35氯化胆碱Cholinechloride0.100.10预混料Premix1)0.220.22合计Total100100营养水平Nutrientlevel2)代谢能/(MJ·kg-1)ME12.2212.39粗蛋白CP22.6020.30钙Ca0.940.86总磷TP0.680.57有效磷AP0.430.34赖氨酸Lys1.241.08蛋氨酸Met0.480.36蛋氨酸+胱氨酸Met+Cys0.820.68
1).预混料为每千克饲粮提供:Zn 75 mg,Fe 80 mg,Mn 100 mg,Cu 8 mg,I 0.35 mg,Se 0.15 mg,VA 7 800 IU,VD32 500 IU,VK32.65 mg,VE 15 IU,VB10.98 mg,VB26 mg,VB62.5 mg,VB120.25 mg,泛酸钙12 mg,烟酸50 mg,生物素0.12 mg,叶酸1.25 mg。2).营养水平均为计算值
Provided per kilogram diet:Zn 75 mg, Fe 80 mg, Mn 100 mg, Cu 8 mg, I 0.35 mg, Se 0.15 mg, Vitamin A 7 800 IU, Vitamin D32 500 IU, Vitamin K32.65 mg, Vitamin E 15 IU, Vitamin B10.98 mg, Vitamin B26 mg, Vitamin B62.5 mg, Vitamin B120.25 mg, Ca-pantothenate 12 mg, Niacin 50 mg, Biotin 0.12 mg, Folic acid 1.25 mg.2).Nutrient level are calculated values
1.3 样品采集及分析方法
1.3.1 生长性能 出雏当日统计出雏量,计算孵化率,并以每30只为一单位称重,计算平均出壳重。
分别于试验的第0、21和42天早上09:00之前,以重复为单位空腹称重,计算平均体重(BW)、平均日增重(ADG);试验期间每天以重复为单位,统计耗料量,计算试验前期、后期及全期的平均日采食量(ADFI)和饲料转化效率(F/G)。
1.3.2 胴体组成 分别于21、42日龄从每个重复中选取1只接近平均体重的肉仔鸡,颈动脉放血,按照《家禽生产性能名词术语和度量统计方法》(NY/T 823-2004)测定试验鸡的屠体重、全净膛重、胸肌重、腿肌重和腹脂重,计算试验鸡的全净膛率、胸肌率、腿肌率和腹脂率。
1.3.3 组织切片制作及图像分析处理 在肉仔鸡出壳后第1、4和7天,每重复取1只经上述方法杀死的鸡,剥离胸肌,顺肌纤维走向,切取胸肌标本(0.3 cm×0.3 cm×0.5 cm),4%多聚甲醛PBS液(0.1 mol·L-1,pH7.4)固定,梯度浓度乙醇脱水,二甲苯透明,石蜡包埋,沿垂直于肌纤维方向连续切片,厚5 μm。苏木素-伊红染色法(H.E)染色,中性树胶封片。
在Nikon 80i显微镜(Nikon,日本)400倍下拍照H.E法染色的切片,随机选取5个视野。用Image-Pro Plus 5.0图像分析软件(Media Cybernetics)随机测定每个视野中约50个完整肌细胞直径(弯曲、变形、扭转、重叠的肌纤维不测量);测量单个图像总面积,统计其中肌细胞数,计算肌细胞密度。
1.3.4 卫星细胞有丝分裂活性指数 出雏后第1、4和7天,从每重复取1只肉仔鸡按100 mg·kg-1体重腹腔注射5-溴-2-脱氧尿嘧啶(BrdU,Sigma),标记具有分裂活性的卫星细胞。注射后2 h,按20 mg·kg-1体重注射戊巴比妥钠处死,顺肌纤维走向收集胸大肌标本,固定于4%多聚甲醛PBS液中,免疫组化染色。根据D.T.Moore等的方法分析卫星细胞有丝分裂活性指数[11]。染色结果判定:黑色小点代表BrdU阳性细胞核。卫星细胞有丝分裂活性指数=(BrdU标记的细胞核数/(BrdU标记的细胞核数+非BrdU标记的细胞核数))×100%。
1.3.5 血浆生化指标 分别在出壳当天及第7、21、42天,每重复选取1只体重接近该重复平均值的肉仔鸡,翅静脉(心)采血,抗凝管存放,4 000 r·min-1离心10 min分离血浆,-20 ℃保存。生长激素(GH)、类胰岛素生长因子-1(IGF-1)含量采用相应的125I标记的放免试剂盒(RIA kits)测定(上海劲马实验设备有限公司,上海)。所有试剂盒在使用前先梯度稀释血浆,依据标准曲线确定加样量。每个血浆样品检测1次以避免批次间变异。
1.4 统计方法
试验数据采用SPSS16.0的one-way ANOVA进行单因素方差分析,采用LSD法进行多重比较,数据差异性以P<0.05为显著水平。结果均以“平均数±标准差”表示。
2 结 果
2.1 胚蛋给养HMB对种蛋孵化率和肉仔鸡生长性能的影响
胚蛋给养HMB对种蛋孵化率和肉仔鸡BW、ADG、ADFI、F/G的影响见表2。空白组、生理盐水组与HMB组的孵化率分别为88.88%、88.33%和91.67%,组间差异不显著(P>0.05)。整体来看,肉仔鸡生长性能(BW、ADG、ADFI、F/G)在空白组和生理盐水组之间均无显著差异(P>0.05)。HMB组肉仔鸡出壳重和21日龄BW均显著高于空白组和生理盐水组(P<0.05),7和42日龄BW差异不显著。HMB组肉仔鸡0~21 d的ADG显著高于空白组和生理盐水组(P<0.01),0~42 d HMB组肉仔鸡ADG较其他两组有升高趋势(P=0.074)。各组间ADFI和F/G无显著差异(P>0.05)。总之,胚蛋给养HMB能加快肉仔鸡生长,未见显著改善F/G;与不注射组相比,注射生理盐水对肉仔鸡生长性能无明显作用。
表2 胚蛋给养HMB对种蛋孵化率和肉仔鸡生长性能的影响
Table 2 Effects ofinovofeeding HMB on hatchability and performance in broilers

项目Item日龄/dDaysofage处理Treatment空白Control生理盐水NormalsaltHMBP值P-value孵化率/%Hatchability88.88±5.4488.33±7.2391.67±4.590.584平均体重/gBW148.41±0.36b48.83±0.42b50.50±0.53a0.0017153.54±4.46153.36±2.98158.14±6.760.20321836.10±9.91b835.15±14.66b858.81±14.27a0.011422389.10±69.502393.01±80.542480.89±82.180.101平均日增重/(g·d-1)ADG0~2137.51±0.35b37.44±0.53b38.49±0.61a0.00822~4273.96±3.6074.18±3.2777.24±3.990.2480~4255.73±1.6655.81±1.9257.87±1.960.110平均日采食量/(g·d-1)AD-FI0~2153.49±3.9053.75±3.0354.96±3.300.63622~42140.32±9.29141.46±10.58147.86±10.110.1570~4296.90±3.3397.65±3.95101.41±4.620.183饲料转化效率/(g·g-1)F/G0~211.43±0.091.44±0.081.43±0.120.54122~421.90±0.181.91±0.171.92±0.140.4160~421.74±0.101.74±0.111.75±0.110.573
同行数据后所标字母相异表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)。下表同
Different letters in the same row means significant difference between the treatments (P<0.05), same letter in the same row means not significant difference between treatments (P>0.05). The same as below
2.2 胚蛋给养HMB对肉仔鸡胴体性状的影响
由表3可知,与空白组和生理盐水组相比,HMB组肉仔鸡21和42日龄屠体重、全净膛率和腿肌率差异不显著(P>0.05)。7日龄时,HMB组肉仔鸡胸肌率较生理盐水组提高了1.01%(P=0.019);21日龄时,HMB组肉仔鸡胸肌率显著高于其他组(P<0.05),较空白组和生理盐水组分别提高了1.11%和1.04%。21和42日龄时,HMB组肉仔鸡的腹脂率均最低,且在21日龄时显著低于空白组(P=0.018)。空白组和生理盐水组各监测点的胴体性状均无显著差异(P>0.05)。提示,胚蛋给养HMB能增大肉仔鸡胸肌率,降低腹脂率,对全净膛率和腿肌率无明显作用。
表3 胚蛋给养HMB对肉仔鸡胴体性状的影响
Table 3 Effects ofinovofeeding HMB on carcass composition in broilers
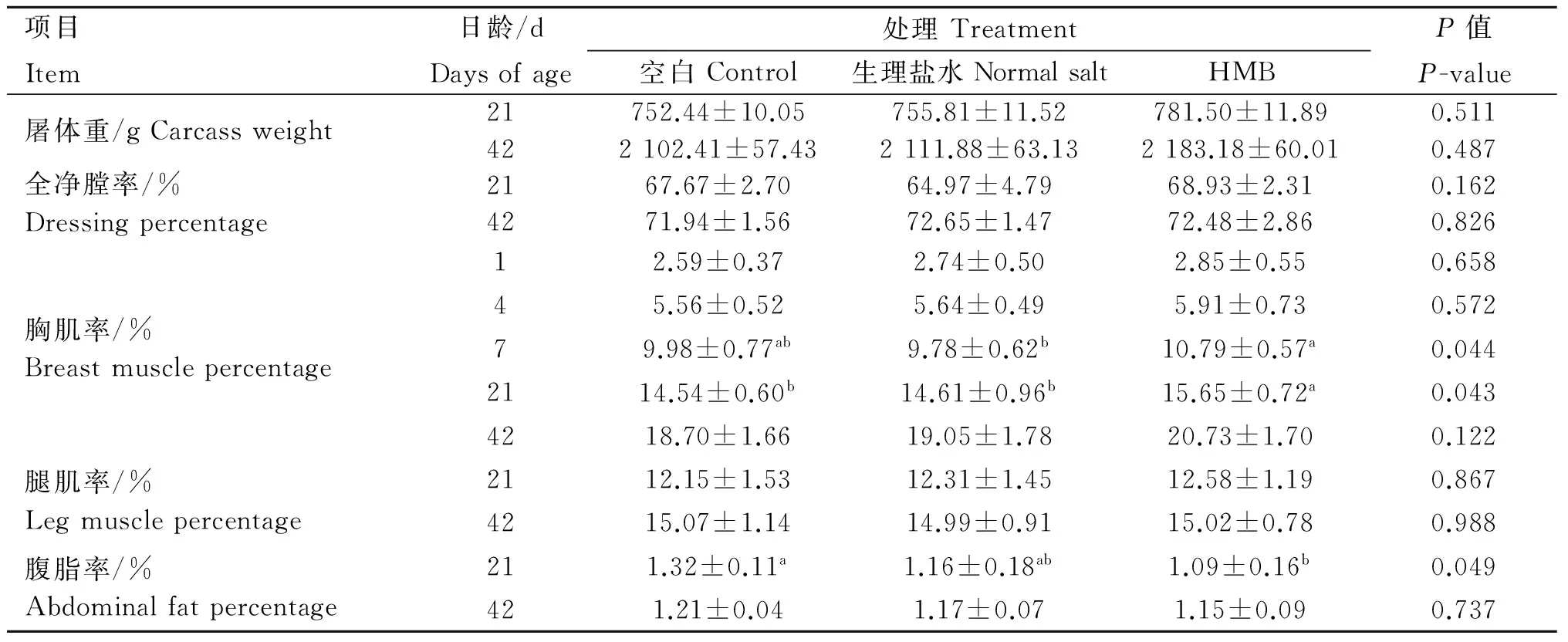
项目Item日龄/dDaysofage处理Treatment空白Control生理盐水NormalsaltHMBP值P-value屠体重/gCarcassweight21752.44±10.05755.81±11.52781.50±11.890.511422102.41±57.432111.88±63.132183.18±60.010.487全净膛率/%Dressingpercentage2167.67±2.7064.97±4.7968.93±2.310.1624271.94±1.5672.65±1.4772.48±2.860.826胸肌率/%Breastmusclepercentage12.59±0.372.74±0.502.85±0.550.65845.56±0.525.64±0.495.91±0.730.57279.98±0.77ab9.78±0.62b10.79±0.57a0.0442114.54±0.60b14.61±0.96b15.65±0.72a0.0434218.70±1.6619.05±1.7820.73±1.700.122腿肌率/%Legmusclepercentage2112.15±1.5312.31±1.4512.58±1.190.8674215.07±1.1414.99±0.9115.02±0.780.988腹脂率/%Abdominalfatpercentage211.32±0.11a1.16±0.18ab1.09±0.16b0.049421.21±0.041.17±0.071.15±0.090.737
2.3 胚蛋给养HMB对肉仔鸡肌细胞直径和密度的影响
胚蛋给养HMB对肉仔鸡胸肌肌细胞直径、肌细胞密度的影响见表4。随日龄增加,肉仔鸡胸肌肌细胞直径不断增加、肌细胞密度减小。与空白组和生理盐水组相比,HMB组肉仔鸡出壳当天和4日龄肌细胞直径显著提高(P<0.05),7日龄时差异不显著。各处理组间肉仔鸡出壳当天、4和7日龄肌细胞密度差异不显著(P>0.05)。提示,胚蛋给养HMB有利于肉仔鸡肌肉细胞体积增大,对细胞密度无明显作用。
2.4 胚蛋给养HMB对肉仔鸡肌肉卫星细胞有丝分裂活性指数的影响
由表4可见,肉仔鸡胸肌卫星细胞有丝分裂活性指数随日龄增加而减小。出壳当天和7日龄肉仔鸡,HMB组胸肌卫星细胞有丝分裂活性指数较空白组和生理盐水组显著提高(P<0.05)。4日龄时,与空白组相比,HMB组胸肌卫星细胞有丝分裂活性指数有提高趋势(P=0.071),与生理盐水组相比差异不显著(P>0.05)。空白组和生理盐水组胸肌卫星细胞有丝分裂活性指数均无显著差异(P>0.05)。提示,胚蛋给养HMB能增加肉仔鸡出壳后早期胸肌卫星细胞有丝分裂活性。
2.5 胚蛋给养HMB对肉仔鸡血浆激素水平的影响
表5所示为肉仔鸡不同阶段血浆指标变化情况。由表可知,胚蛋给养HMB对GH无显著影响(P>0.05)。与空白组相比,胚蛋给养HMB显著提高了7日龄肉仔鸡血浆IGF-1含量(P<0.05),与生理盐水之间差异不显著(P>0.05);1、21和42日龄肉仔鸡,各处理组间血浆IGF-1含量差异不显著(P>0.05)。整体来看,胚蛋给养HMB对肉仔鸡血浆GH和IGF-1含量作用不明显。
表4 胚蛋给养HMB对肉仔鸡肌细胞直径、密度和卫星细胞有丝分裂活性指数的影响
Table 4 Effects ofinovofeeding HMB on the muscle fiber diameter, density and satellite cell mitotic activity in broilers
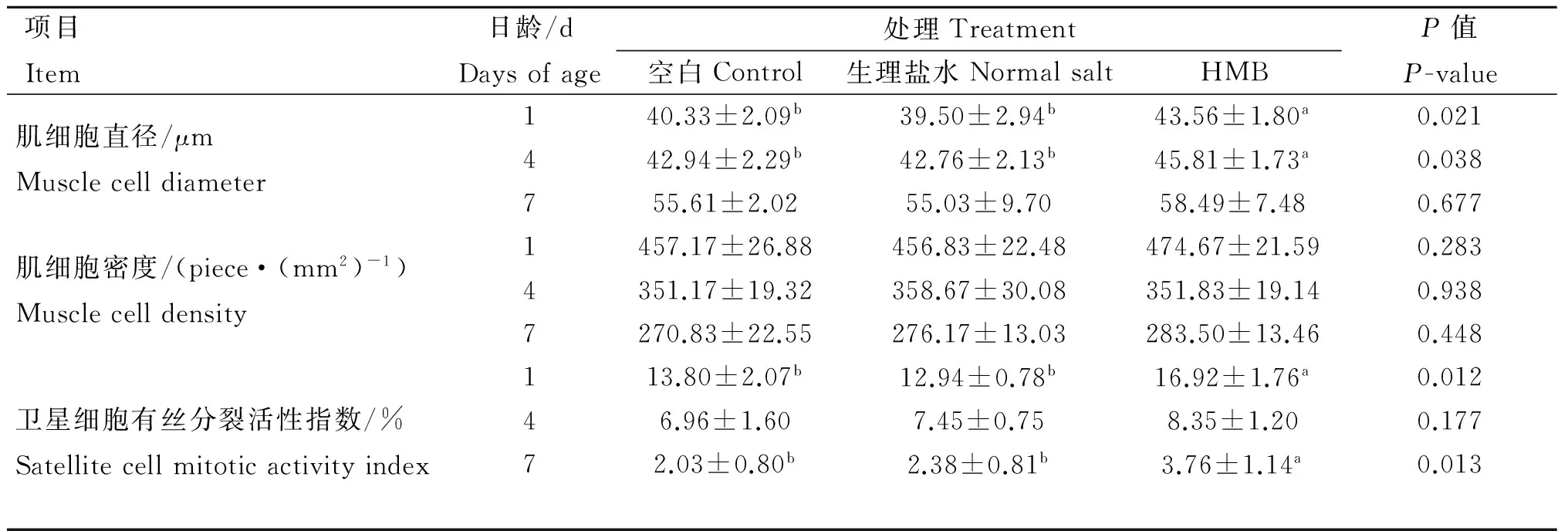
项目Item日龄/dDaysofage处理Treatment空白Control生理盐水NormalsaltHMBP值P-value肌细胞直径/μmMusclecelldiameter140.33±2.09b39.50±2.94b43.56±1.80a0.021442.94±2.29b42.76±2.13b45.81±1.73a0.038755.61±2.0255.03±9.7058.49±7.480.677肌细胞密度/(piece·(mm2)-1)Musclecelldensity1457.17±26.88456.83±22.48474.67±21.590.2834351.17±19.32358.67±30.08351.83±19.140.9387270.83±22.55276.17±13.03283.50±13.460.448卫星细胞有丝分裂活性指数/%Satellitecellmitoticactivityindex113.80±2.07b12.94±0.78b16.92±1.76a0.01246.96±1.607.45±0.758.35±1.200.17772.03±0.80b2.38±0.81b3.76±1.14a0.013
表5 胚蛋给养HMB对肉仔鸡血浆激素水平的影响
Table 5 Effects ofinovofeeding HMB on blood hormone level in broilers
3 讨 论
3.1 胚蛋给养HMB对种蛋孵化率和肉仔鸡生长性能的影响
孵化率直接关系到种禽场和孵化场的经济效益,是胚蛋给养应用过程中必须考虑的重要因素。胚蛋气室可用于外源营养注射,气室注射可最大限度地降低因注射液体和机械损伤对胚胎产生的应激,操作简单、方便[13]。胚蛋气室注射L-精氨酸显著提高了鹌鹑的孵化率[14]。本试验表明,与不注射相比,胚蛋注射HMB对种蛋孵化率无显著影响,这与S.Nowaczewski等[15]的研究一致。本试验设置了注射生理盐水组,结果提示注射操作不影响种蛋孵化率。本研究结果与早期报道的气室中注射氨基酸,显著降低孵化率[16]并不一致,这可能与注射液剂种类、种禽年龄、胚龄、注射操作、孵化条件等有关。
HMB是机体代谢产物,系生长所必需。它不仅刺激巨噬细胞和淋巴细胞增殖,改善机体免疫功能,还能促进肌肉生长发育,改善畜禽生长性能和产肉量[17-18]。近年来,国内外有关畜禽日粮中添加适量HMB对生产性能影响的研究较多。母猪妊娠后期及哺乳期饲粮中连续添加HMB,可显著提高仔猪初生重和哺乳期增重,改善母猪及仔猪免疫功能[7];产前2周饲喂母猪HMB,可提高初生仔猪血清中激素水平,从而改善仔猪初生至上市全期的体重[19];肉仔鸡日粮中添加HMB,14日龄时体重显著高于对照组[20],但随日龄增加,因HMB刺激由免疫应激引起的免疫应答,体增重效果不明显。利用胚蛋注射技术为孵化期的胚胎补充HMB,可及早调控家禽生长发育。胚胎羊膜内注射HMB,大幅度提高了肠道的早期发育,进而提高火鸡的出壳重和促进出壳后的生长[21-22]。前期研究表明,胚蛋给养HMB能够提高肉鸡前期平均日增重,降低饲料转化效率[5]。与前期结果一致,本试验结果表明胚蛋气室注射HMB显著提高了肉仔鸡出壳重和生长期体重,但未观察到对饲料转化效率有明显改善作用,结果不一致的原因可能是偶然因素造成,有待进一步验证。HMB在蛋白质合成过程中起到重要作用,可有效促进孵化期胚胎生长发育,尤其是刺激了肌细胞的增殖、分化和肠道的早期发育,提前发挥其遗传潜力。胚蛋给养HMB具有激活家禽生长动力的作用,促进了家禽早期生长发育,使出壳时的体重优势持续到试验期结束。综上,胚蛋给养是一种改善肉仔鸡生产性能的有效手段。
3.2 胚蛋给养HMB对肉仔鸡胴体性状的影响
现有试验表明,HMB能促进蛋白质合成,抑制蛋白质降解,增加脂肪代谢。临床上,运动训练中补充适合剂量的HMB具有增加肌肉体积和力量[23],减轻肌肉损伤和延缓肌肉疲劳的作用[24]。胚蛋给养HMB对家禽骨骼肌的发育作用明显,研究表明,胚蛋给养HMB,通过增加体内糖原水平和刺激肌肉卫星细胞增殖,可显著提高肉仔鸡胸肌重和胸肌率[25]。本研究团队在早期试验中,向孵化期的鸡胚羊膜腔注射HMB,结果显示,在21日龄肉仔鸡胸肌率和腿肌率均显著提高[5]。与以上结果类似,本试验表明,胚蛋注射HMB对肉仔鸡全净膛率、腿肌率影响不大,但显著提高了7和21日龄时肉仔鸡的胸肌率,对42日龄时胸肌率没有显著性影响。HMB对幼雏的有效作用可能是因为幼雏的生长潜能和肌卫星细胞的活力较大[11]。相对于胸肌率的显著提高,肉仔鸡腿肌率未见受到影响,表明胸肌对HMB更敏感,具体机理还有待进一步研究。
与空白组相比,胚蛋给养HMB的肉仔鸡在第21日龄时腹脂率降低,而在42日龄时无显著变化。提示肉仔鸡生长前期,HMB参与了机体的脂肪代谢。一些报道研究HMB对肌肉生长和脂肪含量的作用时也得到了相似的结果,日粮中添加HMB能够降低兔子[26]、肉牛[8]脂肪的含量。临床试验报道,每天补充3 g HMB显著降低了体脂百分率,降低血浆中总胆固醇和低密度脂蛋白[27]。目前,对于HMB参与脂肪代谢的机制尚未清楚。综上,胚蛋给养HMB可改善肉仔鸡的胴体性状,增加胸肌比例,降低脂肪含量。
3.3 胚蛋给养HMB对肉仔鸡肌细胞形态和卫星细胞有丝分裂活性的影响
肌纤维的形成分为孵化和出壳后两阶段,孵化阶段主要是肌源性卫星细胞的增殖,出壳后阶段肌细胞数量几乎不再改变,主要是肌细胞的肥大。肌肉组织离体培养研究表明,HMB可上调卫星细胞增殖及成肌分化调节因子的表达,促进蛋白质合成[25]。日粮中添加适量HMB可增加小鼠[28]和肉鸡[18]的肌纤维直径。与以上结果相似,在本试验中,胚蛋给养HMB提高了肉仔鸡出壳后一周以内的肌细胞直径,未见显著影响胸肌细胞密度。一般情况下肌细胞密度与肌细胞直径呈负相关,HMB引起的肌纤维的生长可能与肌细胞的肥大和肌细胞密度未明显降低有关。
卫星细胞的活力在家禽出雏后的第一周较高,然后不断下降[29]。与出壳后立即饲喂商业日粮相比,孵化后即刻采食含有HMB日粮的仔火鸡48 h和1周龄体重显著增加,且48 h的卫星细胞核分裂能力最高[11]。本试验观察肉鸡出壳后一周内的胸肌卫星细胞有丝分裂活性的变化,结果显示胚蛋给养HMB显著提高了雏鸡肌肉卫星细胞有丝分裂活性指数。因成熟肌细胞的生长能力有限,家禽出雏后期肌肉最终重量更大程度上取决于肌细胞核增殖和融合。比日粮添加HMB更有优势,通过胚蛋给养可以将HMB对肌肉发育的作用提前到胚胎期,及早调控了卫星细胞的增殖潜力。综上,HMB改善骨骼肌生长和增加肌肉产量,可通过影响肉仔鸡出壳后卫星细胞的活性实现。
3.4 胚蛋给养HMB对肉仔鸡血浆激素水平的影响
肌纤维的生长发育受体内代谢激素的调节,其中GH是促进蛋白质合成的重要激素之一。研究表明GH可直接作用于组织器官中的特异性受体,促进组织对糖和氨基酸的吸收利用;GH促生长作用还可经IGF-1的介导实现[30]。IGF-1是GH诱导靶细胞产生的一种肽类物质,主要由肝合成,是调节肌卫星细胞增殖和分化的主要生长因子之一,其能促进骨骼肌的合成,促使肌纤维增大。给妊娠母猪补充HMB可显著提高仔猪血清中GH和IGF-1的含量(38%和20%),从而促进生长轴的调节作用[19];类似的,肉羊试验表明,采食HMB饲粮的羔羊血清GH和IGF-1水平均显著高于对照组[31]。本试验结果表明,胚蛋给养HMB未见影响各阶段肉仔鸡血浆GH,这与前期研究相类似[5,12],表明HMB对肉仔鸡生长的调节与GH关联性不强。胚蛋给养HMB能够提高7日龄肉仔鸡血浆中的IGF-1水平,对1、21和42日龄IGF-1水平的影响不显著,这可能与日粮营养水平、肉鸡的生理状态和生长阶段有关。
4 结 论
胚蛋给养HMB可提高肉仔鸡出壳重,增加卫星细胞有丝分裂活性,促进肉仔鸡肌肉发育,加快肉仔鸡生长,尤其是在其生长前期;注射HMB不影响种蛋孵化率和肉仔鸡饲料/增重;注射生理盐水与不注射处理结果相似,对肉仔鸡生长没有影响。
[1] 马友彪, 张海军, 王 晶, 等. 肉禽卵内给养研究进展[J].动物营养学报,2015,27(10):3012-3019.
MA Y B, ZHANG H J, WANG J, et al. Research progress ofinovofeeding in meat-type poultry[J].ChineseJournalofAnimalNutrition,2015,27(10):3012-3019.(in Chinese)
[2] UNI Z, FERKET P R. Enhancement of development of oviparous species byinovofeeding:US,EP1307230 A2 [P].2003-05-07.
[3] 丁庆峰, 刘贺贺, 陈 禧, 等. 鸭胚卵内注射rhIGF-1对其出壳后卵泡抑素基因表达及胸肌发育的影响[J].畜牧兽医学报,2011,42(8):1101-1106.
DING Q F, LIU H H, CHEN X, et al. The effect of in ovo injecting rhlGF-1 into egg on the expression of follistatin gene after out of shell and the muscle development in duck[J].ActaVeterinariaetZootechnicaSinica,2011,42(8):1101-1106. (in Chinese)
[4] LIU H H, WANG J W, ZHANG R R, et al.Inovofeeding of IGF-1 to ducks influences neonatal skeletal muscle hypertrophy and muscle mass growth upon satellite cell activation[J].JCellPhysiol,2012,227(4):1465-1475.
[5] 马友彪, 周 梁, 王 晶, 等. 胚蛋给养β-羟基-β-甲基丁酸对肉仔鸡生长性能、胴体组成和血浆激素指标的影响[J].动物营养学报,2015,27(2):588-595.
MA Y B, ZHOU L, WANG J, et al. Effects ofinovofeeding of β-Hyroxy-β-Methylbutyrate on growth performance, carcass composition and plasma hormones indexes in broilers[J].ChineseJournalofAnimalNutrition,2015,27(2):588-595. (in Chinese)
[6] NISSEN S L, ABUMRAD N N. Nutritional role of the leucine metabolite beta-hydroxy beta-methylbutyrate(HMB)[J].JNutrBiochem,1997,8(6):300-311.
[7] 李永明, 徐子伟, 刘 杰, 等. 母猪饲粮添加β-羟基-β-甲基丁酸对母猪繁殖性能及仔猪生长性能和免疫功能的影响[J].动物营养学报,2012,24(9):1745-1753.
LI Y M, XU Z W, LIU J,et al. Effects of adding β-hydroxy-β-methylbutyrate to sow diets on reproductive performance of sows and growth performance of piglets and their immune function[J].ChineseJournalofAnimalNutrition,2012,24(9):1745-1753. (in Chinese)
[8] VAN KOEVERING M T, DOLEZAL H G, GILL D R, et al. Effects of beta-hydroxy-beta-methyl butyrate on performance and carcass quality of feedlot steers[J].JAnimSci,1994,72(8):1927-1935.
[9] 郭俊清. 亮氨酸及β-羟基β-甲基丁酸钙对绒山羊免疫机能和生产性能影响的研究 [D].呼和浩特: 内蒙古农业大学,2009.
GUO J Q. Study on effects of leucine and HMB-Ca on immune function and performance of Inner Mongolia white cashmere goats [D].Hohhot: Inner Mongolia Agricultural University,2009. (in Chinese)
[10] 张海军, 王 成, 武书庚, 等. β-羟基-β-甲基丁酸对肉仔鸡生长性能和屠宰性能的影响[J].中国饲料,2009(2):19-21.
ZHANG H J, WANG C, WU S G, et al. Effects of beta-hydroxy-beta-methylbutyrate on growth and slaughter performance in broiler chick[J].ChinaFeed,2009(2):19-21. (in Chinese)
[11] MOORE D T, FERKET P R, MOZDZIAK P E. The effect of early nutrition on satellite cell dynamics in the young turkey[J].PoultSci,2005,84(5):748-756.
[12] 乔 璇, 岳洪源, 计 峰, 等. β-羟基-β-甲基丁酸钙对肉仔鸡生长性能、屠宰性能和血液激素的影响[J].中国畜牧兽医,2011,38(8):5-9.
QIAO X, YUE H Y, JI F, et al. Effects of beta-hydroxy-beta-methyl-butyrate calcium on growth performance, slaughter trait and serum hormones in broiler chickens[J].ChinaAnimalHusbandry&VeterinaryMedicine,2011,38(8):5-9. (in Chinese)
[13] 邓留坤. 家禽胚蛋注射早期给养的研究进展[J].家禽科学,2013(12):46-49.
DENG L K. Advances on embryonated egg injection in poultry nutrition research[J].Poultry,Science,2013(12):46-49. (in Chinese)
[14] AL-DARAJI H J, AL-MASHADANI A A, AL-HAYANI W K, et al. Effect ofinovoinjection withL-arginine on productive and physiological traits of Japanese quail[J].SAfrJAnimSci,2012,42(2):139-145.
[15] NOWACZEWSKI S, KONTECKA H, KRYSTIANIAK S. Effect ofinovoinjection of vitamin C during incubation on hatchability of chickens and ducks[J].FoliaBiol(Krakow),2012,60(1-2):93-97.
[16] OHTA Y, TSUSHIMA N, KOIDE K, et al. Effect of amino acid injection in broiler breeder eggs on embryonic growth and hatchability of chicks[J].PoultSci,1999,78(11):1493-1498.
[17] 谷 英. N-氨甲酰谷氨酸和β-羟基-β-甲基丁酸盐复合物对白绒山羊和绵羊生长性能及肉品质的影响 [D].呼和浩特: 内蒙古农业大学,2012.
GU Y. Effect of NCG and HMB on growing performance and meat quality of white cashmere goats and sheep [D].Hohhot: Inner Mongolia Agricultural University,2012. (in Chinese)
[18] 乔 璇. β-羟基-β-甲基酸钙(HMB-Ca)对肉仔鸡肌肉生长的调控和相关基因表达的影响 [D].广州: 华南农业大学,2012.
QIAO X. Effects of beta-hydroxy-beta-methylbutyrate-Ca (HMB-Ca) in muscle metabolism and related genes to growth in broilers [D].Guangzhou: South China Agricultural University,2012. (in Chinese)
[19] TATARA M R, SLIWA E, KRUPSKI W. Prenatal programming of skeletal development in the offspring: Effects of maternal treatment with β-hydroxy-β-methylbutyrate (HMB) on femur properties in pigs at slaughter age[J].Bone,2007,40(6):1615-1622.
[20] BUYSE J, SWENNEN Q, VANDEMAELE F, et al. Dietary β-hydroxy-β-methylbutyrate supplementation influences performance differently after immunization in broiler chickens[J].JAnimPhysiolAnimNutr(Berl),2009,93(4):512-519.
[21] FOYE O T, UNI Z, FERKET P R. Effect ofinovofeeding egg white protein, β-hydroxy -β-methylbutyrate, and carbohydrates on glycogen status and neonatal growth of turkeys[J].PoultSci,2006,85(7):1185-1192.
[22] FOYE O T, FERKET P R, UNI Z. The effects ofinovofeeding arginine, beta-hydroxy-beta-methyl-butyrate, and protein on jejunal digestive and absorptive activity in embryonic and neonatal turkey poults[J].PoultSci,2007,86(11):2343-2349.
[23] SLATER G J, JENKINS D. Beta-hydroxy-beta-methylbutyrate (HMB) supplementation and the promotion of muscle growth and strength[J].SportsMed,2000,30(2):105-116.
[24] NISSEN S, SHARP R, RAY M, et al. Effect of leucine metabolite beta-hydroxy-beta-methylbutyrate on muscle metabolism during resistance-exercise training[J].JApplPhysiol,1996,81(5):2095-2104.
[25] KORNASIO R, HALEVY O, KEDAR O, et al. Effect ofinovofeeding and its interaction with timing of first feed on glycogen reserves, muscle growth, and body weight[J].PoultSci,2011,90(7):1467-1477.
[26] OSTASZEWSKI P, GRZELKOWSKA-KOWALCZYK K, MOTYL T, et al. 3-hydroxy-3-methylbutyrate and 2-oxoisocaproate affect body composition and cholesterol concentration in rabbits[J].JAnimPhysiolAnimNutr,1998,79(1-5):135-145.
[27] VUKOVICH M D, STUBBS N B, BOHLKEN R M. Body composition in 70-year-old adults responds to dietary beta-hydroxy-beta-methylbutyrate similarly to that of young adults[J].JNutr,2001,131(7):2049-2052.
[28] WILSON J M, GRANT S C, LEE S R, et al. Beta-hydroxy-beta-methyl-butyrate blunts negative age-related changes in body composition, functionality and myofiber dimensions in rats[J].JIntSocSportsNutr, 2012,9(1):18.
[29] NIEROBISZ L S, FELTS V, MOZDZIAK P E. The effect of early dietary amino acid levels on muscle satellite cell dynamics in turkeys[J].CompBiochemPhysiolBBiochemMolBiol,2007,148(3):286-294.
[30] SCANES C G, VASILATOS-YOUNKEN R. Somatotropic axis and growth in broilers[J].ArchivFuerGefluegelkunde,1995(3):9-13.
[31] TATARA M R. Neonatal programming of skeletal development in sheep is mediated by somatotrophic axis function[J].ExpPhysiol,2008,93(6):763-772.
(编辑 郭云雁)
Effect ofinOvoFeeding of β-Hydroxy-β-Methylbutyrate on Hatchability,Performance and Skeletal Muscle Development in Broilers
MA You-biao#,ZHANG Hai-jun#,WANG Jing,WU Shu-geng*,QI Guang-hai
(KeyLaboratoryofFeedBiotechnologyofMinistryofAgriculture,FeedResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China)
The objective of the present study was to investigate the effect ofinovofeeding of beta-hydroxy-beta-methylbutyrate (HMB) on hatchability, growth performance and skeletal muscle development in broilers. A total of 540 fertilized eggs from Arbor Acre broilers were allotted into 3 treatments: one control group (without injection), and two injection groups injected with 1 mL 0.9% saline (saline group) and 1 mL 0.1% HMB (HMB group) at 7 d of incubation, respectively. After hatching, 72 healthy male chicks were selected from each treatment and randomly divided into 6 replicates with 12 birds each. The results showed that: 1)Inovofeeding had no significant effect on hatchability of fertilized eggs (P>0.05). 2) Compared with the other groups, HMB injection significantly increased the BW of broiler at hatch and 21 d posthatch and markedly elevated ADG during the first 21 days (P<0.05). 3) At 7 d of age, breast muscle percentage of chicks from HMB injection group were increased by 1.01% than that of chicks from saline group (P=0.019).Inovofeeding HMB significantly increased breast muscle percentage of broilers by 1.11% (P<0.05) than the control group and by 1.04% (P<0.05) than the saline injection group at 21 d of age. 4) The abdominal fat percentage of chicks from HMB injection group was the lowest, and significantly lower than that of chicks from the control group at 21 d of age (P=0.018). 5) Compared with the control group and saline group, chicks from HMB injection group had significantly higher myofiber diameter at hatch and 4 d of age (P<0.05). 6) At hatch and 7 d of age, the mitotic activity of satellite cells in breast muscle in chicks from HMB group were significantly higher than that from other groups (P<0.05). 7) At 7 d of age, plasma Insulin-like growth factor-1 (IGF-1) content in HMB injection group was significantly higher than that in the control group (P<0.05), while there was no significant difference between HMB and the saline groups (P>0.05).Inovofeeding HMB may improve BW at hatch, increase mitotic activity of satellite cells and IGF-1 content in the blood circulation, thus facilitating the breast muscle development and promoting the growth in the early period.Inovofeeding HMB did not affect hatchability and feed conversion ratio in broilers. Growth performance was not different between the control and saline injection groups.
β-hydroxy-β-methylbutyrate;inovofeeding; growth performance;breast muscle; broiler
10.11843/j.issn.0366-6964.2016.11.012
2016-01-08
家禽产业技术体系北京市创新团队(CARS-PSTP);北京市自然科学基金(6132027)
马友彪(1989-),男,山东济宁人,硕士生,主要从事动物营养与饲料科学研究,E-mail:myb0514@126.com;张海军(1976-),男,河南南阳人,副研究员,硕士生导师,主要从事动物营养调控研究,E-mail:fowlfeed@163.com。马友彪和张海军并列为第一作者
*通信作者:武书庚,研究员,硕士生导师,主要从事动物营养调控研究,E-mail:wushugeng@caas.cn
S831.4
A
0366-6964(2016)11-2248-09
