酿酒葡萄皮渣对单栏饲养方式下公绵羊繁殖性能及睾丸抗氧化性的影响
2016-12-13金亚倩刘文忠赵俊星任有蛇张春香张文佳项斌伟马雪豪张建新
金亚倩,刘文忠,赵俊星,任有蛇,张春香,张文佳,项斌伟,马雪豪,张建新*
(1.山西农业大学动物科技学院,太谷 030801; 2.山西省右玉县畜牧局,右玉 037200)
酿酒葡萄皮渣对单栏饲养方式下公绵羊繁殖性能及睾丸抗氧化性的影响
金亚倩1,刘文忠1,赵俊星1,任有蛇1,张春香1,张文佳2,项斌伟2,马雪豪1,张建新1*
(1.山西农业大学动物科技学院,太谷 030801; 2.山西省右玉县畜牧局,右玉 037200)
旨在研究日粮中添加一定量的酿酒葡萄皮渣对绵羊繁殖性能及睾丸抗氧化性能的影响。试验选取30只5月龄,体重(25±1)kg的杜泊×小尾寒羊杂交公羊,采用完全随机设计平均分为5组。1组自由活动,其余4组单栏饲养,建立应激模型。自由活动绵羊饲喂未添加葡萄皮渣日粮,单栏饲养绵羊分别饲喂不同葡萄皮渣添加水平(0%、5%、10%、20%)日粮。试验期80 d。试验结束后,屠宰取样,测定睾丸系数并作附睾精子分析,测定睾丸组织抗氧化水平,对睾丸组织中Cu-ZnSOD、CAT、GPx4及Nrf2 mRNA和蛋白相对表达量进行研究。结果表明,与自由活动组相比,单栏组绵羊睾丸组织中MDA及ROS水平升高(P<0.01),睾丸重量显著降低(P<0.05),睾丸系数也表现出下降趋势(P=0.06),附睾精子密度及顶体完整率显著降低(P<0.05),精子活动率极显著降低(P<0.01),精子畸形率极显著升高(P<0.01),表明单栏饲养方式对绵羊造成氧化应激,并在一定程度上影响绵羊繁殖性能。适量添加酿酒葡萄皮渣后,绵羊附睾精子密度和精子活动率均显著升高(P<0.05),精子畸形率显著降低(P<0.05),睾丸组织MDA含量显著下降(P<0.01),SOD、CAT及GSH-Px活性均显著提高(P<0.01,P<0.05,P<0.01);睾丸组织中Cu-ZnSODmRNA相对表达量显著提高(P<0.05),Cu-ZnSOD、CAT、GPx4蛋白相对表达量显著提高(P<0.05)。综上表明,酿酒葡萄皮渣可以提高单栏饲养方式下绵羊睾丸组织抗氧化性,进而改善绵羊繁殖性能。
单栏饲养;酿酒葡萄皮渣;公绵羊;睾丸;繁殖性能;抗氧化性
中国养羊业发展迅速,在为农民带来增收的同时,也对生态环境造成了巨大压力。因此,在北方地区,尤其是在牧区,养羊模式已经从传统的放牧饲养转变为以舍饲为主的集约化饲养模式[1]。为了减少占地面积,降低饲养成本,舍饲状态下羊群密度也在增加,羊只活动范围越来越小,这种变化对羊造成一定应激,影响其生产性能与繁殖性能[2]。
酿酒葡萄皮渣(Wine grape pomace,WGP)是葡萄酒厂的下脚料,中国每年会产生80万t以上的WGP,其中极少部分被用作肥料,绝大部分被直接当垃圾倒掉,造成了环境污染与资源浪费[3]。WGP中含有较高的粗蛋白和粗脂肪,是一种很好的饲料,更重要的是其含有大量的葡多酚,能够有效清除机体自由基,减少氧化应激[4-6],有利于动物的生产与健康[7-9]。
雄性动物睾丸组织中含大量高不饱和脂肪酸[10],且在精子发生过程中会产生大量活性氧[11],使其更易遭受氧化应激。当睾丸组织受到氧化损伤时,精子发生障碍,精液品质下降[10]。研究发现,白藜芦醇[12]、原花青素[13]等天然抗氧化剂可以减少大鼠睾丸组织损伤,提高组织抗氧化水平,改善繁殖性能。本研究鉴于WGP的抗氧化功能,以杜泊×小尾寒羊杂一代公羔为研究对象,通过单栏饲养方式来建立应激模型,旨在研究WGP对单栏饲养方式下绵羊繁殖性能以及睾丸抗氧化性能的影响,为合理利用废渣、减少资源浪费,同时开发功能性饲料提供科学依据。
1 材料与方法
1.1 试验材料与主要仪器
1.1.1 试验日粮 所用WGP购自山西省太谷县怡园干红葡萄酒厂,经自然晾晒后贮存备用。WGP中所含常规营养成分及总多酚含量均在试验开始前测定(表1)。
表1 酿酒葡萄皮渣营养成分表(风干基础)
Table 1 Nutrient composition of wine grape pomace (air-dry matter basis)%
基础日粮参照NRC(2007)绵羊营养需要中体重25 kg,日增重200 g公羔营养需要设计配方,其他3种日粮分别添加5%、10%、20%WGP,调整玉米、豆粕及粗饲料的比例,使这3种日粮能量、蛋白含量与基础日粮一致。试验日粮均制成全混合颗粒饲料。4种试验日粮组成及营养水平见表2。
1.1.2 主要试剂 附睾稀释液参照文献[14]配制,配方见表3。
表2 试验日粮组成及营养成分
Table 2 Composition and nutrient level of diets (air-dry matter basis)%
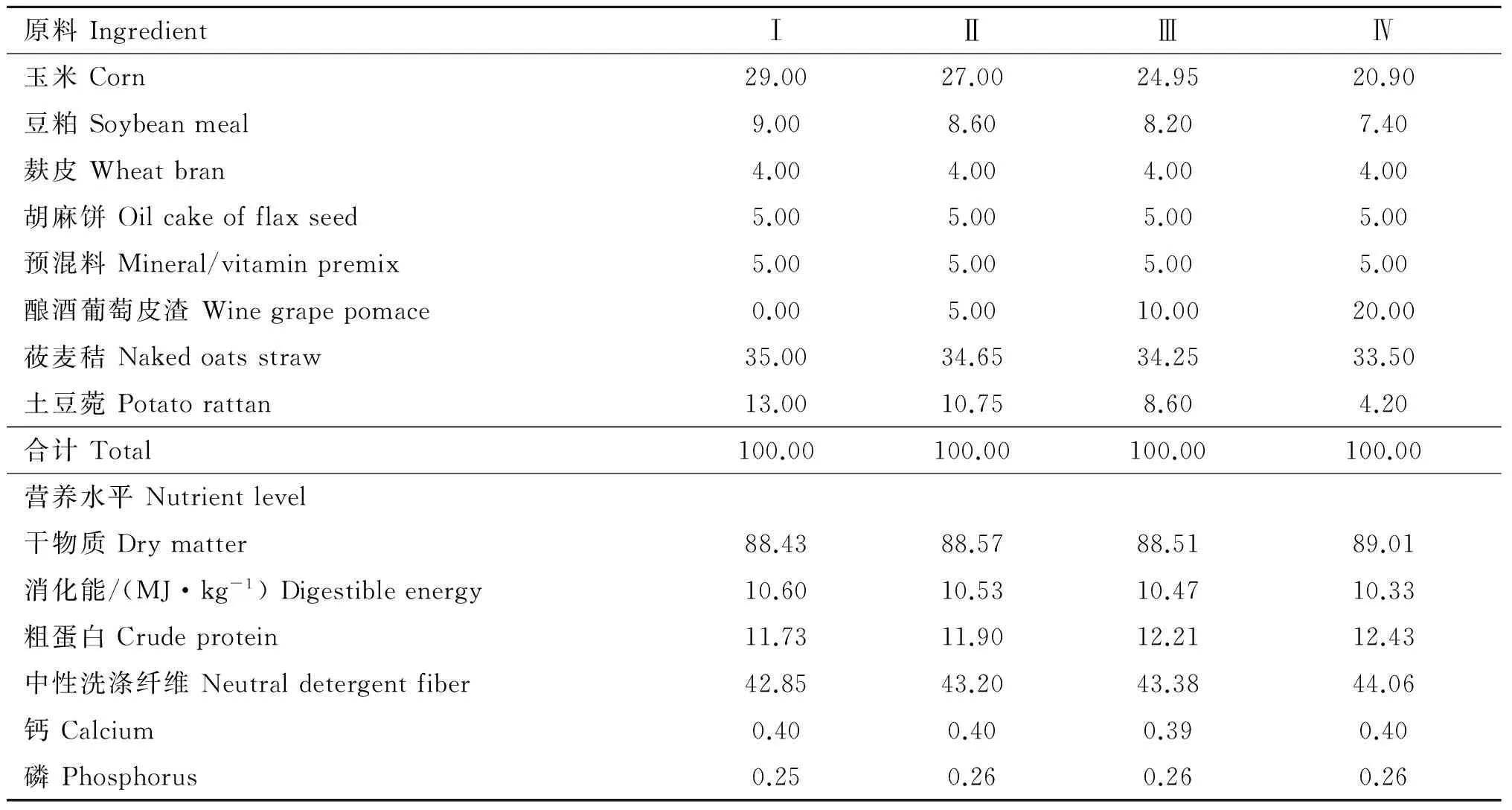
原料IngredientⅠⅡⅢⅣ玉米Corn29.0027.0024.9520.90豆粕Soybeanmeal9.008.608.207.40麸皮Wheatbran4.004.004.004.00胡麻饼Oilcakeofflaxseed5.005.005.005.00预混料Mineral/vitaminpremix5.005.005.005.00酿酒葡萄皮渣Winegrapepomace0.005.0010.0020.00莜麦秸Nakedoatsstraw35.0034.6534.2533.50土豆菀Potatorattan13.0010.758.604.20合计Total100.00100.00100.00100.00营养水平Nutrientlevel干物质Drymatter88.4388.5788.5189.01消化能/(MJ·kg-1)Digestibleenergy10.6010.5310.4710.33粗蛋白Crudeprotein11.7311.9012.2112.43中性洗涤纤维Neutraldetergentfiber42.8543.2043.3844.06钙Calcium0.400.400.390.40磷Phosphorus0.250.260.260.26
饲料中微量元素添加量(mg·kg-1):Cu 14, Fe 50, Mn 40, Se 0.3, I 0.5, Co 0.2;饲料中维生素添加量(IU·kg-1):VA 20 000, VD 4 000, VE 400。除DE外,饲料中其他各营养成分均为实测值
Additive mineral premix(mg·kg-1):Cu 14, Fe 50, Mn 40, Se 0.3, I 0.5, Co 0.2; Additive vitamin premix(IU·kg-1):VA 20 000, VD 4 000, VE 400. Beside DE, the composition of diet was measured by analyzing really
表3 附睾稀释液配方
Table 3 Ingredients of the diluent of epididymis
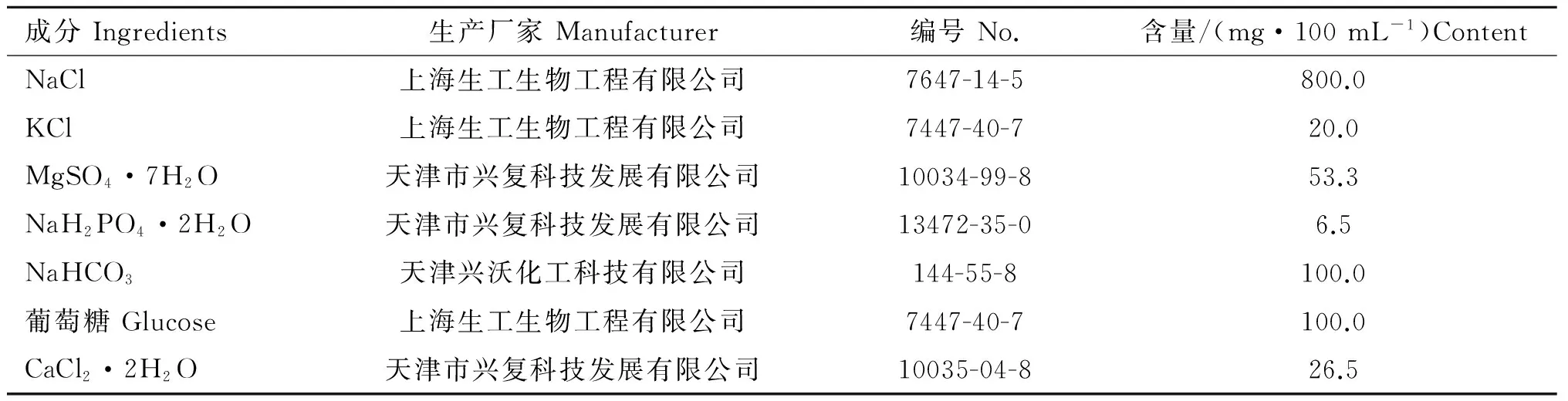
成分Ingredients生产厂家Manufacturer编号No.含量/(mg·100mL-1)ContentNaCl上海生工生物工程有限公司7647-14-5800.0KCl上海生工生物工程有限公司7447-40-720.0MgSO4·7H2O天津市兴复科技发展有限公司10034-99-853.3NaH2PO4·2H2O天津市兴复科技发展有限公司13472-35-06.5NaHCO3天津兴沃化工科技有限公司144-55-8100.0葡萄糖Glucose上海生工生物工程有限公司7447-40-7100.0CaCl2·2H2O天津市兴复科技发展有限公司10035-04-826.5
总可抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化物酶(CAT)、丙二醛(MDA)和活性氧(ROS)测定试剂盒购自南京建成生物工程研究所;PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒、SYBR®Premix Ex TaqTMⅡ试剂盒购自TaKaRa 公司;Goat-Cu/ZnSOD多克隆一抗(sc-8637)、Goat-Catalase多克隆一抗(sc-34281)、Rabbit-GPx4多克隆一抗(sc50497)购自Santa Cruz Biotechnology公司,Rabbit-Nrf2多克隆一抗(LS-C31637)购自LifeSpan BioSciences公司,β-Tubulin Antibody购自Cell Signaling Technology公司,Donkey Anti-goat IgG-HRP(sc-2020)二抗和Donkey Anti-rabbit IgG-HRP(sc-2313)二抗购自Santa Cruz Biotechnology公司。
1.1.3 主要仪器 显微镜(Olympus,BH2型)、酶标仪(BioTek Synergy H1/H1MFD)、实时荧光定量PCR仪(Mx3000,Stratagene,美国)、Western bolt电泳仪(Bio-Rad Mini-PROTEAN,CAT1658001)
1.2 试验设计
选用30只5月龄,体重25 kg左右的杜泊×小尾寒羊杂一代公羔,试验前经过严格检疫。试验采用单因素完全随机试验设计,将30只试验羊随机分为5组,每组6只:A、B、C、D为单栏饲养,活动范围为0.8 m2,E组6只羊混合饲养,且能自由活动,每只羊平均活动范围为2.00 m2。A、E组饲喂日粮I(WGP含量为0);B组饲喂日粮II(WGP含量为5%);C组饲喂日粮III(WGP含量为10%);D组饲喂日粮IV(WGP含量为20%)。其中,A组(对照组)与E组对比用于建立应激模型。
1.3 动物饲养管理
试验于2015年5-8月在山西省右玉县宏宇牧业有限公司种羊养殖场进行。试验期90 d,其中预饲期10 d,正式期80 d。试验前对试验羊舍进行清扫消毒,并对试验羊进行免疫注射羊痘、口蹄疫和小反刍兽疫疫苗。在预饲期进行试验羊的分组、编号及驱虫工作,使试验羊适应单栏饲养管理方式,并将B、C、D组的日粮由基础日粮逐渐过渡到其相应的试验日粮。
正式期,试验羊每日分两次饲喂,分别为8:00和18:00,各组羊饲喂其相应的日粮,所有羊自由采食,自由饮水,并记录每只羊每天的采食量。
1.4 样品采集
在试验结束当天下午16:00,对所有试验羊禁食、禁水16 h,并在次日上午8:00进行屠宰。屠宰后,将一侧附睾组织放入40 mL 附睾稀释液中,迅速将其剪碎,静置15 min以使附睾中的精子充分逸出,然后用两层擦镜纸滤去组织残渣,制成精子悬液以用作精子分析(冰上操作);取一侧睾丸组织剪成小块,液氮速冻,-80 ℃保存,用于测定组织抗氧化指标以及提取总RNA与总蛋白。
1.5 测定指标与方法
1.5.1 睾丸重量系数及睾丸体积计算 屠宰后迅速取两侧睾丸,去除周围结缔组织,称取两侧睾丸总重量,计算睾丸系数,公式:睾丸系数(%)=(睾丸重量/体重)×100%;测量睾丸长、宽、厚,计算睾丸体积,体积(cm3)=长×宽×厚。
1.5.2 精子分析 精子密度:用移液枪吸取0.1 mL精子悬液,用附睾稀释液将其稀释20倍,然后取20 μL滴于血细胞计数板,显微镜下观察计数,作好记录。
精子活动率:取精子悬液10 μL滴于载玻片上,加上盖玻片,低倍镜下观察5个视野,计数200个精子,记录活动精子百分率。
精子畸形率:将精子悬浮液制作抹片,以中性福尔马林固定,风干后姬姆萨染液染色1 h后清水冲洗,显微镜观察。精子畸形率(%)=(畸形精子数/精子总数)×100%。
顶体完整率:样品处理同精子畸形率,顶体完整率(%)=(顶体完整精子数/精子总数)×100%。
1.5.3 睾丸组织抗氧化指标测定 样品预处理:取在 -80 ℃ 保存的睾丸样品,在液氮中充分研磨至粉末,称取组织粉末1 g,按1∶9的比例加入冰冷生理盐水,用组织匀浆仪匀浆5~10 min,制成10%的组织匀浆。将制好的匀浆4 ℃,3 500 r·min-1离心10 min,取上清进行下一步检测。
睾丸组织上清T-AOC、SOD、CAT、GSH-Px活性及MDA、ROS水平等指标测定按照南京建成公司提供的试剂盒说明书操作。
1.5.4 mRNA相对表达量检测 按照Trizol法提取睾丸组织总RNA,检测浓度及完整性后,以RNA单链为模板,用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒合成cDNA。引物(表4)参照GenBank上已登录的绵羊Cu-ZnSOD、CAT、GPx4及Nrf2基因序列,以RPL13为内参基因,利用Primer Premier 5.0 软件设计5对特异性引物,然后将设计好的引物与NCBI基因数据库进行引物比对,对其进行特异性检测,由北京六合华大基因科技股份有限公司合成。以反转录产物cDNA为模板进行实时荧光定量PCR,结果根据2-△△CT法计算。
表4 各基因引物序列
Table 4 Primer sequence

基因登录号引物序列(5'-3')产物/bpGenenameAccessionNo.PrimersequenceProductCu-ZnSODNM_001145185.1F:GGAGACCTGGGCAATGTGAAR:CCTCCAGCGTTTCCAGTCTT182CatalaseXM_004016396.3F:GAGCCCACCTGCAAAGTTCTR:CTCCTACTGGATTACCGGCG148GPx4XM_015096017.1F:TCGCTGCTGGCTATAACGTCR:GACCATACCGCTTCACCACA189Nrf2XM_015098735.1F:TGTGGAGGAGTTCAACGAGCR:CGCCGCCATCTTGTTCTTG88RPL13XM_015100414.1F:GCAAAAAGGGCCAAGGAAGCR:CAAAGGTCAGACACACCCCA155
1.5.5 Western blot分析 利用蛋白裂解液提取睾丸组织总蛋白,SDS-PAGE电泳,经转膜、封闭后加入相应一抗,4 ℃过夜,漂洗后孵育相应二抗,室温2 h,漂洗,用ECL发光试剂盒进行曝光。将曝光结果用Image Lab软件分析,得到目的蛋白与内参β-Tubulin的蛋白含量,目的蛋白的相对表达量=目的蛋白含量/β-Tubulin蛋白含量。
1.6 数据分析
数据用Excel 2013初步整理和计算,用于建立应激模型的数据(A组与E组)采用SPSS 22.0进行独立样本t检验分析;单栏饲养的4组数据(A、B、C、D组)采用SPSS 22.0进行单因素方差分析,并用Dunnett法将各处理组与对照组进行差异显著性检验。
2 结 果
2.1 饲养方式对绵羊繁殖性能的影响
由表5可以看出,自由活动组绵羊睾丸重量显著高于单栏组(P<0.05),睾丸系数也有升高趋势,但未出现显著差异(P>0.05);与自由活动组相比,单栏组绵羊睾丸长度、宽度及体积均显著降低(P<0.05),厚度无显著性差异(P>0.05);自由活动组绵羊附睾精子密度和顶体完整率显著高于单栏组(P<0.05),精子活动率极显著地高于单栏组(P<0.01),精子畸形率极显著地低于单栏组(P<0.01)。
表5 饲养方式对公绵羊繁殖性能的影响
Table 5 Effect of feeding model on reproductive performance of ram
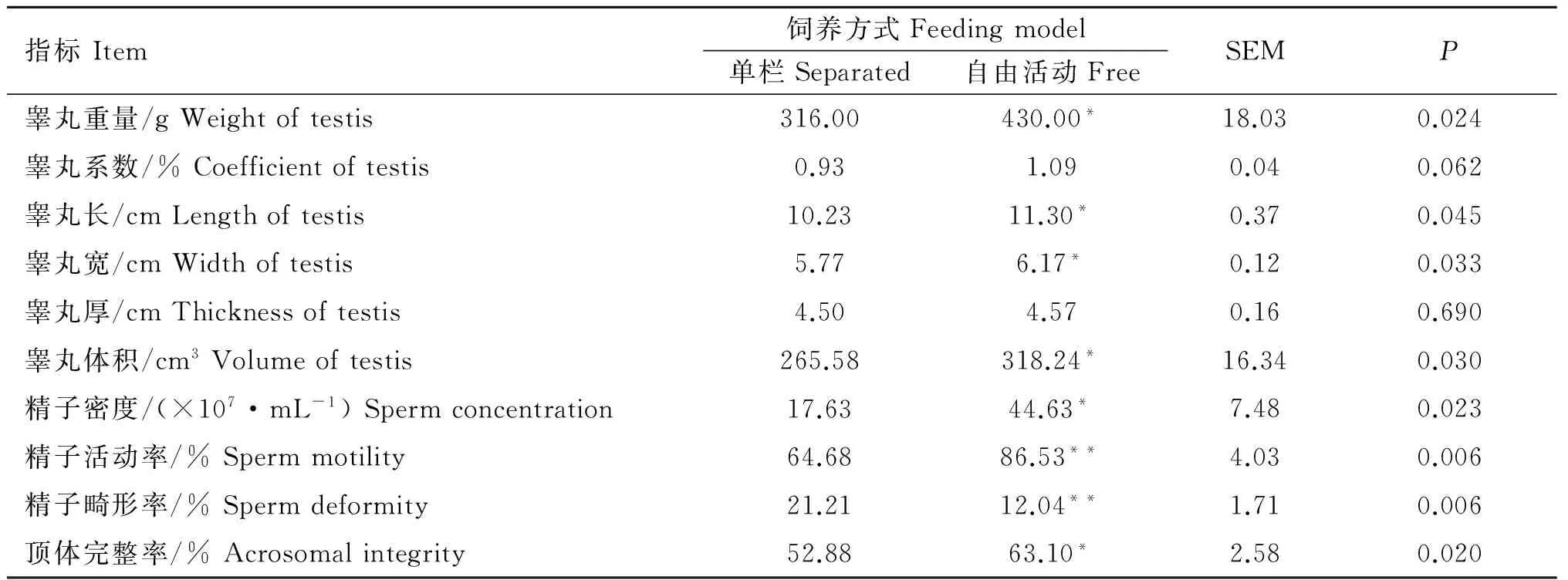
指标Item饲养方式Feedingmodel单栏Separated自由活动FreeSEMP睾丸重量/gWeightoftestis316.00430.00*18.030.024睾丸系数/%Coefficientoftestis0.931.090.040.062睾丸长/cmLengthoftestis10.2311.30*0.370.045睾丸宽/cmWidthoftestis5.776.17*0.120.033睾丸厚/cmThicknessoftestis4.504.570.160.690睾丸体积/cm3Volumeoftestis265.58318.24*16.340.030精子密度/(×107·mL-1)Spermconcentration17.6344.63*7.480.023精子活动率/%Spermmotility64.6886.53**4.030.006精子畸形率/%Spermdeformity21.2112.04**1.710.006顶体完整率/%Acrosomalintegrity52.8863.10*2.580.020
同行标有*表示与对照组差异显著(P<0.05),标有**表示与对照组差异极显著(P<0.01),不标表示差异不显著(P>0.05)。下表同
In the same raw, values with * mean significant difference with control group atP<0.05, **mean significant difference with control group atP<0.01, no * means no significant difference with control group (P>0.05). The same as below
2.2 饲养方式对绵羊睾丸组织氧化水平的影响
本研究中单栏组绵羊睾丸组织T-AOC与自由活动组相比有升高趋势,但差异不显著(P>0.05)(图1A)。MDA和ROS都是机体氧化应激产生的有害物质,本研究中绵羊睾丸组织MDA及ROS水平在单栏饲养后极显著升高(P<0.01)(图1B、C)。
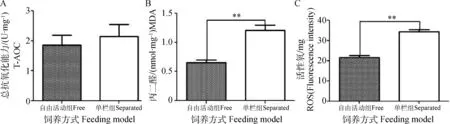
**. P<0.01图1 饲养方式对绵羊睾丸组织T-AOC(A)、MDA(B)及ROS(C)含量的影响Fig.1 Effect of feeding model on testicular T-AOC (A), MDA (B) and ROS (C) level of ram
2.3 日粮中添加酿酒葡萄皮渣对绵羊睾丸发育及附睾精子分析结果的影响
由表6可以看出,添加WGP 3个处理组的睾丸均较对照组重,但差异不显著(P>0.05);睾丸系数基本无变化(P>0.05),可能是由于睾丸重量增加不及体重增加幅度大所导致;睾丸长度在添加WGP后有增加趋势,但无统计学意义(P>0.05);与对照组相比,3个添加组的睾丸宽度、厚度及体积均未出现显著变化(P>0.05)。10%和20%WGP添加组与对照组相比,附睾精子密度明显增大(P<0.01),5%添加组精子密度也较对照组大,差异显著(P<0.05);添加WGP可以提高绵羊精子活动率,降低精子畸形率,其中5%和10%添加组的精子活动率均显著高于对照组(P<0.05),10%添加组的精子畸形率显著低于对照组(P<0.05),20%添加组与对照组相比未出现显著差异(P>0.05);添加酿酒葡萄皮渣后,顶体完整率有升高趋势,但未出现显著差异(P>0.05)。研究表明,酿酒葡萄皮渣可以改善单栏饲养方式下绵羊的繁殖性能。
2.4 日粮中添加酿酒葡萄皮渣对绵羊睾丸组织抗氧化性的影响
由表7可以看出,绵羊睾丸组织的T-AOC未受到WGP添加水平的影响(P>0.05)。睾丸组织中的MDA含量在添加WGP后有所降低,3个添加组均极显著低于对照组(P<0.01)。CAT、GSH-Px及SOD是机体内存在的3种主要抗氧化酶,尤其是GSH-Px及SOD在动物睾丸组织中含量较高,其活性可以有效反映睾丸组织的抗氧化能力。本研究中3种抗氧化酶活性在添加WGP后都出现了不同程度的升高,其中5%和20%添加组CAT活性极显著高于对照组(P<0.01),10%添加组CAT活性也高于对照组,但差异不显著(P>0.05);3个添加组的GSH-Px活性均显著高于对照组(P<0.05),SOD活性均极显著高于对照组(P<0.01)。
表6 WGP添加水平对公绵羊繁殖性能的影响
Table 6 Effect of wine grape pomace on reproductive performance of ram
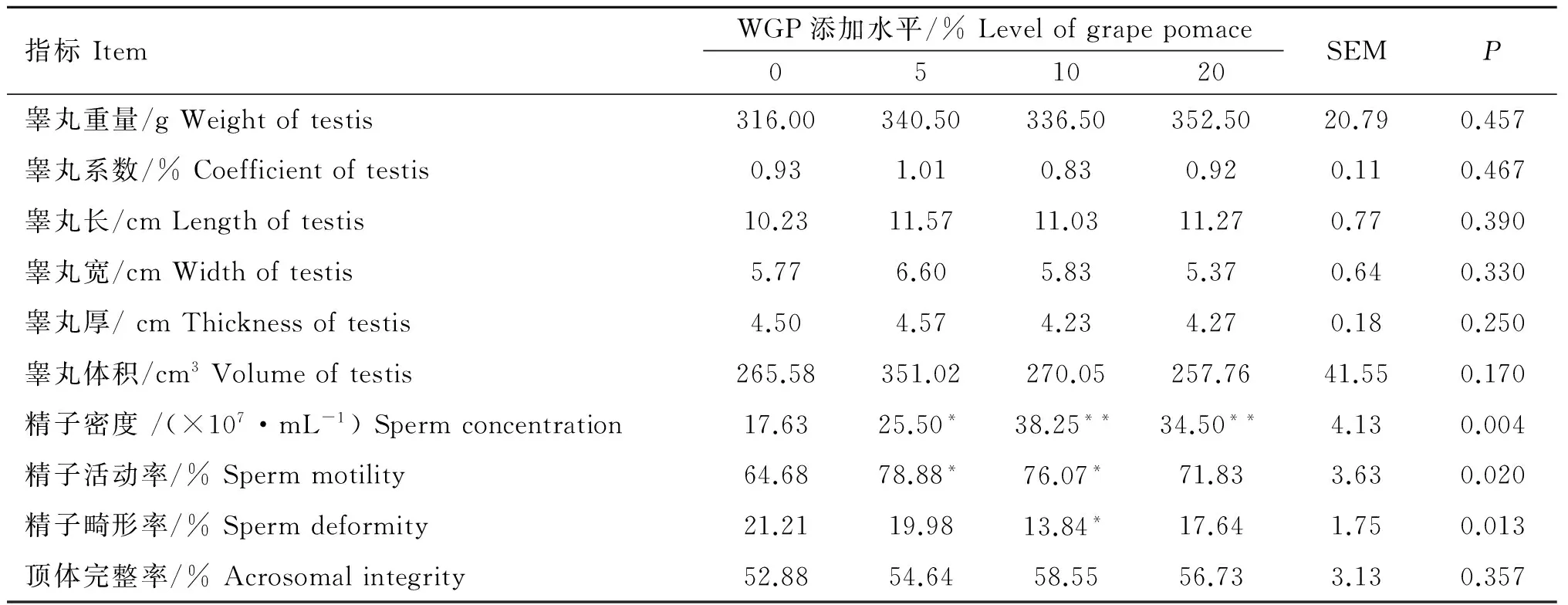
指标ItemWGP添加水平/%Levelofgrapepomace051020SEMP睾丸重量/gWeightoftestis316.00340.50336.50352.5020.790.457睾丸系数/%Coefficientoftestis0.931.010.830.920.110.467睾丸长/cmLengthoftestis10.2311.5711.0311.270.770.390睾丸宽/cmWidthoftestis5.776.605.835.370.640.330睾丸厚/cmThicknessoftestis4.504.574.234.270.180.250睾丸体积/cm3Volumeoftestis265.58351.02270.05257.7641.550.170精子密度/(×107·mL-1)Spermconcentration17.6325.50*38.25**34.50**4.130.004精子活动率/%Spermmotility64.6878.88*76.07*71.833.630.020精子畸形率/%Spermdeformity21.2119.9813.84*17.641.750.013顶体完整率/%Acrosomalintegrity52.8854.6458.5556.733.130.357
表7 WGP添加水平对绵羊睾丸组织抗氧化性能的影响
Table 7 Effect of wine grape pomace on testicular anti-oxidative status of ram
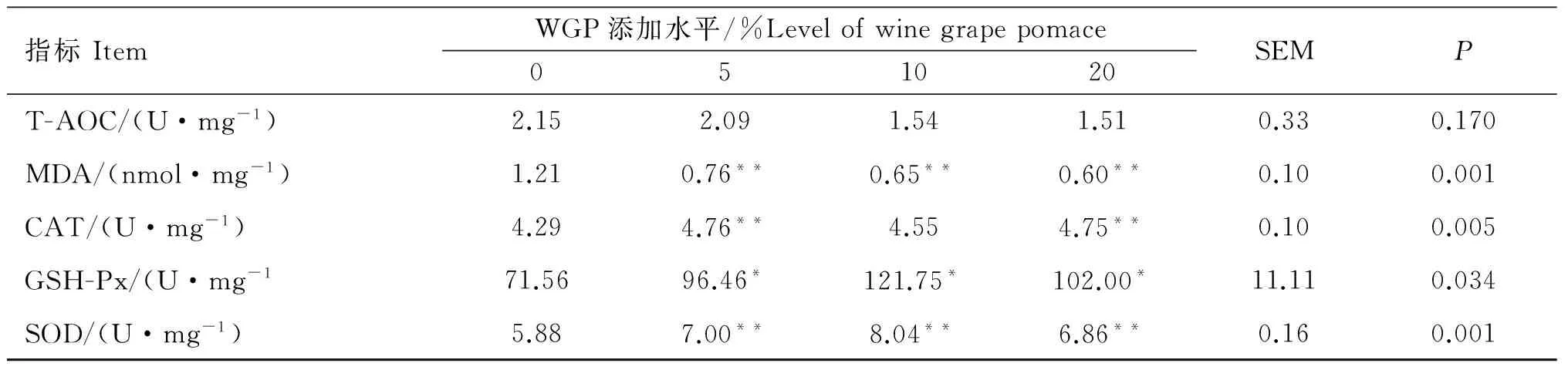
指标ItemWGP添加水平/%Levelofwinegrapepomace051020SEMPT-AOC/(U·mg-1)2.152.091.541.510.330.170MDA/(nmol·mg-1)1.210.76**0.65**0.60**0.100.001CAT/(U·mg-1)4.294.76**4.554.75**0.100.005GSH-Px/(U·mg-171.5696.46*121.75*102.00*11.110.034SOD/(U·mg-1)5.887.00**8.04**6.86**0.160.001
2.5 不同WGP添加水平下绵羊睾丸组织中Cu-ZnSOD、CAT、GPx4和Nrf2 mRNA相对表达量
Nrf2是机体抗氧化信号通路中的一个关键因子,Cu-ZnSOD、CAT、GPx4是其下游靶基因,调控抗氧化酶的表达,与机体抗氧化水平密切相关。本研究用内参RPL13 mRNA对睾丸组织中Cu-ZnSOD、CAT、GPx4和Nrf2 mRNA表达量进行校正,其荧光定量分析结果见图2。由图2A可以看出,10%和20%WGP添加组睾丸组织Cu-ZnSODmRNA相对表达量显著高于对照组(P<0.05),5%添加组与对照组相比基本无差异(P>0.05);由图2B~D可见,不同WGP添加水平下,睾丸组织CAT、GPx4和Nrf2 mRNA相对表达量无显著性差异(P>0.05)。
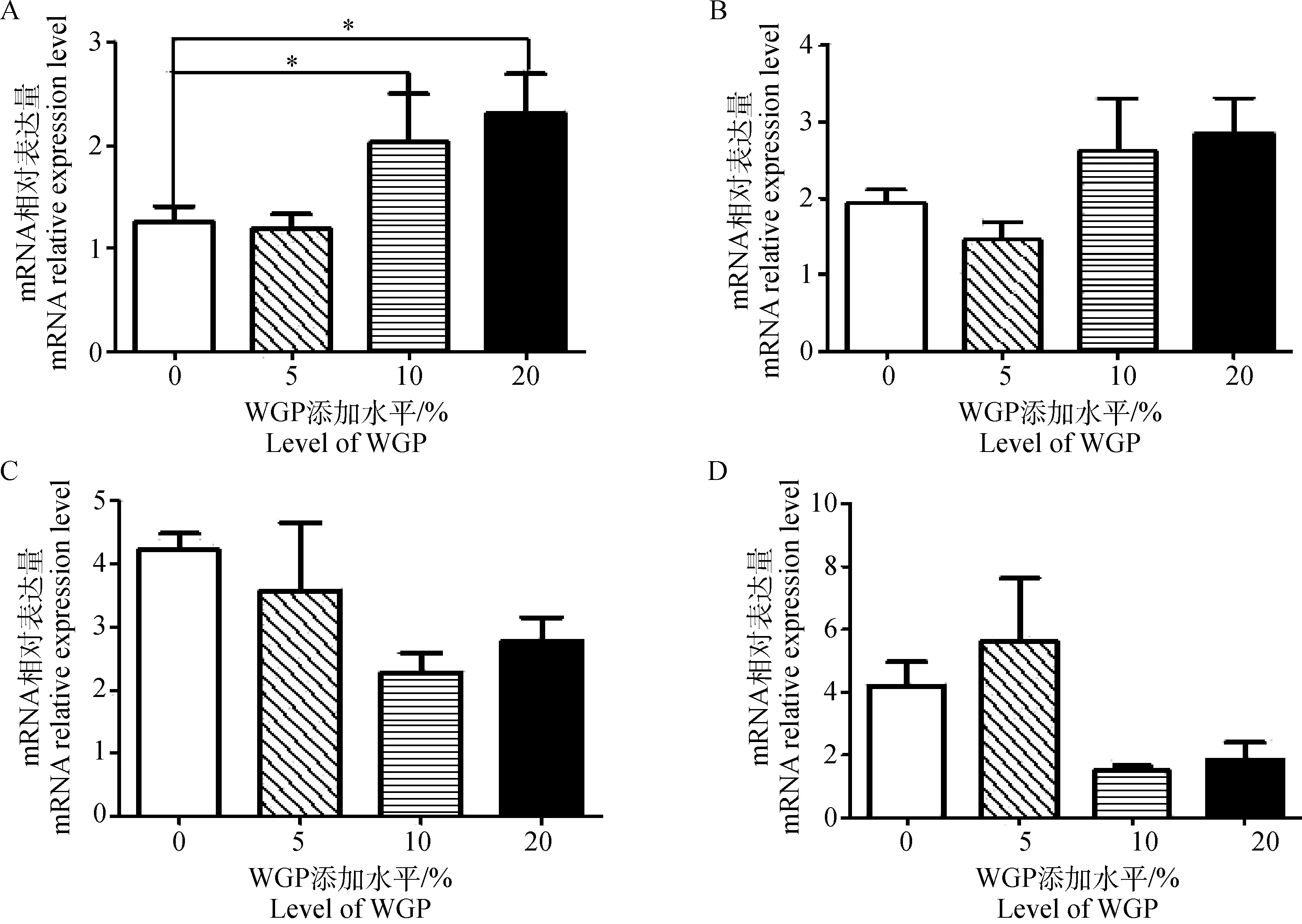
*.P<0.05。A.Cu-ZnSOD;B.GPx4;C.CAT;D.Nrf2图2 不同WGP添加水平下绵羊睾丸组织Cu-ZnSOD、CAT、GPx4和Nrf2 mRNA相对表达量Fig.2 Relative Cu-ZnSOD,GPx4,CAT and Nrf2 mRNA expression level in ram testis from groups with different WGP level
2.6 不同WGP添加水平下绵羊睾丸组织中Cu-ZnSOD、CAT、GPx4和Nrf2蛋白相对表达量
Western blotting对不同WGP添加水平绵羊睾丸抗氧化蛋白相对定量结果如图3。Cu-ZnSOD、CAT、GPx4、Nrf2和Tubulin蛋白分子量分别为23、64、21、60和55 ku。根据图3A相对灰度值分析结果显示,WGP添加组Cu-ZnSOD蛋白表达量均高于对照组,其中10%添加组显著高于对照组(P<0.05);由图3B可以看出,5%添加组GPx4蛋白表达量显著高于对照组(P<0.05),10%添加组极显著高于对照组(P<0.01);由图3C可见,5%添加组CAT蛋白表达量与对照组相比极显著升高(P<0.01),20%添加组较对照组显著升高(P<0.05),而10%添加组与对照组相比有升高趋势,但差异不显著(P>0.05);由图3D可见,Nrf2蛋白在各组之间的表达量无显著差异(P>0.05)。
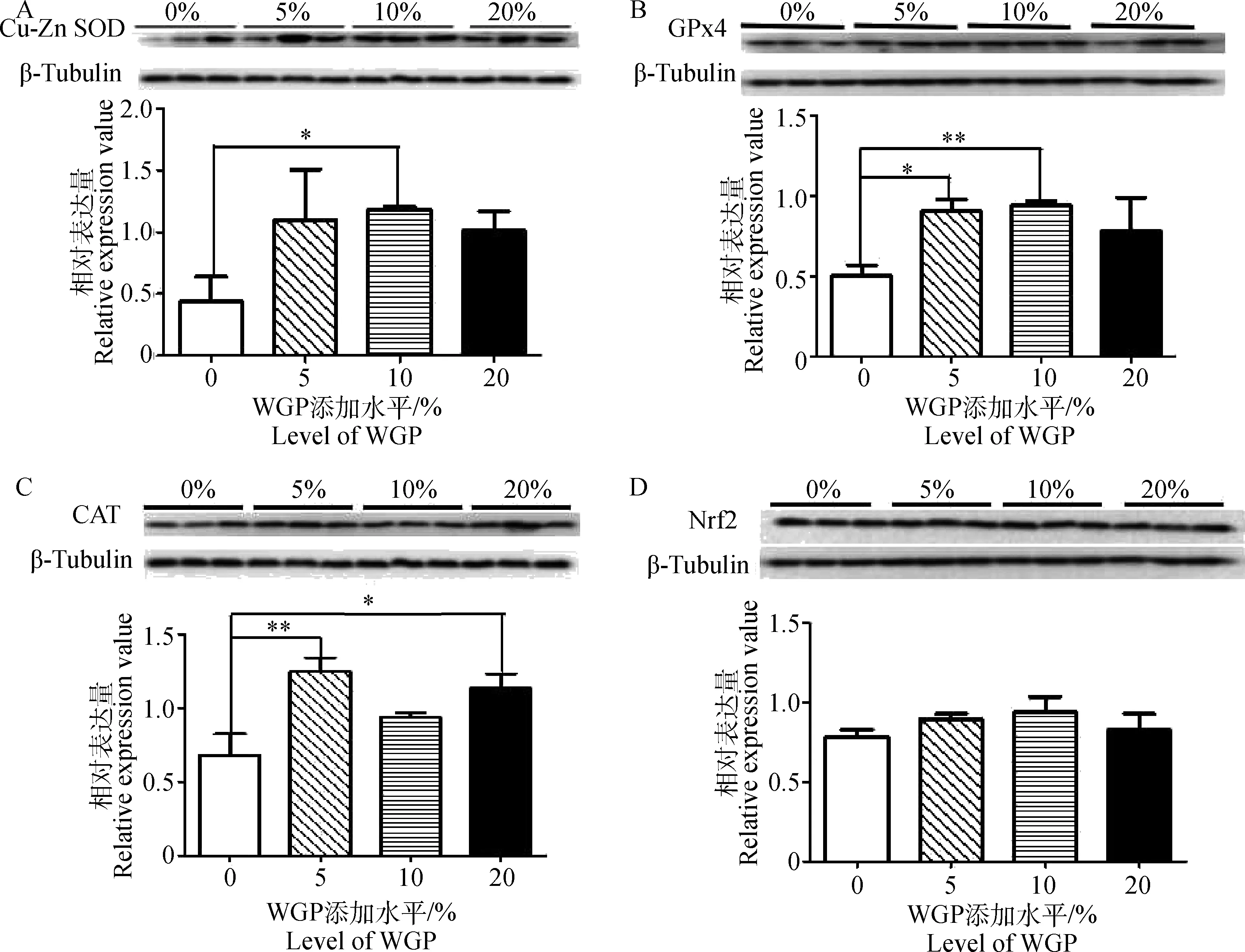
*.P<0.05;**.P<0.01.A.Cu-ZnSOD;B.GPx4;C.CAT;D.Nrf2图3 不同WGP添加水平下绵羊睾丸组织中Cu-ZnSOD、CAT、GPx4和Nrf2蛋白相对表达量Fig.3 Relative Cu-ZnSOD, GPx4, CAT and Nrf2 protein contents in ram testis from groups with different WGP level
3 讨 论
3.1 饲养方式对绵羊繁殖性能及氧化应激的影响
动物饲养环境、日粮条件、运输等都会对动物造成一定程度的应激,影响其正常生长与健康。研究表明,高密度饲养极显著降低了肉仔鸡采食水平与日增重,影响生产性能[15]。在日粮中添加高不饱和脂肪酸会引起大鼠血清抗氧化酶活性下降,MDA和NO升高,肝细胞DNA发生损伤,使机体多处组织遭受氧化损伤[14]。运输应激不仅会引起动物免疫机能发生变化,还会降低肉品质[16-17]。另外,束缚应激也会造成氧化损伤[18],对于雄性动物而言,尤其影响其精子发生,致使睾酮分泌异常,降低动物繁殖性能[19-20]。研究发现,束缚应激会使雄性动物生殖细胞退化,显著降低动物睾丸重量和精液品质[21]。据P.H.Priya报道,束缚应激会进一步加剧酒精对大鼠繁殖性能造成的损伤[22]。G.Bitgul等发现长期束缚会使大鼠发生氧化应激,细胞凋亡,引起睾丸组织受损[12]。
本试验通过模拟束缚应激模型,研究单栏饲养方式对绵羊造成的应激损伤。研究结果表明,无论从睾丸重量还是从睾丸体积来看,单栏组均显著低于自由活动组,睾丸系数也有降低趋势,这说明单栏饲养从一定程度上限制绵羊睾丸的正常发育。从附睾精子分析结果表明,自由活动组精子数量是单栏组的2.5倍,精子活力也极显著高于单栏组,说明单栏饲养会降低绵羊精液品质,影响绵羊繁殖性能。T-AOC能够有效反映机体防御体系抗氧化能力的强弱,与机体健康水平存在着密切联系;MDA是机体发生脂质过氧化反应的终产物之一;ROS是参与机体氧化还原反应的含氧自由基以及能够生成自由基的过氧化物的总称,过多会使组织发生氧化损伤。本研究通过对睾丸组织中T-AOC、MDA及ROS的检测发现,单栏饲养会增加绵羊睾丸中的MDA和ROS含量,但是T-AOC无显著性变化。这一结果说明单栏饲养方式会造成绵羊机体发生氧化应激,但是其本身的抗氧化能力并没有升高,从而导致脂质过氧化反应加剧,有害产物MDA增加。大鼠在遭受有毒物质(如重金属或杀虫剂等)作用后,血清及睾丸组织中的MDA都出现不同程度升高,抗氧化酶活性显著下降,并伴随精液品质下降[23-25]。由此推测,本研究绵羊睾丸组织遭受氧化损伤可能是导致其附睾精子密度及活力下降的原因之一。
3.2 酿酒葡萄皮渣对绵羊繁殖性能的影响
器官重量与系数在一定程度上可以反映其功能强弱,使人们了解动物的某种机能状况和健康水平,在理论研究及生产实践中都有重要的指导意义[26]。在本研究中,各WGP添加组之间睾丸重量与系数无显著性差异,说明WGP并没有从睾丸重量方面改善绵羊繁殖性能。附睾是精子成熟与贮存的重要场所,附睾精子密度与活力能够有效反映动物精液品质的高低[27]。本试验在添加WGP后,绵羊附睾精子数量均显著增加,精子活力也显著提高,但添加量达到20%时反而开始下降,说明适量添加WGP有利于提高绵羊精液品质。白藜芦醇是WGP中的一种重要活性物质,可以缓解睾丸扭转引起的生殖细胞凋亡[28]。本研究中绵羊附睾精子密度与活力的改善可能与WGP中的白藜芦醇具有重要关系。另外,有研究发现桑叶提取物能够提高小鼠睾丸组织T-AOC,有效改善水浸及束缚应激造成的睾丸功能紊乱[29]。Y. A. Heba等发现,绿茶提取物是一种有效的抗氧化剂,可以减缓丙烯酰胺对小鼠睾丸造成的损伤[30]。因此,在本研究中,WGP添加组附睾精子密度与活力的提高可能与组织本身氧化应激水平与抗氧化能力有关,需要进一步研究。
3.3 酿酒葡萄皮渣对绵羊睾丸组织抗氧化性的影响
葡多酚以其超强的抗氧化性,早已被人们熟知,而WGP作为酒厂废渣却被大家所忽视。目前,关于葡萄渣的研究还多集中于葡萄皮(籽)提取物上。研究表明,葡萄原花青素可以保护红细胞膜免受脂质过氧化,防止溶血现象[31]。F. Natella等发现,葡萄籽提取物可以提高人体饭后血浆抗氧化能力[32]。组织总抗氧化能力是反应组织抗氧化水平最直观的指标;抗氧化酶活性对减轻组织氧化应激,抵抗脂质过氧化反应具有重要意义,也是反映组织抗氧化能力的一个重要指标。MDA作为氧化应激反应的终产物之一,其含量能够有效反映组织遭受氧化应激的程度。在本试验中,睾丸组织MDA含量随着WGP添加量的加大而逐渐减少,且3个添加组均显著低于对照组;SOD、CAT及GSH-Px活性在添加WGP后均显著升高,说明WGP可以通过提高组织抗氧化酶的活性来消除体内自由基,阻碍脂质过氧化反应,减少MDA的产生。白藜芦醇也可以提高睾丸组织中GSH-Px活性,降低MDA含量[12],与本试验结果一致。睾丸组织抗氧化水平变化趋势与本研究附睾精子分析结果相吻合,说明睾丸组织抗氧化水平的提高可能是精液品质提高的因素之一。秦小伟等也研究发现,精浆Cu-ZnSOD活性与精子活力和精子密度呈正相关[33]。
生物机体代谢速率一方面与酶的活性有关,另一方面还与其数量有关。当代谢旺盛时,机体除了提高酶活性外,还会增加酶的数量来满足代谢需要[34]。在本试验中,睾丸组织MDA含量在添加WGP后显著降低,除了与酶活性有关外,是否还和其数量有一定关系,笔者作了进一步研究。从mRNA水平来看,10%和20%添加量提高了Cu-ZnSOD表达量,对CAT及GPx4的表达并无影响;但从蛋白水平来看,添加WGP后,3种抗氧化酶的蛋白表达量均高于对照组。这说明WGP没有从转录水平调控抗氧化酶的表达,而是加强了翻译过程,从而增加机体抗氧化酶的量。核转录因子Nrf2是机体的一个重要调控因子,参与多条信号通路,其中Nrf2-Keap1-ARE信号通路是机体最主要的抗氧化信号通路[35-36],该通路能够调控基底可诱导性解毒酶、抗氧化酶、ABC转运蛋白及其他一些抗应激酶类及蛋白质的表达,与抗氧化、抗炎症、抗肿瘤及细胞保护密切相关。当细胞受到氧化性刺激时,Nrf2被激活,调控其下游靶基因的表达。研究表明,葡萄原花青素可以诱导Nrf2及抗氧化反应元件(ARE)蛋白表达增加,通过p38-PI3K/Akt信号通路诱导抗氧化酶的表达[37],而白藜芦醇则通过激活Nrf2进而激活Nrf2/ARE抗氧化信号通路[38]。在本研究中,Nrf2无论是在转录水平还是翻译水平都未出现显著差异,说明WGP没有改变Nrf2的量,可能是通过磷酸化激活后调控靶基因表达的。
在生物机体代谢中,酶的活性一定时,酶数量越多,代谢速率会越高。然而,酶数量与活力之间是否存在着某种关系,目前尚无定论。研究发现,在肉鸡饲料中添加女贞子原粉有效提高了鸡肉抗氧化酶活性和总抗氧化水平,同时检测到GPx4基因的相对表达量显著提高[39]。但M. Koziorowska-Gilun等报道,在性腺器官中Cu-ZnSOD活性与其表达量并不是呈正相关[40]。在本研究中,随着WGP添加水平的变化,Western blot检测到的抗氧化酶信号强度与其活性表现出相同的变化趋势,表明二者之间可能存在某种关系。是否同植物机体类似[41],组织中抗氧化酶的代谢产物诱导了酶表达的增高,还需进一步研究。
4 结 论
4.1 与自由活动组相比,单栏组绵羊睾丸组织中MDA及ROS水平升高(P<0.01),表明单栏饲养对绵羊造成了氧化应激,即模型建立成功。
4.2 单栏饲养方式下,绵羊睾丸重量显著降低(P<0.05),睾丸系数也表现出下降趋势(P=0.06),附睾精子密度显著降低(P<0.05),精子活力极显著降低(P<0.01),表明单栏饲养方式会在一定程度上影响绵羊繁殖性能;添加WGP后,绵羊附睾精子密度和精子活力均显著升高(P<0.05),表明日粮中适量添加WGP有利于提高绵羊的繁殖性能。
4.3 添加WGP后,绵羊睾丸组织MDA含量显著下降(P<0.01),SOD、CAT及GSH-Px活性均显著提高(P<0.01,P<0.01,P<0.05);适量添加WGP后,睾丸组织Cu-ZnSODmRNA相对表达量显著提高(P<0.05),Cu-ZnSOD、CAT、GPx4蛋白相对表达量显著提高(P<0.05)。
综上表明,WGP可以提高单栏饲养方式下绵羊睾丸组织抗氧化性,进而改善绵羊繁殖性能。
[1] 赵天章, 张慧鲜, 王文义, 等. 集约化饲养模式下巴美肉羊与小尾寒羊产肉性能的比较研究[J]. 中国农业大学学报, 2014, 19(4):121-128.
ZHAO T Z, ZHANG H X, WANG W Y, et al. Comparison meat-productivities between Bamei sheep and Small-tail Han sheep under intensive feeding pattern[J].JournalofChinaAgriculturalUniversity, 2014, 19(4):121-128. (in Chinese)
[2] MONTALDO H H, FLORES-SERRANO C, SULAIMAN Y, et al. Growth and reproductive performance of Poll Dorset and Suffolk sheep under intensive conditions[J].RevMexdeCiencPecuarias, 2011, 2(4):359-369.
[3] 卢珍珍, 郑 琛, 李发弟, 等. 葡萄渣对羔羊生产性能、屠宰性能和养分消化代谢的影响[J].草业学报, 2015, 24(4):114-120.
LU Z Z, ZHENG C, LI F D, et al. Effect of feeding grape pomace on nutrient digestibility, body weight gain, and carcass quality in lambs[J].ActaPrataculturaeSinica, 2015, 24(4):114-120. (in Chinese)
[4] O′BRIEN N M, ROSEMARY C, O′CALLAGHAN Y C, et al. Modulatory effects of resveratrol, citroflavan-3-ol, and plant-derived extracts on oxidative stress in U937 cells[J].JMedFood, 2006, 9(2):187-195.
[5] CAILLET S, SALMIÉRI S, LACROIX M. Evaluation of free radical-scavenging properties of commercial grape phenol extracts by a fast colorimetric method[J].FoodChem, 2006, 95(1):1-8.
[6] SHI J, YU J,POHORLY J E, et al. Polyphenolics in grape seeds-biochemistry and functionality[J].JMedFood, 2003, 6(4):291-299.
[7] GESSNER D K, FIESEL A, MOST E, et al. Supplementation of a grape seed and grape marc meal extract decreases activities of the oxidative stress-responsive transcription factors NF-κB and Nrf2 in the duodenal mucosa of pigs[J].ActaVetScand, 2013, 55:18.
[8] CHOY Y Y,QUIFER-RADA P, HOLSTEGE D M, et al. Phenolic metabolites and substantial microbiome changes in pig feces by ingesting grape seed proanthocyanidins[J].FoodFunct, 2014, 5(9):2298-2308.
[9] CHAMORRO S, VIVEROS A, CENTENO C, et al. Effects of dietary grape seed extract on growth performance, amino acid digestibility and plasma lipids and mineral content in broiler chicks[J].Animal, 2013, 7(4):555-561.
[10] AITKEN R J, SMITH T B, JOBLING M S, et al. Oxidative stress and male reproductive health[J].AsianJAndrol, 2004, 16(1):31-38.
[11] AITKEN R J, JONES K T, ROBERTSON S A. Reactive oxygen species and sperm function-in sickness and in health[J].JAndrol, 2012, 33(6):1096-1106.
[12] BITGUL G, TEKMEN I, KELES D, et al. Protective effects of resveratrol against chronic immobilization stress on testis[J].ISRNUrol, 2013,2013(6):278720.
[13] SU L, DENG Y, ZHANG Y, et al. Protective effects of grape seed procyanidin extract against nickel sulfate-induced apoptosis and oxidative stress in rat testes[J].ToxicolMechMethods, 2011, 21(6):487-494.
[14] 龚灵芝. 基于自由基的动物繁殖机能的损伤与修复机理及其调控技术研究[D]. 上海:上海交通大学, 2009.
GONG L Z. Study on injury and repair mechanisms of animal reproductive function and regulative technology based on free radical[D].Shanghai:Shanghai Jiao Tong University, 2009. (in Chinese)
[15] 汤建平, 蔡辉益, 常文环, 等. 饲养密度与饲粮能量水平对肉仔鸡生长性能及肉品质的影响[J]. 动物营养学报, 2012, 24(2):239-251.
TANG J P, CAI H Y, CHANG W H, et al. Effects of stocking density and dietary energy level on growth performance and meat quality of broilers[J].ChineseJournalofAnimalNutrition, 2012, 24(2):239-251.(in Chinese)
[16] 吕琼霞, 张书霞, 赵茹茜. 运输应激对猪免疫机能的影响及其细胞因子的调控[J]. 中国农业科学, 2009, 42(7):2579-2585.
LÜ Q X, ZHANG S X, ZHAO R Q. Effects of transportation stress on immune function and regulation of cytokines in pigs[J].ScientiaAgriculturaSinica,2009, 42(7):2579-2585. (in Chinese)
[17] 张 林, 岳洪源, 张海军,等. 不同强度的运输应激对肉仔鸡血液应激指标和肌肉品质的影响[J]. 动物营养学报, 2009, 21(3):288-293.
ZHANG L, YUE H Y, ZHANG H J, et al. Effects of different intensities of transport on blood stress parameters and meat quality in broiler chicks[J].ChineseJournalofAnimalNutrition, 2009, 21(3):288-293. (in Chinese)
[18] SAHIN E, GÜMÜLÜ S. Immobilization stress in rat tissues: Alterations in protein oxidation, lipid peroxidation and antioxidant defense system[J].CompBiochemPhysiolCToxicolPharmacol, 2007, 144(4):342-347.
[19] ALMEIDA S A, PETENUSCI S O, ANSELMOFRANCI J A, et al. Decreased spermatogenic and androgenic testicular functions in adult rats submitted to immobilization-induced stress from prepuberty[J].BrazJMedBiolRes,1998, 31(11):1443-1448.
[20] RAI J,PANDEY S N,SRIVASTAVA R K. Testosterone hormone level in albino rats following restraint stress of long duration[J].JAnatSocIndia,2004, 53(1):17-19.
[21] PRIYA P H, REDDY P S. Effect of restraint stress on lead-induced male reproductive toxicity in rats[J].JExpZoolAEcolGenetPhysiol, 2012, 317(7):455-465.
[22] PRIYA P H, GIRISH B P, REDDY P S. Restraint stress exacerbates alcohol-induced reproductive toxicity in male rats[J].Alcohol, 2014, 48(8):781-786.
[23] MESSAOUDI I, BANNI M, SAÏD L, et al. Involvement of selenoprotein P and GPx4 gene expression in cadmium-induced testicular pathophysiology in rat[J].ChemBiolInteract, 2010, 188(1):94-101.
[24] SARADHA B, MATHUR P P. Induction of oxidative stress by lindane in epididymis of adult male rats[J].EnvironToxicolPharmacol, 2006, 22(1):90-96.
[25] CHANDRA A K, GHOSH R, CHATTERJEE A, et al. Effects of vanadate on male rat reproductive tract histology, oxidative stress markers and androgenic enzyme activities[J].JInorgBiochem, 2007, 101(6):944-956.
[26] 张晋青, 岳度兵, 罗海玲, 等. 日粮中维生素E水平对敖汉细毛羊内脏器官生长发育的影响[J]. 中国畜牧杂志, 2010, 46(17):43-46.
ZHANG J Q, YUE D B, LUO H L, et al. Effects of dietary vitamin E on growth and development of internal organs in Aohan Fine Wool sheep[J].ChineseJournalofAnimalScience, 2010, 46(17):43-46. (in Chinese)
[27] POVLSEN B B, AW L D, LAURSEN R J, et al. Pregnancy and birth after intracytoplasmic sperm injection with normal testicular spermatozoa in a patient with azoospermia and tail stump epididymal sperm[J].IntBrazJUrol, 2015, 41(6):1220-1225.
[28] UGURALP S, USTA U, MIZRAK B. Resveratrol may reduce apoptosis of rat testicular germ cells after experimental testicular torsion[J].EurJPediatrSurg, 2005, 15(5):333-336.
[29] XU M, WEI Q, ZHENG K, et al. Protective effects of Big-leaf mulberry and physiological roles of nitric oxide synthases in the testis of mice following water immersion and restraint stress[J].ActaHistochem, 2014, 116(8):1323-1330.
[30] YASSA H A, GEORGE S M, REFAIY AEL R, et al. Camellia sinensis (green tea) extract attenuate acrylamide induced testicular damage in albino rats[J].EnvironToxicol, 2014, 29(10):1155-1161.
[31] SIMONETTI P, CIAPPELLANO S, GARDANA C, et al. Procyanidins from Vitis vinifera seeds:invivoeffects on oxidative stress[J].JAgricFoodChem, 2002, 50(21):6217-6221.
[32] NATELLA F, BELELLI F, GENTILI V, et al. Grape seed proanthocyanidins prevent plasma postprandial oxidative stress in humans[J].JAgricFoodChem, 2002, 50(26):7720-7725.
[33] 秦小伟. 日粮中添加纳米锌对绵羊精液品质和睾丸、附睾中Cu-ZnSOD表达的影响[D]. 太谷:山西农业大学, 2014.
QIN X W. Effect of Nano-zinc diets on sheep semen quality and gonadsCu-ZnSODexpression[D]. Taigu:Shanxi Agricultural University, 2014. (in Chinese)
[34] 王宇光. 基于药物代谢酶的中药相互作用研究[D].北京:中国人民解放军军事医学科学院, 2006.
WANG Y G. Study of interaction of Chinese herbal medicine based on drug metabolism enzymes[D]. Beijing:Academy of Military Medical Sciences, 2006. (in Chinese)
[35] MCMAHON M, ITOH K, YAMAMOTO M, et al. Keap1-dependent proteasomal degradation of transcription factor Nrf2 contributes to the negative regulation of antioxidant response element-driven gene expression[J].JBiolChem,2003, 278(24):21592-21600.
[36] ZHANG D D. The Nrf2-Keap1-ARE signaling pathway: The regulation and dual function of Nrf2 in cancer[J].AntioxidRedoxSignal, 2010, 13(11):1623-1626.
[37] BAK M J, JUN M, JEONG W S. Procyanidins from wild grape (Vitisamurensis) seeds regulate ARE-mediated enzyme expression via Nrf2 coupled with p38 and PI3K/Akt pathway in HepG2 cells[J].IntJMolSci, 2012, 13(1):801-818.
[38] LI C, XU X, TAO Z, et al. Resveratrol dimers, nutritional components in grape wine, are selective ROS scavengers and weak Nrf2 activators[J].FoodChem, 2015, 173:218-223.
[39] 陈志辉,任皓威,徐良梅.女贞子对AA肉鸡肌肉抗氧化能力及GPx4基因表达的影响[J].中国畜牧杂志, 2013, 49(5):53-56.
CHEN Z H, REN H W, XU L M. Effect of Ligustrum Lucidum on muscle antioxidant capacity andGpx4 gene expression of AA broilers[J].ChineseJournalofAnimalScience, 2013, 49(5):53-56. (in Chinese)
[40] KOZIOROWSKA-GILUN M, GILUN P, FRASER L, et al. Antioxidant enzyme activity and mRNA expression in reproductive tract of adult male European Bison (Bisonbonasus, Linnaeus 1758)[J].ReprodDomestAnim, 2013, 48(1):7-14.
[41] 王永章, 张大鹏. 苹果果实发育过程中α-淀粉酶的活性、数量变化和亚细胞定位[J].植物学报:英文版, 2002, 44(1):34-41.
WANG Y Z, ZHANG D P. Activities, quantitative changes and subcellular localization of α-amylase during development of apple fruit[J].ActaBotanicaSinica, 2002, 44(1):34-41.(in Chinese)
(编辑 程金华)
Effect of Dietary Wine Grape Pomace on Reproductive Performance,Antioxidant Ability of Testis in Ram
JIN Ya-qian1, LIU Wen-zhong1, ZHAO Jun-xing1, REN You-she1, ZHANG Chun-xiang1,ZHANG Wen-jia2, XIANG Bin-wei2, MA Xue-hao1, ZHANG Jian-xin1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China; 2.AnimalHusbandryBureauofYouyuCounty,Youyu037200,China)
This experiment was conducted to investigate the effect of wine grape pomace supplementation to base diet on reproductive performance and antioxidant ability of testis in ram. A total of thirty 5-month-old with average weight of (25±1) kg Dorper (♂) × Small Tail Han sheep (♀) F1 male lambs were randomly selected and divided into 5 groups equally. To establish a stress model, lambs in one of groups were raised freely, while the other 4 groups were confined in stall. Lambs raised freely were fed with a base diet without grape pomace, and other lambs were fed with diets supplemented with grape pomace at 0%, 5%, 10%, 20%, respectively. The experiment lasted for 80 d. At the end of experiment, all lambs were slaughtered and sampled. Testis coefficient, epididymal sperm indicators, antioxidant levels of testis were analyzed, and moreover, expression ofCu/ZnSOD,CAT,GPx4,Nrf2 mRNA and protein in testis were detected. The results showed that, compared with free group, MDA and ROS level of testis significantly increased (P<0.01), testis weight of lambs significantly decreased (P<0.05), and the organ coefficient of testis had a trend to be lower (P=0.06) in confined group with 0% wine grape pomace; epididymal sperm density, acrosomal integrity and motility were lower (P<0.05 andP<0.01, respectively), while epididymal sperm deformity higher (P<0.01), in confined group with 0% wine grape pomace than those in free group. These results showed that ram raised in confined condition could cause oxidative stress and affect the reproductive performance. However, compared with confined group with 0% wine grape pomace, epididymal sperm density and motility were higher, while deformity lower, in wine grape pomace-added groups (P<0.05). MDA level of testis significantly decreased (P<0.01), but SOD, CAT and GSH-Px activity significantly increased (P<0.01,P<0.05 andP<0.01) in wine grape pomace-added groups. Furthermore, the mRNA expression ofCu-ZnSODand protein expression of Cu-ZnSOD, GPx4 and CAT in testis significantly increased (P<0.05) in wine grape pomace-added groups. The results indicate that wine grape pomace can enhance antioxidant capacity in testis and improve the reproductive performance of separated-raising lambs.
separated raising; wine grape pomace; ram; testis; reproductive performance; antioxidant ability
10.11843/j.issn.0366-6964.2016.11.010
2016-05-12
国家现代肉羊技术体系专项(CARS-39)
金亚倩(1990-),女,山西曲沃人,硕士,主要从事动物繁殖生物技术研究,E-mail:jinyq2009@163.com
*通信作者:张建新,教授,硕士生导师,主要从事饲料资源开发与利用研究,E-mail:ypzjx@126.com
S826.2
A
0366-6964(2016)11-2228-12
