T-exo 负载DC诱导抗肝癌细胞免疫效应研究①
2016-12-13李洁羽陈明水陈淑萍周智锋叶韵斌
李洁羽 陈明水 陈淑萍 周智锋 王 玲 叶韵斌
(福建省肿瘤医院肿瘤免疫学研究室,福建省肿瘤转化医学重点实验室,福州350014)
T-exo 负载DC诱导抗肝癌细胞免疫效应研究①
李洁羽 陈明水 陈淑萍 周智锋 王 玲 叶韵斌
(福建省肿瘤医院肿瘤免疫学研究室,福建省肿瘤转化医学重点实验室,福州350014)
目的:观察肝癌细胞来源的外泌体(T-exo)负载DC体外诱导细胞毒T细胞(CTL)对肝癌细胞的杀伤作用。方法:采用超滤离心技术联合蔗糖密度梯度超速离心的方法从肝癌Huh-7细胞培养上清液中分离外泌体(T-exo),透射电镜鉴定形态,Western blot 检测外泌体相关蛋白CD9、CD63、HSP70及肿瘤抗原分子AFP的表达;分离健康供者外周血单个核细胞(PBMC)培养DC,流式细胞术鉴定负载T-exo 的DC细胞表型;用2-(4-碘苯)-3-(4硝基苯)-5-(2,4-磺苯基四氮唑)-2H-四唑单钠盐-1(WST-1)法检测负载T-exo 的DC 刺激 T淋巴细胞增殖情况;流式细胞术Annexin-V/PI双染法检测负载T-exo 的DC诱导CTL分别对AFP阳性Huh-7细胞及AFP阴性的SMMC7721细胞的杀伤作用。结果:透射电镜下可见T-exo为圆形或椭圆形双层膜囊泡状小体,大小不等,平均直径50~100 nm,表达外泌体膜相关分子及肿瘤抗原分子。负载T-exo 的DC 可促进初始T细胞增殖,T-exo致敏DC对AFP阳性的Huh-7肝癌细胞系杀伤活性明显高于AFP阴性的SMMC7721肝癌细胞组(P<0.05)及未负载T-exo 的对照组DC(P<0.05)。结论:负载T-exo 的DC 能促进 T细胞增殖,提高CTL细胞的细胞毒活性诱导特异性的抗肝癌效应。经T-exo抗原致敏DC诱导的CTL对肝癌细胞有明显的细胞毒作用,明显高于DC对照组(P<0.05)。
树突状细胞;外泌体;肝癌;细胞毒T细胞
外泌体(Exosome)[1]是由多种活细胞分泌的,直径在50~100 nm,具有脂质双层结构的纳米级的囊泡小体,由细胞内多囊泡体(Multivesicular bodies,MVBs)的界膜向腔内出芽而成,经MVBs 与质膜直接融合后释出胞外。外泌体含有大量与其来源和功能密切相关的蛋白质、脂质及RNA成分,能介导细胞间物质和信息传递[2]。研究发现肿瘤细胞分泌的Exosomes(T-exo)可调节肿瘤微环境,介导肿瘤遗传物质转运而促进肿瘤侵袭转移[3]。此外,T-exo上也表达肿瘤细胞同源的共同和特异性抗原、跨膜分子CD63、细胞靶向相关分子CD9和肿瘤抗原运载蛋白HSPs等,能将肿瘤抗原转移到APC或直接刺激诱导CD8+T 细胞介导的抗肿瘤免疫应答,提示T-exo可作为一种新型的非细胞结构肿瘤疫苗。目前,Exosomes已应用于免疫研究及少数肿瘤的临床治疗研究,在法国Institut Gustave Roussy和美国Duck大学进行的晚期黑色素瘤和非小细胞肺癌患者Ⅰ、Ⅱ期临床治疗中,其稳定病情的作用及安全性得到证实[4]。本研究从肝癌Huh-7细胞提取T-exo,体外刺激树突状细胞,探讨携带AFP抗原的T-exo负载DC制备的DC疫苗的生物学功能以及诱导细胞毒T细胞对肝癌细胞的杀伤作用,为进一步研究新型DC疫苗应用于肿瘤免疫治疗奠定基础。
1 材料与方法
1.1 主要试剂和仪器 肝癌细胞株Huh-7和SMMC7721为本实验室保存。细胞培养液RPMI1640、DMEM购自Gibco Invitrogen公司,IL-4、GM-CSF、LPS及胎牛血清(FBS)购自PeproTech公司,重水、分析纯蔗糖购自Sigma 公司,超速离心管购自美国Beckman 公司,0.22 μm滤膜购自美国Millipore公司。 Annexin-V/PI购自美国BD公司,淋巴细胞分离液(Ficoll 1.077 g/ml)购自天津血研所,一抗(鼠抗AFP、CD9、CD63、HSP70单抗)购自Abcam公司。2-(4-碘苯)-3-(4硝基苯)-5-(2,4-磺苯基四氮唑)-2H-四唑单钠盐-1[2-(4-Iodophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazo-lium,monosodium salt,WST-1]检测试剂盒均购自Promega公司,超高速低温离心机购自美国Beckman 公司,流式细胞仪FACS CantoⅡ购自美国BD公司,透射电镜购自日立公司,酶标仪购自Thermos公司 。
1.2 方法
1.2.1 肿瘤细胞外泌体(Tumor exosome,T-exo)的制备 将胎牛血清加入到普通离心管中,4℃、8 819 r/min离心30 min ,取上清液,用Beckman 专用超速离心管中,4℃ 24 100 r/min超速离心1 h,取上清液,即为去除Exosomes的胎牛血清。 Huh-7细胞加入DMEM、10% 胎牛血清(已去除内在Exosomes)培养48 h后收集细胞培养上清液,4 ℃ 1 528 r/min离心10 min去除细胞,2 494 r/min低温离心30 min去除细胞碎片,8 819 r/min低温离心30 min取上清液,用离心超滤管,以2 789 r/min离心30 min浓缩,并将30 g/L的蔗糖重水、浓缩液和PBS以约3∶3∶4的比例依次加入离心管中,以 24 100 r/min,4℃超速离心60 min。取出承载Exo的蔗糖/重水缓冲垫,置于100 kD MWCO超滤离心管中2 789 r/min离心30 min,用PBS洗涤后得到的T-exo,0.22 μm滤膜过滤除菌,采用BCA法定量T-exo的总蛋白,-80℃保存备用。
1.2.2 透射电镜观察T-exo 形态 取20 μl T-exo悬液滴于电镜专用载样铜网上,室温静置1 min,滴加2% pH7.0磷钨酸溶液,室温静置负染1 min,白炽灯下烤干后,透射电镜下观察拍照。
1.2.3 Western blot检测T-exo中CD63、CD9、HSP70、AFP蛋白的表达及DC摄取T-exo后肝癌抗原AFP分子的表达 提取Huh-7细胞的总蛋白及经超声波冲击破膜后的Huh-7细胞来源的Exosomes,采用BCA法测定蛋白浓度,分别取30 μg经10 % SDS-PAGE电泳分离,湿转至PVDF膜,3%BSA室温封闭1 h,分别加入一抗CD63、CD9、HSP70及AFP(鼠源性,均按1∶1 000稀释)和β-Actin(1∶3 000),4 ℃孵育过夜,TBST缓冲液洗膜后,加入辣根过氧化物酶(HRP)标记的山羊抗鼠或山羊抗兔IgG (1∶5 000),室温孵育2 h,充分洗膜后加入ECL化学发光试剂暗室显影。同时收集对照组DC细胞和T-exo抗原负载组DC细胞,BCA法测定蛋白浓度后,检测AFP的表达水平(按照试剂盒方法操作)。采用Image Lab 4.1凝胶图像分析软件分析灰度。以目的蛋白条带与β-Actin条带灰度值比值表示各目的蛋白表达水平。
1.2.4 DC细胞的分离和培养 常规抽取健康志愿者肝素抗凝外周血50 ml,淋巴细胞分离液Ficoll分离外周血单个核细胞,细胞密度调整为4×106ml-1,置于37℃、5%CO2培养箱孵育2 h,贴壁的DC前体细胞,加入含rhGM-CSF 100 ng/ml和rhIL-4 50 ng/ml的RPMI1640完全培养基,第 3天换液,加入T-exo抗原并补充相应的细胞因子,第6天加入10 μg/ml LPS,置培养箱中继续培养过夜,次日收获DC细胞。
1.2.5 流式细胞术检测负载T-exo 的DC表型 收集培养到第7天的DC细胞,分别加入CD83、CD209(ICAM-3)、CD1a、CD80、CD86、 HLA-DR 荧光标记抗体或相应的同型对照抗体,混匀后室温避光孵育30 min,PBS缓冲液洗涤后,用FACS Canto II(BD Biosciences)流式细胞仪检测,BD FACSDivaTMsofeware软件进行DC细胞表型的数据分析。
1.2.6 肝癌细胞体外培养 以DMEM+10% FBS 培养液将冻存的肝癌细胞株Huh-7、SMMC7721复苏,于37℃、5%CO2培养箱中培养,细胞生长状态良好,细胞平铺培养瓶底融合度达80% 时进行传代培养,以备后续实验。
1.2.7 CTL细胞的诱导 将诱导至第8天的T-exo负载的DC疫苗和未经肝癌抗原致敏的对照组DC作为刺激细胞,调整细胞浓度为1×105ml-1,加入丝裂霉素C 25 μg/ml,37℃孵育45 min,PBS洗3次,完全培养基悬浮。常规密度梯度离心分离PBMC,置37℃、5%CO2培养箱孵育2 h,收集非贴壁细胞,进行CD3+T淋巴细胞的磁珠分选,调整CD3+T(简称初始T淋巴细胞)浓度为1×106ml-1,DC细胞与T细胞按1∶10 的比例混合,置37℃、5%CO2培养箱共孵育48 h。
1.2.8 DC诱导初始T淋巴细胞的增殖效应 采用WST法测定细胞增殖活性,WST-1是一种四唑盐,能被活细胞线粒体内脱氢酶还原生成橙黄色的可溶性甲瓒,甲瓒产生的水平和代谢活性细胞数量成正比,将结晶融解后,根据吸光度(A)值计算细胞增殖情况。取上述各刺激组的淋巴细胞,充分混匀后,调密度1×105ml-1,各吸取100 μl/孔于96孔细胞培养板中,每组设三个复孔,37℃、5%CO2、100%湿度条件下孵育24 h后,每孔分别加入10 μl WST-1试剂,混匀后,继续孵育4 h。用酶标仪测定波长450nm下样品的吸光值。
1.2.9 Annexin-V/PI双染法检测T-exo-DC诱导CTL对肝癌细胞的杀伤效应 将Huh-7和SMMC7721作为靶细胞,调整靶细胞密度至1×106ml-1,分别收集效应细胞1 764 r/min离心5 min,调整效应细胞密度至5×106个/ml。效/靶细胞25∶1混合,37℃、5% CO2条件下孵育4 h 。1 764 r/min离心5 min吸弃上清,预冷的1×PBS 清洗一遍,将细胞重悬于500 μl binding buffer,分别加入CD3-APC、 Annexin-V-FITC置于4℃孵育30 min,以预冷binding buffer洗涤后,上机前 Propidium Iodide染色10 min,不用洗涤,直接上流式细胞仪检测。CTL细胞杀伤率(%)=(APC-细胞-APC-FITC-PI-细胞)/(APC-细胞)×100。

图1 Huh-7细胞来源的exosomes电镜结构(×150 000)Fig.1 Electron micrograph of Exosome derived from Huh-7 cells(×150 000)
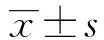
2 结果
2.1T-exo的形态观察Huh-7细胞培养上清经蔗糖密度梯度超速离心获得的T-exo,透射电镜观察形态(图1)显示,T-exo为直径介于30~100nm的膜性微囊,呈圆形或椭圆形,散在分布或聚集成团,腔内为低电子密度成分。
2.2Westernblot通过Westernblot法检测T-exo中CD63、CD9、HSP70及肝癌抗原AFP蛋白的表达水平,检测结果(图2)显示T-exo表达来源Huh-7细胞的相关分子:跨膜分子CD63、细胞靶向相关分子CD9、肿瘤抗原运载蛋白HSP70及AFP抗原分子。同时,与对照组DC细胞相比,T-exo负载的DC细胞高表达肝癌抗原AFP蛋白,说明DC细胞摄取了携带抗原物质的外泌体。

图2 CD63、CD9、HSP70(A)和AFP(A、B)表达水平Fig.2 Expression of CD63,CD9,HSP70(A) and AFP(A,B) detected by Western blot

图3 未成熟树突状细胞(A)和成熟树突状细胞(B)的形态(×40)Fig.3 Morphology of imDC(A) and mDC(B)(×40)

图5 T-exo负载DC对T淋巴细胞增殖的影响Fig.5 Effect of lymphocyte proliferation induced by DC-T-exo
2.3T-exo负载的DC表型分析rhIL-4、rhGM-CSF诱导DC分化增殖,T-exo抗原负载DC后第6天加入LPS,培养24h后高倍镜下可见细胞大部分呈悬浮生长,体积增大,细胞边缘有毛刺样突起,呈现典型的树突状细胞形态,聚集成簇呈集落状态(图3A、B)。经LPS刺激后的DC表面分子CD83、CD209(ICAM-3)、CD1a、CD80、CD86、HLA-DR的表达分别为(70.59±2.89%)、(80.51%±2.86%)、(33.48%±2.80%)、(58.11%±2.68%)、(77.84%±4.75%)、(94.55%±1.48%)与未成熟DC的(30.33%±5.65%)、(80.59%±3.49%)、(13.15%±4.25%)、(25.39%±4.53%)、(36.74%±4.08%)、(89.65%±4.12%)相比,CD83、CD1a、CD80、CD86的表达率明显增高,差异有统计学意义(P<0.05)(图4A、B)。
2.4 负载T-exo的DC对初始T淋巴细胞增殖的影响T-exo负载的DC与对照组DC分别与初始T细胞(1∶10)共孵育48h,取刺激组及对照组T细胞,按照细胞增殖检测试剂WST-1操作说明,测定各组吸光度(A)值,结果(图5)显示,DC疫苗可诱导强烈的增殖反应,T-exo抗原负载DC组诱导初始T细胞增殖测得的吸光(A)值为(1.472±0.067)显著高于单纯淋巴细胞组(0.390±0.074)(P<0.05)和无抗原负载DC组(0.906±0.020)(P<0.05)。

图6 T-exo-DC诱导的CTL对Huh-7和SMMC7721肝癌细胞的杀伤Fig.6 Cytotoxic effect of CTLs induced by DC-Texo against Huh-7 and SMMC7721 cells
2.5T-exo负载的DC体外诱导CTL对肝癌细胞株的杀伤效应 在效靶比为25∶1条件下各组CTL分别与Huh-7 及SMMC7721肝癌细胞株共培养4h后,流式细胞术检测Annexin-V/PI双标记细胞百分比,结果(图6)显示,经T-exo抗原致敏DC诱导的CTL对肝癌细胞有明显的细胞毒作用,明显高于DC对照组(P<0.05)。T-exo致敏DC组对AFP阳性的Huh-7肝癌细胞系有显著的杀伤作用,杀伤率(68.3±3.34)% 明显高于AFP阴性的SMMC7721肝癌细胞组(36.3±5.29)%(P<0.05)。
3 讨论
肝癌是我国高发的恶性肿瘤之一,目前治疗手段主要包括手术、肝动脉化疗栓塞术(TACE)、射频消融、分子靶向等[5]。但是,患者由于术后复发,化疗药物的耐药及毒副作用使肝癌的治疗效果仍不理想。基于树突状细胞(Dendriticcell,DC)的免疫治疗能够诱导针对肿瘤抗原的特异性杀伤的细胞毒T细胞(CytotoxicTlymphocyte,CTL),使其成为肿瘤免疫治疗的主要策略之一[6]。甲胎蛋白(Alphafetoprotein,AFP)是肝癌较为特异的标志物,大约2/3的肝癌患者血清高表达AFP,故其成为肝癌免疫治疗的潜在靶点。T-exo指肿瘤细胞来源的外泌体,作为一种新型亚细胞肿瘤疫苗,成为近年来疫苗研究的热点。蛋白组学分析显示,T-exo表达MHCⅠ类分子、四跨膜蛋白、热休克蛋白及肿瘤相关抗原等[7],成分简单,免疫原性强,既避免了肿瘤细胞裂解物成分的复杂性,又克服于肿瘤抗原肽半衰期短、转导效率低的不足,T-exo作为肿瘤疫苗,被树突状细胞摄取后,可激活T淋巴细胞,诱导机体特异性的抗肿瘤免疫效应[8,9]。
本实验中采用蔗糖密度梯度超速离心的方法从Huh-7肝癌细胞培养上清中提取Exosomes,电镜下观察呈圆形或椭圆形,直径介于50~100nm的膜性微囊,表达跨膜分子CD63、细胞靶向分子CD9、肿瘤抗原运载蛋白HSPs,同时携带有肝癌相关抗原AFP。用rhIL-4和rhGM-CSF联合培养外周血来源的DC,使其负载Huh-7肝癌细胞来源的T-exo,经LPS诱导成熟,显微镜下可观察到典型的树突状细胞形态,流式细胞术测定DC细胞高表达CD83、CD209(ICAM-3)、CD1a、CD80、CD86、HLA-DR分子。T-exo负载的DC细胞高表达肝癌抗原AFP蛋白,说明DC细胞摄取了携带肿瘤抗原物质的T-exo。功能性的DC可刺激初始T淋巴细胞的增殖并产生CTL细胞,诱导生成的CTL对AFP阳性Huh-7细胞具有明显的杀伤活性,对于AFP阴性的SMMC7721也可发挥一定的杀伤效应,且杀伤率要显著高于无抗原负载的DC组。实验结果说明T-exo可作为较好的肿瘤疫苗,启动免疫效应细胞介导的抗肿瘤免疫。
肿瘤细胞来源Exosome上表达肿瘤共同和特异性抗原,细胞靶向和肿瘤抗原运载分子等,含有多种肿瘤的共同抗原,通过特异的受体或配体被DC摄取,经MHC分子交叉呈递并激活T细胞,从而发挥杀瘤效应[10]。T-exo充当肿瘤抗原的采集和运输载体,用其制备的DC疫苗可用于一种甚至多种肿瘤的免疫治疗和预防[11]。本研究成功地从肝癌细胞分离出T-exo,并证实了肝癌细胞来源的T-exo可诱导CTL反应,增强抗肿瘤免疫效应,为肝癌的免疫治疗提供新的治疗方法。Exosome尽管在动物和人的研究中都取得了很大进展,但也有研究发现T-exo除了可通过DC刺激抗肿瘤免疫应答外,在一定条件下可以诱导免疫耐受[12]。如今越来越多的研究者们开始致力于如何提高T-exo作为疫苗的疗效和安全性,同时降低其对肿瘤免疫的负向调节,这对阐明其生物学功能及在肿瘤免疫治疗中的应用具有重要意义。
[1] Frydrychowicz M,Kolecka-Bednarczyk A,Madejczyk M,etal.Exosomes-structure,biogenesis and biological role in non-small-cell lung cancer[J].Scandina J Immunology,2015,81(1):2-10.
[2] Simons M,Raposo G.Exosomes--vesicular carriers for intercellular communication [J].Curr Opinion Cell Biol,2009,21(4):575-581.
[3] Andre F,Schartz NE,Chaput N,etal.Tumor-derived exosomes:a new source of tumor rejection antigens [J].Vaccine,2002,20(Suppl 4):A28-31.
[4] Chaput N.Dendritic cell derived-exosomes:biology and clinical implementations [J].J Leukocyte Biol,2006,80(3):471-478.
[5] Jarnagin WR.Management of small hepatocellular carcinoma:a review of transplantation,resection,and ablation [J].Ann Surg Oncol,2010,17(5):1226-1233.
[6] Sbiera S,Wortmann S,Fassnacht M.Dendritic cell based immunotherapy--a promising therapeutic approach for endocrine malignancies [J].Hormone Metabolic Res,2008,40(2):89-98.
[7] Cho JA,Lee YS,Kim SH,etal.MHC independent anti-tumor immune responses induced by Hsp70-enriched exosomes generate tumor regression in murine models[J].Cancer Lett,2009,275(2):256-265.
[8] Marton A,Vizler C,Kusz E,etal.Melanoma cell-derived exosomes alter macrophage and dendritic cell functions in vitro[J].Immunol Lett,2012,148(1):34-38.
[9] Bu N,Wu H,Sun B,etal.Exosome-loaded dendritic cells elicit tumor-specific CD8+cytotoxic T cells in patients with glioma[J].J Neuro Oncol,2011,104(3):659-667.
[10] 倪 勤,侯 伟,刘克洲,等.抗原呈递细胞外质体的研究进展[J].国外医学.流行病学传染病学分册,2004,31(4):226-230.
[11] 王东关,孙善珍,王振光,等.肿瘤exosome诱导特异性T杀伤细胞的研究[J].华西口腔医学杂志,2006,24(2):160-163.
[12] 王雅卓,郝淑维,崔 澂,等.肿瘤细胞来源的胞外体诱导机体免疫耐受及其临床应用[J].中国免疫学杂志,2014,30(2):287-289.
[收稿2015-10-08 修回2015-11-06]
(编辑 倪 鹏)
Cytotoxic effects against hepatoma cells by DCs loaded with exosome derived from Huh-7 cells
LI Jie-Yu,CHEN Ming-Shui,CHEN Shu-Ping,ZHOU Zhi-Feng,WANG Ling,YE Yun-Bin.Immunology Laboratory of Fujian Provincial Cancer Hospital,Fujian Key Laboratory of Translational Cancer Medicine,Fuzhou 350014,China
Objective:To investigate the cytotoxic effects of CTL cell induced by DCs loaded with exosomes derived from hepatoma Huh-7 cells(T-exo).Methods: Exosomes derived from hepatoma Huh-7 cells were isolated and purified by combination of ultrafiltration centrifugation and sucrose density gradient centrifugation.Morphology of exosomes was observed under transmission electron microscopy and the expression of CD9,CD63,HSP70 and AFP was detected by Western blot.DCs were induced with peripheral blood monocytes isolated from healthy donors.Flow cytometry was used to analysis surface markers of the DCs loaded with T-exo.WST-1 light absorption measurement was adopted to evaluate the T cell proliferation ability.Annexin-V/PI Flow cytometry were respectively used to examined cytotoxicity against the tumor cells.Results: Exosomes isolated and extracted from culture supernatant of Huh-7 cells presented as circular or elliptical vesicle with bilayer membrane,unequal in size,and with diameter of 50 to 100 nm.Western blot showed that the T-exo expressed CD9,CD63,HSP70 and AFP molecules.DCs loaded with T-exo caused significantly higher T cell proliferation and cytotoxic effect against AFP positive Huh-7 cells as compare to gainst AFP negative SMMC7721 cells and un-loaded control group(P<0.05).Conclusion: T-exosome loaded-DC can promote proliferation and induce significant cytotoxic effect of CTL against Huh-7 cells.
Dendritic cells(DC);Exosome;Liver cancer;Cytotoxic T cells
10.3969/j.issn.1000-484X.2016.04.015
①本文受厦门大学药学院-福建省肿瘤医院促进科技合作联合研究基金(No.2014LY-2L-04)和国家临床重点专科建设项目资助。
李洁羽(1975年-),女,硕士,主要从事肿瘤免疫学研究,E-mail:2013ljy@sina.com。
及指导教师:叶韵斌(1964年-),女,博士,教授,硕士生导师,主要从事肿瘤免疫学方面研究,E-mail:zjyunbin@189.cn。
R392.12
A
1000-484X(2016)04-0519-05
