二氢杨梅素抗感染性休克的作用与机制研究①
2016-12-13苏晓慧陈剑钰
王 蕊 刘 娟 苏晓慧 陈剑钰 杨 芬 李 婷
(澳门科技大学中药质量研究国家重点实验室,澳门药物与健康应用研究院,澳门999078)
二氢杨梅素抗感染性休克的作用与机制研究①
王 蕊 刘 娟 苏晓慧 陈剑钰 杨 芬 李 婷
(澳门科技大学中药质量研究国家重点实验室,澳门药物与健康应用研究院,澳门999078)
目的:探讨二氢杨梅素(Dihydromyricetin,DMY)抗内毒素休克的作用及其机制。方法:小鼠给予DMY处理 7 d后,腹腔注射脂多糖(Lipopolysaccharide,LPS)建立小鼠休克模型,在LPS刺激24、48、72、96、120、144、168 h后统计小鼠的死亡率。体外培养RAW264.7细胞,以DMY(10、50、100 μmol/L)预处理细胞1 h 后给予LPS 100 ng/ml刺激细胞。利用Western blot技术检测P-ERK、ERK、P-JNK、JNK、P-p38、p38蛋白的表达,免疫细胞化学技术检测RAW264.7 巨噬细胞中c-Jun,c-Fos 的核转录。结果:与LPS诱导组相比,DMY明显降低了LPS诱导小鼠感染性休克的死亡率;同时体外实验结果显示, DMY不仅可剂量依赖性抑制LPS诱导的RAW264.7细胞P-ERK 、P-JNK、P-p38和蛋白表达水平的上调。还可明显抑制LPS诱导引起的RAW264.7细胞c-Jun,c-Fos蛋白核转录。结论:DMY可通过抑制 MAPK信号通路的磷酸化水平从而抑制c-Jun和c-Fos的激活,降低LPS诱导的小鼠感染性休克的死亡率。
二氢杨梅素;RAW264.7细胞;MAPK;脂多糖
广西藤茶[Ampelopsis grossedentata (Hand.-Mazz) W.T.Wang]是葡萄科蛇葡萄植物显齿葡萄的茎叶,是一种应用广泛的药用植物,具有清热利湿、活血通络、平肝降压的功效。二氢杨梅素(dihydromyricetin,DMY)是广西藤茶中的主要活性成分,具有抗氧化、抗炎、降血脂以及预防酒精肝等药理作用[1-3]。据报道,其药理作用与抑制葡萄糖转运蛋白4(Glucose transporter 4,GLUT4)的核转移、促进AMPKα(AMP-activated protein kinase α)的磷酸化以及对抗超氧阴离子自由基引起的氧化性损伤有关[4,5]。最近研究报道,DMY作为IKK的抑制剂,通过抑制T细胞活化,对小鼠迟发性超敏反应和大鼠关节炎发挥抑制作用[6]。但目前该化合物对LPS诱导的小鼠感染性休克尚无相关报道,其作用机理亦不清楚。
临床上感染性休克主要源于LPS对巨噬细胞和单核细胞的过度活化[7]。作为一种重要免疫细胞,巨噬细胞参与很多种慢性炎症反应疾病如:动脉粥样硬化、神经退行性疾病等,并且在肿瘤发生、衰老的生理病理过程中具有重要作用。在外界因素的刺激下丝裂原蛋白激酶(Mitogen activation protein,MAPK)及IKK-NF-κB信号通路被激活,促进趋化因子的分泌,进一步造成IL-6和TNF-α,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧化酶-2(Cyclooxygenase-2,COX-2)等细胞因子和炎症介质的分泌。RAW264.7细胞是一种鼠源性的单核巨噬细胞系,在受到外界因素如脂多糖(Lipopolysaccharide,LPS)刺激时能够合成并释放大量的炎症介质和炎症因子,作为一种炎症细胞模型而被广泛用于炎症研究。因此,本研究拟通过建立LPS诱导小鼠休克模型进行整体动物研究,同时建立LPS激活RAW264.7巨噬细胞的炎症实验模型探讨 DMY的抗炎作用分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄的雄性C57/BL6小鼠,购自广东省实验动物中心。
1.1.2 细胞株 小鼠来源的巨噬细胞株(RAW264.7)购自ATCC。
1.1.3 主要试剂 DMY分析标准品,HPLC≥98%(南京泽朗医药科技有限公司);脂多糖 (LPS)、地塞米松(Sigma 公司);c-Jun、c-Fos、P-ERK、ERK、P-JNK、JNK、P-p38、p38、辣根过氧化物酶(HRP)标记的二抗(Cell signaling公司);β-actin(Santa Cruz公司);胎牛血清、DMEM(Gibco公司); 羊抗兔荧光二抗(Invitrogen公司)。
1.2 方法
1.2.1 小鼠感染性休克模型的建立和分组 实验动物被随机分空白对照组、模型组、DMY组、DEX组。DMY组腹腔注射给药7 d,在第7天DMY给药1 h以及DEX给药30 min后分别腹腔注射LPS(40 mg/kg)制备小鼠感染性休克模型[8]。之后每隔24 h观察一次行为变化及死亡率,连续观察7 d。
1.2.2 细胞培养 细胞用 DMEM 完全培养液(含10% 胎牛血清,含青霉素、链霉素各1 000 U/L)于5% CO2、37℃培养箱进行培养。细胞生长至80%融合后用于实验。
1.2.3 DMY作用于LPS诱导的RAW264.7细胞 将处于对数生长期的RAW264.7细胞按1×106个/孔接种于6孔板中。24 h后待细胞生长至80%融合状态,加入DMY至终浓度为10、50、100 μmol/L干预1 h,之后LPS刺激组和DMY给药组均加入LPS,使其终浓度为100 ng/ml,正常对照组加入相同体积的培养基,继续培养1 h后,收集细胞提取蛋白。
1.2.4 Western blot 检测P-ERK、ERK、P-JNK、JNK、P-p38、p38蛋白的表达 10%SDS-PAGE胶电泳分离蛋白、电转移法使蛋白转移至PVDF膜上,用含5%脱脂奶粉的TBST (Tris Buffered Saline with Tween 20) 室温下封闭后加入相应蛋白的一抗,4℃过夜。TBST洗膜后以辣根过氧化物酶(Horseradish peroxidase,HRP)标记的二抗(1∶2 000)孵育2 h,TBST洗膜后加ECL曝光显影。
1.2.5 免疫荧光 在培养板中将已爬好细胞的玻片用磷酸盐缓冲溶液(Phosphate buffer saline,PBS)浸洗3次之后用4%的多聚甲醛固定15 min,PBS浸洗3次×3 min。0.5%Triton X-100破膜5 min,PBS浸洗3次×3 min。每张玻片滴加DAPI(1∶200),室温避光孵育30 min后PBS浸洗3次×3 min。每张玻片滴加稀释好的c-Fos 或 c-Jun抗体(1∶500),37℃孵育2 h,PBS浸洗3次×3 min。滴加稀释好的荧光二抗,室温孵育1 h,PBS浸洗3次×3 min。避光封片,拍照。
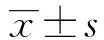
2 结果
2.1DMY对LPS诱导的小鼠感染性休克模型的影响 结果如表1及图1所示,模型组小鼠在给予致死剂量的LPS刺激后120h内全部死亡,死亡率为100%;100mg/kg的DMY治疗组中13只小鼠,在给予致死剂量的LPS刺激后,至第5天时死亡率为53.8% ,即有6只小鼠存活,在第7天小鼠死亡率仍为53.8%,表明在5d之后,仍然存活的6只小鼠身体状态恢复正常。50mg/kg的DMY治疗组第2天至第5天的死亡率为58.3%,至第7天时12只小鼠有11只死亡,死亡率为91.7%,这一结果表明,DMY可抑制LPS诱导的小鼠死亡并呈剂量依赖性。
2.2DMY对LPS诱导的MAPKs信号通路的影响 如图2A结果所示,未被LPS刺激的RAW246.7细胞并不能表达P-ERK,P-JNK以及P-p38。该细胞在给予LPS刺激1h以后,P-ERK、P-JNK、P-p38蛋白的表达显著提高,与空白对照组相比有显著性差异。加入DMY干预以后与LPS组相比,DMY可剂量依赖性抑制LPS诱导引起的RAW264.7细胞P-JNK、P-p38蛋白表达水平的上调,尤其在100 μmol/L DMY作用下,这一抑制作用最为明显,三次结果统计分析如图2B所示。但是该化合物对P-ERK则没有明显的抑制作用。虽然P-ERK、P-JNK及p38均属于MAPKs家族,但是DMY对其抑制作用并不完全相同。
表1 DMY对LPS诱导的小鼠感染休克模型的影响
Tab.1 Effcet of DMY on LPS-induced septic shock model in mice

Mortalityrate24h48h72h96h120h144h168hModelgroup38.59%(5/13)61.5%(8/13)92.3%(12/13)92.3%(12/13)100%(13/13)100%(13/13)100%(13/13)DMY100mg/kggroup15.4%(2/13)23.1%(3/13)38.5%(5/13)46.2%(6/13)53.8%(7/13)53.8%(7/13)53.8%(7/13)DMY50mg/kggroup25%(3/12)58.3%(7/12)58.3%(7/12)58.3%(7/12)58.3%(7/12)75%(9/12)91.7%(11/12)DMY30mg/kggroup0%(0/12)0%(0/12)0%(0/12)0%(0/12)0%(0/12)0%(0/12)0%(0/12)

图1 DMY对LPS诱导的小鼠感染性休克模型的影响Fig.1 Effect of DMY on LPS-induced septic shock model in mice
2.3 DMY对LPS诱导的c-Jun蛋白的影响 如上述结果所示,DMY能够明显抑制JNK磷酸化表达,而JNK可以调节核转录因子c-Jun的核转移。因此在本研究中,我们进一步观察DMY是否对c-Jun的核转移产生影响。研究中采用免疫荧光技术观察c-Jun的核内表达情况。实验中,带有绿色荧光抗体用于标记c-Jun,采用可与细胞核中双链DNA结合而发挥标记作用的DAPI标记细胞核。如图3 所示,带有绿色荧光的c-Jun主要集中于细胞质当中,与DAPI所标记的细胞核不能重叠。与空白对照组相比,LPS刺激1 h可明显增加c-Jun在细胞核内表达,与标记细胞核的DAPI发生重叠,表明LPS作用后可促进c-Jun的核转移。加入100 μmol/L DMY干预以后,与LPS刺激组相比,c-Jun的在核内表达的荧光强度明显减弱,更接近对照组水平,证明DMY可明显抑制LPS诱导引起的RAW264.7细胞c-Jun蛋白的核转录。
2.4 DMY对LPS诱导的对c-Fos蛋白的影响

图2 DMY对LPS诱导的RAW 264.7 细胞MAPKs磷酸化蛋白表达的影响Fig.2 Effect of DMY on LPS-induced related protein expression in RAW 264.7 cellsNote: Compared with LPS group,*.P<0.05.
c-Jun是可诱导的转录因子异二聚体AP-1的一种蛋白,另一个蛋白为c-Fos。我们的研究结果表明,DMY能够明显抑制c-Jun核转录,及其调节因子JNK的磷酸化。我们前期的研究结果显示,DMY亦可抑制MAPK家族另一蛋白p38的活化,该蛋白可调节c-Fos的核转录,因此我们进一步观察DMY是否能够抑制c-Fos在细胞核中的表达。如图4 所示,我们同样采用带有绿色荧光抗体标记c-Fos,采用DAPI定位细胞核。空白对照组中,带有绿色荧光的c-Fos集中于细胞质当中。但是在LPS刺激1 h后,可明显增加c-Fos在细胞核内表达。加入100 μmol/L DMY干预以后,与LPS刺激组相比,c-Fos的在核内表达的荧光强度明显减弱,更接近对照组水平,证明DMY可明显抑制LPS诱导引起的RAW264.7细胞c-Fos在细胞核内的表达。
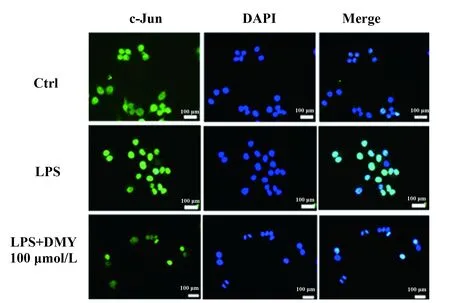
图3 DMY对LPS诱导的RAW264.7细胞 c-Jun蛋白核转录的影响Fig.3 Effect of DMY on LPS-induced c-Jun expression in RAW264.7 cells
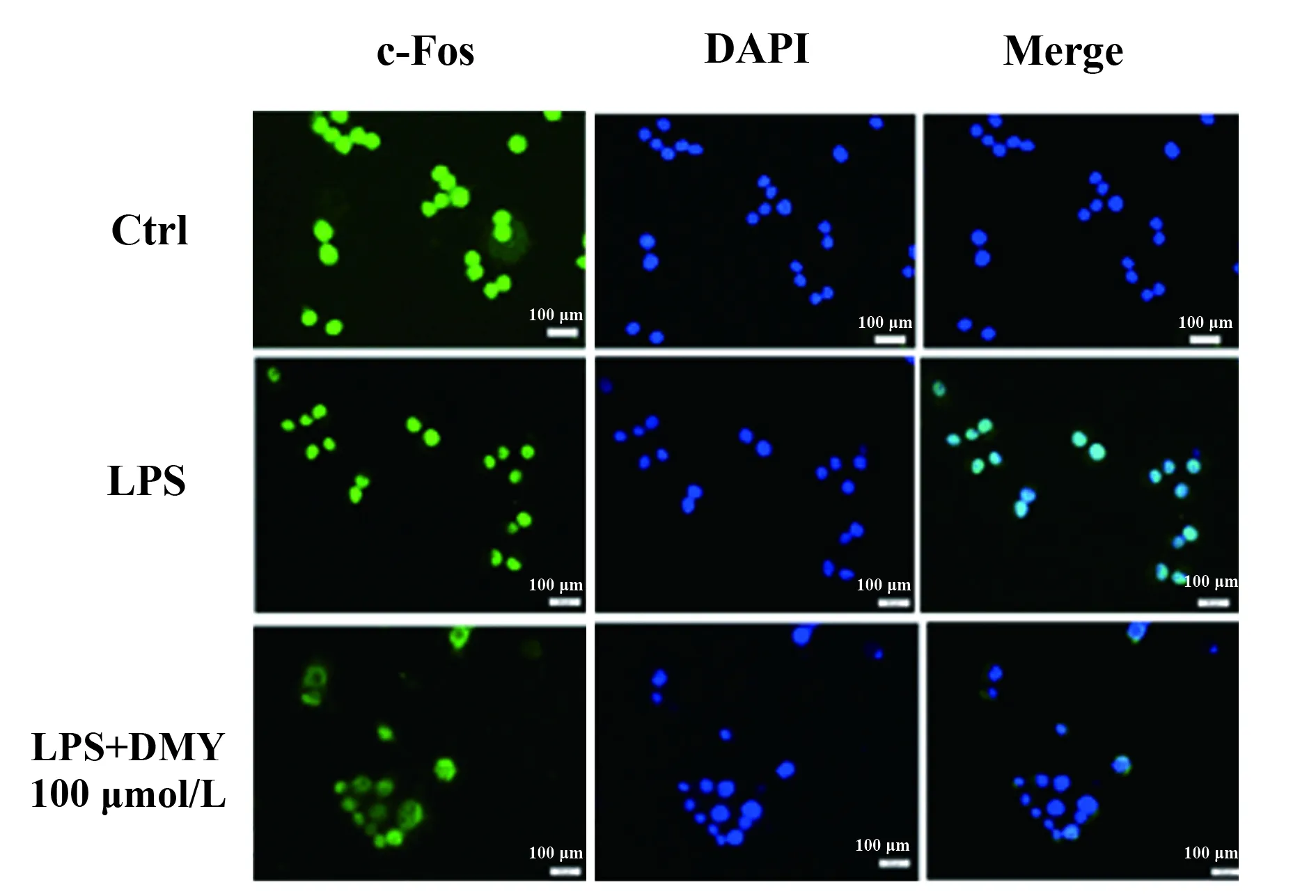
图4 DMY对LPS诱导的RAW264.7细胞 c-Jun核转录的影响Fig.4 Effect of DMY on LPS-induced c-Jun nucleus translocation in RAW264.7 cells
3 讨论
黄酮类化合物广泛存在于自然界的多种植物中。这类化合物具有多种活性,包括抗氧化、抗炎等作用。DMY是来源于中药藤茶的一种黄酮类化合物,已经被报道具有抗炎镇痛、抗癌、抗氧化及免疫调节等作用[9]。研究表明,该化合物可改善非酒精性脂肪肝患者的糖代谢、脂代谢及各项生化指标[10]。通过上调HO-1 (Heme oxygenase-1) 表达发挥抗氧化作用[5],同时研究表明DMY的抗氧化活性和抗酸碱活性主要归因于其结构中邻三羟基群[11]。我们的前期研究结果表明,DMY通过结合于IKKβ第46位半胱氨酸,抑制IKKβ激酶活性,从而抑制T细胞活化,及相关细胞因子的分泌,达到免疫抑制作用[11]。巨噬细胞与T细胞同为机体重要的免疫细胞,是感染性休克的主要参与细胞。在本研究当中,我们观察了DMY对LPS所导致的小鼠休克死亡率影响。实验结果表明,DMY能够明显降低LPS所导致的小鼠休克死亡率,提示DMY可能通过抑制巨噬细胞活化从而抑制炎症反应。巨噬细胞不仅本身参与炎症反应,其分泌的炎症因子COX-2、iNOS、TNF-α和 IL-1β等,亦与炎症的进展密切相关[12]。已有研究报道,DMY可抑制iNOS,IL-6等炎症因子的释放,这一作用可归因于抑制IKKβ-IKBα-NF-κB信号转导通路[13]。
根据文献报道,LPS所参与的跨膜信号受体TLR4不仅可通过IKKβ-NF-κB信号转导通路 ,还可以通过MAPK信号转导通路来调控LPS诱导的巨噬细胞活化[14]。MAPK所调节的转录因子AP-1(Activator protein-1,AP-1) 由c-Jun和c-Fos组成,是哺乳动物细胞中最早发现具有结合特异性序列的转录因子之一。c-Jun和c-Fos的活性可被多种刺激因素诱导,包括生长因子、炎性因子、细菌及病毒感染、各种理化刺激等。这些刺激因素可以通过活化的MAPK级联反应促进多种底物磷酸化,激活c-Jun和c-Fos的瞬时表达[15], 从而参与炎症发生过程。其中c-Jun的转录活性是通过磷酸化其N端的丝氨酸-63和-73而获得。外界的各种刺激,包括生长因子,细胞因子和UV辐射均可诱导其活化。JNK通过结合于c-Jun的活化区域,从而特异性磷酸化这两个丝氨酸位点[16]。 我们的结果表明,DMY正是通过抑制MAPK家族中JNK的磷酸化,而产生抑制c-Jun核转录的作用。 c-Fos是组成AP-1二聚体中的另一个蛋白, MAPK家族中的p38在整体动物,及体外模型上均可磷酸化c-Fos的转录活化区域。在UV诱导活化的相关途径中,外源性c-Fos不仅是p38的底物,其核内表达水平也可被p38所诱导,提示p38在介导c-Fos的磷酸化和基因转录活化方面,发挥关键作用[17]。我们的研究结果表明,DMY通过抑制p38活化,而达到抑制c-Fos蛋白的核内表达水平。
MAPK家族除JNK,p38以外,还包括ERK。虽然ERK活化亦可诱导促进c-Fos合成增加,转入核内与已存在的c-Jun结合,形成AP-1异二聚体,增加AP-1活性[15]。但是我们研究发现DMY并不能影响ERK的磷酸化表达,综上,我们的研究表明,DMY通过下调P-JNK和P-p38表达,抑制LPS诱导的c-Jun和c-Fos的核转移,从而抑制巨噬细胞的活化,最终发挥抗炎作用并对LPS诱导的小鼠感染性休克产生保护作用。
[1] Zhang Y,Ning Z,Yang S,etal.Antioxidation properties and mechanism of action of dihydromyricetin from Ampelopsis grossedentata[J].Acta Pharmaceutica Sinica,2003,38(4):241-244.
[2] Zhang T,Mi M,Liang X,etal.Dihydromyricetin attenuates high glucose-induced oxidative stress in human umbilical vascular endothelial cells (1146.2)[J].FASEB J,2014,28(1 S):1146.
[3] Shen Y,Lindemeyer AK,Gonzalez C,etal.Dihydromyricetin as a novel anti-alcohol intoxication medication[J].J Neurosci,2012,32(1):390-401.
[4] Jiang B,Le L,Pan H,etal.Dihydromyricetin ameliorates the oxidative stress response induced by methylglyoxal via the AMPK/GLUT4 signaling pathway in PC12 cells[J].Brain Res Bull,2014,109:117-126.
[5] Kou X,Shen K,An Y,etal.Ampelopsin Inhibits H2O2-induced apoptosis by ERK and Akt signaling pathways and up-regulation of heme oxygenase-1[J].Phytother Res,2012,26(7):988-994.
[6] Li T,Wong V,Jiang ZH,etal.Mutation of cysteine 46 in IKK-beta increases inflamma-tory responses[J].Oncotarget,2015,6(31):31805-31819.
[7] Shapira L,Soskolne WA,Houri Y,etal.Protection against endotoxic shock and lipopolysaccharide-induced local inflammation by tetracycline:correlation with inhibition of cytokine secretion[J].Infect Immunity,1996,64(3):825-828.
[8] Zuckerman SH,Bendele AM.Regulation of serum tumor necrosis factor in glucocorticoid-sensitive and-resistant rodent endotoxin shock models[J].Infect Immunity,1989,57(10):3009-3013.
[9] Nijveldt RJ,Van Nood E,Van Hoorn DE,etal.Flavonoids:a review of probable mechanisms of action and potential applications[J].Ame J Clin Nutr,2001,74(4):418-425.
[10] Chen S,Zhao X,Wan J,etal.Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease:a randomized controlled trial[J].Pharmacol Res,2015,99:74-81.
[11] Xin M,Ma Y,Xu K,etal.Structure-activity relationship for dihydromyricetin as a new natural antioxidant in polymer[J].J Appl Polym Sci,2013,128(3):1436-1442.
[12] Won JH,Im HT,Kim YH,etal.Anti-inflammatory effect of buddlejasaponin IV through the inhibition of iNOS and COX-2 expression in RAW 264.7 macrophages via the NF-κB inactivation[J].Br J Pharmacol,2006,148(2):216-225.
[13] Hou X,Tong Q,Wang W,etal.Suppression of inflammatory responses by dihydromyricetin,a flavonoid from ampelopsis grossedentata,via inhibiting the activation of NF-κB and MAPK signaling pathways[J].J Nat Prod,2015,78(7):1689-1696.
[14] Jiang Q,Akashi S,Miyake K,etal.Cutting edge:Lipopolysaccharide induces physical proximity between CD14 and Toll-like receptor 4 (TLR4) prior to nuclear translocation of NF-κB[J].J Immunol,2000,165(7):3541-3544.
[15] Karin M.The regulation of AP-1 activity by mitogen-activated protein kinases[J].J Biol Chem,1995,270(28):16483-16486.
[16] Minden A,Lin A,Smeal T,etal.c-Jun N-terminal phosphorylation correlates with activation of the JNK subgroup but not the ERK subgroup of mitogen-activated protein kinases[J].Mol Cell Biol,1994,14(10):6683-6688.
[17] Tanos T,Marinissen MJ,Leskow FC,etal.Phosphorylation of c-Fos by Members of the p38 MAPK family role in the AP-1 response to UV ligh[J].J Biol Chem,2005,280(19):18842-18852.
[收稿2016-01-20]
(编辑 许四平)
Study on anti-inflammatory effect and underlying mechanism of DMY in LPS-induced septic mice
WANG Rui,LIU Juan,SU Xiao-Hui,CHEN Jian-Yu,YANG Fen,LI Ting.State Key Laboratory of Quality Research in Macau Institute for Applied Research in Medicine and Health,Macau University of Science and Technology,Macau 999078,China
Objective:To investigate the effect of dihydromyricetin (DMY) on LPS-induced septic shock in mice and the related underlying mechanism.Methods: The LPS-induced septic shock mice model was established after the mice were pre-treated by DMY for 7 days.The mortality rate was calculated at 24,48,72,96,120,144 and 168 h after the mice were intraperitoneal injected with LPS.For elucidation of underlying mechanism,RAW246.7 were pre-incubated with DMY for 1 h,and then stimulated by LPS 100 ng/ml.Western blot was performed for determination of P-ERK,P-JNK and P-p38 expression.Immunohistochemistry was applied to explore c-Fos and c-Jun nucleus translocation.Results: DMY could significantly inhibit LPS-induced mice mortality.Inhibitory effect of DMY on the phosphorylation of JNK and p38 contributed to the anti-inflammatory effect of DMY in vivo.Furthermore,DMY obviously prevented c-Fos and c-Jun nucleus translocation.Conclusion: The anti-inflammatory effect of DMY is attributed to the suppression on c-Fos and c-Jun nucleus translocation,via inhibition of the phosphorylation of JNK and p38.
Dihydromyricetin;RAW264.7;MAPK;Lipopolysaccharide
10.3969/j.issn.1000-484X.2016.04.003
①本文受澳门科技发展基金资助(081/2013/A3)。
王 蕊(1988年-),女,博士,主要从事中药抗炎与免疫药理方面的研究,E-mail:ruiwang853@gmail.com。
及指导教师:李 婷(1980年-),女,博士,助理教授,博士生导师,主要从事中药抗炎与免疫药理方面的研究,E-mail:tli@must.edu.mo。
R96
A
1000-484X(2016)04-0465-05
