IRF3基因干扰对LPS刺激原代枯否细胞早期细胞因子分泌动态变化的影响①
2016-12-13涂文娟谈志丽刘亮明
朱 彤 涂文娟 谈志丽 刘亮明
(南京医科大学附属上海松江中心医院/上海交通大学附属第一人民医院松江分院感染科,上海201600)
IRF3基因干扰对LPS刺激原代枯否细胞早期细胞因子分泌动态变化的影响①
朱 彤 涂文娟 谈志丽 刘亮明
(南京医科大学附属上海松江中心医院/上海交通大学附属第一人民医院松江分院感染科,上海201600)
目的:探讨干扰素调节因子3(Interferon regulator factor 3,IRF3)shRNA腺病毒对脂多糖(Lipopolysaccharide,LPS)刺激枯否细胞(Kupffer cell,KC)早期细胞因子分泌动态变化的影响。方法:采用在体灌注分离培养大鼠原代KC,以IRF3 shRNA腺病毒体外感染KC,48 h后采用LPS刺激细胞,于0、2、4和6 h收集细胞培养上清液,并收集6 h细胞。上清液细胞因子的分泌采用ELISA分析;细胞IRF3基因表达采用RT-PCR和Western blot方法检测。结果:LPS刺激诱导了KC内IRF3 mRNA和蛋白质表达升高,IRF3 shRNA腺病毒的应用抑制了LPS刺激诱导和非刺激组成性IRF3 mRNA和蛋白质的表达;KC受LPS刺激活化后极早期(2 h)IFN-β分泌即上升,4 h达峰值,6 h分泌水平开始下降,但仍维持于高水平。干扰腺病毒的应用抑制了LPS刺激后各时间点IFN-β的分泌,抑制分泌高峰的出现,并使6 h分泌水平趋于正常;KC活化后极早期即分泌大量TNF-α,并于2 h内达到峰值,随后分泌逐渐下降,但6 h仍维持于高水平。干扰腺病毒的应用抑制了LPS刺激各时间点TNF-α的分泌,并抑制了分泌高峰的出现;IL-1β分泌增高出现于LPS刺激4 h后,6 h分泌水平达更高值。干扰腺病毒的应用抑制了LPS刺激早期KC对IL-1β的分泌;KC受LPS刺激活化后极早期IL-10分泌即上升,且随着LPS刺激时间延长,其分泌水平逐渐增加。IRF3 shRNA腺病毒的应用促进了LPS刺激后早期各时间点IL-10的分泌。结论:IRF3 shRNA腺病毒可使原代枯否细胞IRF3基因表达沉默;在LPS刺激原代KC,IRF3可促进其下游信号分子IFN-β、前炎细胞因子TNF-α和IL-1β的分泌,并抑制抑炎细胞因子IL-10分泌。因此,IRF3可能在肝组织免疫炎症性损伤的发生中起中心作用。
原代枯否细胞;干扰素调节因子3;基因干扰;固有免疫;炎性反应
枯否细胞(Kupffer cell,KC)是肝脏常驻的组织巨噬细胞,是肝脏针对来自肠道和/或血循环中病原微生物及其释放的毒性代谢产物的第一道防线,是机体固有免疫应答的重要成分。病原微生物或其毒性产物可激活KC,诱导其表达和释放多种炎性细胞因子,造成肝组织急性损伤性炎症[1]。已知KC活化后的炎性释放效应主要是由TLR4信号通路激活所介导的[2,3]。LPS等炎性刺激物,可结合并激活KC表面TLR4分子,进而诱导其下游接头蛋白MyD88和TRIF信号活化[1,2]。MyD88信号可通过激活NF-κB,诱导前炎细胞因子TNF-α、IL-1β等的表达和释放,引起组织炎性损伤;TRIF信号(或MyD88非依赖信号)可通过激活IRF3,诱导Ⅰ型干扰素的产生[1]。已证实,IRF3-IFN-β是KC发挥固有免疫应答的关键信号分子通路[1]。在病原微生物感染期间,转录因子IRF3在巨噬细胞内的升高程度与机体对病原微生物的固有免疫应答水平呈密切的正相关关系[4]。
传统认为,IRF3和NF-κB是两条独立并互不影响的信号分子通路。但是,近年发现,IRF3在组织炎症反应中也起重要的作用[5,6]。我们前期研究也证实,在肝组织炎症损伤期间,肝内IRF3的表达显著升高[7]。为进一步探讨IRF3对肝组织炎症反应的影响机制,在本项目中,我们采用IRF3基因沉默实验,研究了IRF3信号对KC活化后早期前炎细胞因子TNF-α和IL-1β以及抑炎性细胞因子IL-10分泌水平动态变化的影响。因为固有免疫细胞的炎性释放是组织炎症反应发生的一个早期事件。项目研究的完成,有助于阐明IRF3对KC炎症信号通路的影响,为将来探讨IRF3在急性肝衰竭发生中的免疫炎症效应奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性健康SD大鼠,体重250 g,由上海交通大学附属第一人民医院实验动物中心提供。动物合格证号:SYXK(沪)2009-0086。动物饲养环境温度:20℃~23℃。湿度:40%~80%。所有大鼠均自由饮水和进食。每12 h开灯或关灯。实验前禁食12 h。实验动物的使用符合国家动物保护法。
1.1.2 主要试剂与耗材 IV型胶原酶和Trizol购自美国Invitrogen公司;1640培养液和胎牛血清购自美国Gibco公司;青链霉素混合液购自德国Hyclone公司;Percoll细胞分离液购自瑞典Pharmacia公司;LPS购自美国Sigma公司;逆转录试剂盒和SYBR Green PCR试剂盒购自美国Thermo公司;PCR引物由上海生工生物工程有限公司合成; ELISA试剂盒购自美国Ebioscience公司;IRF3兔单克隆抗体购自美国Cell Signaling公司;Western blot试剂购自碧云天公司。
1.2 方法
1.2.1 原代枯否细胞的分离与培养 采用文献[8]方法分离培养大鼠原代KC。操作方法简述如下:0.2%戊巴比妥钠以25 ml/kg腹腔注射麻醉,0.1%的肝素1 ml腹腔注射。75%酒精消毒大鼠后,行开腹门静脉插管,予PBS灌注冲洗肝脏,推注0.05% Ⅳ胶原酶行原位在体灌注消化肝组织。随后剪取肝脏置于Ⅳ型胶原酶消化液中,小心撕碎肝组织。用不连续Percoll密度梯度离心分离枯否细胞,分离出来的枯否细胞以1640培养液(胎牛血清10%、青霉素1 000 U/L、链霉素1 000 U/L)、37℃、5%CO2培养箱培养3~4 h后,洗去未贴壁细胞即可获得纯化的枯否细胞。枯否细胞鉴定采用墨汁吞噬试验和ED2染色,方法见参考文献[8]。细胞活性在90%以上时用于下一步实验研究。
1.2.2 腺病毒感染原代枯否细胞方法 IRF3 shRNA绿色荧光蛋白(GFP)表达腺病毒由本实验室设计合成,并经抑制效率研究,选取抑制效率最好者(针对基因位点1219~1239:5′-GGTTGTTCCTACATGTCTTAA-3′)进行实验。该干扰腺病毒采用了pAdeno-U6-CMV-EGFP质粒携带,并经与腺病毒骨架质粒pBHGlox E1E3重组包装构建。其中的绿色荧光蛋白(GFP)基因可方便病毒感染效率的观察。腺病毒感染原代枯否细胞的具体方法:细胞接种于6孔板,每孔细胞数4×106个。细胞培养24 h待其稳定贴壁后,吸弃培养上清液。每孔细胞中加入500 μl含腺病毒MOI为150的无血清的培养液,置于37℃、5%CO2培养箱培养2 h。弃上清,换成含5%血清的培养液,继续培养46 h。
1.2.3 细胞的处置 干扰腺病毒感染细胞48 h后,按照文献[9,10],以终浓度为20 μg/ml的LPS刺激细胞。在LPS刺激细胞0、2、4和6 h后,分别收集细胞培养上清液并收集刺激6 h细胞用于后续实验。
1.2.4 RT-PCR检测 肝枯否细胞采用Trizol处理,总RNA抽提按说明书进行。以总RNA作为模板用于第一链cDNA的合成。引物设计借助Primer Premier 6软件设计,基因检测引物序列和产物长度见表1。操作方法按试剂盒说明书进行。反应体系:4.0 μl cDNA模板,2 μl 10×PCR缓冲液,4 μl dNTP混合物,2 μl TaqDNA聚合酶,上、下游引物各2 μl,补充无核酶水至25 μl, 置于PCR仪中进行聚合扩增。IRF3基因反应条件为: 94℃预变性5 min,94℃ 1 min,51℃ 45 s,72℃ 45 s,共32个循环; 72℃延伸10 min。所得PCR产物经2%琼脂糖凝胶电泳,GAPDH作为内参照。电泳结果经Bio-Rad Quantity-One 4.7成像分析软件检测,并计算待测基因灰度相对GAPDH的表达量。
1.2.5 细胞总蛋白抽提 细胞总蛋白提取按照试剂盒说明书操作。简要步骤如下:用PBS洗细胞后,加入100 μl裂解液。用枪吹打数下,使裂解液与细胞充分接触。待细胞充分裂解后,10 343 r/min离心5 min,取上清即为所需的细胞总蛋白。蛋白浓度的测定按照碧云天蛋白浓度测定试剂盒说明书操作,水浴煮沸,-70℃保存备用。
1.2.6 免疫印迹(Western blot) 每个样本取40 μg蛋白,进行8%十二烷基硫酸钠/聚丙烯酰胺凝胶(SDS-PAGE)电泳后,将蛋白转膜至PVDF膜上,用5%脱脂牛奶封闭1 h。封闭结束后,用IRF3抗体和内参β-actin在4℃下孵育过夜。0.1%PBST漂洗3次,每次10 min。加辣根过氧化物酶标记的二抗,室温下孵育1 h。0.1%PBST漂洗3次,每次10 min。结果用ECL-Plus化学发光试剂盒检测,X光片曝光。X光片显影和定影后观察结果。结果用Image J软件读取灰度值。
表1 基因扩增引物序列和产物长度
Tab.1 Primer sequences and product length of gene amplification

GenePrimersequence5'→3'ProductlengthIRF3Sense:ACGCACAGATGGCTGACTTT102bpAnti-sense:TCCTCTTCCAGGTTGACAGGGAPDHSense:GACATGCCGCCTGGAGAAAC92bpAnti-sense:GACATGCCGCCTGGAGAAAC
1.2.7 酶联免疫技术(ELISA) 细胞上清液采用双抗体夹心酶联免疫技术检测不同时间点的TNF-α、IL-1β、IFN-β和IL-10,操作过程按照试剂盒说明书进行。每份标本取3复孔,结果取三者均值。实验重复进行6次。
2 结果
2.1IRF3shRNA腺病毒感染原代大鼠KC镜下表现 原代KC培养24h后细胞完全舒展,大小基本一致,但形态不规则,可呈星形、多角形等(见图1A)。KC常规培养24h稳定贴壁后,感染IRF3shRNA腺病毒。图1B为感染腺病毒48h后,KC在荧光倒置显微镜下的表现。镜下可见KC内表达的GFP。通过观察细胞内GFP的表达情况,可了解IRF3shRNA腺病毒对KC的感染效率(经计算,腺病毒的细胞感染效率接近100%)。
2.2IRF3shRNA腺病毒对枯否细胞IRF3mRNA表达的影响 原代枯否细胞IRF3mRNA表达的凝胶电泳图及其相对表达水平直方图如图2。经统计学处理,LPS刺激细胞IRF3mRNA的相对表达水平较正常对照组细胞升高[(1.43±0.03)比(1.03±0.03),P<0.05],而干扰腺病毒预处理后,使LPS刺激细胞IRF3mRNA的相对表达水平降低[(0.72±0.07)vs(1.43±0.03),P<0.05]。另外,与正常对照组相比,单独应用干扰腺病毒处理细胞IRF3mRNA的相对表达水平降低[(0.69±0.07)vs(1.03±0.03),P<0.05]。这提示,IRF3shRNA腺病毒对原代枯否细胞LPS刺激诱导IRF3mRNA的高表达和非刺激性IRF3mRNA的组成性表达均有抑制性影响。
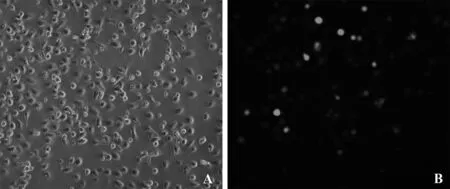
图1 原代KC 腺病毒感染前后镜下表现 Fig.1 Optical microscopic manifestation of primary KC before and after affected by adenovirusNote: A.Optical microscopic manifestation(×200)of primary KC before affected by adenovirus;B.Inversed fluorescent microscopic manifestation(×200)of primary KC after affected by adenovirus.
2.3IRF3shRNA腺病毒对枯否细胞IRF3蛋白表达的影响 枯否细胞内IRF3蛋白免疫印迹图及其蛋白质相对表达水平见图3。经统计学处理,LPS刺激细胞内IRF3蛋白质的水平较正常对照组升高[(1.32±0.10)vs(1.01±0.13),P<0.05],而干扰腺病毒预处理后,LPS刺激细胞IRF3蛋白的表达水平降低[(0.58±0.13)vs(1.32±0.10),P<0.05]。另外,与正常对照组细胞比较,单独应用干扰腺病毒组细胞IRF3蛋白的水平降低[(0.61±0.03)比(1.01±0.13),P<0.05]。这提示,LPS可刺激诱导KC胞内IRF3蛋白表达升高,IRF3shRNA腺病毒对原代枯否细胞LPS刺激诱导IRF3蛋白的超高表达和非刺激性IRF3蛋白的组成性表达均有抑制性影响。

图2 原代枯否细胞IRF3 mRNA表达情况(RT-PCR)Fig.2 Expression of IRF3 mRNA in primary KCs(RT-PCR)Note: A.Representative ethidium bromide-stained gel of RT-PCR products.Lane 1.IRF3 shRNA(-)LPS(-);Lane 2.IRF3 shRNA(-)LPS(+);Lane 3.IRF3 shRNA(+)LPS(-);Lane 4.IRF3 shRNA(+)LPS(+);M.DL2000 DNA marker;B.Statistical bar graph of relative expression of IRF3 mRNA in KCs.*.P<0.05 vs shRNA(-)LPS(-);#.P<0.05 vs IRF3 shRNA(-)LPS(+).
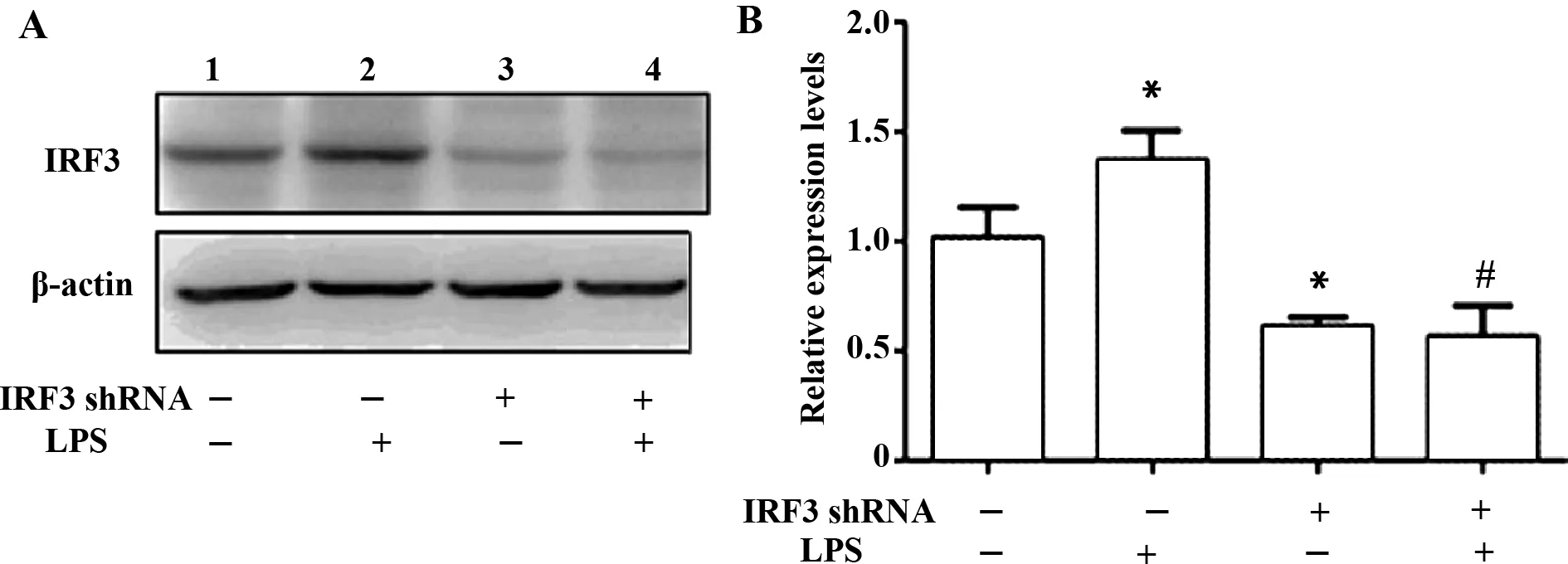
图3 原代枯否细胞IRF3蛋白表达情况(Western blot) Fig.3 Expression of IRF3 protein(Western blot)Note: A.Western blot;B.Statistical bar graph of expression of IRF3 protein.Lane 1.IRF3 shRNA(-)LPS(-);Lane 2.IRF3 shRNA(-)LPS(+);Lane 3.IRF3 shRNA(+)LPS(-);Lane 4.IRF3 shRNA(+)LPS(+).*.P<0.05 vs shRNA(-)LPS(-);#.P<0.05 vs IRF3 shRNA(-)LPS(+).
2.4IRF3shRNA腺病毒对LPS刺激枯否细胞IFN-β早期分泌的动态影响IRF3shRNA腺病毒对LPS刺激枯否细胞IFN-β早期分泌的动态影响见图4A。经统计学处理,单独应用LPS处理原代枯否细胞IFN-β蛋白的分泌水平,在LPS刺激后2、4、6h时间点均较0h升高[(35.57±2.23)、(43.04±2.00)、(26.31±7.82)vs(17.09±1.84)pg/ml,均P<0.05],4h时间点较2h和6h增高(均P<0.05);干扰腺病毒预处理原代枯否细胞IFN-β蛋白的分泌水平,在LPS刺激后2h和4h时间点较0h和6h均增高[(24.73±2.68)、(25.77±5.26)vs(17.27±1.27)和(17.15±1.14)pg/ml,均P<0.05)],4h与2h时间点之间以及6h与0h时间点之间IFN-β蛋白水平无明显统计学差异(均P>0.05)。另外,干扰腺病毒预处理细胞在LPS刺激后2、4、6h各时间点IFN-β蛋白的分泌水平均较单独应用LPS处理细胞低(均P<0.05)。这提示,LPS刺激后极早期(2h)即可诱导KC分泌IFN-β,4h达分泌峰值,6h分泌水平开始下降,但仍维持于高水平;IRF3shRNA腺病毒可抑制LPS刺激后各时间点IFN-β的分泌,抑制分泌高峰的出现,并使6h分泌水平正常。

图4 原代枯否细胞培养上清液IFN-β、TNF-α、IL-1β和IL-10蛋白分泌水平(ELISA分析)Fig.4 Secretion levels of IFN-β,TNF-α,IL-1β and IL-10 protein in culture supernatant of primary KCs(ELISA assay)Note: A.Secretion levels of IFN-β protein;B.Secretion levels of TNF-α protein;C.Secretion levels of IL-1β protein;D.Secretion levels of IL-10 protein.*. P<0.05 vs 0 h;#.P<0.05 vs 2 h;△.P<0.05 vs 4 h;▼.<0.05 vs LPS.
2.5IRF3shRNA对LPS刺激枯否细胞TNF-α早期分泌的动态影响IRF3shRNA腺病毒对LPS刺激枯否细胞TNF-α早期分泌的动态影响见图4B。经统计学处理,单独应用LPS处理原代枯否细胞TNF-α蛋白分泌水平在LPS刺激后2、4、6h时间点均较0h升高[(445.52±49.08)、(348.96±13.08)、(288.80±27.74)vs(76.85±20.19)pg/ml,均P<0.05],同时2h时间点较4h和6h高(P<0.05),4h较6h高(P<0.05);干扰腺病毒预处理原代枯否细胞TNF-α蛋白的分泌水平,在LPS刺激后2、4和6h时间点较0h升高[(234.39±40.04)、(208.15±85.62)、(179.27±13.37)vs(69.99±17.33)pg/ml,均P<0.05],2、4和6h时间点之间比较无明显统计学差异(均P>0.05)。另外,干扰腺病毒预处理细胞在LPS刺激后2、4 、6h各时间点TNF-α蛋白的分泌水平均较单独应用LPS处理细胞低(均P<0.05)。这提示,LPS刺激后极早期(2h)即可诱导KC大量分泌TNF-α并达峰值,随后分泌逐渐下降,但6h仍维持于高水平;IRF3shRNA腺病毒可抑制LPS刺激后早期各时间点TNF-α的分泌,并抑制了分泌高峰的出现。
2.6IRF3shRNA腺病毒对LPS刺激枯否细胞IL-1β早期分泌的动态影响IRF3shRNA腺病毒对LPS刺激枯否细胞IL-1β早期分泌的动态影响见图4C。经统计学处理,单独应用LPS处理原代枯否细胞IL-1β蛋白的分泌水平,在LPS刺激后4h和6h时间点均较0h和2h明显升高[(173.35±20.23)、(560.73±89.26)vs(50.03±4.90)、(52.90±1.91)pg/ml,均P<0.05],6h时间点较4h高(P<0.05),0h与2h之间比较无明显统计学差异(P>0.05);干扰腺病毒预处理原代枯否细胞IL-1β蛋白分泌水平,在LPS刺激后4h和6h时间点较0h和2h升高[(87.73±27.34)、(330.42±97.27)比(48.35±4.10)、(50.57±3.28)pg/ml,均P<0.05],6h较4h增高(均P<0.05),0h和2h之间比较无明显统计学差异(P>0.05)。另外,干扰腺病毒预处理细胞在LPS刺激后IL-1β水平均较单独应用LPS处理细胞4h和6h时间点分泌降低(均P<0.05),2h和0h时间点比较无明显统计学差异(P>0.05)。这提示,LPS刺激后极早期,IL-1β的分泌无明显增加,直到4h后才开始上升,6h分泌达峰值;IRF3shRNA腺病毒抑制了LPS刺激后早期KC对IL-1β的分泌。
2.7IRF3shRNA腺病毒对LPS刺激枯否细胞IL-10早期分泌的动态影响IRF3shRNA腺病毒对LPS刺激枯否细胞IL-10早期分泌的动态影响见图4D。经统计学处理,单独应用LPS处理原代枯否细胞IL-10蛋白的分泌水平,在LPS刺激后2、4、6h时间点均较0h升高[(28.32±7.79)、(47.55±15.36)、(149.29±27.06)vs(18.89±3.53)pg/ml,均P<0.05],6h时间点较2h和4h均高(均P<0.05);干扰腺病毒预处理原代枯否细胞IL-10蛋白分泌水平,在LPS刺激2、4和6h时间较0h均升高[(39.05±3.09)、(180.20±35.48)、(621.38±178.99)vs(22.10±1.78)pg/ml,均P<0.05],6h较2h和4h高(均P<0.05)。另外,干扰型病毒预处理细胞在LPS刺激后2、4和6h各时间点IL-10蛋白分泌水平均较单独应用LPS处理细胞高(均P<0.05)。这提示,LPS刺激后极早期(2h)即可诱导KC分泌IL-10,且在早期阶段呈现进行性分泌增加;IRF3shRNA腺病毒的应用促进了LPS刺激后早期各时间点IL-10的分泌。
3 讨论
我们前期研究证实,急性肝衰竭肝内IRF3的表达升高,阻断炎症相关信号系统UII/UT信号传导,可抑制IRF3的表达和活化,并能减轻肝组织免疫炎症性损伤[7,11,12]。这提示IRF3可能对肝组织炎症反应有影响。为探讨IRF3在肝内的免疫炎性效应,我们在本项目中采用了LPS刺激原代KC实验。我们首先对KC内IRF3的表达进行了研究。我们发现,LPS刺激可诱导KC对IRF3mRNA和蛋白质表达上调。在此基础上,我们研究了IRF3-IFN-β信号与炎症相关因子分泌之间的关系。
已知,在组织炎症反应中,固有免疫细胞对前炎细胞因子的分泌是一个早期事件。损伤性刺激在极早期诱导的肝内TNF-α大量分泌,并进而诱导IL-1β等细胞因子的级联式释放,是造成急性肝组织损伤性炎症反应的关键因素[13]。因此,在本实验中,我们研究了LPS刺激早期,KC对细胞因子的分泌及其动态变化情况。我们发现,LPS刺激KC后,IRF3下游细胞因子IFN-β分泌在极早期(2h)即开始上升,4h达分泌峰值,而TNF-α的分泌水平在刺激2h内即达峰值,随后逐渐下降;IL-1β分泌则直到4h后才开始上升,6h分泌达峰值;IL-10分泌于2h开始逐渐上升,至6h达到峰值。上述细胞因子的这种时间依赖性分泌的动态变化规律,使我们至少可以得到以下三个方面的提示:①IRF3下游信号分子IFN-β可能不是TNF-α早期分泌的促发因素。因为KC对IFN-β的分泌晚于TNF-α,特别是其分泌高峰出现于TNF-α峰值之后;②TNF-α可能是免疫炎症反应的始动因素。我们的实验显示,除IFN-β外,IL-1β的分泌也晚于TNF-α。已证实,巨噬细胞活化后,TNF-α的早期爆式分泌,是随后IL-1β等前炎细胞因子级联式释放的前提,决定了炎症反应的发生和发展[14]。TNF-α对枯否细胞IFN-β的表达与分泌是否存在影响目前尚不十分清楚。近年有文章显示,TNF-α可诱导肿瘤细胞IFN-β表达上调[15]。这提示TNF-α可能也存在固有免疫应答效应;③抑炎细胞因子IL-10分泌增加可能是细胞自身的一种负反馈调控机制。我们发现,在炎性激活早期,KC对IL-10的分泌是紧随TNF-α和IFN-β分泌之后逐渐升高的。这时炎性释放和炎症反应已开始启动,并随时间呈进行性或级联式增强,IL-10分泌水平的逐渐增加可能有助于防止过度的炎症和免疫反应。
为进一步探讨IRF3对炎症相关因子的影响,我们对KC进行了IRF3基因干扰实验。我们的研究显示,IRF3shRNA腺病毒感染KC后,LPS刺激诱导的IRF3mRNA和蛋白质超高表达及非刺激状态下细胞对IRF3mRNA和蛋白质的组成性表达均下调,且明显抑制了LPS诱导的IRF3下游信号分子IFN-β在炎性激活早期各个时间点的分泌水平,抑制了分泌高峰的出现,并使其6h的水平趋于正常。这提示,我们所构建的干扰腺病毒能有效地使IRF3 基因表达沉默,并阻断其信号通路的传导。此外,我们的结果还显示,干扰腺病毒抑制了KC在炎性激活早期各时间点TNF-α分泌及随后的IL-1β分泌,特别是抑制了极早期(2h)TNF-α的分泌峰值。这表明,IRF3存在炎性分泌促进效应。然而,IRF3促进TNF-α等前炎细胞因子分泌的机制目前并未完全清楚。在KC炎性激活早期,TNF-α早于IFN-β分泌,因而TNF-α分泌不依赖于IRF3下游信号分子IFN-β。报告显示,IRF3对NF-κB不存在直接作用[16]。最近研究发现,LPS刺激后,IRF3基因敲除巨噬细胞对TNF-α的分泌明显减少,但细胞内TNF-αmRNA的水平未受影响[17]。因此,IRF3对TNF-α的调控可能主要发生在转录后。
我们也研究了IRF3shRNA腺病毒对细胞因子IL-10分泌水平的影响。我们发现,干扰腺病毒的应用促进了LPS刺激KC早期各时间点IL-10的分泌。这表明,IRF3对IL-10的分泌存在抑制效应。已知,IL-10是一种具有免疫调控效应的抗炎性细胞因子(anti-inflammatorycytokine)。IL-10可通过诱导SOCS3的表达,抑制LPS刺激巨噬细胞对TNF-α、IL-6和iNOS的表达[18]。最近报告显示,IL-10可降解NF-κBp65亚基并诱导MAPK磷酸酶使MAPK信号失活[19]。此外,IL-10还可抑制巨噬细胞激活,抑制固有免疫细胞针对病原体的免疫应答[20]。因此,IL-10可能是TLR4免疫炎症信号传导的负性调控分子。在损伤刺激期间,IRF3对LPS诱导IL-10超高表达的抑制效应,有助于增强细胞的固有免疫应答和组织炎症反应。
本项目的研究从一个侧面对急性肝衰竭发生的炎症和免疫机制相统一的分子基础进行了探讨。枯否细胞作为肝内主要的固有免疫细胞,不仅发挥着针对外源物质的固有免疫应答效应,而且也是肝内炎性释放的主要来源。而上述免疫和炎症效应的产生都有一个统一的分子基础,那就是IRF3。IRF3通过对其下游信号分子IFN-β、前炎细胞因子TNF-α和IL-1β分泌的促进效应以及对抑炎细胞因子IL-10分泌的抑制效应,可能在急性肝衰竭肝组织免疫炎症损伤的发生中起中心作用。项目成果对于将来急性肝衰竭内科治疗药物关键分子靶点的选择有重要价值。
[1] Tsutsui H,Nishiguchi S.Importance of Kupffer cells in the development of acute liver injuries in mice[J].Int J Mol Sci,2014,15(5):7711-7730.
[2] Jeong E,Lee J Y.Intrinsic and extrinsic regulation of innate immune receptors[J].Yonsei Med J,2011,52:379-392.
[3] 涂文娟,汪小庭,刘亮明,等.UII/UT系统对LPS刺激枯否细胞固有免疫炎症信号通路TLR4-IRF3的影响[J].中国免疫学杂志,2014,30(10):1313-1319.
[4] Rustagi A,Gale Jr M.Innate antiviral immune signaling,viral evasion and modulation by HIV-1[J].J Mol Biol,2014,426:1161-1177.
[5] Di Paolo NC,Doronin K,Baldwin LK,etal.The transcription factor IRF3 triggers "defensive suicide" necrosis in response to viral and bacterial pathogens[J].Cell Rep,2013,3:1840-1846.
[6] Shaik-Dasthagirisaheb YB,Huang N,Gibson FC 3rd.Inflammatory response to Porphyromonas gingivalis partially requires interferon regulatory factor(IRF)3[J].Innate Immun,2014,20:312-319.
[7] 汪小庭,涂文娟,刘亮明,等.Urantide对急性肝衰竭小鼠肝组织中IRF3表达的影响[J].世界华人消化杂志,2014,22(18):2559-2564.
[8] 叶长根,梁冬雨,赵亮,于芳萍,孙水林,张吉翔,刘亮明.大鼠枯否细胞的分离、鉴定以及LPS刺激诱导TNF-α的表达[J].世界华人消化杂志,2013,21(4):307-312.
[9] Liu LM,Liang DY,Ye CG,etal.The UII/UT system mediates upregulation of proinflammatory cytokines through p38 MAPK and NF-κB pathways in LPS-stimulated Kupffer cells[J].PLoS One,2015,10(3):e0121383.[10] Liu LM,Zhao L,Liang DY,etal.Effects of urotensin-Ⅱ on cytokines in early acute liver failure in mice[J].World J Gastroenterol,2015,21(11):3239-3244.
[11] Liang DY,Liu LM,Ye CG,etal.Inhibition of UII/UTR system relieves acute inflammation of liver through preventing activation of NF-κB pathway in ALF mice[J].PloS One,2013,8(6):e64895.
[12] 祝娟娟,程明亮,赵雪珂.肝脏免疫炎症在非酒精性脂肪肝病发生发展中的作用[J].临床肝胆病杂志,2016,32(3):570-573.
[13] Liu D,Li C,Chen Y,etal.Nuclear import of proinflammatory transcription factors is required for massive liver apoptosis induced by bacterial lipopolysaccharide[J].J Biol Chem,2004,279:48434-48442.
[14] Parameswaran N,Patial S.Tumor necrosis factor-α signaling in macrophages[J].Crit Rev Eukaryot Gene Expr,2010,20(2):87-103.
[15] Chairatvit K,Wongnoppavich A,Choonate S.Up-regulation of interferon-stimulated gene 15 and its conjugates by tumor necrosis-α via type I interferon-dependent and-independent pathways[J].Mol Cell Biochem,2012,368:195-201.
[16] Covert MW,Leung TH,Gaston JE,etal.Achieving stability of lipopolysaccharide-induced NF-kappaB activation[J].Science,2005,309(5742):1854-1857.
[17] Siegfried A,Berchtold S,Manncke B,etal.IFIT2 is an effector protein of type I IFN-mediated amplification of lipopolysaccharide(LPS)-induced TNF-α secretion and LPS-induced endotoxin shock[J].J Immunol,2013,191(7):3913-3921.
[18] Berlato C,Cassatella MA,Kinjyo I,etal.Involvement of suppressor of cytokine signaling-3 as a mediator of the inhibitory effects of IL-10 on lipopolysaccharide-induced macrophage activation[J].J Immunol,2002,168:6404-6411.
[19] Kwilasz AJ,Grace PM,Serbedzija P,etal.The therapeutic potential of interleukin-10 in neuroimmune diseases[J].Neuropharmacology,2014,4:1-15.
[20] Krause P,Morris V,Greenbaum JA,etal.IL-10-producing intestinal macrophages prevent excessive antibacterial innate immunity by limiting IL-23 synthesis[J].Nat Commun,2015,6:7055
[收稿2015-08-01]
(编辑 张晓舟)
Effects of IRF3 gene interference on dynamic changes of cytokine secretions in early of LPS stimulation in primary Kupffer cells
ZHU Tong,TU Wen-Juan,TAN Zhi-Li,LIU Liang-Ming.Department of Infection,Songjiang Hospital Affiliated to First People′s Hospital,Shanghai Jiaotong University,Shanghai Songjiang Central Hospital Affiliated to Nanjing Medical University,Shanghai 201600,China
Objective:To investigate the effects of IRF3 shRNA adenovirus on dynamic changes of early cytokines in LPS-stimulated primary Kupffer cells(KCs).Methods: Rat KCs were isolated and purified by means of in situ perfusion.After being infected with adenovirus carrying IRF3 shRNA for 48 h,KCs were stimulated with LPS.Cell culture supernatants were collected respectively at 0,2,4 and 6 h after LPS stimulation as well as cells at 6 h.Supernatant cytokine secretion levels were detected by enzyme-linked immunosorbent assay(ELISA).Intracellular gene expressions were tested by RT-PCR and Westeron blot.Results: IRF3 mRNA and protein were induced by LPS,but suppressed by IRF3 shRNA adenovirus in LPS-stimulated or non-stimulated KCs.IFN-β secretions rose in the very early stage(at 2 h),reached the peak at 4 h,and began to reduce but still remained high levels at 6 h after LPS stimulation in KCs.Interference adenovirus pretreatment suppressed IFN-β secretions(especially the secretion peak)at each time point after LPS stimulation.IFN-β secretions reached normal levels at 6 h after the stimulation in adenovirus-pretreated cells;TNF-α secretions rapidly increased in the very early stage and reached the peak at 2 h,then began to decrease gradually,but remained high levels at 6 h after LPS stimulation in KCs.Interference adenovirus pretreatment inhibited LPS-induced TNF-α secretions,especially the secretion peak;IL-1β secretions did not increase untill 4 h,but reached a higher level at 6 h after LPS stimulation.Interference adenovirus suppressed IL-1β secretions in the early stage of LPS stimulation;IL-10 secretions began to rise in the very early stage,and gradually increased over time after LPS stimulation in KCs.Pretreatment of adenovirus with IRF3 shRNA promoted upregulations of IL-10 secretions at each time point of the early of LPS stimulation.Conclusion: IRF3 gene expression can be silenced by IRF3 shRNA adenovirus.IRF3 can promote its downstream signaling molecule IFN-β and pro-inflammatory cytokines including TNF-α and IL-1β,and block anti-inflammation cytokine IL-10 secretions in LPS-stimulated primary KCs.Therefore,IRF3 may play a central role in immune inflammatory injury of liver tissues.
Primary kupffer cells;IRF3;Gene interference;Innate immune;Inflammatory reaction
10.3969/j.issn.1000-484X.2016.04.004
①本文为国家自然科学基金项目(81070357, 30660066)和上海市松江区科学技术攻关项目(14SJGGYY22)。
朱 彤(1990年-),女,主要从事重症肝病免疫机制研究,E-mail:zhutong1990@foxmail.com。
及指导教师:刘亮明(1968年-),男,医学博士,教授,主任医师,硕士生导师,主要从事肝脏病基础和临床研究,E-mail: liuliangming@hotmail.com。
R575.3
A
1000-484X(2016)04-0470-07
