芍药苷通过抑制脊髓CC趋化因子配体2拮抗吗啡镇痛耐受
2016-12-12洪广辉李轶聪
赵 昱,宋 扬,洪广辉,李轶聪*
(1.解放军第二一一医院 麻醉科,黑龙江 哈尔滨150080;2.佳木斯大学临床医学院,黑龙江 佳木斯154000)
芍药苷通过抑制脊髓CC趋化因子配体2拮抗吗啡镇痛耐受
赵 昱1,宋 扬2,洪广辉1,李轶聪1*
(1.解放军第二一一医院 麻醉科,黑龙江 哈尔滨150080;2.佳木斯大学临床医学院,黑龙江 佳木斯154000)
目的 探讨脊髓CC趋化因子配体2(CCL2)在芍药苷拮抗大鼠慢性吗啡镇痛耐受中的作用。方法 成功鞘内置管清洁级Sprague-Dawley(SD)大鼠60只,随机分为4组(n=15):生理盐水组(NS组),吗啡组(MOR组),芍药苷组(PF组)和吗啡+芍药苷组(MOR+PF组)。连续7 d鞘内注射15μg吗啡建立慢性吗啡耐受的动物模型。应用甩尾潜伏期法(tail flick latency,TFL)及机械反射阈值法(mechanical withdrawal threshold,MWT)观察鞘内注射芍药苷对吗啡镇痛耐受的影响;应用免疫组织荧光染色法检测芍药苷对腰段脊髓小胶质细胞活化的影响;应用免疫印迹法(Western blot)检测芍药苷对腰段脊髓CCL2表达的影响。结果 连续7 d鞘内注射吗啡后,与NS组比较,MOR组大鼠腰段脊髓背角小胶质细胞显著增多,腰段脊髓CCL2表达显著增加(P<0.05);而与MOR组比较,MOR+PF组大鼠腰段脊髓背角小胶质细胞显著减少,腰段脊髓CCL2表达显著减少(P<0.05)。与MOR组大鼠最大镇痛效应百分率(percent of maximal possible potential effect,MPE)比较,MOR+PF组大鼠%MPE显著增加(TFL:19%±4% vs 41%±3%;MWT:18%±6% vs 42%±4%,P<0.05)。结论 芍药苷可能通过抑制脊髓内CCL2表达增加拮抗大鼠慢性吗啡镇痛耐受。
吗啡镇痛耐受;芍药苷;CCL2;脊髓
(ChinJLabDiagn,2016,20:1822)
吗啡是临床上缓解重度疼痛及治疗癌性疼痛最常用的镇痛药物,但长期给予吗啡会出现镇痛效能降低,需要不断加大吗啡使用剂量的现象被称为吗啡的镇痛耐受。镇痛耐受的出现会导致恶心、呕吐、便秘、呼吸抑制等不良反应发生率增加,因此对其机制的研究就更具临床意义。已经证实吗啡导致的胶质细胞激活在吗啡镇痛耐受的产生过程中发挥重要作用[1]。脊髓CC趋化因子配体2[chemokine (C-C motif) ligand 2,CCL2]作为分泌型的小分子量蛋白质可以诱导免疫细胞向炎症发生部位迁移。体外研究发现[2],吗啡可以刺激原代培养神经元分泌CCL2;在体研究发现[3],大鼠鞘内注射吗啡可以增加脊髓神经元分泌CCL2,并导致脊髓小胶质细胞激活,而同时注射CCL2中和抗体能抑制小胶质细胞激活并拮抗吗啡镇痛耐受。另有研究发现[4],小鼠鞘内注射CCL2能激活脊髓小胶质细胞,并剂量依赖性地诱发机械性痛敏,而同时注射CCL2中和抗体能抑制小胶质细胞激活并减少机械性痛敏的发生。因此我们推测脊髓CCL2可能介导了吗啡耐受过程,但其具体作用仍有待证实。
芍药苷(Paeoniflorin,PF)是一种从芍药根部提取的单萜糖苷,具有抗炎、抗氧化等多种功能,并对小胶质细胞具有免疫调控作用。研究发现[5],芍药苷可以减轻脂多糖激活的原代小胶质细胞释放促炎症细胞因子。另有研究发现[6],芍药苷还可以通过抑制吗啡诱导的小胶质细胞激活,从而减轻吗啡镇痛耐受,但其具体机制仍有待阐明。为此,本文通过鞘内连续注射吗啡建立吗啡镇痛耐受的在体模型,观察芍药苷对吗啡镇痛耐受及对大鼠脊髓CCL2表达的影响,探讨芍药苷是否通过抑制脊髓CCL2表达拮抗大鼠慢性吗啡镇痛耐受,旨在为芍药苷治疗吗啡镇痛耐受提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 体重(200±10)g清洁级雄性Sprague-Dawley(SD)大鼠,购于哈尔滨医科大学实验动物中心。饲养环境:维持光照周期为12 h、温度为(23±1)℃,自由进食水。所有操作和动物处理均遵循国家卫生机构制定的实验室动物指南。
1.1.2 药品与试剂 盐酸吗啡(沈阳第一制药厂);芍药苷(Sigma公司,美国);IBA-1兔多克隆抗体(1∶400,Wako,日本);荧光素标记羊抗兔二抗(1∶1 000,Millipore,美国);CCL2小鼠单克隆抗体(1∶1 000,Millipore,美国);β-Tubulin兔多克隆抗体(1∶1 000,Abcam,英国)。
1.2 方法
1.2.1 实验分组 成功鞘内置管SD大鼠60只,随机分为4组(每组15只): ①生理盐水组(NS组);②吗啡组(MOR组);③芍药苷组(PF组);④吗啡+芍药苷组(MOR+PF组)。NS组连续7 d鞘内注射生理盐水(20 μl);MOR组连续7 d鞘内注射15 μg吗啡(20 μl);PF组连续7 d鞘内给予40 μg芍药苷(20 μl);MOR+PF组连续7 d鞘内注射吗啡及芍药苷(15 μg吗啡+40 μg芍药苷)。于鞘内注射1、3、5、7 d测量行为学,行为学测量完毕断头处死大鼠行Western Blot测定腰段脊髓CCL2表达,行免疫组织荧光染色法检测腰段脊髓小胶质细胞活化情况。
1.2.2 大鼠鞘内置管术 戊巴比妥钠(40 mg/kg)腹腔注射麻醉。髂嵴连线定位L5椎体,正中切开L4-L6背部皮肤,钝性分离椎旁肌,钳去L6椎体部分脊突以充分暴露L5-6椎间隙,将带管芯的Microspinal导管倾斜60°角插入第5腰椎间隙,大鼠尾部或后肢突然出现抽动表明管芯进入蛛网膜下腔。将导管向头端方向插入2.5 cm后固定,封闭导管外口后逐层缝合肌肉与皮肤。鞘内置管恢复3 d后,通过鞘内注射2%利多卡因10 μl验证置管是否成功,双后肢出现短暂瘫痪判定为鞘内置管成功,否则为失败。鞘内置管失败及置管后出现后肢或尾部瘫痪、运动功能障碍的动物从实验中排除并立即注射过量戊巴比妥钠处死。断头取材时观察导管位置,导管末端位置不正确的大鼠行为学数据从该组中排除。
1.2.3 行为学测试 甩尾潜伏期法(tail flick latency,TFL):鞘内注射30 min后,秒表记录大鼠热水甩尾潜伏期(s),即从大鼠尾部进入(50±0.2)℃热水到开始甩尾的时间。注射前为基础甩尾潜伏期(basal tail flick latency,BL),注射后为实验甩尾潜伏期(test tail flick latency,TL)。设定动物尾部在热水中停留最长时间为15 s(cut-off time),以防对尾部造成损伤。间隔2 min,连续测定3次。将3次潜伏期的平均值确定为痛阈值。将基础阈值超过5 s的动物从实验中排除。MPE=(TL-BL)/(cut off-time-BL)×100%。
机械缩足反射阈值法(mechanical withdrawal threshold,MWT):有机玻璃箱(22 cm×12 cm×22 cm)置于金属筛网上,待大鼠适应15 min后,用von Frey纤维丝垂直刺激大鼠后肢足底中部,持续时间≤4 s,大鼠出现抬足或舔足行为定义为阳性反应,否则为阴性反应。从2 g开始测定,当该力度的刺激不足以引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则给予相邻小一级力度的刺激,直至出现第一次阳性和阴性反应的骑跨,每次刺激间隔30 s,连续测定4次。最大力度为15 g,大于此值时记为15 g,以防造成组织损伤。
以MPE TFL和MPE MWT做为行为学结果比较的统计值。
1.2.4 Western Blot 戊巴比妥钠腹腔注射深麻醉后断头处死大鼠(n=4),迅速分离腰段脊髓(L4-L6 节段)组织,液氮速冻后-80℃深低温冰箱保存。提取蛋白时,将组织放入2 ml匀浆器中,按1 ml/100 mg比例加入预冷的蛋白提取液(KeyGEN全蛋白提取试剂盒),充分匀浆后冰上裂解15 min,转移至洁净EP管后4℃12 000rpm离心15 min取上清液即为蛋白提取液。用BCA(bicinchoninic acid)蛋白质测定试剂盒(美国Peirece公司)进行蛋白定量。配制12% SDS-PAGE凝胶,每个泳道上样量均为100 μg,120 V恒压电泳70 min,待溴酚蓝染料到达凝胶底部时停止电泳。80 V恒压湿法转膜80 min,将凝胶上的蛋白转移至0.45 μm孔径PVDF膜上,转膜后使用封闭液室温封闭1h,一抗(CCL2 1∶1 000,β-Tubulin 1∶1 000)4℃孵育过夜,辣根过氧化物酶标记种属特异性二抗(1∶5 000)室温摇床孵育1 h,使用ECL化学发光液于荧光和可见光凝胶成像系统(Alpha Innotech)显影并进行条带灰度分析,通过计算目的蛋白条带灰度值与内参照蛋白条带灰度值的比值,半定量分析目的蛋白表达情况。
1.2.5 免疫组织荧光染色 行为学测定结束后,戊巴比妥钠腹腔注射深麻醉后断头处死大鼠(n=3)。用预冷的生理盐水 100 ml 和 4%多聚甲醛 400 ml 经左心室灌注固定。将腰段脊髓 ( L4-L6 ) 即腰膨大取出,4%多聚甲醛后固定 2 h 后置入蔗糖溶液梯度脱水。 冰冻切片机(LEICA)切片(片厚 12 μm)。IBA-1兔多克隆抗体( 1∶400,Wako,日本) 4℃孵育过夜,荧光素标记羊抗兔二抗( 1∶1 000,Millipore,美国) 37℃避光孵育1 h,各步骤间用 PBS 冲洗3次,5 min/次,50%甘油封片后荧光显微镜拍片,并用 Image pro-Plus 6.0 软件进行数据分析。
1.2.6 统计学处理 使用SPSS13.0软件对本实验数据进行单因素方差分析,使用SNK(Student-Newman-Keuls)检验进行组间两两比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 芍药苷对吗啡镇痛耐受形成的影响
MOR组和MOR+PF组在吗啡注射1 d时均产生了最大镇痛作用,两组的镇痛作用比较差异没有统计学意义(Fig.1,P>0.05)。注射吗啡3 d时MOR组大鼠开始出现镇痛耐受,至7 d时形成明显耐受。与之比较,MOR+PF组大鼠接受吗啡注射后5 d和7 d仍可以产生明显的镇痛作用,两组吗啡镇痛作用差异有统计学意义(P<0.05)。PF组与NS组比较MPE差异没有统计学意义(P>0.05)。
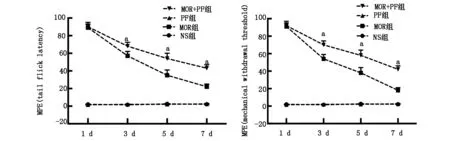
Fig.1 Effects of Paeoniflorin on the tolerance to morphine analgesia(n=8)
2.2 芍药苷抑制大鼠腰段脊髓背角小胶质细胞活化
图2显示,与NS组比较,注射吗啡7 d后,MOR组小胶质细胞标记物IBA-1在大鼠腰段脊髓背角表达显著增加(P<0.05)。与MOR组比较,MOR+PF组大鼠在鞘内注射7 d后腰段脊髓背角IBA-1表达显著减少(P<0.05)。NS组与PF组大鼠腰段脊髓背角IBA-1表达差异无统计学意义(P>0.05)。
2.3 芍药苷下调腰段脊髓CCL2表达
图3显示,与NS组比较,注射吗啡7 d后,MOR组大鼠腰段脊髓CCL2表达显著增加(P<0.05)。与MOR组比较,MOR+PF组大鼠在鞘内注射7 d后腰段脊髓CCL2表达显著减少(P<0.05)。NS组与PF组大鼠腰段脊髓CCL2表达差异无统计学意义(P>0.05)。

Fig.2 Paeoniflorin suppressed morphine-induced microglia activation in the spinal cord(n=3)
A:Microglia in spinal cord immunostained with an IBA-1 antibody; B:Integrated density of microglia immunofluorescence in spinal cord.aP<0.05 vs NS group;bP<0.05 vs MOR group.Bar=200 μm
3 讨论
研究发现,吗啡可以通过神经元表面的吗啡受体和小胶质细胞表面的TLR4(toll-like receptor 4)受体等间接或直接引起脊髓背角小胶质细胞的显著活化,导致吗啡镇痛效果降低[7]。CCL2与它的特异性受体CCR2广泛表达于中枢神经系统,在多发性硬化症及脑损伤等疾病过程中表达会显著增加[8,9]。体外研究发现[2],吗啡可以刺激原代培养神经元分泌CCL2。本研究发现,连续鞘内注射吗啡7天后,腰段脊髓CCL2表达显著上调,大鼠腰段脊髓背角小胶质细胞显著增多,这与Zhao等[3]研究结果相一致,且他们还证实CCL2中和抗体可以拮抗吗啡镇痛耐受,这些结果证实CCL2介导了吗啡耐受过程。胶质细胞激活在吗啡镇痛耐受形成中的作用越来越受到人们的关注。研究证实[10],小胶质细胞激活后可以进入经典的M1状态及选择性激活的M2状态,M1状态的小胶质细胞可以产生大量促炎症细胞因子,发挥有害作用;而M2状态的小胶质细胞可以分泌抗炎因子及神经营养素,发挥有益作用。鞘内注射吗啡导致的脊髓背角神经元分泌CCL2增多,可能通过诱导小胶质细胞激活进入M1状态,从而诱发吗啡镇痛耐受。本研究发现,PF组与NS组比较MPE差异没有统计学意义,提示芍药苷抑制吗啡耐受形成并非通过增强镇痛作用来达到的。腰段脊髓CCL2表达上调与小胶质细胞的激活存在时间上的一致性,而鞘内注射芍药苷可以拮抗这一现象。这些结果提示,芍药苷可能正是通过抑制大鼠慢性吗啡镇痛耐受形成中CCL2表达上调从而拮抗吗啡镇痛耐受形成。
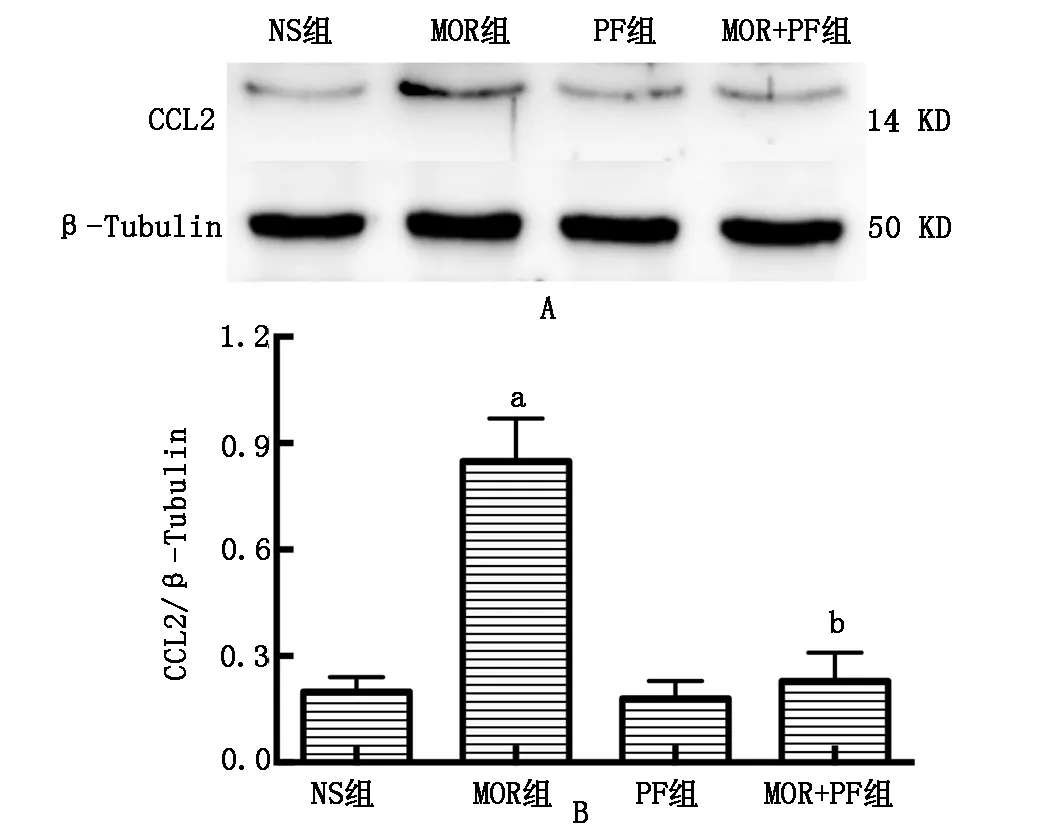
Fig.3 Paeoniflorin down-regulated the expression of CCL2 in the spinal cord in rats(n=4)
A:Representative Western blot bands;B:The bar graph shows quantification of the Western blot analysis for CCL2 protein.aP<0.05 vs NS group;bP<0.05 vs MOR group
至今尚未能完全阐明注射吗啡导致脊髓背角小胶质细胞激活的具体机制。Zhao等[3]研究发现,鞘内注射吗啡可以导致脊髓背角神经元CCL2表达增加,但双重免疫荧光染色发现,CCL2与神经元标记物NEUN共表达,而与小胶质细胞标志物OX-42无共表达,提示CCL2可能并非直接作用于脊髓背角小胶质细胞导致其活化。有研究发现[11,12],在吗啡镇痛耐受过程中丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,MAPK)可能介导了脊髓小胶质细胞激活。已有研究证实[13],在小胶质细胞激活过程中CCL2与MAPK通路存在直接联系。p38 MAPK 抑制剂 SB203580可以显著抑制吗啡导致的小胶质细胞活化及炎症因子释放[14]。Yang等[15]研究发现,CCL2还可以通过细胞外调节蛋白激酶(extracellular signal regulated kinase,ERK )和p38 MAPK通路刺激人主动脉平滑肌细胞分泌基质金属蛋白酶- 9(matrix metalloproteinase-9,MMP-9)。因此可以推测,鞘内注射吗啡可能是通过刺激脊髓背角神经元分泌CCL2,从而激活MAPK通路导致脊髓背角小胶质细胞活化。本实验未检测背根神经节中CCL2表达情况,不能排除CCL2表达增加来源于背根神经节的可能,这将有待进一步探讨。
综上所述,CCL2介导了吗啡镇痛耐受的发生,其活化小胶质细胞的作用可能是通过激活下游靶分子实现的,芍药苷通过抑制脊髓CCL2表达从而拮抗吗啡镇痛耐受形成。本文为进一步阐明吗啡镇痛耐受机制提供了新颖的实验资料,为防治吗啡镇痛耐受提供了新的药物选择。
[1]Watkins LR,Hutchinson MR,Rice KC,et al.The ‘toll’ of opioid-induced glial activation:improving the clinical efficacy of opioids by targeting glia [J].Trends Pharmacol Sci,2009,30:581.
[2]R Bryan Rock,Shuxian Hu,Wen S Sheng,et al.Morphine stimulates CCL2 production by human neurons [J].E Journal of Neuroinflammation,2006,3:32
[3]Zhao CM,Guo RX,Hu F,et al.Spinal MCP-1 contributes to the development of morphine antinociceptive tolerance in rats [J].Am J Med Sci,2012,344:473.
[4]Van Steenwinckel J,Reaux-Le Goazigo A,Pommier B,et al.CCL2 released from neuronal synaptic vesicles in the spinal cord is a major mediator of focal inflammation and pain after peripheral nerve injury[J].J Neurosci,2011,31:5865.
[5]Nam KN,Yae CG,Hong JW,et al.Paeoniflorin,a monoterpene glycoside,attenuates lipopolysaccharide-induced neuronal injury and brain microglial inflammatory response[J].Biotechnol Lett,2013,35:1183.
[6]Jiang C,Xu L,Chen L,et al.Selective suppression of microglial activation by paeoniflorin attenuates morphine tolerance[J].Eur J Pain,2015,19:908.
[7]Hutchinson MR,Shavit Y,Grace PM,et al.Exploring the neuroimmunopharmacology of opioids:an integrative review of mechanisms of central immune signaling and their implications for opioid analgesia[J].Pharmacol Rev,2011,63:772.
[8]Mahad DJ,Ransohoff RM.The role of MCP-1 (CCL2) and CCR2 in multiple sclerosis and experimental autoimmune encephalomyelitis (EAE) [J].Semin Immunol,2003,15:23.
[9]Little AR,Sriram K,O’Callaghan JP.Corticosterone regulates expression of MCP-1 in the intact and chemically injured hippocampus[J].Neurosci Lett,2006,399:162.
[10]Benson MJ,Manzanero S,Borges K.Complex alterations in microglial M1/M2 markers during the development of epilepsy in two mouse models[J].Epilepsia,2015,56:895.
[11]Cui Y,Chen Y,Zhi JL,et al.Activation of p38 mitogen-activated protein kinase in spinal microglia mediates morphine antinociceptive tolerance [J].Brain Res,2006,1069:235.
[12]Cui Y,Liao XX,Liu W,et al.A novel role of minocycline:attenuating morphine antinociceptive tolerance by inhibition of p38 MAPK in the activated spinal microglia [J].Brain Behav Immun,2008,22:114.
[13]Zhou Y,Ling EA,Dheen ST.Dexamethasone suppresses monocyte chemoattractant protein-1 production via mitogen activated protein kinase phosphatase-1 dependent inhibition of Jun N-terminal kinase and p38 mitogen-activated protein kinase in activated rat microglia [J].J Neurochem,2007,102:667.
[14]Chen Y,Geis C Sommer.Activation of TRPV1 contributes to morphine tolerance:involvement of the mitogen-activated protein kinase signaling pathway[J].J Neurosci,2008,28:5836.
[15]Yang CQ,Li W,Li SQ,et al.MCP-1 stimulates MMP-9 expression via ERK 1/2 and p38 MAPK signaling pathways in human aortic smooth muscle cells [J].Cell Physiol Biochem,2014,34:266.
Paeoniflorin attenuates morphine antinociceptive tolerance through suppressing spinal CCL2 up-regulation
ZHAOYu1,SONGYang2,HONGGuang-hui1,etal.
(1.DepartmentofAnesthesioloy,the211HospitalofPLA,Harbin150080,China;2.JiamusiUniversityClinicalMedicineCollege,Jiamusi154000,China)
Objective To investigate the role of spinal CCL2 in attenuation of chronic morphine antinociceptive tolerance by Paeoniflorin(PF).Methods Sixty male Sprague-Dawley rats with successful intrathecal catheter were randomly divided into four groups(n=15):Saline group(NS); Morphine group(MOR); Paeoniflorin group(PF); Morphine plus Paeoniflorin group(MOR+PF).A morphine tolerance model of rats was induced by intrathecal injection of morphine 15 μg once daily for 7 consecutive days.The effect of Paeoniflorin on morphine antinociceptive tolerance was explored by MPE TFL and MPE MWT.Immunohistochemistry assay was applied to detect the expression of IBA-1.Western blot was used to evaluate the change of spinal CCL2 expression.Results After 7 d of repeated intrathecal injection of morphine,the expressions of IBA-1 and CCL2 in MOR group were significantly up-regulated as compared with NS group(P<0.05),While the expressions of IBA-1 and CCL2 in MOR+PF group were significantly down-regulated as compared with MOR group(P<0.05).On day 7 after intrathecal injection of morphine,%MPE TFL was significantly increased in MOR+PF group as compared with MOR group (TFL:19%±4% vs 41%±3%; MWT:18%±6% vs 42%±4%,P<0.05).Conclusion Paeoniflorin may attenuate chronic morphine antinociceptive tolerance through Inhibition of spinal CCL2 up-regulation.
Morphine antinociceptive tolerance;Paeoniflorin; chemokine (C-C motif) ligand 2;Spinal cord
全军医学科技“十二五”科研课题(CWS11J006)
1007-4287(2016)11-1822-06
R614
A
2016-04-17)
*通讯作者
