卵巢癌抗原冲击DC在体外对SKOV3细胞作用的研究
2016-12-12盛敏佳薛丽娟王立岩郝筱诗刘玉萍
盛敏佳,薛丽娟,王立岩*,郝筱诗,刘玉萍
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林大学第一临床医院)
*通讯作者
卵巢癌抗原冲击DC在体外对SKOV3细胞作用的研究
盛敏佳1,薛丽娟2,王立岩1*,郝筱诗1,刘玉萍1
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林大学第一临床医院)
目的 探讨卵巢癌患者外周血和腹水中培养的树突细胞(DC)在体外激活淋巴细胞产生的肿瘤特异性细胞毒T淋巴细胞(CTL)作用,及其对卵巢癌SKOV3细胞的杀伤作用。方法 分别培养卵巢癌患者外周血及腹水来源DC,进行细胞形态学观察及细胞表面分子表达检测;以卵巢癌冻融抗原致敏DC,检测两种来源DC刺激T淋巴细胞增殖的能力及对IL-2水平的影响;检测抗原负载DC与T细胞诱导CTL对卵巢癌细胞的杀伤作用。结果 镜下显示卵巢癌患者外周血及腹水来源的DC形态学无明显差异,腹水来源DC成熟时间较外周血来源DC晚,二者表面分子表达的阳性率除CD83外无明显差异;卵巢癌冻融抗原负载DC上调其表面相关分化抗原表达,统计学差异具有显著性(P<0.05);经卵巢癌冻融抗原负载后的DC刺激T淋巴细胞的增殖,差异有显著性(P<0.05),但两种来源DC间刺激指数无统计学差异;抗原负载DC与无抗原负载DC相比,其上清中IL-12浓度增高,差异具有显著性(P<0.05);负载与不负载抗原的DC对卵巢癌细胞杀伤作用增强,与对照组相比具有显著性差异(P<0.05),随着效应细胞数量的增高,杀伤作用增强,加入IL-2增强其杀伤作用,但外周血及腹水来源DC间相应情况下对卵巢癌细胞的杀伤作用无统计学差异(P<0.05)。结论 卵巢癌患者外周血及腹水来源的DC均具有诱导CTL作用,DC作为载体负载肿瘤抗原后可以激发T淋巴细胞形成CTL,在体外有效的杀伤卵巢癌SKOV3细胞。
卵巢癌;树突细胞;细胞毒T淋巴细胞;白细胞介素-2;杀伤作用
(ChinJLabDiagn,2016,20:1811)
卵巢癌是妇科恶性肿瘤患者死亡的首要原因之一,5年生存率较低,近年来生物治疗成为卵巢癌患者治疗的重要手段。树突状细胞(DC)在抗原提呈及激活淋巴细胞使其成为肿瘤特异性细胞毒T淋巴细胞(CTL)方面起着重要作用。目前研究证实,DC可由外周血单核细胞及腹水中的单核细胞等多种细胞诱导而来[1-3]。本研究分别从卵巢癌患者外周血和腹水中培养DC,观察体外激活淋巴细胞产生CTL及CTL在体外对卵巢癌SKOV3细胞的杀伤作用,同时对比加入IL-2后对卵巢癌细胞杀伤作用,为卵巢癌的生物治疗研究提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 人白细胞成分血 健康人抗凝静脉血制备的浓缩白细胞成分血标本来自长春市中心血站健康献血者共10份,每份50 ml,年龄20-45岁,均在献血后2 h行外周血单核细胞分离。
1.1.2 卵巢癌患者腹水及血液标本 6份晚期卵巢癌腹水2 000 ml取自吉林大学中日联谊医院的确诊的住院患者,在术前诊断性腹穿或术中无菌收集,采集前均未进行放化疗,离心后分离单核细胞。同时采50 ml外周抗凝静脉血,用于分离淋巴细胞。
1.1.3 其他试剂 IMDM,RPMI-1640培养基(美国Gibco提供);rhIL-1,rhIL-4, rhIL-2(北京军科院四所);rhGM-CSF(长春金赛药业);TNF-a(美国Coring);无关系细胞(COS,苏州医学院免疫室提供);人卵巢浆液性囊腺癌细胞株SKOV3(上海细胞研究所);淋巴细胞分离液(上海生化二厂生产);FITC标记的鼠抗人CD1a,DC83,IgG1单克隆抗体,PE标记的鼠抗人CD86,CD80单克隆抗体及APC标记的HLA-DR单克隆抗体(深圳晶美公司提供);MTT及DMSO (Sigma 公司);IL-12ELISA检测试剂盒购自R&D公司。
1.1.4 仪器设备 低温冰箱(日本日立公司);CO2细胞培养箱(日本平泽公司);高速离心机(北京医用离心机厂);流式细胞仪(美国 Coulter 公司ELITE-Ⅱ型号);倒置显微镜(日本Olympus公司);酶标仪(美国索林公司ELX800型号);电子天平(日本岛津公司)等。
1.2 实验方法
1.2.1 DC 的体外诱导
①人外周血单核细胞(PBMC)的分离 取健康人抗凝静脉血制备浓缩白细胞,离心1 000 r·min-1,5 min后去除血浆,用pH7.2的D-Hank’s液稀释1倍后混匀;按1∶2加入淋巴细胞分层液(Ficoll)2 000 r·min-1离心20 min;吸取单个核细胞层至离心管中,加入约5倍体积的pH7.2的含1%FCS的D-Hank’s液,混匀,1 500 r·min-1离心1 000 r·min-1,8 min,弃上清;重复后加入1%FCS-D-Hank’s 液混匀。台酚蓝记数细胞,用无血清-IMDM 重悬细胞。
②外周血DC[DC(P)]的体外培养 调整上述重悬细胞浓度为2×106/ml,加入24孔板,置于37℃,5%CO2培养箱中培养2 h;收集悬浮细胞备用;以无血清IMDM 清洗培养板两次;加入10%FCS-IMDM完全培养基,培养箱中过夜;去掉无血清IMDM,加入10%FCS-IMDM,GM-CSF 200 ng/ml,IL-450 ng/ml,3天后进行半量换液,加入带有细胞因子的培养基,培养5天后收集未成熟DC,3天半量换液一次;自第7天开始换成带有 rhTNF-α10 ng/ml、rhGM-CSF 200 ng·ml-1的培养基,3天半量换液,第11-14天收获成熟的DC(mDC)。
③卵巢癌患者腹水来源的DC(A)的培养 取卵巢癌患者腹水2 000 ml以2 000 r/min离心10 min后弃上清,Hanks液重悬细胞,置于Ficoll溶液上,2 000 r/min,离心15分钟,吸取单核细胞层,培养基重悬细胞后计数,置于24孔培养板中,37℃5%CO2培养箱培养24 h,收集贴壁细胞,获得了腹水中的单核细胞。腹水中DC的培养同血中DC的培养过程。
④分离卵巢癌患者外周血T淋巴细胞 取卵巢癌患者抗凝静脉血50 ml(20 U/ml 肝素抗凝),Hanks适量稀释,按1∶2加入淋巴细胞分层液(Ficoll)稀释血液2 000 rpm,离心20 min,吸取界面灰白单核细胞层T细胞,以2%胎牛血清的PBS液悬浮细胞,离心1 000 rpm,5 min,洗涤2次,获得富集纯化的自体T淋巴细胞备用。
1.2.2 DC 形态学观察
用倒置显微镜每日观察细胞的大小、形态及生长状况;用PE-CD83、FITC-HLA-DR、CD80、CD86、CD1a处理DCs,,观察成熟DCs表面表达的荧光强度。
1.2.3 流式细胞术(FCM)检测树突细胞表型 取培养5-7 d未成熟DC(iDC)和11-14dmDC,0.02%EDTA,37℃消化30 min,收集细胞并制备成浓度4×105/ml的细胞悬液;用PBS洗涤细胞2次;稀释为200 μl,加入荧光标记的5 μl FITC标记的鼠抗人CD1a,DC83,IgG1单克隆抗体,PE标记的鼠抗人CD86,CD80单克隆抗体及APC标记的HLA-DR单克隆抗体,4℃孵育30 min; PBS洗涤细胞,1 200 r·min-1离心5 min,弃上清液;加入0.5 ml pH7.4 PBS后重悬细胞。
1.2.4 SKOV3卵巢癌冻融抗原的制备 取对数生长期SKOV3细胞,调整密度为2×107/ml,置于液氮中10 min,迅速放入100℃水浴,反复冻融3次。600 g离心20 min,收集上清,13 000 g离心1 h。经微孔滤膜过滤后作为可溶性卵巢癌冻融抗原,-20℃保存备用。
1.2.5 致敏DC 分别取培养6天的DC(P)及DC(A)(1×105/ml), 每孔加入肿瘤细胞抗原冻融液0.1 ml,DC与抗原比例为1∶5,置于37℃,5%CO2培养箱中继续培养2 d。
1.2.6 同种异体混合淋巴细胞反应(MLR) MLR反应分为4组,第1组按上述常规方法培养6 d的DC,第2组为DC+T淋巴细胞,第3组为在培养至第6天时加入经SKOV3卵巢癌冻融抗原致敏的DC+T淋巴细胞,第4组为在培养至第6天时加入经SKOV3卵巢癌冻融抗原致敏的DC+IL-2+T淋巴细胞。在经紫外线处理后的96孔板中,分别加入1×104,2×103,1×103/L的树突状细胞悬液,以自身T淋巴细胞作为对照,每孔设 3 个复孔,分别加入T淋巴细胞1×105/孔,配成树突状细胞∶T细胞分别为1∶10,1∶50,1∶100 的比例,终体积为 200 μl,CO2培养箱中孵育90 h后,MTT法在酶标仪上测570 nm波长的OD值。计算刺激指数(SI)=实验孔OD平均值/对照孔OD平均值。
1.2.7 IL-12检测 收集DC上清,ELISA法定量检测IL-12含量,具体步骤按试剂盒说明书进行。
1.2.8 抗原负载DC激活CTL的细胞毒作用
①靶细胞制备 复苏SKOV3卵巢癌细胞株,用 IMDM 培养基清洗细胞,1 000 r·min-1,离心5 min;将肿瘤细胞以1×106/ml 浓度接种于含10%FCS-IMDM 培养基的培养瓶中培养,每2-3 d 换液一次;收集对数生长期的细胞,用 PBS 洗涤细胞,1 000 r·min-1离心5 min,计数细胞,用10%FCS-IMDM培养基重悬细胞;调整细胞密度为104/ml,接种于 96 孔板,每孔200 μl 培养基培养过夜。
②DC致敏抗原特异性CTL的活性检测 将致敏DCs与T细胞按1∶10的比例,加入/不加入IL-2(40 U·ml-1)共孵育为效应细胞,调整细胞密度为2×105/ml,加入SKOV3靶细胞密度为104/ml,使效靶比为20∶1,37℃,5%CO2培养箱中培养 2天;分组:实验组1:SKOV3细胞冻融抗原负载 DC(P) 诱导 CTL 杀伤SKOV3细胞组;实验组2:SKOV3细胞冻融抗原负载 DC(P) 诱导 CTL +IL-2杀伤SKOV3细胞组;实验组3:SKOV3细胞冻融抗原负载 DC(A) 诱导 CTL杀伤SKOV3细胞组;实验组4:SKOV3细胞冻融抗原负载 DC(A) 诱导 CTL +IL-2杀伤SKOV3细胞组;实验组5:SKOV3细胞冻融抗原负载 DC(P) 诱导 CTL杀伤COS细胞组;实验组6:SKOV3细胞冻融抗原负载 DC(A) 诱导 CTL杀伤COS细胞组;阴性对照组:未负载冻融抗原DC诱导CTL杀伤SKOV3细胞组;空白对照组:SKOV3肿瘤细胞组。
③检测前4 h,每孔加入MTT 20 μl,培养4 h后,1 000 r·min-1离心5 min,弃上清,每孔加入DMSO 100 μl,室温振荡10 min,酶标仪 490 nm 处测各孔光密度(OD)值,计算杀伤率。杀伤率(%)=[1-(实验孔 OD-阴性对照孔 OD)/对照 OD]×100%。
1.2.9 统计学处理 实验数据应用 SPSS13.0 统计软件处理,应用t检验、方差分析,P<0.05 为有显著差异性,有统计学意义。
2 结果
2.1 DC形态学观察
2.1.1 体外诱导DC形态观察 外周血单个核细胞粘附培养2 h后,分离出圆形贴壁细胞,主要为单核细胞。过夜培养后有部分细胞悬浮,多为残留的B细胞、T细胞及外周血树突状细胞,将悬浮细胞去除,获得较纯的单核细胞;加入GM-CSF、IL-4 培养72 h,呈半悬浮状态的细胞开始增多,但细胞表面未见明显突起;培养3天后细胞表面伸出毛刺样突起,细胞数目增多,体积增大;培养7天后,细胞贴壁生长,分布较均匀,大小为成熟单核细胞的1-1.5倍,可见典型的树突状突起(图1)。外周血来源的DC(P),体外培养5-6天表现为悬浮丛状生长,体积增大,表现为树突状外形,腹水来源的DC(A)较外周血来源的DC晚1-2天,但显微镜下未见明显差别。如图1、2。
2.1.2 抗原负载DC形态观察 与未负载抗原组DC相比,细胞多为悬浮生长,呈圆形、细胞突起变少。(图2)
2.1.3 与T细胞共培养DC形态观察 加入淋巴细胞共培养2-3天,细胞增大,细胞突起增多,淋巴细胞成簇状分布在DC周围生长。
图1 外周血来源的DC细胞 图2 腹水来源的DC细胞
2.1.4 荧光显微镜下所见成熟DCs表面表达 HLA-DR的荧光强度高,其次为CD80及CD86,其他均较弱,仅见到细胞轮廓。
2.2 FCM 检测DC细胞表型特点外周血来源DC[DC(P)]及腹腔水来源DC[DC(A)]经流式细胞计进行表型鉴定,7天和14天时两种来源DC表面分子表达的阳性率无明显差异(见图3),但CD83在第14天时的表达明显高于第7天,具有统计学意义。
结果显示抗原负载能增强表面分子的表达。培养7天时,与无抗原负载的DC相比,经卵巢癌冻融抗原负载后能上调各种DC相关分化抗原表达(见表1),统计学差异具有显著性(P<0.05)。
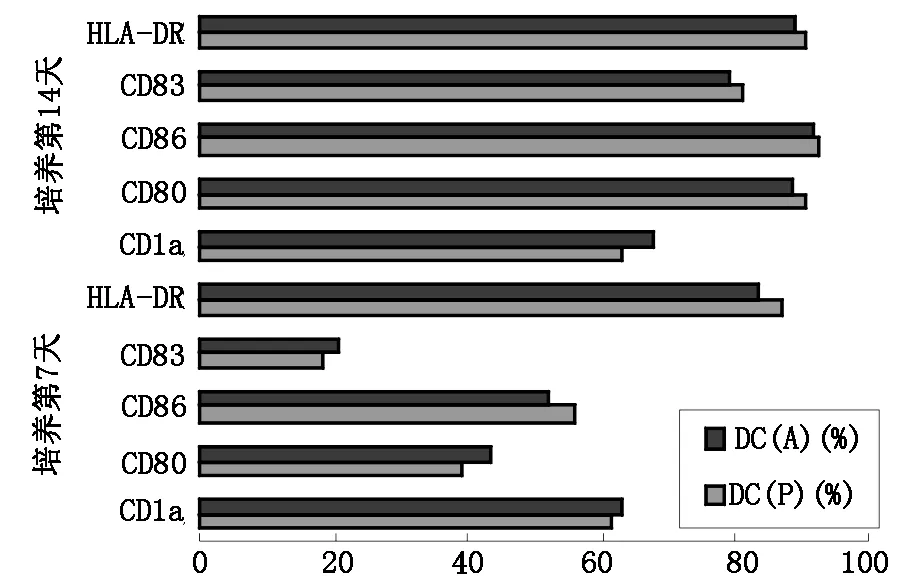
图3 DC细胞表面分子的表达
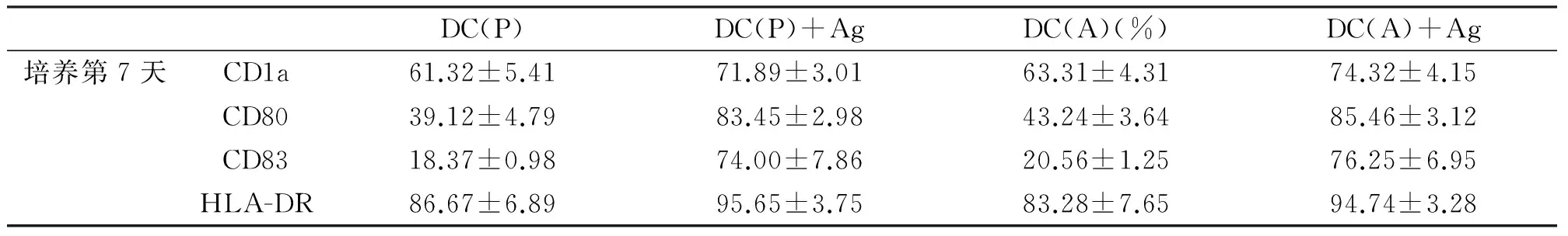
DC(P)DC(P)+AgDC(A)(%)DC(A)+Ag培养第7天CD1a61.32±5.4171.89±3.0163.31±4.3174.32±4.15CD8039.12±4.7983.45±2.9843.24±3.6485.46±3.12CD8318.37±0.9874.00±7.8620.56±1.2576.25±6.95HLA-DR86.67±6.8995.65±3.7583.28±7.6594.74±3.28
2.3 同种异体混合淋巴细胞反应(MLR) 在效靶比分别为1∶10、1∶50、1∶100的条件下,与无抗原负载的DC相比,经卵巢癌冻融抗原负载后的DC可强烈激发自身淋巴细胞的增殖,刺激指数SI分别是外周血来源DC(P):42.12±6.56 vs 17.98±4.72、22.87±5.67 vs 12.16±3.57、13.67±3.84 vs 6.27±3.52;腹水来源DC(A):39.72±5.16 vs 15.23±3.24、20.65±4.33 vs 10.76±2.98、11.87±2.58 vs 5.64±2.59,差异均有显著性(n=4,P<0.05)。不同来源DC间相应各比例的刺激指数无统计学意义。
2.4 IL-12检测 如图4所示,第7天加入卵巢抗原致敏DC与无抗原致敏DC相比,其上清中IL-12浓度明显增高,分别为77.125.89 pg/ml vs 20.553.44,经统计学处理,差异具有显著性(n=3,P=0.0001)。
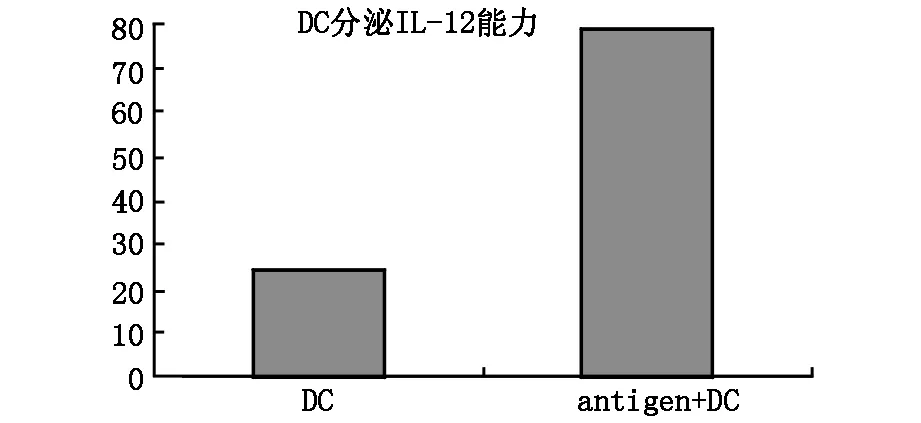
图4 DC细胞分泌IL-12水平
2.5 DC负载卵巢癌抗原激发T淋巴细胞特异性免疫杀伤作用如图5所示,经人卵巢癌细胞SKOV3冻融抗原负载DC激活的CTL在体外对SKOV3的杀伤能力增强,当CTL与SKOV3共培养24 h后SKOV3的死亡率与未经抗原负载DC诱导的CTL对SKOV3的杀伤率相比较,负载与不负载抗原的杀伤能力与对照组相比具有显著性差异(n=4,P=0.0001),但不同DC间相应情况下的杀伤能力无统计学意义(P>0.05)。
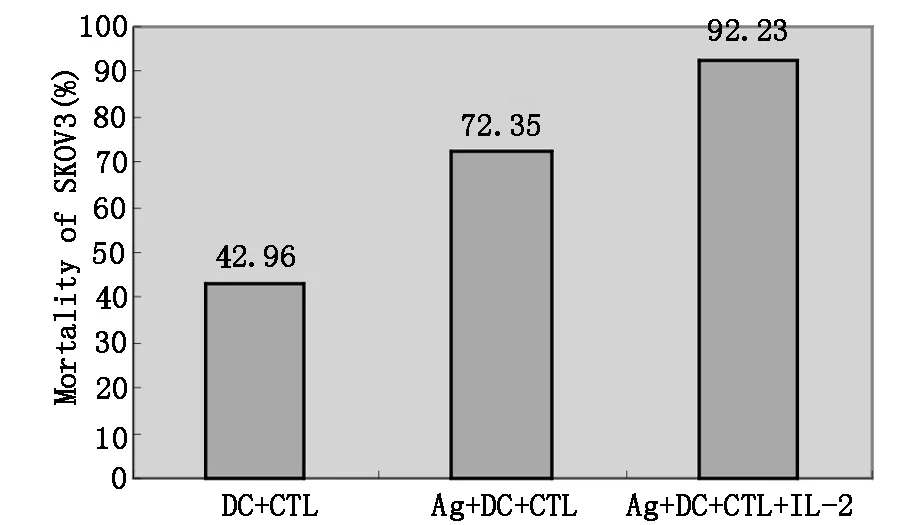
图5 DC负载卵巢癌细胞激发T淋巴细胞特异性细胞毒作用
两组来源的DC经卵巢细胞冻融癌抗原负载后诱导CTL细胞对卵巢癌细胞系SKOV3具有特异性杀伤作用,随着效应细胞数量的增高(50∶1,100∶1),负载卵巢癌抗原的DC能诱导出CTL细胞对卵巢癌细胞系SKOV3呈最强的细胞毒杀伤率(分别为DC(P):89.23±5.45%,81.51 ±4.67%与DC(A):86.47±6.12%,78.49±3.89%,两组比较差异无统计学意义,且两种来源的DC负载卵巢癌抗原后加入IL-2诱导出CTL细胞对卵巢癌细胞的杀伤作用更强(分别为DC(P):92.23±5.2%,89.21±6.1%与DC(A):90.14±6.25%,85.43±7.46%)。且与各自对照组比较有显著性差异(P<0.01),而两种DC间各组的杀伤作用无显著性性差别(P>0.05)。
3 讨论
卵巢上皮癌大部分患者发现即为晚期,5年生存率低。近年来随着大量肿瘤抗原的发现,以肿瘤疫苗为基础的主动免疫治疗和T淋巴细胞介导的抗肿瘤细胞免疫应答已成为抗肿瘤治疗新的热点。树突状细胞(DC)是功能最强的专职性抗原递呈细胞APC。大量的研究表明,通过不同形式的肿瘤抗原致敏的DC体内注射后可诱导出特异性的抗肿瘤免疫应答,证明DC免疫疗法具有的抗肿瘤治疗效果。本研究从卵巢癌腹水中提取单核细胞作为DC的来源,并与外周血单核细胞来源的DC比较,结果显示:两种来源的DC在外形特征上未见差别,且两种来源DC表面免疫分子表型(DC1a,DC80,DC86)表达的阳性率无明显差异。但腹水来源的DC比外周血来源的DC晚成熟1-2天,推测腹水中的单核细胞所处的环境中免疫抑制因子多于外周血中的因子种类及含量,导致腹水中的单核细胞对GM-CSF及IL-4反应迟缓,但在比较DC刺激淋巴细胞功能时,两组不同来源的DC没有差别。故认为腹水来源的DC虽然发育较慢,但在体外培养12天后仍具有成熟DC递呈抗原及刺激淋巴细胞的功能。
DC依赖于独特的抗原递呈功能及免疫佐剂功能诱导高效而特异的抗肿瘤免疫,而DC前体及成熟DC各具特点。DC前体即未成熟DC识别、摄取、加工处理抗原的能力强,刺激幼稚T细胞的能力弱,而成熟DC的功能则与其相反。本研究在DC未成熟阶段与肿瘤抗原共同培养,保证肿瘤抗原的有效摄取、加工。而DC成熟后吞噬肿瘤抗原, DC高表达共刺激分子及其他黏附分子,可提呈抗原并诱导T细胞增殖为抗原特异性的CTL,诱导出高效而特异的抗肿瘤免疫[4,5]。
DC作为载体负载肿瘤抗原后可以激发机体有效的抗肿瘤免疫反应,同时亦可在体外激发T淋巴细胞形成CTL细胞,有效的杀伤肿瘤细胞。肿瘤相关抗原不易得到,目前多用肿瘤细胞裂解产物、肿瘤抗原多肽、合成的MHC-1限制性多肽等负载DC及通过遗传工程传导肿瘤相关抗原或细胞因子的DC[6-8]。但上述方法存在着抗原提呈效果不佳及技术上的困难等缺点。应用卵巢癌细胞反复冻融后的溶解物冲击DC,即可诱导出已知和未确定的肿瘤相关抗原,引起特异性抗肿瘤免疫反应[9]。Li[10]等研究显示,卵巢癌患者外周血起源的DC在其自身热休克蛋白反复刺激下,能明显的诱导T淋巴细胞的增殖和毒性。肿瘤细胞提取物负载的DC疫苗可以明显诱导机体产生保护性的免疫反应,并具有操作简便、递呈抗原效率高等优点。本研究使用冻融细胞的方法使两种来源的DC负载卵巢癌抗原,成功诱导出具有抗肿瘤特性的CTL,且腹水来源的DC和外周血来源的DC两组比较差异无显著性。本研究证实从卵巢癌腹水中分离单核细胞培养大量DC,为卵巢癌DC基础免疫治疗提供了新的细胞来源,为其临床应用奠定了基础,避免了体外对同一病人DC进行反复操作[11,12]。
国外最新研究证实来源于腹水中单核细胞的不成熟DC可诱导卵巢癌细胞凋亡,且该来源的DC与自身的卵巢癌细胞共同培养能够诱导CTLs的增殖反应[13]。Chu[3]等人研究证实,从卵巢癌腹水中的巨噬细胞来源的DC(TAMS,可获得成熟的和不成熟DC)与外周血单核细胞来的DC的表型及功能进行比较,两种DCs在同种异体杂交的淋巴细胞反映中,有同样的激活T淋巴细胞增殖的作用,而且呈递肿瘤抗原的TAM来源的DCs通过肿瘤特异性T细胞系能激活γ-IFN,杀伤肿瘤细胞。卵巢癌患者TAMs可生成大量的DCs。因此,TAMs可用于外源性或内源性DC免疫治疗,特别是常规外周血单核细胞DCs来源耗竭的患者,与本研究结果及观点一致。
IL-2具有较强的免疫调节、提高抗原对免疫系统的激活作用,具有正负反馈现象,即使少量的IL-2可引发强烈的免疫反应。本研究将IL-2加入到两种来源的DC培养液中,可在肿瘤细胞局部产生较高浓度的细胞因子,并可维持较长时间,结果显示IL-2具有显著的激活特异性CTLs活性,两组比较差异无显著性。IL-12是各种抗原提呈细胞产生的细胞因子,他们在抗癌免疫系统中起着非常重要的作用[14]。Kim[15]等用叶酸蛋白的191-199肽段E39刺激DC,在细胞因子IL-2和IL-15的作用下将致敏的DC两种细胞与卵巢癌患者的淋巴细胞在体外共同培养,能引起肿瘤特异性的CTL介导的抗瘤反应。两种来源DC经卵巢癌抗原负载后培养液上清中IL-12的含量均增加,且与各自对照组比较有显著性差异(P<0.05)。说明肿瘤抗原能增强白细胞介素12的分泌从而刺激DC的免疫力。国内蓝春燕[16]等的研究表明,卵巢癌外周血来源的DC刺激同种异体淋巴细胞增殖能力较健康妇女组低,提示卵巢癌患者来源的DC存在某种程度的免疫功能异常,影响抗原的递呈作用,从而影响其抗肿瘤免疫应答。
综上,DC疫苗在常规疗法消除绝大部分肿瘤负荷后,作为一种辅助治疗手段,能够消灭残余肿瘤细胞,增强机体抗肿瘤免疫反应,抑制肿瘤生长,防止肿瘤复发转移,诱导T细胞免疫反应能够杀灭残余的肿瘤细胞等方面,有望成为难治性和常规治疗后有残留病灶的一种有效治疗方法。DC在卵巢癌免疫治疗的实验和临床应用研究中显示了美好的前景。
[1]Syme R,Bajwa R,Robertson L,et al.Comparison of CD34 and monocyte-derived dendritic cells from mobilized peripheral bloodfrom cancer patients[J].Stem Cells,2005,23(1):74.
[2]Zou GM1,Tam YK.Cytokines in the generation and maturation of dendritic cells:recent advances[J].Eur Cytokine Netw,2002,13(2):186.
[3]Chu CS,Woo EY,Toll AJ,et al.Tumor associated macrophages as a source of functional dendritic cells in ovarian cancer patients[J].Clin Immunol,2002,102:291.
[4]Adams S,O'Neill DW,Bhardwaj N.Recent advances in dendritic cell biology[J].J Clin Immunol,2005 Mar,25(2):87.
[5]Zamarin D,Wolchok JD.Potentiation of immunomodulatory antibody therapy with oncolytic viruses for treatment of cancer[J].Mol Ther Oncolytics,2014,1:14004.
[6]Ojima T,Iwahashi M,Nakamura M,et al.The boosting effect of co-transduction with cytokine genes on cancer vaccine therapy using genetically modified dendritic cells expressing tumor-associated antigen[J].Int J Oncol,2006,28(4):947.
[7]Bloy N,Pol J,Aranda F,et al.Trial watch:Dendritic cell-based anticancer therapy[J].Oncoimmunology,2014,3(11):e963424.
[8]KleinC,Bueler,Mulligan R,Comparative analysis of genetically modified dendritic cells and tumor cells as therapeutic cancer vaccines[J].J Exp Med,2000,191(10):1699.
[9]Brossart P,Wirths S,Brugger W,et al.Dendritic cells in cancer vaccines[J].Exp Hematol,2001,29(11):1247.
[10]Li G,Zeng Y,Chen X,et al.Human ovarian tumour derived chaper one rich cell lysate elicitsT cell responses in vitro[J].Clin Exp Immunol,2007,148(1):136.
[11]Silveira GF,Wowk PF,Machado AM,et al.Immature dendritic cells generated from cryopreserved human onocytes show impaired ability to respond to LPS and to induce allogeneic lymphocyte proliferation[J].PLoS One,2013,8(7):e71291.doi:10.1371
[12]Lewalle P,RouasR,Lehmann F,et al.Freezing of dendritic cells,generated from cryopreserved leukaphereses,does not influence their ability to induce antigen-specific immune responses or functionally react to maturation stimli[J].Immunol Methods,2002,240:69.
[13]Krempski J,Karyampudi L,Behrens MD,et al.Tumor-infiltrating programmed death receptor-1+ dendritic cells mediate immune suppression inovarian cancer[J].J Immunol,2011,186(12):6905.
[14]Zhu EF,Gai SA,Opel CF,et al.Synergistic innate and adaptive immune response to combination immunotherapy with anti-tumor antigen antibodies and extended serum half-life IL-2[J].Cancer Cell,2015,27(4):489.
[15]Kim DK,Kim JH,Kim YT,et al.The comparison of cytotoxic T-lymphocyte effects of dendritic cells stimulated by the folate binding protein peptide with IL-15and IL-2in solid tumor[J].Yonsei Medical Journal,2003,43(6):691.
[16]蓝春燕,刘继红,夏建川,等.卵巢癌患者外周血来源树突状细胞的生物学特征[J].癌症,2009,28(2):161.
The effect of ovarian cancer antigen impacted DC on SKOV3 in vitro
SHENGMin-jia1,XUELi-juan2,WANGLi-yan1*,etal.
(1.ChinaJapanUnionHospitalofJilinUniversity,Changchun130033,China;2.TheFirstHospitalofJilinUniversity)
Objective To study the effect of tumor specific cytotoxic T lymphocyte (CTL) produced by the activation of lymphocytes from the peripheral blood and ascites of dendritic cells (DC) in ovarian cancer patients in vitro,and its killing role on ovarian cancer cell SKOV3.Methods Cultured DC from blood and ovarian cancer ascites,observed the cell morphology and detected the cell surface molecules expression;DC was pulsed by freeze-thaw ovarian cancer antigen,to detect T lymphocyte proliferation and IL-2 levels stimulated by two sources of DC;To detect killing roll of antigen load DC and T cells induce CTL for ovarian cancer cells.Results Microscopic display of peripheral blood and ascites derived DC morphology has no significant difference,maturation time of ascites source DC is later than peripheral blood DC;The positive rate of surface molecules expression has no significant difference except CD83;ovarian cancer lysates DC raised its surface associated antigen expression,the difference was statistically significant (P<0.05);The proliferation of T lymphocytes stimulated by ovarian cancer cell lysates DC was high,the difference was significant (P<0.05),but two sources of DC stimulation index has no significant difference;compared DC with antigen loaded,the DC without antigen loaded has supernatant IL-12 concentration increased,the difference was significant (P<0.05);Without loaded DC and with loaded DC antigen ovarian cancer killing effect enhanced as compared with the control group with significant difference (P<0.05);with the increasing number of cells,the killing effect after added IL-2 was enhanced,but the peripheral blood DC sources and ascites has no significant difference (P<0.05).Conclusion The DC from peripheral blood and ascites of ovarian cancer patients have the effect of inducing CTL.DC loaded tumor antigen as a carrier can stimulate T lymphocytes formed CTL,that has anti-ovarian cancer cell SKOV3 effect in vitro.
ovarian cancer;dendritic cells;cytotoxic T lymphocytes;interleukin-2;killing effect
1007-4287(2016)11-1811-06
R737.31
A
2016-02-15)
