螺旋藻藻蓝蛋白亚基的提取和免疫活性研究
2016-12-12赵小霞邱丽君宣成睿孙鹏周杨周玥杨丽敏
赵小霞,邱丽君,宣成睿,孙鹏,周杨,周玥,杨丽敏,
螺旋藻藻蓝蛋白亚基的提取和免疫活性研究
赵小霞1,邱丽君1,宣成睿2,孙鹏2,周杨3,周玥3,杨丽敏2,3
目的:探讨螺旋藻藻蓝蛋白亚基的提取和免疫活性。方法:低温破壁,离心获取上清,经粗纤维膜过滤后,采用SephadexG-50凝胶过滤提取藻蓝蛋白亚基,SDS-PAGE检测蛋白纯度和分子量,经红外光谱技术和紫外/可见光分光光度计扫描图谱,检测其在波长620 nm和280 nm处的吸光度,进一步观察提取物对小鼠脾脏淋巴细胞的作用。结果:低温水提和凝胶过滤层析提取1号和2号提取物,分别为墨绿色和蓝色水溶性室温储存性状稳定的干粉。1号和2号提取物SDS-PAGE检测均见一条分子量约17 kDa的蛋白条带。红外光谱技术扫描图谱可见在1600~1800 cm-1的波长范围,螺旋藻原粉在1656 cm-1处可见1个吸收峰,1号提取物在1655 cm-1、1633 cm-1、1594 cm-1处可见3个吸收峰,2号提取物在1631 cm-1和1602 cm-1处可见2个吸收峰,残渣在1658 cm-1处可见1个吸收峰。紫外/可见光分光光度计检测1号提取物在232.0 nm和617.0 nm波长处有吸收峰,2号提取物在263.5 nm和619.5 nm波长处有吸收峰,1号提取物纯度A620/A280为0.78,得率15%,2号提取物纯度A620/ A280为0.85,得率20%。提取物能够促进小鼠脾脏淋巴细胞增殖。结论:低温提取藻蓝蛋白亚基且具有增强免疫活性。
低温提取;藻蓝蛋白亚基;免疫活性
螺旋藻是一种丝状多细胞螺旋形原核藻类生物,含有丰富的蛋白质、脂肪、维生素、矿物质、叶绿素、B-胡萝卜素及多糖类物质,是人类理想的食物及药物资源。藻蓝蛋白是螺旋藻中的重要活性物质,其中藻蓝蛋白作为天然捕光色素蛋白仅存在于蓝藻等少数藻类中,是一种少见的天然蓝色素,具有提高机体免疫力[1-2]、抗氧化[3]、抗炎症和抑菌[4]、抗癌[5]、预防糖尿病[6]、清除自由基等生理活性,可制成生化药品,而且可作为天然色素和营养蛋白用于食品和化妆品行业,利用藻蓝蛋白具有强烈荧光的特点,还可将其制备成荧光探针,用于临床检验。藻蓝蛋白由α和β两种亚基组成,天然状态下以(αβ)3或(αβ)6等杂聚体形式存在。研究发现亚基分子量小,细胞渗透性好,具有良好的抗肿瘤活性[7]。
藻蓝蛋白的提取方法包括离子交换色谱法、凝胶过滤层析、硫酸铵梯度盐析、羟基磷灰石、利凡诺沉淀法、膨化床吸附法等方法[8-10],不同的提取方法对藻蓝蛋白的规模化生产、总得率、纯度、蛋白活性等均有影响。在藻蓝蛋白提取的基础上进一步采用SepharoseG 75FF层析或SephadexG-75凝胶柱等处理获取,进而通过β亚基自然降减的方式获取α亚基[11-12]。本研究拟采用低温破壁,离心获取上清,凝胶过滤层析,提取藻蓝蛋白α和β亚基的粗提物,并进一步探讨其是否有活性,旨在为藻蓝蛋白的高价值资源化利用提供新途径。
1 材料与方法
1.1材料
1.1.1试剂螺旋藻粉购于福建福清市新大泽螺旋藻有限公司;胰酶、Acrylamide、Tris-Cl、TEMED、Con A、MTT购于Sigma公司;APS、SDS、溴酚兰、β-巯基乙醇、甘油购于上海生工;SephadexG-50购于Amersham公司。
1.1.2仪器GZX-9070MBE电热恒温鼓风干燥箱购于上海博讯;LGJ-18冷冻干燥机购于北京松原兴华;DZG-303A离子纯水机购于美国摩尔;YDL5M离心机购于湘仪离心机厂;TU-1901紫外/可见分光光度计购于北京普析通用有限责任公司;电泳仪和电泳槽购于北京六一公司;酶标仪购于美国thermo公司。
1.2方法
1.2.1藻蓝蛋白亚基的提取和纯化蒸馏水溶解螺旋藻粉1 kg,放置于-30~-35℃的冰箱中过夜,自然解冻后破碎离心,10 000 r/min,10 min,分离上清液,留取上清,去掉沉渣,经粗纤维膜过滤后,采用SephadexG-50凝胶过滤提取藻蓝蛋白亚基,进而通过冷冻干燥得到干粉。
1.2.2光谱特征测定将提取物在清华大学分析中心采用红外光谱技术进行成分测定,紫外/可见分光光度计对提取物进行扫描。
1.2.3SDS-PAGESDS-聚丙烯酰胺凝胶电泳(SDS-10%PAGE)配制12%分离胶和4%浓缩胶,加样,样品中加入等体积的2×Loading buffer,100℃煮沸5 min变性,10 000 r/min,4℃离心1 min,用加样器吸取各管中的全部上清液加入上样孔中,恒压130 V进行电泳,溴酚蓝指示直至电泳至凝胶的底部。将凝胶取出用考马斯亮蓝R-250染色30 min,然后摇床脱色至条带清晰,拍照。
1.2.4纯度和得率分析紫外/可见分光光度计测定样品溶液在620 nm和280 nm处的吸光度,根据下式计算藻蓝蛋白亚基的纯度:
螺旋藻提取物纯度=A620/A280
螺旋藻提取物得率=藻蓝蛋白冻干粉质量/螺旋藻原料质量×100%
式中:A280和A620分别为波长280 nm和620 nm处的吸光度。
1.2.5提取物对小鼠脾脏单个核细胞的作用脱颈椎处死小鼠,无菌取脾,200目钢网研磨制成脾细胞悬液,70%Percoll分离单个核细胞,2000 r/min,20 min,吸取灰白层细胞,IMDM洗二次,0.04%台酚兰染色计数,细胞存活率>90%,调细胞浓度5×106/mL备用。分别设阴性对照组、Con A阳性对照组、1号提取物、2号提取物实验组,阴性对照组不加任何刺激物,阳性对照组由5 μg/mL Con A刺激,提取物配置后滤过除菌,实验组分别由0.5 μg/mL、1 μg/mL、2 μg/ mL提取物刺激,96孔板培养,三复孔,每孔脾细胞5×105个,总体系200 μL,培养至44 h,掺入MTT,每孔10 μL,4 h后酶标仪测定570 nm A值,结果用刺激指数SI表示,刺激指数SI=实验孔A值/对照孔A值。
2 结果
2.1藻蓝蛋白亚基提取物的性状和分子量采用低温提取和凝胶过滤层析的方法从螺旋藻粉中提取蛋白,共获得2部分提取物,分别称为1号提取物,2号提取物。结果见图1,分别为螺旋藻原粉(A)、1号提取物(B)、2号提取物(C)、提取后的残渣(D),颜色依次为深墨绿色、墨绿色、蓝色、黑色,常规室温储存。SDS-PAGE结果见图2,1号提取物和2号提取物均见一条分子量约17 kDa的蛋白条带。
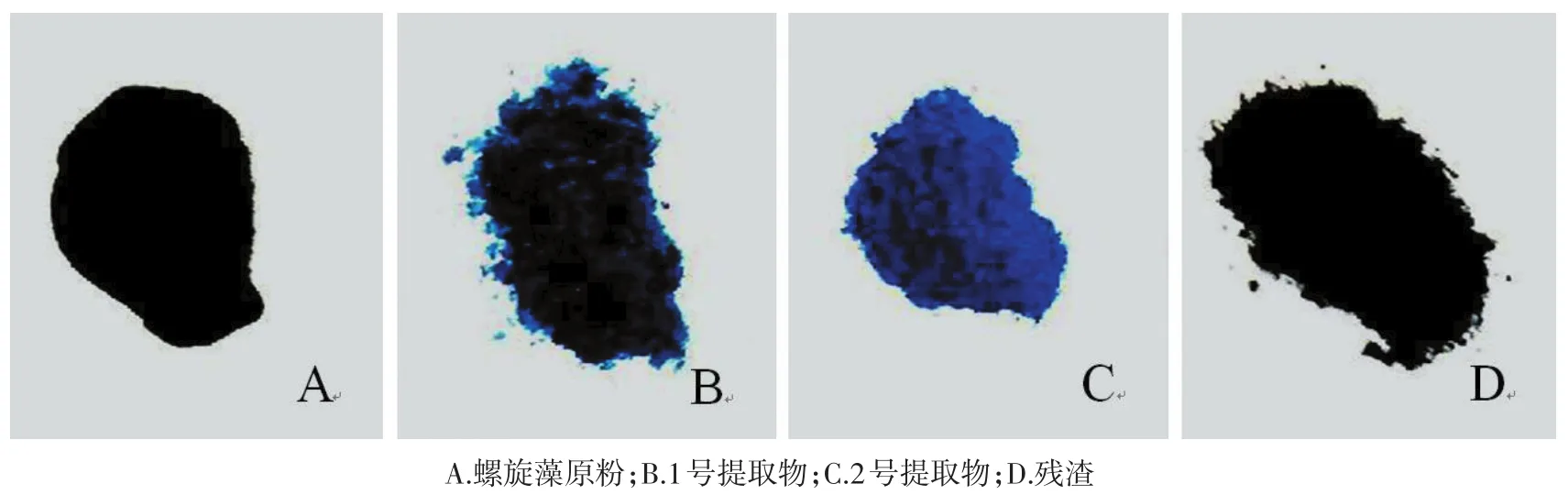
图1 螺旋藻提取物图片
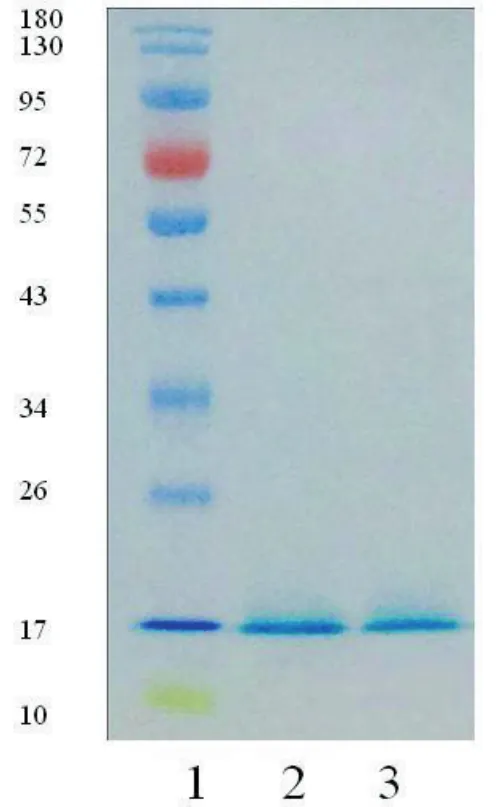
图2 螺旋藻提取物SDS-PAGE电泳扫描图
2.2螺旋藻提取物光谱扫描采用红外光谱技术扫描提取物图谱(图3),结果可见在1600~1800 cm-1的波长范围,螺旋藻原粉在1656 cm-1处可见1个吸收峰,1号提取物图谱在1655 cm-1、1633 cm-1、1594 cm-1处可见3个吸收峰,2号提取物图谱在1631和1602 cm-1处可见2个吸收峰,残渣图谱在1658 cm-1处可见1个吸收峰。分别取上述2种提取液,稀释到合适的倍数,采用紫外/可见分光光度计在200~800 nm波长范围内进行波长扫描,结果见图4,1号提取物在232.0 nm和617.0 nm波长处有吸收峰,2号提取物在263.5 nm和619.5 nm波长处有吸收峰,1号提取物纯度A620/A280为0.78,得率15%,2号提取物纯度A620/A280为0.85,得率20%。
2.3提取物诱导小鼠脾脏淋巴细胞增殖为检测提取的蛋白质是否具有活性,采用观察提取物对小鼠脾脏单个核细胞的作用。不同浓度提取物的刺激结果可见,阳性对照Con A组SI值为1.84±0.07,实验组各组小鼠脾脏单个核细胞增殖明显(P<0.05或P<0.01)。提示藻蓝蛋白亚基提取物具有促进小鼠脾脏淋巴细胞增殖的作用。见表1。
3 讨论
藻胆蛋白主要存在于蓝藻、红藻、隐藻和少数一些甲藻中,其主要功能是作为光合作用的捕光色素复合体。己知的藻胆蛋白主要可以分为四大类,即藻红蛋白、藻蓝蛋白、藻红蓝蛋白和别藻蓝蛋白。藻蓝蛋白是一种主要的藻胆蛋白,其提取主要包括破壁和细胞裂解、分离、纯化、干燥、产物的特性描述[7]。破壁的物理方法主要有超声法、负压空化法、渗透压冲击法、冻融法,化学方法主要使用酸、碱、洗涤剂、酶等。不同方法对螺旋藻细胞壁的破坏程度不同,藻蓝蛋白溶出量各异,研究报道超声波破壁技术处理物料破壁率高,目的物质提取效果好,且藻蓝蛋白提取率高[10],但是蛋白的提取工艺中,不仅要提取得率较高的蛋白,而且要保持蛋白的活性,文献报道,超声波是机械振动能量的传播,在这样激烈振动声场中,会导致生物体系的功能或结构发生改变。强超声波辐照生物体可发生超声空化效应,使生物体内局部温度升高至几千度,将会使蛋白结构受到改变和破坏。考虑蛋白得率和蛋白活性的保持,以及化学试剂的干扰,所以本研究采用冻融法低温提取蛋白质。蛋白提取物的进一步纯化目前有几种方法,离子交换色谱法、凝胶过滤层析、硫酸铵梯度盐析、羟基磷灰石、利凡诺沉淀法、膨化床吸附法等方法[8-10],采用硫酸铵盐析结合疏水层析技术分离纯化螺旋藻中的藻蓝蛋白,而高盐可能会导致蛋白的变性。羟基磷灰石分离,操作复杂且成本较高。采用利凡诺沉淀法和膨化床吸附法得到的藻蓝蛋白,总得率高,但纯度较低,仍需进一步纯化。Patil等[13]设计了一个简单而高效的操作方法,该方法包括两个步骤:双水相萃取和离子交换层析,但是在操作中也添加了化学试剂。本研究采用常用分离方法离心沉淀去渣,然后采用凝胶过滤层析方法分离不同分子量的蛋白质。红外光谱技术测定螺旋藻原粉、1号提取物、2号提取物、残渣的红外图谱对比可见,其在不同波长区间内存在不同程度的差异1600~1800 cm-1波长范围附近的吸收峰提示存在蛋白质,结果可见螺旋藻原粉与提取物吸收峰在此范围内可见差异,且提取物波数范围下的峰面积明显大于螺旋藻原粉,提示蛋白含量高。研究报道,藻蓝蛋白的α亚基和β亚基的分子量分别18.4 kDa和21.3 kDa[14],也有报道分子量分别15.4 kDa和17.3 kDa[10],也有报道为16 kDa和17 kDa[15],而本研究获得的1号提取物和2号提取物都仅有一条带,且分子量均约17 kDa,这与文献报道[15]的α亚基和β亚基的分子量分别16 kDa和17 kDa的大小相一致,但本研究1号提取物和2号提取物SDS-PAGE结果是分子量同样大小的一条条带,这与文献报道[15]的藻蓝蛋白有两个亚基,SDS-PAGE结果会有两条条带的结果不符,可能在本研究中分别提取了藻蓝蛋白的两个亚基。文献报道主要几种藻胆蛋白的吸收光谱是不同的,进一步采用紫外/可见光分光光度计扫描提取物的图谱发现1号提取物在617.0 nm波长处有最大吸收峰,2号提取物在619.5 nm波长处有最大吸收峰,这与文献报道的藻蓝蛋白在615 nm-620 nm波长处有最大吸收峰相一致[7,16],文献报道[17]可见区藻蓝蛋白的最大吸收峰为620 nm,而且在600 nm处还有一个明显的肩峰,α亚基最大吸收峰为624 nm,β亚基最大吸收峰为610 nm,吸收峰与蛋白的提取工艺、纯度、测试时溶液的PH值等都有关系,这一数值并非绝对的,而是一个波动范围,结果提示本研究1号提取物和2号提取物分别为藻蓝蛋白的两个亚基。藻蓝蛋白纯度是以A620/A280的吸收率来评定的,食品级的纯度是0.7,反应级是3.9,而高于4.0的就是分析级的。本研究中1号提取物纯度A620/ A280为0.78,得率15%,2号提取物纯度A620/A280为0.85,得率20%。,本研究提取了食品级的藻蓝蛋白亚基。进一步探讨其免疫活性发现提取物诱导小鼠脾脏淋巴细胞增殖。总之,本提取工艺采用低温水提和凝胶过滤层析的方法,未添加任何化学试剂,提取了藻蓝蛋白亚基,且提取物具有活性。本课题组将进一步纯化藻蓝蛋白亚基的提取物,并探讨1号提取物和2号提取物分别属于哪个亚基及其生物活性,为藻蓝蛋白亚基的提取及应用提供实验数据。

图3 螺旋藻提取物红外光扫描图谱

图4 螺旋藻提取物紫外/可见光扫描图谱
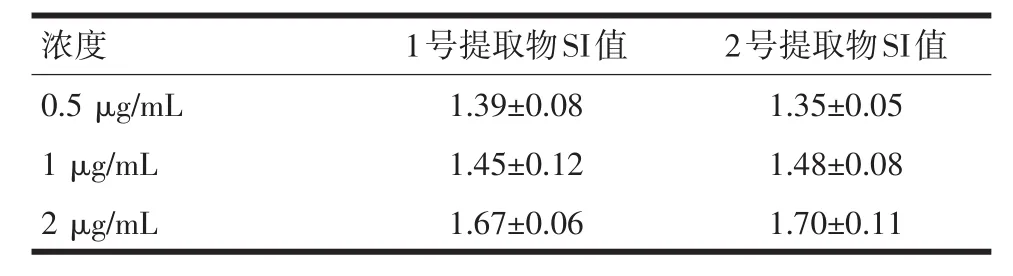
表1 螺旋藻亚基提取物对小鼠脾脏单个核细胞的作用
[1]Marín-Prida J,Pavón-Fuentes N,Llópiz-Arzuaga A,et al.Phyco⁃cyanobilin promotes PC12 cell survival and modulates immune and inflammatory genes and oxidative stress markers in acute cere⁃bral hypoperfusion in rats[J].Toxicol Appl Pharmacol,2013,272(1): 49-60.
[2]Chang CJ,Yang YH,Liang YC,et al.A novel phycobiliprotein al⁃leviates allergic airway inflammation by modulating immune re⁃sponses[J].Am J Respir Crit Care Med,2011,183(1):11-25.
[3]Zheng J,Inoguchi T,Sasaki S. Phycocyanin and phycocyanobilin from Spirulina platensis protect against diabetic nephropathy by in⁃hibiting oxidative stress[J].Am JPhysiol Inteqr Comp Physiol, 2013,304(2):110-120.
[4]Pak W,Takayama F,Mine M,et al.Anti-oxidative and anti-in⁃flammatory effects of Spirulina on rat model of non-alcoholic ste⁃atohepatitis[J].J Clin Biochem Nutr,2012,51(3):227.
[5]Ravi M,Tentu S,Baskar G,et al.Molecular mechanism of an⁃ti-cancer activity of phycocyanin in triple-negative breast cancer cells[J].BMC Cancer,2015,15(23):768-771.
[6]Ou Y,Lin L,Yang X,et al.Antidiabetic potential of phycocyanin: effects on KKAy mice[J].Pharm Biol,2013,51(5):539-544.
[7]Kuddus M,Singh P,Thomas G,et al.Recent Developments in Pro⁃duction and biotechnological applications of C-Phycocyanin[J]. Biomed Res Int,2013,8(26):1-9.
[8]Niu J F,Wang G C,Lin X,et al.Large-scale recovery of C-phyco⁃cyanin from Spirulina platensis using expanded bed adsorption chromatography[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,850(1-2):267-276.
[9]Minkova KM,Tchernov AA,Tchorbadjieva MI,et al.Purification of C-phycocyanin from Spirulina(Arthospira)fusiformis[J].J Bio⁃technol,2003,102(1):55-59.
[10]邵明飞,赵楠,李勇勇,等.一步柱层析纯化螺旋藻藻蓝蛋白[J].生物学杂志,2013,30(5):59-63.
[11]郭瑞勇,黄蓓,左漫漫,等.藻蓝蛋白亚基脂质体制备及其光动力学抗肿瘤作用实验[J].药学学报,2008,43(10):1060-1065.
[12]谭阳,黄蓓,任艳敏,等.藻蓝蛋白亚基细胞渗透性及对肿瘤细胞光敏作用的研究[J].激光生物学报,2007,16(6):684-688.
[13]Patil G,Chethana S,Sridevi AS,et al.Method to obtain C-phyco⁃cyanin of high purity[J].J Chromatogr A,2006,1127(1-2):76-81.
[14]Chen T,Wong YS,Zheng W.Purification and characterization of selenium-containing phycocyanin from selenium-enriched Spiruli⁃na platensis[J].Phytochemistry,2006,67(22):2424-2430.
[15]Kumar D,Dhar DW,Pabbi S,et al.Extraction and purification of C-phycocyanin from Spirulina platensis(CCC540)[J].Ind J Plant Physiol,2014,19(2):184-188.
[16]Lüder UH1,Knoetzel J,Wiencke C.Two forms of phycobilisomes in the Antarctic red macroalga Palmaria decipiens(Palmariales, Florideophyceae)[J].Physiol Plant,2001,112(4):572-581.
[17]张昕,郦剑勇,龚兴国.螺旋藻C-藻蓝蛋白亚基分离及抗肿瘤活性研究[J].浙江大学学报(理学版),2010,37(3):319-323.
(收稿:2016-02-06修回:2016-03-28)
(责任编辑刘洪斌)
Extract of Phycocyanin Subunits and Immunological Activity
ZHAO Xiao-Xia,QIU Li-Jun,XUAN Cheng-Rui,et al.Department of Clinical Laboratory,Tianjin Fourth Central Hospital,Tianjin(300140),China
ObjectiveTo explore the crude extract technology for phycocyanin subunits from spirulina and the immunological activity.MethodsSpirulina powder were wall-broken at low temperature,and phycocya⁃nin was extracted by thick fibrous membrane from the centrifugal supernatant,then purified by SephadexG-50 gel chromatography.The purity and molecular weight were tested by SDS-PAGE,the absorbance at the wave⁃length of 620 nm and 280 nm were detected by infrared spectroscopy and UV/visible spectrophotometer scan⁃ ning spectrum.And then the effect of phycocyanin subunits extract on the mouse spleen lymphocytes was observed.ResultsThe extracts of phycocya⁃nin subunits,No.1 and No.2 were dark green and blue dry powder respectively.They were water-solu⁃ble,and storage-stable at room temperature storage.In SDS-PAGE,both the extracts had a protein bands with molecular weights of 17kDa.In the infrared spectro⁃gram,spirulina powder showed 1 absorption peak at 1656 cm-1wavelength,No.1 extract showed 3 absorption peaks at 1655 cm-1,1633 cm-1,and 1594 cm-1,No.2 extract showed 2 absorption peaks at 1631 cm-1and 1602 cm-1,and in the residue had 1 absorption peaks at 1658 cm-1.In UV-vis,the absorption peaks of No.1 extract were at 263.5nm、619.5 nm wavelength,and of No.2 extract,were at the 263.5 nm and 619.5 nm.The puritys of No.1 extract and No.2 extract(A620/A280)waere 0.78 and 0.85,and the recoverys of No.1 extract and No.2 extract were 15%and 20%respectively.Phycocyanin subunit extracts promoted the proliferation of the mouse spleen lymphocytes.ConclusionThe crude extracts of phycocyanin subunits from spirulina by low tempera⁃ture have immunological activity.
Low temperature extract;phycocyanin subunit extract;immunological activity
R631
A
1007-6948(2016)02-0156-05
10.3969/j.issn.1007-6948.2016.02.013
1.天津市第四中心医院检验科(天津 300140)
2.内蒙古医科大学病原生物研究中心(呼和浩特 010110)
3.内蒙古燚阳生物科技有限公司(呼和浩特010059)
杨丽敏,E-mail:yanglm18@163.com
