利用EMS筛选豆科模式植物百脉根的根瘤突变体及突变部位
2016-12-09车成来金龙哲王欣宇李永一
车成来,金龙哲,林 花,王 霞,王欣宇,李永一
(延边朝鲜族自治州农业科学院,吉林 龙井 133400)
利用EMS筛选豆科模式植物百脉根的根瘤突变体及突变部位
车成来,金龙哲,林 花,王 霞,王欣宇,李永一*
(延边朝鲜族自治州农业科学院,吉林 龙井 133400)
豆科植物百脉根是研究共生固氮体系的模式植物之一,被根瘤菌感染后形成根瘤,根瘤菌固定氮素变换成铵态氮,植物利用铵态氮进行营养生长,而根瘤菌利用植物供给的碳酸同化产物为能源。为获得根瘤的成熟、维持的基因,本研究利用化学诱变试剂EMS处理百脉根MG-20得到多种突变体,筛选根瘤成熟、维持有异常的突变植株,利用SSR标记和dCAPS标记进行基因定位。结果表明:约10万M2百脉根植株中获得nup85突变体 2株,nup133突变体 4株,pollux突变体 6株,ccamk、symrk、castor、nin、nfr1、nfr5突变体各1株等不结瘤突变体(Nod-)18株;结无效根瘤突变体(Fix-)6株并确定了突变体的突变部位。
豆科植物;百脉根;突变体;根瘤;突变基因
目前,很多科学家解读微生物的根瘤菌基因序列,利用豆科植物研究根瘤形成有关基因分离、鉴定及确定基因的功能。为了阐明有关植物结瘤过程的基因网络,从豌豆、大豆、百脉根、三叶草等植物中分离很多共生突变体。影响形成根瘤过程的突变表型分为不结瘤突变体(Nod-)、结无效结瘤突变体(Fix-)和超结瘤突变体(Nod++)等3种突变体。最近,利用豆科模式植物百脉根共生突变体的分子遗传学的分析逐渐确定根瘤共生信号因子Nod factor收容因子等宿住豆科植物的根瘤形成早期反应有关的植物基因的功能。
百脉根(Lotus japonicas)基因长度比较短(约4亿5千万碱基对,染色体为二倍体2 n=12),可以安定转型,生育周期短,易栽培,可以共生根瘤菌Mesorhizobium loti以及丛枝菌根真菌(Arbuscular Mycorrhizal Fungi),被称为豆科植物中的模式植物利用于研究。很多研究人员利用百脉根在结瘤过程中表达改变的基因分析鉴定根瘤突变的原因基因。根瘤突变体的分子遗传学分析有EMS(ethyl methane sulfonate)处理法、T-DNA插入法、离子束辐射诱变法、转座子介导诱变法、启动子诱变法、转基因法等多种筛选方法。百脉根突变体中最初被克隆和确定的基因是与结瘤初期过程有关的基因Nin(nodule inception)[1]。这些年2类微生物与宿主植物共生关系研究中很多有关结瘤过程的基因被分离、鉴定,还确定了根瘤菌和丛枝菌根真菌享有相同的共生途径,这共生途径被称为Common Sym Pathway。
克隆是指生物体通过体细胞进行的无性繁殖,以及由无性繁殖形成的基因型完全相同的后代个体组成的种群。研究者们利用RT-PCR方法克隆小麦[2]、大豆[3]等植物中的基因,并对其进行生物信息学分析。NIN是形成感染丝和结瘤原基必需的,被认为是结瘤初期阶段发挥功能的转录因子。之后分离Nfr1[4]和Nfr5[5],克隆SYMRK[5-6]、Castor[7]、Pollux[7]等基因。
本研究通过EMS诱变百脉根MG-20获得多种表型突变体,并对这些突变体进行基因定位,不仅提供更多筛选根瘤的成熟、维持的基因方法,也为突变体的基因功能研究提供重要材料。
1 材料与方法
1.1 材料
百脉根MG-20、Gifu B-129,东京大学农学生命科学研究科植物功能研究室提供。
1.2 诱变处理
百脉根MG-20种子用0.4% EMS处理8 h。5 000株M1植物中获得约10万M2种子。
1.3 播种与筛选
M2种子用含少量氮源的土壤(含50 mg/kg铵态氮和10 mg/kg硝酸态氮)栽培1周后,接Mesorhizobium lotiMAFF303099的根瘤菌。接菌3~4周后,筛选不结瘤突变体或异常根瘤的突变体。筛选的突变体用含大量氮源的土壤栽培7周后再次筛选。利用M3植物和MG-20回交获得同样表型的F2植物。筛选过程中除掉结少量根瘤或生长不良的突变体。
1.4 丛枝菌根真菌感染
用直径2~0.5 mm筛子筛出的砂子灭菌1 h。砂子里丛枝菌根真菌Glomus intraradicesDAOM1862孢子(200个/株)结菌的洋葱栽培1周,洋葱周围移栽突变体2周后,利用Trypan blue染色,用光学显微镜观察菌根真菌的感染。
1.5 提取DNA和突变基因定位
获得的突变体植株和Gifu B-129杂交获得F2植物。F2植物的叶片利用CTAB法提取DNA。提取的DNA用SSR标记(http://www.kazusa.or.jp)和dCAPS标记PCR,电泳后利用凝胶成像仪观察扩增结果,确定突变基因的位置。
1.6 解读基因序列
设计各基因的解读基因序列用引物,进行PCR,利用这些引物Direct sequencing法解读基因分析。
2 结果与分析
2.1 筛选突变体
利用化学诱变试剂EMS处理的百脉根M2约10万株中筛选根瘤突变体24株(表1),其中包括不结瘤突变体(Nod-)18株,结无效根瘤突变体(Fix-)6株,并获得多数同样基因突变体。如图1所示,Nod-突变体完全不结根瘤,Fix-突变体结瘤,根瘤颜色为白色或绿色,无固氮能力或固氮能力很低。一般野生株百脉根的正常根瘤颜色为红色。

表1 百脉根的根瘤突变体及突变植株编号

MG-20:野生植株;Nod-:不结瘤突变体;Fix-:结无效根瘤突变体;1:正常(红色)根瘤;2:白色根瘤;3:粉色根瘤;4:绿色根瘤;Bar 1cm
图1 脉根的根瘤突变体的表型
Fig.1 The phenotype ofLotusjaponicusmutants
2.2 丛枝菌根真菌感染
为了找出根瘤菌和丛枝菌根真菌共生路径上的突变体及基因,做丛枝菌根真菌感染试验。百脉根野生植株(MG-20)中可以观察到丛枝菌根真菌的内生菌丝和丛枝状(图2)。No.193、No.1674、No.1690突变体中只观察到外生菌丝,而其他的突变体中都观察到内生菌丝和丛枝状。结果表明:No.193、No.1674、No.1690突变体未感染丛枝菌根真菌,而其他突变体感染丛枝菌根真菌(表2)。
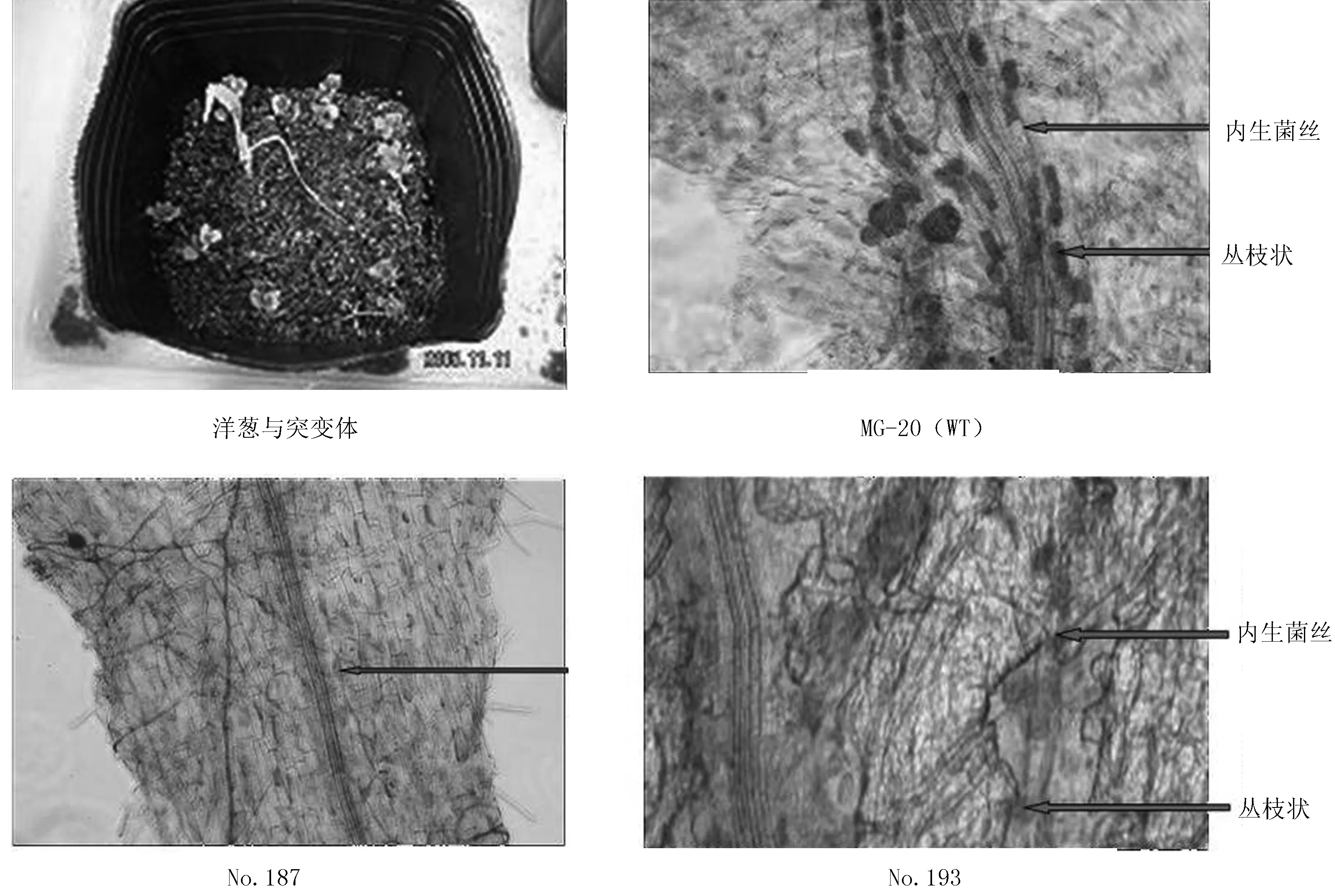
图2 接菌(丛枝菌根真菌)2周后光学显微镜观察

表2 Nod-突变体及突变部位
注:Amy+:丛枝菌根真菌感染;Amy-:丛枝菌根真菌未感染;Vesicle:泡囊状;Arbuscule:丛枝状。
2.3 Nod-突变体的突变部位
本研究利用SSR分子标记和dCAPS标记确定各突变体基因在百脉根染色体中的突变部位及氨基酸的变化部位。结果表明,No.145突变体是CCaMK基因突变;No.187、No.1950突变体是NUP85基因突变;No.193突变体是NIN基因突变;No.601突变体是Castor基因突变;No.1383突变体是SymRK基因突变;No.1674突变体是Nfr1基因突变;No.1690突变体是Nfr5基因突变;No.1466、No.1967. No.1969、No.2094、No.2226、No.3124突变体是均Pollux基因突变;No.1566、No.1942、No.2494、No.3142突变体是均NUP133基因突变。各突变体的基因都发生点突变,而且突变基因碱基和突变部位都各不相同或有的失去碱基。
2.4 根瘤菌和丛枝菌根真菌的共生基因
根瘤菌产生的Nod factor因子和丛枝菌根真菌产生的Myc factor因子受到一些基因的影响,而这些基因在信号传达途径Common Sym Pathway上。根瘤菌结瘤因子受体激酶NFR1和NFR5(LysM-type serine/threonine receptor kinase)提示Nod factor信号都能感知结瘤因子,在根系中介导植物对根瘤菌感染的早期反应,认为是Nod factor的收容因子。symRK(symbiosis receptor-like kinase)认为是具有构成富含信号肽、亮氨酸重复序列的细胞外域、跨膜细胞内蛋白质域的受体激酶NFR1和NFR5的下游Calcium spiking之间传递信号的蛋白质,但它的详细功能尚未确定。symRK基因可能是识别丛枝菌根真菌和固氮细菌产生的特异分子并与之结合的受体。SYMRK下游被离子通道蛋白CASTOR和POLLUX细胞内的Ca短周期地出现钙振荡,CCaMK[8]利用某些机制把这信号传达,转录因子CYCLOPS[9]诱导基因表达。由CYCLOPS的作用,一些机制积累细胞分裂素(cytokinin),介导这些分子的受体(LHK1)进行之后的结瘤过程(图3)。结果表明,本研究中获得目前为止已知的根瘤菌与丛枝菌根真菌的共生途径上作用的几乎全部基因。

★为至今被克隆的基因;*为至今获得的突变体,但未克隆的基因;Common Sym Pathway:根瘤菌与丛枝菌根真菌的共生途径
图3 经过结瘤因子Nod factor后的信号传达途径和共生初期有影响的宿主基因群
Fig.3 Nod factor signaling pathway and early symbiotic influential group of host genes
2.5 百脉根突变体的突变基因初步定位
SSR(Simple Sequence Repeats)标记是近年来发展起来的一种以特异引物RCR为基础的分子标记技术,也称为微卫星DNA(microsatellite DNA),是一类由几个核苷酸为重复单位组成的长达几十个核苷酸的串联重复序列。为了探索百脉根Nod-突变体在染色体上的位置和突变基因的突变部位,利用日本かずさDNA研究所网站记载的SSR分子标记和dCAPS标记进行突变基因初步定位,对候补基因进一步确定突变部位进行基因测序。结果表明,nin、nfr1、nup133、castor突变体在第1染色体的上端和下端部位;symrk、nfr5在第2染色体的中下端和下端部位;ccamk在第3染色体的中上端部位;pollux在第6染色体的下端部位突变(图4)。

★为本研究中获得的百脉根突变体的基因在染色体上的位置
3 讨论
3.1 百脉根栽培方法
目前很多研究室利用蛭石栽培百脉根种子的方法进行筛选百脉根突变体[10],本研究利用赤玉土和kureha培养土14∶1混合的富含氮源的土壤(约含50 mg/kg的铵态氮及10 mg/kg的硝态氮)栽培百脉根进行筛选。筛选过程中对生长受到抑制或结瘤极少的突变体排除研究对象外,只筛选在富含氮源培养土中跟野生株一样生长良好的突变体为研究对象。筛选结果,获得至今为止已报告的几乎所有功能的基因,并获得多数部分突变体。因此,利用含少量氮源土壤的栽培方法筛选获得更大数量突变群体的可能性高。
3.2 EMS诱变以及筛选突变体
EMS化学诱变法具有操作简便、受外界因素影响较少、突变频率高、易形成点突变、突变范围广等特点,是最常用诱变剂。本研究利用EMS诱变百脉根获得不结瘤突变体18株和结无效根瘤突变体6株。
3.3 无效结瘤突变体
无效结瘤突变体(Fix-)是百脉根结根瘤但有少量或无固氮能力的根瘤。首先被克隆的无效结瘤突变体的基因是Sst1(symbiotic sulfate transpoter)[11],其次Ign1(ineffective greenish nodules)[12]基因被克隆。IGN1被认知具有跨膜域和7个针锚蛋白重复的蛋白质,但它的功能还没阐明。其他还有未确定基因的突变体sen1(stationary endosymbiont nodule)[13]比野生株结2~3倍的根瘤,几乎无固氮能力,结白色根瘤,利用Microarray进行基因表达分析。Lot1(low nodulation and trichome distortion)[14]是抑制根瘤数量的突变体;Alb1(aberrant localization of bacteria inside nodule)[15]是影响维管束分化的突变体;Fen1(fail in enlargement of infected cells)[16]是破坏感染细胞的突变体;Ljsym105[17]结粉色的小根瘤,固氮能力约为野生株的50%,形成小的感染细胞的突变体。本研究获得的无效根瘤突变体有2株ign1突变体、3株sen1突变体、1株sym7突变体。结果表明:Kumagai获得的ign1突变体结白色根瘤,而本研究获得的ign1突变体结粉色(图1相片中看不清,但的确是粉色根瘤)和白色根瘤;Suganuma获得的sen1突变体结白色根瘤,而本研究获得的sen1突变体结绿色根瘤。从而看出,同样基因的不同核苷酸改变而根瘤颜色表型也不同。
4 结论
本研究确定少量含氮源土壤栽培百脉根的方法比蛭石栽培方法较全面且多量筛选突变体。该方法获得了9种不结瘤突变体(Nod-)和3种无效结瘤突变体(Fix-),并获得了pollux突变体 6株、nup133突变体 4株、nup85突变体 2株、sen1突变体3株、ign1突变体2株等多数同样突变体。无效结瘤突变体中还获得了粉色、白色、绿色等3种不同颜色根瘤表型的突变体。这些突变体将为豆科植物根瘤形成机理的研究提供重要材料和理论依据。
[1] Schauser L,Roussis A.A plant regulator controlling development of symbiotic root nodules[J].Nature,1999,402(6758):191-195.
[2] Radutoiu S,Madsen L H.Plant recognition of symbiotic bacteria requires two LysM receptor-like kinases[J].Nature,2003,425(6958):585-592.
[3] 张蕾,于永昂,杨天佑.小麦TaxRCC1基因的克隆及生物信息学分析[J].河南科技学院学报,2015,43(06):1-7.
[4] 盖江涛,赵团结,李艳,等.大豆腺苷酸激酶基因GmADK的克隆与表达分析[J].作物学报,2013,39(10):1739-1745.
[5] Madsen E B,Madsen L H.A receptor kinase gene of the LysM type is involved in legume perception of rhizobial signals[J].Nature,2003,425(6958):637-640.
[6] Stracke S,Kistner C.A plant receptor-like kinase required for both bacterial and fungal symbiosis[J].Nature,2002,417(6892):959-962.
[7] Imaizumi-Anraku H,Takeda N.Plastid proteins crucial for symbiotic fungal and bacterial entry into plant roots[J].Nature,2005,433(7025):527-531.
[8] Tirichine L,Imaizumi-Anraku H.Deregulation of a Ca2+/calmodulin-dependent kinase leads to spontaneous nodule development[J].Nature,2006,441 (7097):1153-1156.
[9] Yano K,Yoshida S.From the Cover:CYCLOPS,a mediator of symbiotic intracellular accommodation[J].Proc Natl Acad Sci U S A,2008,105(51):20540-20545.
[10] 今泉(安楽) 温子.ミヤコグサ(Lotus japonicum)の基本実験マニュアル[D]. 1999.
[11] Krusell L,Krause K.The sulfate transporter SST1 is crucial for symbiotic nitrogen fixation in Lotus japonicus root nodules[J].Plant Cell,2005, 17(05): 1625-1636.
[12] Kumagai H,Hakoyama T.A novel ankyrin-repeat membrane protein,IGN1,is required for persistence of nitrogen-fixing symbiosis in root nodules of Lotus japonicus[J].Plant Physiol,2007,143(03):1293-1305.
[13] Suganuma N,Yamamoto A.cDNA macroarray analysis of gene expression in ineffective nodules induced on the Lotus japonicus sen1 mutant[J].Molecular Plant-Microbe Interactions,2004,17(11):1223-1233.
[14] Ooki Y,Banba M.Characterization of the Lotus japonicus symbiotic mutant lot1 that shows a reduced nodule number and distorted trichomes[J].Plant Physiol,2005,137(04):1261-1271.
[15] Imaizumi-Anraku H,Kouchi H.Analysis of ENOD40 expression in alb1,a symbiotic mutant of Lotus japonicus that forms empty nodules with incompletely developed nodule vascular bundles[J].Molecular and General Genetics,2000, 264(04):402-410.
[16] Kawaguchi M,Imaizumi-Anraku H.Root,root hair,and symbiotic mutants of the model legume Lotus japonicus[J].Mol.Plant-Microbe Interact,2002,15(01): 17-26.
[17] Hossain M S,Umehara Y.A novel Fix(-) symbiotic mutant of Lotus japonicus, Ljsym105, shows impaired development and premature deterioration of nodule infected cells and symbiosomes[J].Mol.Plant-Microbe Interact,2006,19(07):780-788.
Selection of root nodule mutant and mutation portion of model legume Lotus japonicus by virtue of EMS
CHE Chenglai, JIN Longzhe, LIN Hua, WANG Xia, WANG Xinyu, LI Yongyi*
(YanbianAcademyofAgriculturalSciences,LongjingJilin133400,China)
LegumeLotusjaponicusis one of the model plants for studying the symbiotic nitrogen fixation system. In order to exploring the genes related with root nodule maturing and maintaining, divergent mutants fromLotusjaponicusMG-20 were induced with chemical mutagenesis reagent EMS, subsequently, from which mutant plants characterized by mature and abnormally maintained root nodule were screened and, the candidate genes were mapped with SSR and dCAPS markers. The results showed that among 100 000 M2 mutants induced fromLotusjaponicus, 18 plants were non-nodulation (Nod-) mutants, including twonup85 mutants, fournup133 mutants, sixpolluxmutants, oneccamkmutant, onesymrkmutant, onecastormutant, oneninmutant, 1nfr1 mutant, 1nfr5 mutant and six unavailable nodulation (Fix-) mutants. Additionally, these mutations were positioned successfully.
Leguminous plant;Lotusjaponicus;mutant;nodule;mutant gene
2016-08-22
车成来(1971—),男(朝鲜族),吉林龙井人,助理研究员,研究方向为分子育种学。李永一为通信作者,
E-mail:Lyygood79@163.com
1004-7999(2016)03-0235-07
10.13478/j.cnki.jasyu.2016.03.010
S541.6
A
