马铃薯中立枯丝核菌代谢产物及生物活性研究
2016-12-09张慧秀龙海涛牛红艳蒲陆梅邱慧珍
张慧秀,龙海涛,孙 艳,牛红艳,蒲陆梅,邱慧珍
(1.甘肃农业大学理学院,甘肃兰州 730070;2.甘肃农业大学农业资源化学与应用研究所,甘肃兰州 730070;3.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;4.甘肃农业大学资源与环境学院,甘肃兰州 730070)
马铃薯中立枯丝核菌代谢产物及生物活性研究
张慧秀,龙海涛,孙 艳,牛红艳,蒲陆梅,邱慧珍
(1.甘肃农业大学理学院,甘肃兰州 730070;2.甘肃农业大学农业资源化学与应用研究所,甘肃兰州 730070;3.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;4.甘肃农业大学资源与环境学院,甘肃兰州 730070)
研究了马铃薯中立枯丝核菌的代谢产物。首先利用不同的有机溶剂萃取立枯丝核菌培养滤液并测定各组分生物活性,其次结合薄层色谱(TLC)与硅胶柱层析两种色谱分析方法对有毒性组分进行了分离纯化,最后利用紫外吸收光谱、红外吸收光谱和气相色谱-质谱联用仪(GC-MS)等方法对立枯丝核菌毒素做了分析鉴定。结果表明:乙酸乙酯提取物的毒性显著高于氯仿提取物。硅胶柱层析中分离得到5个立枯丝核菌分离物(I1、I2、I3、I4、I5)。紫外吸收数据表明,I1在198.5 nm处有最大吸光度;红外光谱表明,I1中有-CH2(2927.41、2856.06 cm-1)、C=O(1735.62 cm-1)、C=C(1635.34 cm-1)、-CH3(1417.42 cm-1)、-C-O(1263.1、1128.2 cm-1)等基团存在;GC-MS分析结果表明,I1中的主要物质有磷酸三丁酯、邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯和(甲氧基甲基)三苯基氯化磷几种物质。
马铃薯,立枯丝核菌,代谢产物,生物活性
马铃薯(SolanumtuberosumL.)作为全球四大重要粮食作物之一,具有产量高、易栽培和营养丰富等特点,有“地下面包”之称,在中国逐渐成为增收的优势农作物,具有广阔的发展前景[1-2]。然而,马铃薯土传病害日趋严重,马铃薯黑痣病是主要的土传病害之一[3-5]。马铃薯黑痣病又称为立枯丝核菌病、茎基腐病、丝核菌溃疡病、黑色粗皮病[6]。黑痣病的病原菌为立枯丝核菌(RhizoctoniasolaniKühn),属于半知菌亚门真菌。立枯丝核菌在致病和培养过程中都会产生毒素,毒素接种引起的症状与病原菌直接侵染引起的症状一致,是病菌致病的关键因子[7-8]。立枯丝核菌主要侵染马铃薯的幼芽、茎基部和块茎。黑痣病对马铃薯的产量和品质有着重要的影响,严重阻碍马铃薯产业的发展[9]。
目前,国内外对马铃薯黑痣病的研究主要集中于对其生物、化学防治及对寄主抗病性利用等方面,通过科学的田间农艺措施[10],使用化学药剂[11]和生物防菌剂[12-13]进行生长期预防和控制,或者利用生物因子或非生物因子[14-17]诱导马铃薯块茎对立枯丝核菌的抗性等相关方面报道较多,而对于立枯丝核菌代谢产物的成分及结构等相关方面的研究相对较少[6]。本研究结合两种色谱分析方法,将立枯丝核菌产生的植物性毒素分离、纯化;通过紫外吸收光谱、红外吸收光谱和GC-MS等仪器分析方法鉴定立枯丝核菌毒素,为研究马铃薯黑痣病的预防与控制提供理论依据。
1 材料与方法
1.1 材料与仪器
立枯丝核菌 由甘肃农业大学资源与环境学院生态实验室提供;马铃薯块茎 由甘肃农业大学甘肃省干旱生境作物学重点实验室提供;小麦 实验室培育;碳酸氢钠 分析纯,天津市大茂化学试剂厂;盐酸、乙酸乙酯、石油醚、苯、乙醚、氯仿、丙酮 分析纯,天津市福晨化学试剂厂;甲醇 分析纯,北京化工厂;薄层层析硅胶GF-254 化学纯、柱层层析硅胶 试剂级 青岛裕明源硅胶试剂厂。
旋转蒸发器RE-2000B 上海亚荣生化仪器厂;手提式紫外分析仪WFH-204 上海精科实业有限公司;pH计PHS-3C-01 上海三信仪表厂;电子天平BS 224S 北京赛多利斯仪器系统有限公司;高速冷冻离心机sigma 3K15 北京五州东方科技发展有限公司。
1.2 供试培养基
马铃薯琼脂蔗糖培养基(PSA):马铃薯,200 g;蔗糖,20 g;琼脂,15 g;蒸馏水,1000 mL;pH7.0。马铃薯蔗糖液体培养基(PSB):马铃薯,200 g;蔗糖,20 g;蒸馏水,1000 mL;pH7.0。理查德培养基:KNO3,10 g;KH2P04,5 g;MgSO4·7H2O,2.5 g;Fe2(SO4)3,0.02 g;蔗糖,50 g;蒸馏水1000 mL;pH7.0。
1.3 实验方法
1.3.1 立枯丝核菌的培养 立枯丝核菌的培养方法参考文献[18-19]并稍作修改。将立枯丝核菌于25 ℃下在PSA上恒温培养7 d,把直径为6 cm的菌丝头从PSA培养基中转移至装有50 mL PSB的150 mL烧瓶中,将此培养液于28 ℃下在旋转振荡器(180 r/min)中培养2 d后,于4 ℃储存。将四个菌丝体组从PSB培养基中转移至一个装有200 mL理查德培养基的500 mL烧瓶中,然后将培养基置于28 ℃下恒温培养15~20 d,每天人工振荡一次。立枯丝核菌培养液经过冷冻离心(5000 r/min)得到培养滤液。
1.3.2 培养滤液中可溶性化合物的提取 提取按照文献[18]所描述的方法。40 ℃下将50 mL的培养滤液真空浓缩至原体积的一半,向培养滤液中分别加入等体积的甲醇和丙酮,于4 ℃储存过夜,离心10 min(8500 r/min),收集沉淀物,50 ℃下将上清液蒸发至干得到残余物。用25 mL的乙醚、乙酸乙酯、苯和氯仿将50 mL培养滤液分别萃取三次。将有机相和水相部分都在50 ℃蒸干,得到残余物。将所得沉淀和残余物分别溶于50 mL无菌蒸馏水中,其生物活性运用茎溃疡实验进行评估。用生长在理查德培养基上的立枯丝核菌培养滤液作为对照。
1.3.3 茎溃疡实验的测定 茎坏死实验方法参考文献[20-21],通过马铃薯块茎(青薯2号)的病害程度反映未处理的立枯丝核菌培养滤液和处理组提取物的生物活性。健康的马铃薯块茎先用自来水洗净,然后用蒸馏水冲洗,再用70%乙醇消毒。用一个无菌的4 mm软木钻孔机从马铃薯块茎上移除马铃薯块,将0.2 mL溶液施加到马铃薯块茎孔中,放回马铃薯组织块,用烛蜡密封。在干净的锅底放置一层2 cm厚的蒸汽消毒砂,将种子的芽朝上放置在每个容器的中心。添加足够的沙子,确保芽被额外覆盖2 cm厚的土层。培养12 d后,洗涤植株,评估茎溃疡发生率和严重程度,并和对照组比较。每组实验重复5次。评估如下:0=无损害或无病变存在;1=轻微损伤(一个至几个的病变大小小于5 mm);2=中度损伤(病变大小超过5 mm和一些环剥);3=严重损坏(大的病变范围和环剥或大部分茎出现死亡);4=所有茎全部死亡。
将测定的实验数据进行最小显著性差异(LSD)比较,当p<0.05时,意味着差异显著。
1.3.4 立枯丝核菌代谢产物的分离及纯化 立枯丝核菌代谢产物的分离及纯化方法参照文献[18]并做修改。用12 mol/L HCl调培养液的pH=2.5,取立枯丝核菌培养滤液100 mL,用等体积的乙酸乙酯溶液萃取3次,合并萃取液。在40 ℃下将萃取液浓缩至较小体积,用等体积的1% NaHCO3溶液洗涤三次。将水层用12 mol/L HCl调pH=2.5,用乙酸乙酯溶液萃取3次,合并萃取液,将合并的萃取液在45 ℃下蒸干,得到残余物。将所得残余物溶于5 mL甲醇中做TLC分析。制备分析薄层色谱板时,用荧光硅胶GF-254涂层,在乙酸乙酯∶石油醚(1∶1~20∶1,v/v)溶剂体系中点样,在254 nm紫外光下标记F点,计算Rf值。选择在薄层色谱板上能产生清晰而独立点的溶剂体系,作为在硅胶柱中纯化粗毒素的洗脱剂。
将5 mL粗毒素过15 mm×500 mm硅胶(200~300目)柱,该硅胶柱在105 ℃下活化并与石油醚预平衡,将粗毒素从硅胶柱顶端加入,用不同梯度的洗脱液洗脱。梯度洗脱液依次为:100%石油醚;石油醚∶乙酸乙酯=10∶1;石油醚∶乙酸乙酯=3∶1;石油醚∶乙酸乙酯=1∶1;100%乙酸乙酯;100%甲醇。洗脱的速度是0.25 mL/min,收集洗脱液于样品瓶中,得到纯化的毒素。将所得分离物在包含乙酸乙酯∶石油醚(1∶1~20∶1,v/v)的溶剂体系中点样,在254 nm紫外光下标记F点,并计算Rf值。
1.3.5 立枯丝核菌毒素的生物活性测定 将纯化的毒素在荧光硅胶GF-254薄层板上进行TLC分析,在紫外光(254 nm)下显色的样品进行生物活性评估。
立枯丝核菌毒素生物活性测定采用分离叶鞘生物测定[19]。将分离得到的毒素于45 ℃蒸干,称重。将已知重量的毒素溶解到无菌蒸馏水中,配制200 μg/mL的溶液。在小麦3叶期,分离同一叶位的10个叶片,在叶片轴外的表面用消毒针轻轻地刺使其轻微受伤,将20 μL毒素溶液施加到伤口部位,置于实验室条件下培养5 d,观察病斑大小。每个实验重复三次,用无菌蒸馏水处理的叶子作为对照。
1.3.6 立枯丝核菌代谢产物的鉴定
1.3.6.1 立枯丝核菌代谢产物的紫外全波长扫描 将分离得到的毒素在45 ℃下蒸干,溶解到甲醇中,对其进行紫外全波长扫描,纯甲醇溶液作为参比液。
1.3.6.2 立枯丝核菌代谢产物的红外光谱分析 采用KBr压片法,将立枯丝核菌分离物I1在45 ℃下蒸干,用傅里叶变换红外光谱仪对其进行红外光谱扫描。
1.3.6.3 立枯丝核菌代谢产物的GC-MS分析 气相色谱条件:气相色谱和质谱型号分别为6890N GC system和5973 Mass selective,色谱柱型号为OV1701(0.25 mm×0.25 μm×60 m),温度梯度为80~270 ℃,以15 ℃/min升温至270 ℃保持10 min,载气为氦气(纯度>99.999%),流速为1.0 mL/min,分流进样:60∶1。
质谱条件:电离方式为EI,离子源温度230 ℃;四级杆温度150 ℃;接口温度280 ℃;轰击电压为70 eV,扫描范围为15~550 amu(m/z)。
应用标准图库(NIST05)通过计算机检索系统进行物质的鉴定。
1.4 数据处理
采用SPSS Statistics 19.0和 Microcal Origin 7.5软件进行数据分析。
2 结果与分析
2.1 立枯丝核菌的培养
立枯丝核菌在PSA培养基上恒温培养3 d和7 d后,发现随着培养时间的增长,菌丝体颜色随之发生变化。当立枯丝核菌培养3 d时,菌丝体的颜色是近似白色;而培养到7 d时菌丝体的颜色变为深褐色。
2.2 立枯丝核菌代谢产物的提取及生物活性测定
将马铃薯块茎接种培养12 d后,不同处理组溶液的植物毒性见表1。从表1中的数据可以看出,生长于理查德培养基上的立枯丝核菌培养滤液具有毒性;向培养滤液中加入甲醇、丙酮或乙醚后,只在水相部分检测到毒性;而加入乙酸乙酯、苯或氯仿后,在水相和溶剂部分都检测到毒性。由于乙酸乙酯与氯仿提取物的毒性主要存在于溶剂部分,且乙酸乙酯提取物的毒性显著高于苯和氯仿提取物的毒性,所以本研究中选用乙酸乙酯从培养滤液中提取毒素,该毒素用乙酸乙酯萃取后,结合两种层析步骤进行纯化。
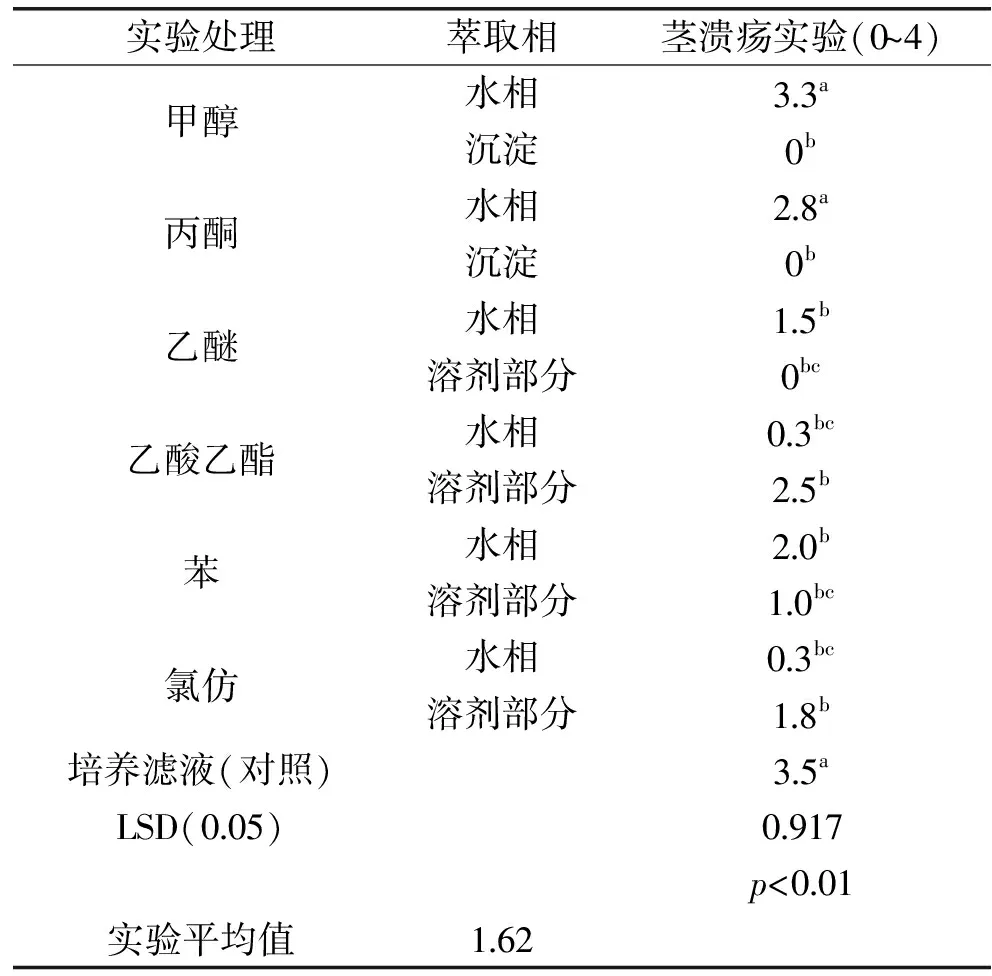
表1 立枯丝核菌培养滤液粗提物的植物毒性
注:茎溃疡实验0:无损害或无病变存在;1:轻微损伤(一个至几个的病变大小小于5 mm);2:中度损伤(病变大小超过5 mm和一些环剥);3:严重损坏(大的病变范围和环剥或大部分茎出现死亡);4:所有茎全部死亡。同列不同小写字母代表数据差异显著(p<0.05);LSD,最小显著性差异。
2.3 立枯丝核菌代谢产物的分离及纯化
为了获得足够多的生物活性化合物,将立枯丝核菌的菌丝体生长在一升理查德液体培养基中15~20 d。培养滤液用乙酸乙酯萃取后,浓缩乙酸乙酯萃取液得到一种淡黄色的粉末。将乙酸乙酯萃取液旋转蒸发后,得到黄色的代谢产物,将其用TLC分析后,在薄层色谱板上点板,发现在石油醚/乙酸乙酯=1∶3(v/v)溶剂中,在紫外光(254 nm)下看见一个斑点,其Rf值为0.5。改变溶剂的极性,进行硅胶柱色谱分析。在硅胶柱层析中选择5个片段进行收集,得到5个分离物I1、I2、I3、I4、I5。将5个分离物在用荧光硅胶GF-254涂层的硅胶板上点样,在254 nm紫外光下可以看见独立清晰的斑点,其Rf值见表2。

表2 五个立枯丝核菌分离物的薄层色谱分析结果
2.4 立枯丝核菌代谢产物的生物活性测定
在小麦叶片伤口施加立枯丝核菌分离物I1,培养7 d后,叶片伤口发现病变,伤口出现黄色现象;培养9 d后,伤口开始腐烂,并出现水珠;而用蒸馏水处理的对照组叶片伤口没有发现病变。由分离叶鞘生物测定结果可以看出分离物I1能引起小麦叶片发生病变。
2.5 立枯丝核菌代谢产物的鉴定
2.5.1 立枯丝核菌代谢产物的紫外全波长扫描 立枯丝核菌分离物I1在甲醇中的紫外吸收光谱见图1。从图1中可以看出,分离物I1在甲醇中的最大吸光度在198.5 nm波长处。
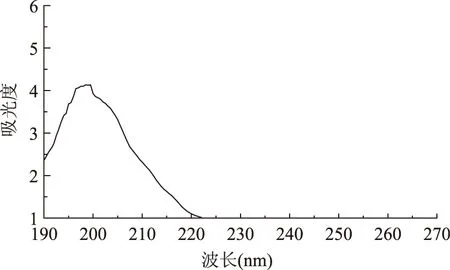
图1 立枯丝核菌分离物I1的紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of Rhizoctonia solani isolate I1
2.5.2 立枯丝核菌代谢产物的红外光谱扫描 立枯丝核菌分离物I1的红外光谱见图2,从图2可以看出,波数2927.41 cm-1和2856.06 cm-1处出现-CH2伸缩振动吸收峰,波数1735.62 cm-1出现了C=O(酯类)的伸缩振动吸收峰,波数1635.34 cm-1处出现的是C=C(苯)的伸缩振动吸收峰,波数1417.42 cm-1处出现-CH3弯曲振动吸收峰,波数1263.1 cm-1和1128.2 cm-1处属于-C-O的伸缩振动吸收峰。从这些特征吸收峰可以推断出I1是含有苯基的酯类物质。

图2 立枯丝核菌分离物I1的红外光谱图Fig.2 FT-IR spectra of the Rhizoctonia solani isolate I1
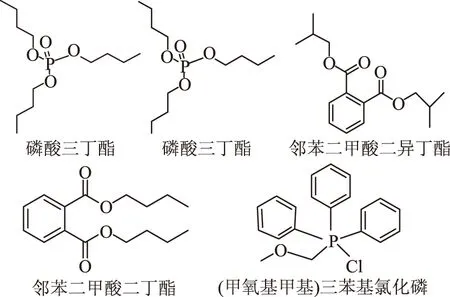
2.5.3 立枯丝核菌分离物的GC-MS分析 立枯丝核菌分离物I1的总离子流图见图3,对图3中的总离子谱图通过计算机检索系统鉴定,按照相似度大于75%,峰面积大于500 000,得到立枯丝核菌代谢产物I1主要包含的物质见表3。结果表明,I1的主要物质有磷酸三丁酯、邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯、(甲氧基甲基)三苯基氯化磷,其中物质1与物质2可能为同分异构体。将检测到的物质分别用其标准品进行验证,将标准品溶解到甲醇溶液中进行GC-MS分析(其总离子流图分别见图4、图5、图6和图7)。
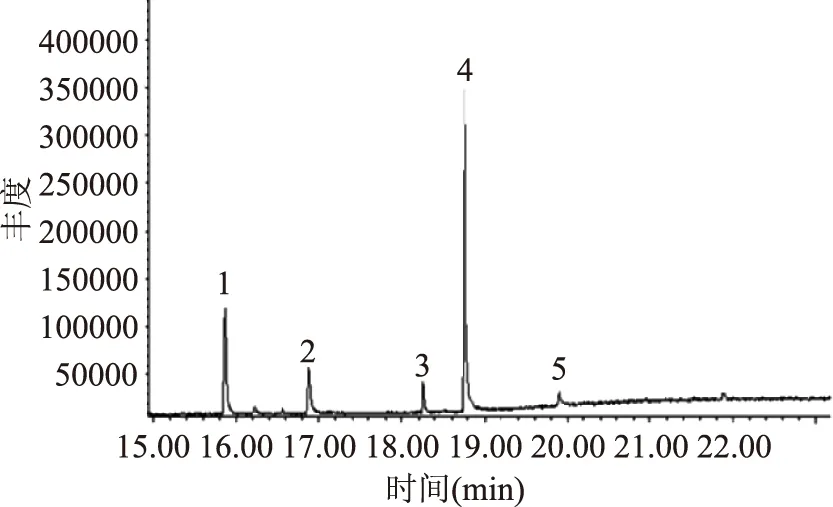
图3 立枯丝核菌分离物I1的总离子流图Fig.3 Total ion current of Rhizoctonia solani isolate I1
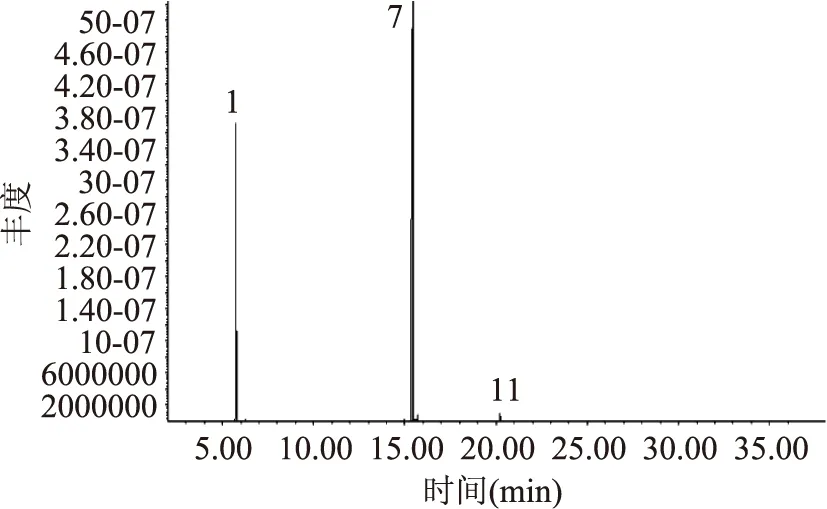
图4 磷酸三丁酯的总离子流图Fig.4 Total ion current of tributyl phosphate
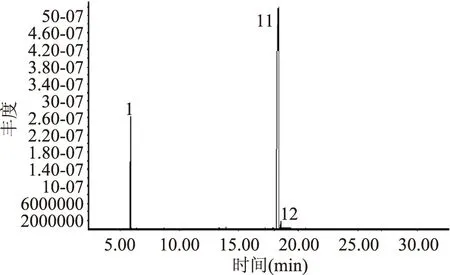
图5 邻苯二甲酸二异丁酯的总离子流图Fig.5 Total ion current of diisobutyl phthalate
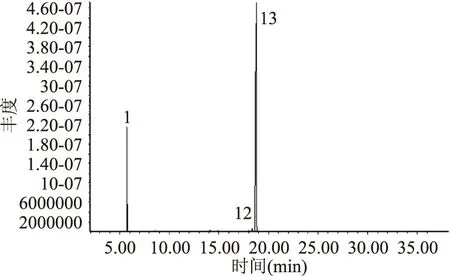
图6 邻苯二甲酸二丁酯的总离子流图Fig.6 Total ion current of dibutyl phthalate

图7 (甲氧基甲基)三苯基氯化磷的总离子流图Fig.7 Total ion current of(methoxymethyl)triphenylphosphonium chloride

主要物质保留时间(min)化合物物质115 868磷酸三丁酯物质216 874磷酸三丁酯物质318 251邻苯二甲酸二异丁酯物质418 757邻苯二甲酸二丁酯物质519 903(甲氧基甲基)三苯基氯化磷
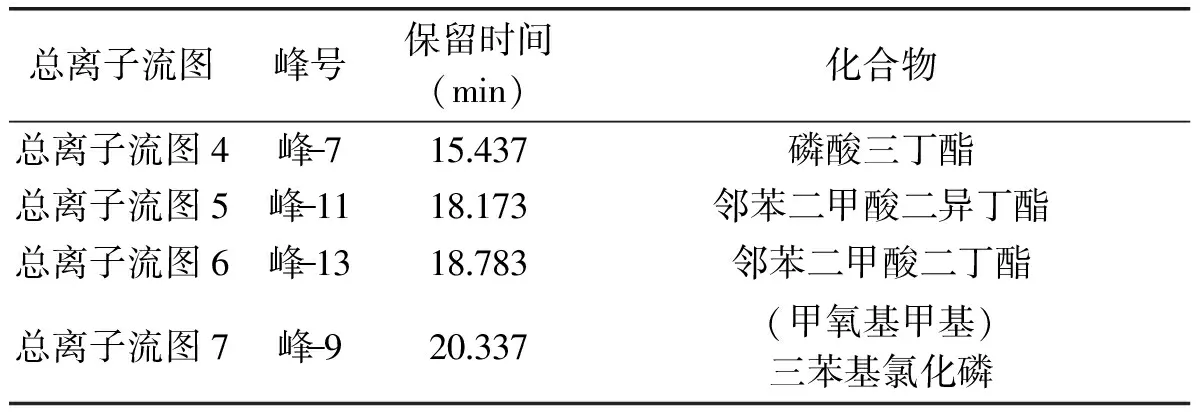
表4 标品GC-MS测定结果
I1包含的五种物质对应的结构式如下:
3 结论
以马铃薯块茎发病程度为指标,优化得出萃取毒素的最佳萃取剂为乙酸乙酯。通过柱色谱分离,得到5个立枯丝核菌分离物I1、I2、I3、I4、I5。分离叶鞘生物测定实验结果表明立枯丝核菌分离物I1能使小麦叶片伤口发生病变。对I1进行紫外吸收、红外吸收和GC-MS测定并用标准品进行验证后,I1中的主要物质有磷酸三丁酯、邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯和(甲氧基甲基)三苯基氯化磷几种物质。
[1]谢从华. 马铃薯产业的现状与发展[J]. 华中农业大学学报:社会科学版,2012(1):1-4.
[2]魏蓓娜. 马铃薯在全球粮食安全中的作用[J]. 农产品市场周刊,2015(29):28.
[3]刘宝玉,胡俊,蒙美莲,等. 马铃薯黑痣病病原菌分子鉴定及其生物学特性[J].植物保护学报,2011,38(4):379-380.
[4]刘秉义,董风林,靳军良,等. 固原市马铃薯连作减产原因分析及应采取的措施[J].中国马铃薯,2009,23(5):303-304.
[5]谭宗九,郝淑芝. 马铃薯丝核菌溃疡病及其防治[J]. 中国马铃薯,2007,21(2):108-109.
[6]陈万利. 马铃薯黑痣病的研究进展[J]. 中国马铃薯,2012(1):49-51.
[7]黄文文,向准,龚亮,等. 水稻纹枯病菌粗毒素提取及活性初步研究[J].安徽农业科学杂志,2009,10(4):132-136.
[8]Frank J A,Francis S K. The effect of a Rhizoctonia solani phytotoxin on potatoes[J]. Canadian Journal of Botany,1976,54:2536-2540.
[9]邱广伟. 马铃薯黑痣病的发生与防治[J]粮食作物,2009(6):133-134.
[10]Boлoвик A C. 苏联马铃薯的植保制度[J]. 杂粮作物,1982(2):31-33.
[11]陈爱昌,魏周全,孙兴明,等. 8种药剂拌种对马铃薯黑痣病的防效实验[J]. 甘肃农业科技,2015(4):48-50.
[12]孙飞. 马铃薯种子处理防治黑痣病药效实验[J].现代农业,2015(2):20-21.
[13]陈雯廷,蒙美莲,曲延军,等. 马铃薯黑痣病综合防控技术的集成[J]. 中国马铃薯,2015(2):103-106.
[14]Lorito M,Woo S L,Fernandez I G. Genes from mycoparasitic fungi as a source for improving plant resistance to fungal pathogens[J]. Proc Natl Acad Sci,1998,95:7860-7865.
[15]Kim J K,Jang I C,Wu R,et al. Co-expression of a modified maize ribosome-inactivating protein and a rice basic chitinase gene in transgenic rice plants confers enhanced resistance to sheath blight[J]. Transgenic Research,2003(12):475-484.
[16]Huang M,Hou P,Wei Q,et al. A ribosome-inactivating protein(curcin 2)induced from Jatropha curcas can reduce viral and fungal infection in transgenic tobacco[J]. Plant Growth Regulation,2008,54(2):115-123.
[17]蒋继志,吴素玉,赵丽坤. 非生物因子诱导马铃薯块茎对立枯丝核菌的抗性[J]. 河北大学学报:自然科学版,2005,25(2):167-171.
[18]LIANG X X,Ai-Ping Zheng. Preliminary characterisation of the phytotoxin of sheath-blight disease of rice caused by Rhizoctonia solani[J]. African Journal of Biotechnology,2012,11(29):7520-7527.
[19]Zheng L,Lv R,Huangn J,et al. Isolation,purification,and biological activity of a phytotoxin produced by Stemphylium solani[J]. Plant Dis,2010,94:1231-1237.
[20]Sowley E.N.K,Kankam F,Afari D. Evaluation of neem seed and ginger as potential control agents of yam(Dioscorea rotundata Poir)tuber rot fungi[J]. Archives of Phytopathology and Plant Protection,2013,46(17):2117-2124.
[21]Carling DE,Leiner RH. Effect of temperature on virulence of Rhizoctonia solani and other Rhizoctonia on potato[J]. Phytopathology,1990,80:930-934.
Study on Rhizoctonia solani metabolites and biological activity in potato
ZHANG Hui-xiu1,LONG Hai-tao1,2,SUN Yan3,NIU Hong-yan1,PU Lu-mei1,2,*,QIU Hui-zhen4,*
(1.College of Science,Gansu Agricultural University,Lanzhou 730070,China;2.Institute of Agricultural Resources Chemistry and Application,Gansu Agricultural University,Lanzhou 730070,China;3.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;4.College of Resources and Environmental Sciences,Gansu Agricultural University,Lanzhou 730070,China)
The Rhizoctonia solani metabolites in potato was investigated. Firstly,the culture filtrates of Rhizoctonia solani were extracted with different organic solvent and the biological activities of each fraction were examined. Then,the toxic components were purified with method of thin layer chromatography(TLC)and silica gel column chromatography. Finally,Rhizoctonia solani toxin was analyzed and identified by UV absorption spectrum,FT-IR spectra and Gas chromatography-mass spectrometry(GC-MS). The results showed that the component extracted by ethyl acetate showed significantly higher toxicity than that extracted by chloroform. Five Rhizoctonia solani isolates(I1,I2,I3,I4,I5)were isolated by Silica gel column chromatography. The absorption bands of the UV spectrum suggested that I1had a higher absorption at 198.53 nm;The IR spectrum showed bands characteristic of -CH2(2927.41、2856.06 cm-1)、C=O(1735.62 cm-1)、C=C(1635.34 cm-1)、-CH3(1417.42 cm-1)and -C-O(1263.1、1128.2 cm-1)groups in I1;GC-MS analysis showed that I1mainly contains several substances of tributyl phosphate,diisobutyl phthalate,dibutyl phthalate and(methoxymethyl)triphenylphosphonium chloride.
potato;Rhizoctonia solani;metabolites;biological activity
2016-30-30
张慧秀(1991-),女,硕士研究生,研究方向:植物毒素,E-mail:18809440215@163.com。
*通讯作者:蒲陆梅(1968-),女,博士,教授,研究方向:天然产物化学,E-mail:pulm@gsau.edu.cn。
国家自然地区科学基金项目(31360500)。
TS215
A
1002-0306(2016)20-0000-00
10.13386/j.issn1002-0306.2016.20.000
邱慧珍(1961-),女,博士,教授,研究方向:植物营养与根际生态调控,E-mail:hzqiu@gsau.edu.cn。
