响应面法优化杜仲叶提取物的制备工艺
2016-12-09侯伟峰范云鹏麻武仁宋晓平
侯伟峰,郭 超,范云鹏,麻武仁,宋晓平
(西北农林科技大学动物医学院 中兽医药研究所,陕西杨凌 712100)
响应面法优化杜仲叶提取物的制备工艺
侯伟峰,郭 超,范云鹏,麻武仁,宋晓平*
(西北农林科技大学动物医学院 中兽医药研究所,陕西杨凌 712100)
优化杜仲叶提取物制备的工艺条件,在单因素试验基础上,以杜仲叶提取物浸膏得率和绿原酸转移率为评价指标,采用Box-Behnken中心组合设计法优化杜仲叶提取物制备的工艺条件。杜仲叶提取物制备的最佳工艺条件为乙醇浓度500 mL/L,液料比10∶1(mL/g),提取温度97℃,提取4次,每次30 min;在此最佳工艺条件下,杜仲叶提取物浸膏得率和绿原酸转移率综合评分均值为99.08,与预测值基本一致。响应面法(RSM)优化的杜仲叶提取物制备工艺稳定可靠。
响应面法;杜仲叶;绿原酸;高效液相色谱
杜仲(EucommiaulmoidesOliv)为杜仲科杜仲属植物,传统用药中,杜仲一直以皮入药,其性味甘温,具有补肝肾,强筋骨,安胎的功效,主治肾虚腰痛,腰肢无力,风湿痹痛和胎动不安[1],但树皮的剥离对于杜仲生长十分不利。现代研究表明,杜仲叶中主要含有绿原酸、桃叶珊瑚苷、京尼平苷、芦丁及儿茶等成分,具有显著的抗菌、增强免疫、促进生长及改善肉质等作用[2-7]。鉴于杜仲叶的主要有效成分、药理作用与杜仲皮基本一致,且杜仲叶廉价易得,杜仲叶代皮入药具有重要的潜在应用价值。本试验以杜仲叶提取物得率及绿原酸转移率为评价指标,在单因素试验基础上,应用响应面法优化杜仲叶提取物制备的最佳工艺条件,旨在为杜仲叶的进一步开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验药物 绿原酸对照品(含量96.2%,批号110753-201415),购自中国食品药品检定研究院;杜仲叶(秦仲1号品种),2015年8月10日采自陕西省略阳县金家河镇寒峰村万亩杜仲基地。
1.1.2 主要仪器 ChromasterΜltra Rs超高效液相色谱仪(diode array detector 6430型二极管阵列检测器,binary pump),日本HITACHI公司产品;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂产品;HH-S6型电热恒温水浴锅,北京科伟永兴仪器有限公司产品;BSA224S-CW型电子天平,北京赛多利斯科学仪器有限公司产品。
1.1.3 主要试剂 甲醇(色谱纯,批号20140410),乙腈(色谱纯,批号20141106),磷酸(色谱纯,批号20130824),购自天津市科密欧化学试剂有限公司;无水乙醇(分析纯,批号2015061501),购自成都市科龙化工试剂厂。
1.2 方法
1.2.1 绿原酸含量测定方法的建立
1.2.1.1 色谱条件 色谱柱:Welchrom C18柱(4.6 mm×250 mm,5 μm),检测波长:327 nm,流速:1.0 mL/min,柱温:25℃,固定相:C18柱,流动相:乙腈-0.4%磷酸(13∶87,V/V)。
1.2.1.2 绿原酸对照品溶液的制备 精密称取绿原酸对照品10.5 mg加500 mL/L甲醇定容于10 mL棕色量瓶中,得1 050 μg/mL绿原酸标准溶液,再分别吸取0.1、0.2、0.3、0.4、0.5、0.6 mL于1 mL棕色容量瓶中,加500 mL/L甲醇定容至刻度,分别得到105、210、315、420、525、630 μg/mL不同浓度梯度的对照品溶液[1]。
1.2.1.3 标准曲线的绘制 将1.2.1.2中不同浓度的绿原酸对照品溶液过0.22 μm滤器过滤,照1.2.1.1色谱条件下操作,高效液相色谱仪注入10 μL,测定峰面积。以进样量为横坐标,峰面积为纵坐标,绘制标准曲线。
1.2.1.4 方法学验证试验 对绿原酸含量测定的方法,进行加样回收率、精密度、稳定性和重复性试验,计算加样回收率及相对标准偏差(RSD)[8]。
1.2.2 杜仲叶提取物制备的工艺优化
1.2.2.1 单因素试验
①单因素试验设计。准确称量杜仲叶粉 20 g,置于 500 mL圆底烧瓶中,以浸膏得率为评价指标,分别固定液料比、乙醇浓度、提取温度、提取时间、提取次数中的4个因素,改变另1个因素,考察单因素对杜仲叶浸膏得率的影响[9]。
②浸膏得率的计算。杜仲叶提取液,减压浓缩至小体积,置于蒸发皿内,50℃水浴加热蒸除溶剂至恒重得浸膏,计算浸膏得率。

1.2.2.2 响应面法优化试验
①响应面法试验设计。在单因素试验基础上,以液料比(A)、提取温度(B)、提取次数(C)等为考察影响因素,以绿原酸转移率(权重系数0.7)和浸膏得率(权重系数0.3)为评价指标[10],根据Box-Behnken中心组合试验设计原理,应用Design Expert 8.0设计3因素3水平优化提取工艺(表1),并进行回归模型方差分析和验证试验。

表1 杜仲叶提取物制备工艺响应面法试验的因素和水平
②转移率测定及计算方法。浸膏中绿原酸含量的测定: 称取浸膏0.37 g置于具塞锥形瓶中,加入500 mL/L甲醇25 mL,超声波助溶,过滤,取续滤液,过0.22 μm滤器,按1.2.1中的方法测定绿原酸含量。杜仲叶中绿原酸含量的测定: 称取杜仲叶粉末1 g,精密称定,置具塞锥形瓶中,精密加入500 mL/L甲醇25 mL,称定重量,加热回流30 min,放冷,再称定重量,用500 mL/L甲醇补足减失的重量,提取3次,摇匀,滤过,取续滤液,过0.22 μm滤器[1],按1.2.1中的方法测定绿原酸含量,并计算绿原酸转移率:

③制备工艺验证试验。按照响应面法优化的最佳提取工艺做3次平行试验,与理论值相比较,计算相对误差。

2 结果
2.1 绿原酸含量测定的标准曲线
绿原酸含量测定的回归方程为y=2 887 462x-148 005,r=0.999 8,在105 μg/mL~630 μg/mL浓度范围内与峰面积值有良好的线性关系(图1)。精密度试验、稳定性试验、重复性试验RSD均小于2.00%;平均回收率为102.17%(浸膏RSD=1.24%)和103.62%(杜仲叶RSD=1.74%);说明该方法的准确度、稳定性和重复性良好。
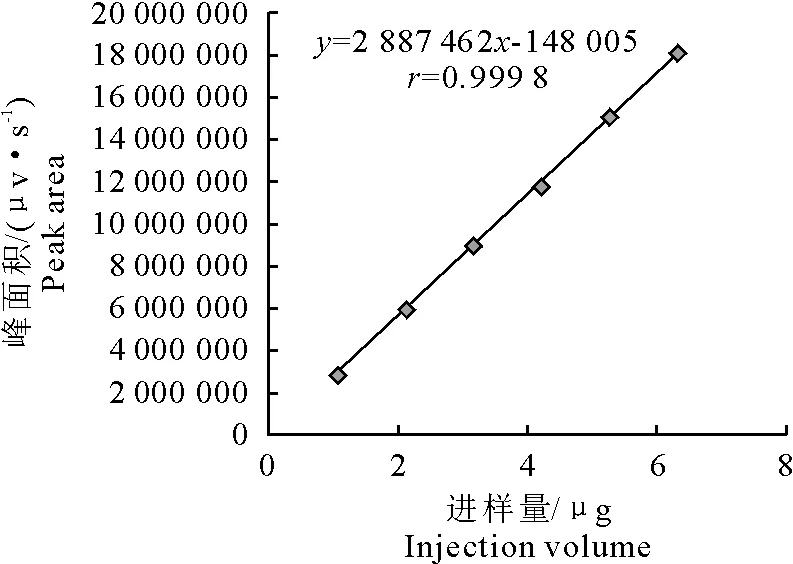
图1 绿原酸对照品标准曲线
2.2 杜仲叶提取物制备的工艺优化结果
2.2.1 单因素试验结果 液料比、提取温度、提取次数对浸膏得率有较明显影响,因此设定提取时间0.5 h,乙醇浓度50%,对料液比、温度、提取次数等进行响应面法优化筛选试验。
2.2.2 响应面法优化制备工艺试验结果 杜仲叶提取物制备响应面法试验结果见表2。浸膏得率及绿原酸转移率加权综合评分Y对液料比A、提取温度B和提取次数C的二次多项回归方程y=87.10+1.55A+4.56B+1.95C-0.011AB+3.03AC-0.70BC+3.83A2+1.64B2-3.07C2。模型的P<0.01,说明该回归模型达到极显著水平,失拟误差P>0.05,说明模型对试验拟合较好,可用此模型对杜仲叶提取浸膏得率和绿原酸转移率进行分析和预测。方差分析表明,B对响应值影响极显著;交互项AC达到显著水平,说明液料比和提取次数存在交互作用;A2和C2对响应值影响显著,说明液料比和提取次数对结果的影响不是简单的线性关系。试验因素对杜仲叶提取浸膏得率和绿原酸转移率的影响顺序为,提取温度>提取次数>液料比(表3)。
由Design Expert预测的最佳条件为:液料比10∶1,提取温度100℃,次数4.7次。根据实际情况及可操作性,调整最佳提取工艺条件为液料比10∶1,提取温度97℃(水浴设定温度100℃,实测温度为97℃),提取次数4次。按修正的最佳条件进行3次验证试验,综合评分分别为97.80、99.38和100.06,均值为99.08,与预测值(100.16)基本一致(相对误差1.08%<5%)。说明相应模型可以较好反映浸膏得率和绿原酸转移率的提取条件。
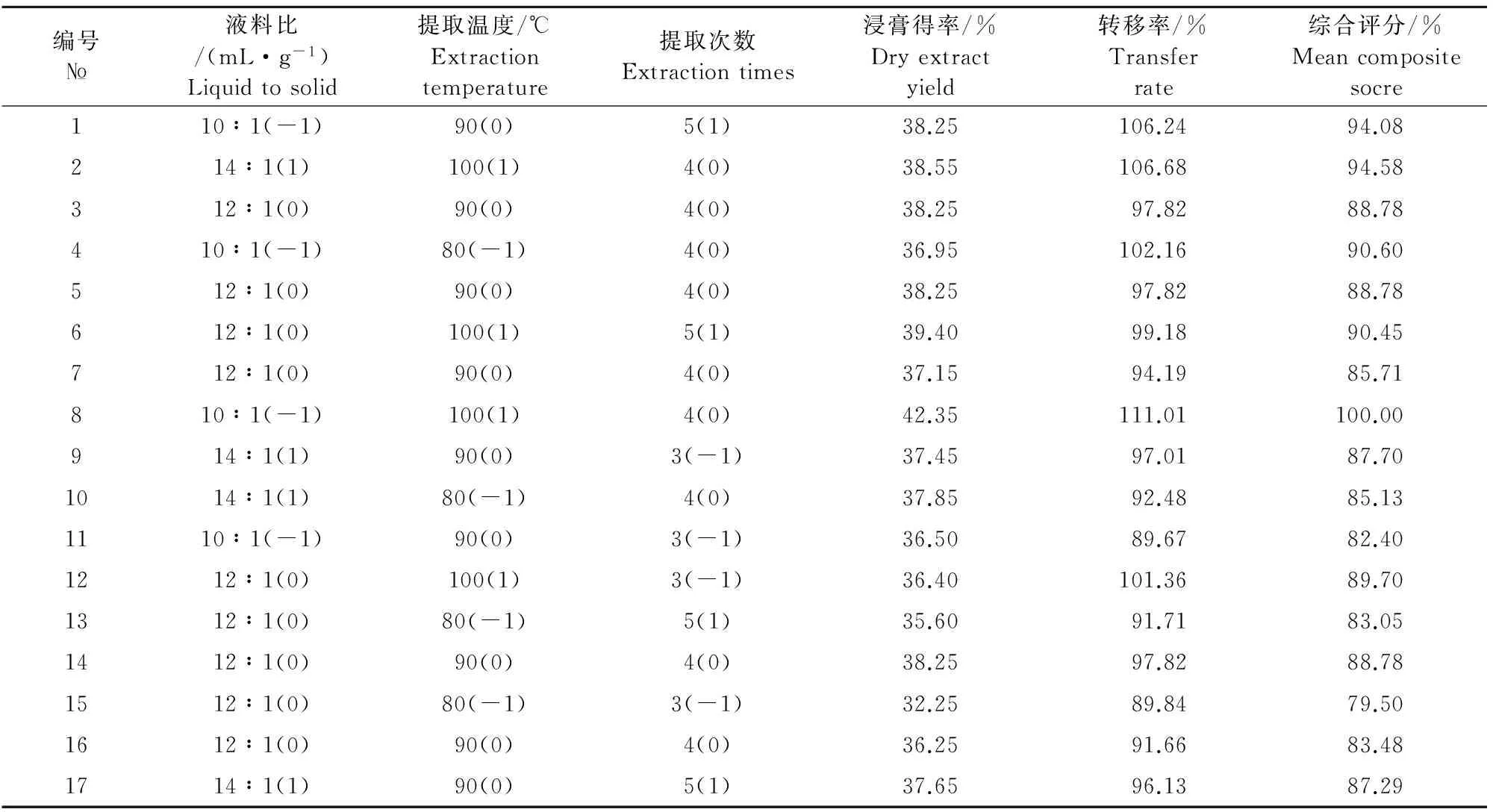
表2 杜仲叶提取物制备响应面法试验设计及结果
注:括号内为对应的编码值,综合评分=绿原酸转移率/绿原酸最大转移率×70%+浸膏得率/浸膏最大得率×30%;杜仲叶中绿原酸含量测定均值为1.41%。
Note:Brackets for the corresponding encoded value,the composite score = transfer rate of chlorogenic acid / the maximum transfer rate of chlorogenic acid × 70% + extract yield / the maximum extract yield × 30%; the mean content of chlorogenic acid in EF is 1.41%.
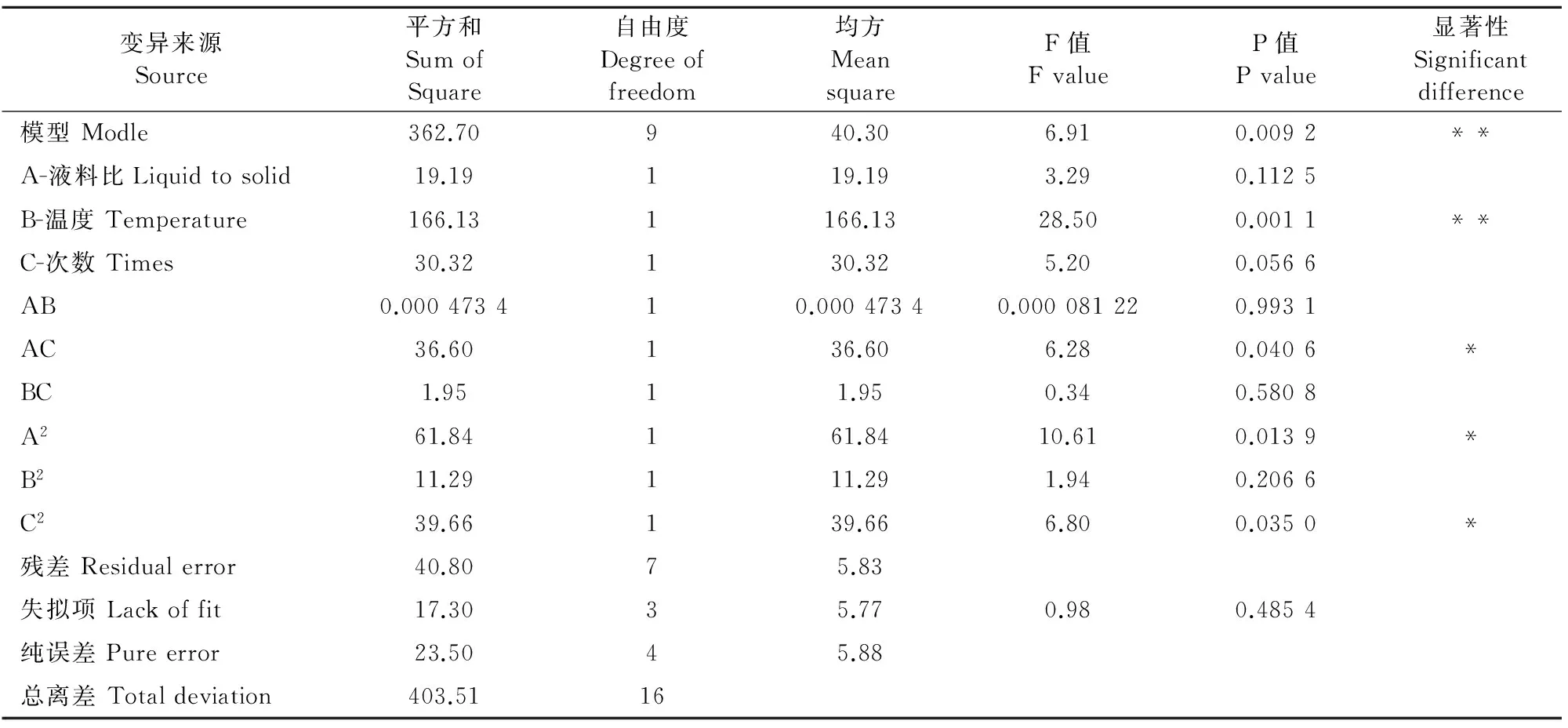
表3 响应面结果方差分析
注:“**” 表示差异极显著,P<0.01;“*” 表示差异显著,P<0.05。
Note:"**" represents extremely significant difference,P<0.01;"*" represents significant difference,P<0.05.
3 讨论
3.1 绿原酸含量测定方法的建立
杜仲叶中绿原酸含量测定方法主要有紫外分光光度法、纸层析-紫外分光光度法和高效液相色谱法。研究表明,紫外分光光度法因杂质干扰较大,重复性差,纸层析-紫外分光光度法可去除杂质干扰,但耗时较长,准确性差,高效液相色谱法快速、准确、方便,精密度、稳定性较高,重复性好[11-14]。本试验曾采用紫外分光光度法测量杜仲叶中绿原酸的含量,但在327 nm附近处峰形不明显,干扰物较多;采用高效液相色谱法测定时,327 nm处峰形明显规整,杜仲叶中绿原酸含量1.41%,高于紫外分光光度法所测含量,且理论塔板数大于8 000,与相邻峰分离度大于3。
3.2 杜仲叶提取物制备的最佳工艺条件
响应面法试验次数少、周期短、所求回归方程精度高,试验数据更加接近实际值,在中兽药提取工艺优化中已逐渐取代正交试验法[15-17]。本试验先经单因素试验,确定了影响杜仲叶提取物制备的主要因素,进一步应用响应面法优化了最佳工艺条件。方差分析结果表明,提取温度对杜仲叶提取物得率及绿原酸转移率有极显著影响,液料比与提取次数存在交互作用,且液料比及提取次数的影响不是简单的线性关系。按乙醇浓度50%,液料比10∶1,提取温度97℃,提取4次,每次提取0.5 h的最佳工艺条件,杜仲叶提取物得率及绿原酸转移率综合评分99.08,与预测值基本一致,为杜仲叶提取物制备的最佳工艺条件。
[1] 中国药典委员会.中华人民共和国药典2015年版第一部 [M].北京:中国医药科技出版社,2015.
[2] 冯 晗,周宏灏,欧阳冬生.杜仲的化学成分及药理作用研究进展[J].中国临床药理学与治疗学,2015,20(6):713-720.
[3] 杨林军,黄文平,吴永忠,等.杜仲板皮和枝皮中4种有效成分差异性比较[J].中草药,2015,46(4):584-587.
[4] 刘荣华,唐芳瑞,陈兰英,等.不同产地杜仲叶中5种主要有效成分的含量比较[J].中国实验方剂学杂志,2015,21(18):31-34.
[5] 陈玉敏,黄 涛,宋小珍,等.饲粮中添加杜仲叶提取物对爱拔益加肉鸡生长性能及免疫功能的影响[J].动物营养学报,2015,27(7):2224-2230.
[6] 唐晓玲.杜仲叶药理作用新进展[J].光明中医,2015,30(2):1565-1567.
[7] 龚桂珍,宫本红,张学俊,等.杜仲叶和杜仲皮中化学成分的比较[J].西南大学学报:自然科学版,2010,32(1):167-172.
[8] 农业部兽药评审中心.兽药研究技术指导原则汇编(2006-2011年),北京:化学工业出版社,2012.
[9] 郭 菡,朱文学,于 明.杜仲叶乙醇提取工艺优化[J].农产品加工,2012(4):78-80.
[10] 崔兵兵,闫雪生,戴雪梅,等.正交试验法优选菊葛天麻颗粒水提工艺的研究[J].食品与药品,2014(3):191-193.
[11] 杨海峰,李勇军,金礼琴,等.吡喹酮混悬注射液的质量标准研究[J].动物医学进展,2015,36(2):91-95.
[12] 兰小艳,张学俊.杜仲叶中绿原酸含量检测的研究[J].中国畜牧兽医,2010(4):53-56.
[13] 李 坤,武 瑞,伊文君,等.杜仲叶中绿原酸含量测定方法的建立[J].中国兽医杂志,2015(3):61-63.
[14] 陈 颖,高媛媛,钟留情,等.高效液相色谱法测定复方中兽药栓剂中没食子酸的含量[J].动物医学进展,2015,36(2):73-76.
[15] 吕惠卿,温成平,谢志军,等.二次回归正交旋转组合设计优化绵萆薢多糖提取工艺[J].中华中医药杂志,2012(11):2918-2921.
[16] 黄萌萌,乔娟娟,邱亚玲,等.响应面法优化玄参提取工艺研究[J].药学与临床研究,2014(1):34-38.
[17] 牟会荣,陈 昆,王晓岚,等.正交试验法与响应面法在桑叶黄酮提取工艺优化中的应用和比较[J].江苏科技大学学报:自然科学版,2016,30(1):88-93.
Optimization of Preparation Technics of Extract from Eucommia Folia Using Response Surface Methodology
HOU Wei-feng,GUO Chao,FAN Yun-peng,MA Wu-ren,SONG Xiao-ping
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,InstituteofTraditionalChineseVeterinaryMedicine,Yangling,Shaanxi,712100,China)
The aim of this study was to optimize the extraction technology of Eucommia folia (EF).On the basis of single factor experiment,to be used the extract yield of EF and transfer rate of chlorogenic acid composite score as the indexes of evaluation,the extraction technology of EF was optimized by using Box-Behnken central composite design method.The optimal extraction technology of EF was as follows:ethanol concentration,liquid to solid ratio,extraction temperature,extraction times and extraction time were 50%,10∶1(mL/g),97℃,4 times and 30 min,respectively.Under the condition,the mean composite socre was 99.08 ,which is almost the same as the predictive value.The extraction technology to optimize the EF by response surface method (RSM) is stable and reliable.
response surface methodology; Eucommia folium; chlorogenic acid; high performance liquid chromatography
2016-04-19
公益性行业(农业)科研专项(201303040);西北农林科技大学科技发展基金项目(A2990215141)
候伟峰(1989-),男,山西运城人,硕士研究生,主要从事中兽药研究。*通讯作者
S859.3
A
1007-5038(2016)11-0074-04
