牛副流感病毒3型抗体间接ELISA检测方法的建立与初步应用
2016-12-09杨建乐赵贵民侯佩莉王洪梅何洪彬
杨建乐,赵贵民,侯佩莉,王洪梅,李 杰,何洪彬*
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030;2.山东省农业科学院奶牛研究中心,山东济南 250100)
牛副流感病毒3型抗体间接ELISA检测方法的建立与初步应用
杨建乐1,2,赵贵民2,侯佩莉2,王洪梅2,李 杰1*,何洪彬2*
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030;2.山东省农业科学院奶牛研究中心,山东济南 250100)
旨在建立牛副流感病毒3型(BPIV3)抗体间接ELISA检测方法。克隆NP-HN截短串联基因并构建原核表达载体pET28a(+)-NP-HN,诱导纯化NP-HN重组蛋白作为包被抗原,优化ELISA反应条件,建立BPIV3抗体间接ELISA检测方法,进一步与病毒中和试验和进口ELISA试剂盒进行比较,应用本方法对270份临床血清样本进行了检测。结果表明,表达的NP-HN重组蛋白大小为44 ku,具有良好的反应原性,建立的ELISA检测方法特异性强,与牛的主要呼吸道病原如牛病毒性腹泻病毒、牛传染性鼻气管炎病毒等均无交叉反应,批内和批间重复性试验的变异系数小于8%,与病毒中和试验和进口商品化ELISA试剂盒的总符合率分别为96.67%和98.89%。对采自山东、辽宁和天津的270份临床血清样本检测后总的阳性率为82.59%(223/270)。建立的BPIV3抗体间接ELISA方法具有较好的特异性和敏感性,可应用于BPIV3的流行病学调查和抗体检测研究。
牛副流感病毒3型;NP-HN基因;原核表达;酶联免疫吸附试验;抗体检测
牛流行性感冒是由牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV3)引起的一种急性接触性传染病,常发生在饲舍牛群或牛的运输中,故又称“运输热”,以支气管炎、肺炎等呼吸道症状为主要特征。Reisinger等在1959年首次从牛体内分离到BPIV3,目前该病毒已经在很多国家和地区被分离到[1]。近年来,随着养牛业的不断发展,以及国内外活牛运输的日益频繁,我国规模化牛场呼吸道综合征造成的经济损失越来越严重[2]。在我国有些省份的牛群中BPIV3血清抗体阳性率甚至高达95.15%[3]。2015年,罗玉江等[4]对新疆北部4个规模化奶牛场的162份流产死胎与鼻拭子等样本进行了BPIV3的实时荧光定量RT-PCR检测,核酸阳性率为9.26%,这提示BPIV3在我国已经流行。当前,针对BPIV3的诊断与防控,国外主要使用疫苗免疫预防并有商品化的抗体ELISA检测试剂盒,我国目前尚无自主知识产权的相关诊断试剂。因此,亟需建立快速检测方法,用于BPIV3的流行病学调查与研究。
BPIV3为副黏病毒科副黏病毒亚科呼吸道病毒属的成员,有囊膜,是不分节段的单股负链RNA病毒。基因组排列次序为3′-leader-NP-P/C/V-M-F-HN-L-trailer-5′,病毒基因组全长至少编码6种结构蛋白,大致为两类,一类为内部蛋白,包括NP(核衣壳蛋白)、P(磷蛋白)、L(大分子蛋白);另一类为外部蛋白,包括M(囊膜蛋白),F(融合蛋白),HN(血凝素和神经氨酸酶)。NP是核衣壳抗原,HN是表面抗原,其中NP蛋白单体呈现螺旋状结构,NP蛋白C端结构域分布在核衣壳表面,含有抗原决定位点,能用于检测病毒自然感染诱导产生的特异性抗体。近年来研究证实了BPIV3 NP蛋白上存在3个主要抗原表位区,有2个分布在C端[5]。HN基因在进化过程中高度保守,是病毒中和抗体产生的主要蛋白。本研究通过分析NP蛋白和HN蛋白主要抗原表位区并对其串联后原核表达,以纯化的重组蛋白为包被抗原建立了BPIV3抗体间接ELISA检测方法,为我国牛群中BPIV3的临床检测和流行病学调查提供了技术保障。
1 材料与方法
1.1 材料
1.1.1 重组菌、病毒、血清及临床样本 pET28a(+)原核表达载体,BPIV3 SD2014分离株(CGMCC 9992),BPIV3抗体阳性血清和阴性血清、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)、牛呼吸道合胞体病毒(Bovine respiratory syncytial virus,BRSV)、牛冠状病毒(Bovine coronavirus,BcoV)、牛流行热病毒(Bovine ephemeral fever vrus)、牛支原体(Mycoplasma bovis,Mb)、多杀性巴氏杆菌(Pasteurella multocida,Pm)阳性血清均通过病毒中和试验(VNT)或进口ELISA试剂盒检测验证,为山东省农业科学院奶牛中心疾病研究实验室保存。90份BPIV3阴阳性血清为山东省农业科学院奶牛中心疾病研究实验室保存,270份临床血清样本分别采自山东省、辽宁省和天津市的3个奶牛场。
1.1.2 主要试剂 大肠埃希菌DH5α和BL21(DE3)、Blue plus Ⅱ protein Marker(14 ku~100 ku)为北京全式金生物技术有限公司产品;Ni-NTA蛋白纯化系统为Qiagen公司产品;马血清为北京索莱宝科技有限公司产品;辣根过氧化物酶标记的山羊抗牛IgG为Sigma公司产品;Pierce BCA蛋白定量分析试剂盒为Thermo Scientific公司产品;Parainfluenza-3 Virus (PI3) Antibody Test Kit(P00652-2,批号4148)为美国爱德士公司产品;分子生物学常规试剂为宝生物工程(大连)有限公司产品;其他生化试剂均为国产分析纯。
1.2 方法
1.2.1 抗原表位区域的筛选 根据本实验室分离测序的BPIV3 SD2014分离株NP基因和HN基因序列,运用Lasergene 7.1软件中的Protean程序分别对NP蛋白和HN蛋白氨基酸序列进行主要抗原表位分析。
1.2.2 原核表达载体pET28a(+)-NP-HN的构建与鉴定 根据BPIV3 SD2014分离株NP和HN基因序列,同时参考SD0835株(登录号HQ530153),针对分析获得的抗原表位区域,设计两对引物分别扩增NP、HN基因抗原表位的截短片段,中间用G4S多肽序列连接,最后通过重叠延伸PCR方法串联,引物序列见表1。以BPIV3 cDNA为模板用NP-BamH I-F和NP-G4S-R为引物扩增NP片段,以HN-G4S-F和HN-Hind III-R为引物扩增HN片段。经电泳检测和凝胶纯化后,再以扩增得到的NP、HN截短片段为模板,用NP-BamH I-F和HN-Hind Ⅲ-R为引物,PCR扩增NP-HN基因。最后将纯化产物连接pET28a(+)原核表达载体,挑菌提取质粒后双酶切鉴定,正确的重组质粒送华大基因测序,并命名为pET28a(+)-NP-HN。

表1 引物序列
注:小写字母为限制性内切酶位点,斜体为45 nt的G4S多肽核苷酸序列。
Note:The small letters are the sites for restriction enzyme digestion,and the italic letters were 45 nt nucleotide sequences of G4S peptides.
1.2.3 融合蛋白诱导表达、可溶性分析、纯化与鉴定 按照本实验室报道的方法[6],利用构建的重组质粒pET28a(+)-NP-HN,依照Ni-NTA纯化试剂盒说明书纯化NP-HN融合蛋白。以BPIV3标准阳性血清为一抗,1∶2 000稀释的辣根过氧化酶标记的山羊抗牛HRP为二抗,Western blot检测纯化蛋白的特异性和反应原性。
1.2.4 间接ELISA反应条件的优化 采用方阵滴定法用包被液将NP-HN融合蛋白分别稀释至0.5 μg/mL~16 μg/mL后包被96孔ELISA板,每孔100 μL,确定最佳抗原包被浓度;以1∶20~1∶200稀释BPIV3标准阳性与阴性血清确定最佳一抗浓度;设置4℃过夜、37℃包被2 h、37℃包被1 h加4℃过夜和37℃包被2 h加4℃过夜4种包被条件,确定最佳包被条件;分别用50 g/L脱脂奶粉、100 mL/L马血清、200 mL/L马血清作为封闭液,37℃分别封闭1 h、1.5 h、2 h进行最佳封闭液及封闭时间的确定。将山羊抗牛IgG-HRP分别稀释2 000倍、4 000倍、8 000倍、16 000倍,确定最佳二抗稀释浓度。以阳性血清和阴性血清分别测量的OD450 nm的P/N值最大值作为ELISA最佳条件。
1.2.6 特异性试验 用优化好的间接ELISA方法分别对本实验室保存的BVDV、IBRV、BRSV、BcoV、BEFV、Mb和Pm阳性血清各10份进行检测(已经用VNT检测BPIV3抗体阴性),以BPIV3标准阳性、阴性血清以及空白孔作为对照。
1.2.7 敏感性试验 选取已经应用VNT检测BPIV3抗体阳性血清8份,分别按1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280的比例稀释,按照优化好的间接ELISA方法进行试验。
1.2.8 重复性试验 首先进行批内重复性试验,用同一批次制备的抗原包被ELISA板,随机抽取应用VNT检测的BPIV3血清抗体效价不同的6份样本,每个样本3次重复,进行批内重复性试验。用同样的方法以不同时间制备的3批抗原包被ELISA板,进行批间重复性试验,分别计算变异系数,评估本方法的重复性。
1.2.9 符合率试验 随机选取本实验室保存的BPIV3阴阳性血清样本90份,分别运用本研究建立的BPIV3间接ELISA方法、进口商品化间接ELISA抗体检测试剂盒和VNT进行比较检测,血清中和试验具体步骤参考文献[7],血清抗体效价≥2时判定为阳性,并分别计算两种间接ELISA方法与VNT的符合率。
1.2.10 临床样品检测 运用本研究建立的BPIV3间接ELISA方法对2015年9~11月分别采自山东省、辽宁省及天津市3个奶牛场的270份临床血清样品进行抗体检测,并统计分析BPIV3抗体阳性率。
2 结果
2.1 抗原表位区的筛选
以BPIV3SD2014株NP蛋白和HN蛋白的氨基酸序列为研究对象,用软件分别对这两个蛋白进行分析,结合文献报道,最终确定NP蛋白的C端388aa-515aa,HN蛋白的C端355aa-572aa为优势抗原区。
2.2 NP-HN基因截短串联扩增与重组原核表达载体的鉴定
PCR扩增产物分别经10g/L琼脂糖凝胶电泳检测,获得截短的NP和HN片段大小与预期的一致,分别为390bp和657bp,重叠延伸PCR扩增NP-HN片段,电泳检测得到与目的片段大小一致的1 092bp的条带。将重组质粒pET28a(+)-NP-HN经BamHⅠ和HindⅢ双酶切,电泳检测在1 092bp与5 369bp左右出现特异性条带,与NP-HN截短串联基因和pET28a(+)大小一致(图1)。

M1.DNA标准DL2 000,M2.DNA标准DL10 000 ;1.NP基因截短扩增;2.HN基因截短扩增;3.NP-HN串联扩增;4.重组表达载体pET28a(+)-NP-HN双酶切产物
M1.DNAMarkerDL2 000;M2.DNAMarkerDL10 000; 1.TheamplificationoftruncatedNPgene; 2.TheamplificationoftruncatedHNgene; 3.TheoverlapextensionamplificationofNP-HNgene; 4.DoubleenzymedigestionproductsofrecombinantexpressionvectorpET28a(+)-NP-HN
图1NP-HN基因的PCR扩增及重组质粒的鉴定
Fig.1PCRamplificationofNP-HNgeneandidentificationofrecombinantplasmid
2.3 融合蛋白的可溶性分析、纯化与鉴定
阳性重组质粒pET28a(+)-NP-HN转化至BL21(DE3)表达菌株,终浓度1mmol/LIPTG在37℃诱导表达6h后,与未诱导组相比NP-HN融合蛋白大量表达。可溶性分析表明,该融合蛋白可以以包涵体和可溶性蛋白两种形式表达,但是因为包涵体蛋白没有活性,故采用Ni-NTA非变性条件下纯化具有天然空间构象的可溶性蛋白,经SDS-PAGE检测,在44ku处获得特异性条带,经BCA蛋白浓度测定试剂盒测定蛋白浓度为900μg/mL。经Westernblot特异检测,融合蛋白在约44ku左右出现条带(图2),说明该重组蛋白具有一定的特异性和反应原性。

M.蛋白分子质量标准;1~2.重组蛋白的可溶性分析(1.超声波破碎后上清,2.超声波破碎后沉淀);3~6.融合蛋白NP-HN的纯化产物,7.重组蛋白表达的Westernblot鉴定
M.ProteinmolecularweightMarker; 1-2.Solubleanalysisofrecombinantproteins(1.Supernatantafterultrasonicbreaking; 2.Precipitateafterultrasonicbreaking); 3-6.PurifiedproductoffusionproteinNP-HN;7.Westernblotanalysisofrecombinantprotein
图2 融合蛋白的可溶性分析与鉴定
Fig.2Thesolubilityanalysisandidentificationoffusionprotein
2.4 BPIV3间接ELISA的建立及反应条件的确定
通过方阵滴定法,对BPIV3间接ELISA反应条件进行优化结果见表2。
2.5 BPIV3间接ELISA判定标准

表2 间接ELISA检测方法的反应条件优化

图3 阴性血清样本OD450nm值正态分布图
2.6 特异性试验
对本实验室保存的BVDV、IBRV、BRSV、BcoV、BEFV、Mb和Pm阳性血清用所建立的BPIV3间接ELISA方法检测,测得其OD450 nm值均小于0.266 2,结果BPIV3抗体均为阴性,说明本研究建立的间接ELISA方法特异性较好。
2.7 敏感性试验
将此8份血清按所建立的间接ELISA方法进行检测,按照评判标准,当血清稀释为1∶1 280时,8份血清依然呈阳性,说明本方法灵敏度高。
2.8 重复性试验
通过批内重复性试验和批间重复性试验,对结果进行分析统计,结果见表3,批内重复性试验变异系数在1.89%~5.48%,批间重复性试验变异系数在3.25%~7.38%,均小于8%,证明了该间接ELISA方法具有良好的重复性。

表3 间接ELISA重复性试验
2.9 符合率试验
分别用三种方法对保存的90份BPIV3阴阳性血清进行检测,结果如表4所示。建立的BPIV3 iELISA方法与VNT总符合率为96.67%(87/90),进口BPIV3 iELISA试剂盒与VNT总符合率为97.78%(88/90),进口iELISA试剂盒和研究建立的iELISA方法两者总符合率为98.89%(89/90)。说明建立的ELISA方法与进口试剂盒有较高的符合率。

表4 不同检测方法的结果比较
2.10 临床样品检测
对采自山东省、辽宁省和天津市的270份血清进行了BPIV3间接ELISA检测,共有BPIV3阳性血清223份,血清抗体总的阳性率为82.59%(223/270),结果见表5,说明我国北方的这3个省份的奶牛场BPIV3已经普遍流行。
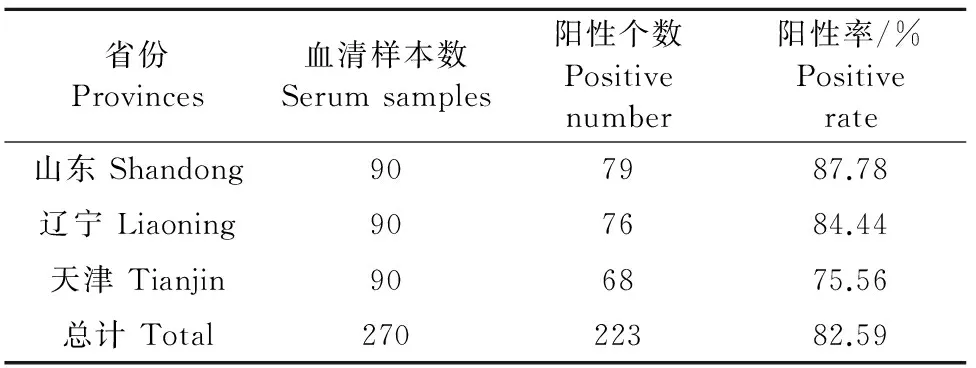
表5 临床血清BPIV3抗体的间接ELISA检测
3 讨论
我国自2008年首次从黑龙江和山东分别分离到BPIV3,2009年又在内蒙古[8]报道分离到BPIV3,目前报道我国12个省份总的抗体阳性率为77.6%[7],说明该病毒已经在我国部分地区流行,国外报道BPIV3流行率最高可以达到90%[9]。由于牛的许多呼吸道疾病都可以表现出与BPIV3相似的临床症状,而且常常引发混合感染和继发感染,所以临床上不易做出确诊,一般需要进行实验室鉴别诊断。目前实验室常用的本病诊断方法主要包括病毒分离培养、免疫学方法和分子生物学方法等。由于病毒的分离培养检出率低,并且对试验条件和操作人员的技能要求较高。分子生物学方法易出现假阳性,同时对试验的仪器设备依赖程度高。此外,免疫学方法中的血凝与血凝抑制试验、病毒中和试验以及免疫荧光与免疫组化试验更倾向于BPIV3的科学研究方面,这些方法在规模化牧场大批量流调筛查中均受到限制,而ELISA方法目前在临床大规模流行病学调查中愈来愈受到青睐。因此,研发具有我国自主知识产权的BPIV3 ELISA诊断方法迫在眉睫。
呼吸道病毒属的仙台病毒NP蛋白免疫试验研究表明,NP蛋白比HN和F蛋白可诱导更高的IgG抗体,特别是在病毒感染后期可以诱导保护性的免疫反应。吕闯等[10]以NP蛋白制备的单抗,通过间接ELISA、Western blot、IFA试验表明该单抗具有良好的反应性和特异性。周玉龙等[11]以6 μg/mL的HN蛋白为包被抗原建立了ELISA方法,这些报道证明了NP蛋白和HN蛋白均具有良好的反应原性,可以作为建立诊断方法的抗原蛋白。本研究分别选取NP蛋白的C端388 aa-515 aa和HN蛋白的C端355 aa-572 aa为优势抗原区,为了不影响两个蛋白的空间表位,我们通过G4S多肽Link将他们串联表达,通过优化蛋白纯化的诱导时间和温度,发现在37℃,诱导6 h能产生大量可溶性的融合蛋白NP-HN,通过优化ELISA条件,选择抗原的包被浓度是4 μg/mL,并通过Western blot检测发现其与标准阳性血清具有很好的反应原性。同时建立的ELISA方法与病毒中和试验和国外进口试剂盒有很高的符合率(96.67%和98.89%),表明本方法可用于BPIV3抗体的定性检测。
目前,我国尚无BPIV3商品化检测试剂盒,本研究建立的BPIV3抗体间接ELISA诊断方法可用于BPIV3的流行病学调查研究和抗体检测,为本病的防控奠定了基础。
[1] Neill J D,Ridpath J F,Valayudhan B T.Identification and genome characterization of genotype B and genotype C bovine parainfluenza type 3 viruses isolated in the United States[J].BMC Vet Res,2015,11:112.
[2] 王洪梅,赵贵民,侯佩莉,等.牛呼吸道疾病综合征流行现状及防控技术研究进展[J].中国畜牧杂志,2015,51(16):33-39.
[3] 霍志云,童 钦,胡嘉欣,等.北方三省(区)牛副流感病毒3型的血清学调查[J].动物医学进展,2012,33(9):124-126.
[4] 罗玉江,李 静,苏贵成,等.奶牛场主要病毒性繁殖障碍疫病感染情况调查[J].中国动物检疫,2015,32(6):15-17.
[5] Ren J L,Zhu Y M,Zhou Y H,et al.Identification of three antigen epitopes on the nucleocapsid protein of the genotype C of bovine parainfluenza virus type 3[J].Vet Microbiol,2015,178(1-2):61-69.
[6] 朱 彤,侯佩莉,刘 晓,等.牛肠道病毒VP2基因的原核表达及其多克隆抗体的制备[J].中国兽医学报,2015,35(7):1037-1041.
[7] 王海勇,童 钦,王 炜,等.我国牛副流感病毒3型血清学调查[J].中国预防兽医学报,2014,36(2):154-156.
[8] Wen Y J,Shi X C,Wang F X,et al.Phylogenetic analysis of the bovine parainfluenza virus type 3 from cattle herds revealing the existence of a genotype A strain in China[J].Virus Genes,2012,45(3):542-547.
[9] Roshtkhari F,Mohammadi G,Mayameei A.Serological evaluation of relationship between viral pathogens (BHV-1,BVDV,BRSV,PI-3V,and Adeno3) and dairy calf pneumonia by indirect ELISA[J].Trop Anim Health Prod,2012,44(5):1105-1110.
[10] 吕 闯,朱远茂,董秀梅,等.牛副流感病毒3型NP单抗的制备及初步应用[J].中国预防兽医学报,2011,33(12):970-973.
[11] 周玉龙,任亚超,朱战波,等.牛副流感病毒3型HN基因原核表达及间接ELISA方法建立[J].病毒学报,2012,28(1):23-28.
Establishment and Preliminary Application of an Indirect ELISA for Detecting Antibodies against Bovine Parainfluenza Virus Type 3
YANG Jian-le1,2,ZHAO Gui-min2,HOU Pei-li2,WANG Hong-mei2,LI Jie1,HE Hong-bin2
(1.CollegeofLifeScience,NortheastAgriculturalUniversity,Harbin,Heinongjiang,150030,China; 2.DairyCattleResearchCenter,ShandongAcademyofAgriculturalScience,Jinan,Shandong,250100,China)
In order to establish an indirect ELISA (iELISA) for detecting antibodies against bovine parainfluenza virus type 3 (BPIV3),the truncated NP-HN gene was cloned and pET28a(+)-NP-HN vector of prokaryotic expression was constructed.We optimized the ELISA reaction conditions using the NP-HN recombinant protein as coating antigen,and established an iELISA method to specifically detect the positive serum of BPIV3.Further the iELISA method was compared with virus neutralization test and imported ELISA kits,respectively.Finally,270 clinical serum samples were tested.The results showed that the recombinant 44 ku protein could highly expressed in the form of soluble and inclusion bodies inE.coli,which had good antigenic specificity and reactionogenicity,and had no cross reaction with positive serum of bovine viral diarrhea virus,infectious bovine rhinotracheitis virus and other respiratory pathogens.The coefficients of variation for intra and inter-assay were lower than 8%.The total coincidence rate with virus neutralization test and imported ELISA kit were 96.67% and 98.89%.The total positive rate of 270 clinical serum samples from Shandong,Liaoning,and Tianjin was 82.59% (223/270).These results demonstrated that BPIV3 indirect ELISA method was specific and sensitive,and can be used for epidemiological investigation and antibody detection for BPIV3.
Bovine parainfluenza virus type 3;NP-HN;prokaryotic expression;ELISA;antibody detection
2016-04-06
现代农业(奶牛)产业技术体系科学家岗位项目(Cars-37);山东省自然科学基金培育项目(ZR2015PC007);山东省农业科学院科技创新重点项目(2014CXZ08)子课题(2014CXZ08-3);山东省农业科学院重大成果培育项目(2015CGPY02)
杨建乐(1991-),男,河南郑州人,硕士研究生,主要从事动物传染病研究。*通讯作者
S852.653
A
1007-5038(2016)11-0019-06
