食管早癌内镜下黏膜剥离术后追加手术及放疗的握判
2016-12-09沈婷庄耘孙静徐馥杨莉君陈建平
沈婷,庄耘,孙静,徐馥,杨莉君,陈建平
[江苏省常州市第一人民医院(苏州大学附属第三医院) 消化内科,江苏 常州 213003]
食管早癌内镜下黏膜剥离术后追加手术及放疗的握判
沈婷,庄耘,孙静,徐馥,杨莉君,陈建平
[江苏省常州市第一人民医院(苏州大学附属第三医院) 消化内科,江苏 常州 213003]
目的初步探讨食管早癌内镜下黏膜剥离术(ESD)后追加手术及放疗的评判依据。方法 回顾性分析2009年7月-2015年10月,该院消化科112例行ESD治疗的食管早癌患者临床资料、术后病理结果及术后随访结果。结果 随访期内共有7例患者进一步治疗,其中追加食管癌根治手术3例;贲门癌根治术1例,术后淋巴结阳性再次追加化疗;追加ESD术1例;放疗2例。7例患者肿瘤浸润至上皮内层(m1)和黏膜下层上1/3(sm1)各3例,浸润至黏膜肌层(m3)者1例。1例患者病理提示脉管内转移,随访13个月胃镜检查局部无复发,但CT提示腹腔淋巴结转移,随访16个月后死亡。另有1例浸润深度达m1的高级别上皮内瘤变(HGIN)患者,垂直及水平切缘均为阴性,随访7个月局部无复发,但CT提示肝及腹膜后淋巴结转移。结论 术前准确判断癌灶浸润深度及有无淋巴结转移是决定患者治疗方式的重要依据;术后评估病灶是否达到了治愈性切除,随访有无局部复发及淋巴结、远处转移则决定是否需要追加手术及放疗。
食管早癌;内镜下黏膜剥离术;治疗方式
内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)治疗食管早癌具有创伤小、花费低和术后生活质量高的优势,疗效与外科手术相当。及时发现和治疗食管早癌及癌前病变,是降低食管癌发病率和病死率的关键。ESD术后是否需要追加手术及放疗等治疗目前报道较少,现就本院2009年7月-2015年10月行ESD治疗食管早癌患者术后追加手术或放疗等措施做一报道及探讨。
1 资料与方法
1.1一般资料
回顾性分析2009年7月-2015年10月,本院消化科对112例胃镜活检证实的食管早癌患者进行ESD治疗。其中,男83例,女29例,男女比例2.86∶1;年龄39~81岁,平均(63.3±8.2)岁。
1.2适应证
目前国内尚无统一规范的内镜下切除适应证,由于欧美食管癌内镜下切除技术的应用现状与我国差别较大,国内早期食管癌内镜下切除治疗多以参考日本指南为主[1]。普通内镜下食管黏膜形态可疑改变,如局部粗糙、颗粒样改变、皱缩、轻微发红、褪色、糜烂或不规则白色隆起等;超声内镜检查黏膜下层结构清晰完整,无异常增厚,无浸润样低回声改变,无病灶周围淋巴结转移;CT检查无局部及远处淋巴结转移;术前病理证实为高级别上皮内瘤变(high grade intraepithelial neoplasia,HGIN)或黏膜内癌。排除常规内镜检查即可明确诊断食管息肉、食管静脉曲张、明显食管癌的患者和明显食管出血影响染色者,有凝血功能障碍或心脑肺疾病不能耐受者。所有接受ESD治疗患者均签署手术知情同意。
1.3器械
采用Olympus GIT-XQ260J胃镜,NM-200L-0421注射针,FD-IU-1热活检钳,KD-611 IT刀(IT2)、KD-650L和KD-650Q Dual刀、KD-620LR Hook刀,HX-610-90和HX-600-135金属止血夹及HX-110QR型可旋式钛夹释放器,ND-201-11802透明帽,ERBE ICC-200高频电切装置和APC300氩离子凝固器。
1.4方法

图1 具体手术过程
手术过程如图1所示,病灶处2%卢戈氏液染色先确定范围,距离病灶边界外缘0.50 cm处用内镜下氩离子凝固(argon plasma coagulation,APC)标记,黏膜下层分多点注射抬举液(1∶1 000肾上腺素1 ml+0.9%氯化钠溶液100 ml+靛胭脂黏膜染色剂1 ml),使病灶充分抬举,用Hook刀、IT刀及Dual刀等沿标记点外侧缘环周切开黏膜后对病灶处黏膜下层进行剥离,剥离完毕后对创面可见的小血管应用APC凝固或热活检钳处理,创面较深处予以金属钛夹夹闭[2]。标本固定、测量、碘染色和拍照后送检病理[1]。
1.5术后处理及随访
术后第1天禁食,常规补液、使用质子泵抑制剂、抗生素和止血药,观察有无头颈部皮下气肿;必要时行胸部X线检查了解有无纵隔气肿和气胸。术后24~48 h如无出血和皮下气肿,开放流质饮食,48 h后进食半流质,一周后恢复软食。术后第3、6和12个月复查胃镜及胸腹部CT,观察创面愈合情况,病变有无残留或复发以及淋巴结和远处转移。第2或3年每6个月复查1次,3年后每年复查1次。
2 结果
2.1病变部位及范围
112例患者中7例患者为双病灶,并且1例患者先后两次行ESD术,病灶总数共计120例。颈段食管3例,胸上段9例,胸中段31例,胸下段77例,切除病变长度1.00~12.00 cm,平均(4.05±2.19)cm。切除病变范围<1/2周的54例,1/2~3/4周的42例,>3/4周的24例。
2.2并发症
术中穿孔8例,穿孔直径均<1.00 cm,完成病灶剥离后均成功用钛夹夹闭;另有6例术中未发生穿孔,但术后发现皮下或纵膈少量气肿,通过延长禁食时间及加强抑酸、抗感染等治疗后游离气体均自行吸收,无严重不良反应。术中出血均通过热活检钳或APC电凝止血;迟发性出血2例,分别发生在术后第2和3天,出血量均<100 ml,均再次内镜下止血后停止。发生术后狭窄11例;狭窄出现时间在术后19~90天,平均为术后(52.3±13.2)天,中位时间为术后29天。
2.3术后病理与浸润深度

图2 浅表微小神经内分泌癌内镜下表现
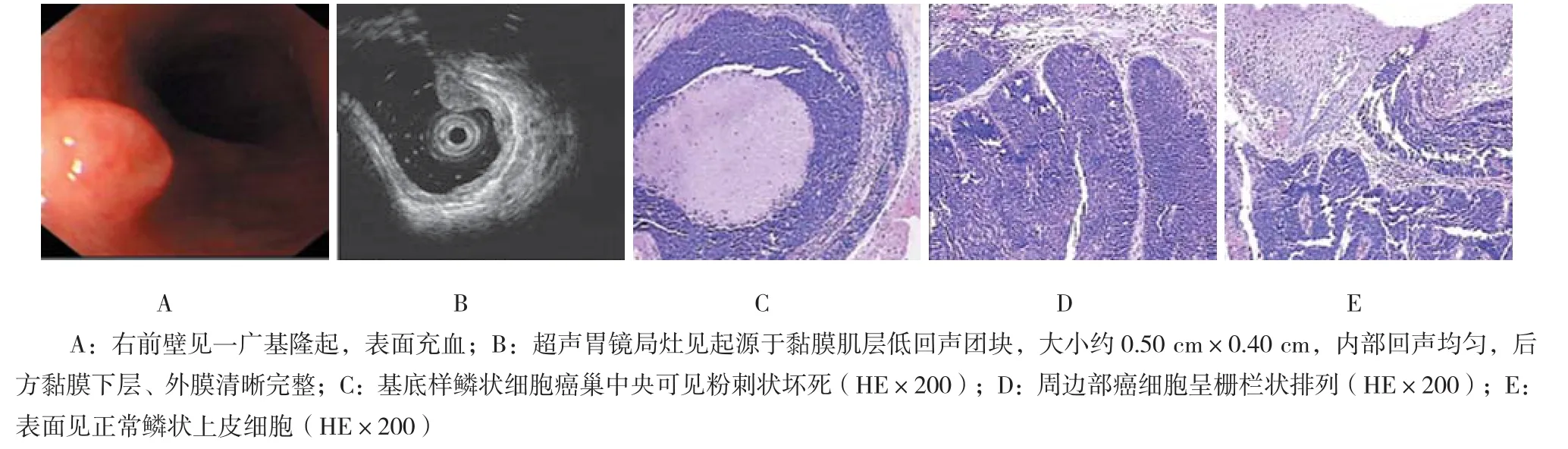
图3 基底样鳞状细胞癌胃镜下表现及术后病理
病理诊断标准参考WHO标准[3],分为低级别上皮内瘤变(low grade intraepithelial neoplasia,LGIN)、HGIN、高分化鳞癌、中分化鳞癌和低分化鳞癌。肿瘤位于上皮内层为m1,肿瘤浸润至黏膜固有层为m2,肿瘤浸润至黏膜肌层为m3,肿瘤浸润至黏膜下层上1/3为sm1。见附表。食管双病灶患者有7例,其中1例患者再次追加ESD手术。食管早癌合并胃早癌3例;食管早癌合并贲门早癌及进展期腺癌各1例。另有2例特殊病理类型的食管肿瘤:1例浅表微小神经内分泌癌,按增殖活性和组织学分级为G3(核分裂相>20个/10HPF,Ki-67增殖指数>20 %),为低分化高度恶性肿瘤(图2);1例为鳞癌的亚型,基底样鳞状细胞癌(图3)。切缘阳性患者共10例。垂直切缘与水平切缘均阳性患者3例,且浸润深度均达sm1;仅有垂直切缘阳性1例;病灶紧邻基底7例;仅有水平切缘阳性8例,水平切缘LGIN者8例。淋巴组织反应性增生5例,脉管内转移1例。
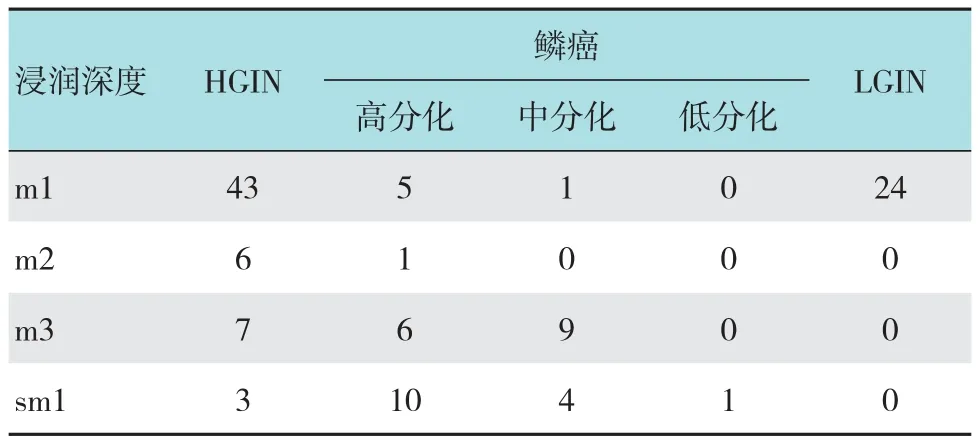
附表 术后浸润深度及其病理结果 例
2.4术后随访
随访期内共7例患者进一步治疗,其中3例追加食管癌根治手术;1例合并贲门进展期腺癌患者行贲门癌根治术,术后淋巴结阳性并追加化疗;1例随访8个月后追加ESD术;2例术后1个月追加放疗。追加治疗患者随访内未见复发;且追加手术及放疗患者术后也未出现吻合口或ESD部位狭窄并发症。7例患者肿瘤浸润深度分别为m1及sm1患者各3例,m3患者1例。切缘阳性患者除上述7例患者追加进一步治疗,余患者随访期内未发现局部复发及淋巴结转移。1例脉管内转移患者由于其未同意行放化疗等进一步治疗,随访13个月胃镜检查局部无复发,但CT提示腹腔淋巴结转移,随访16个月后死亡。另有1例浸润深度达m1的HGIN患者,垂直及水平切缘均为阴性,未行放化疗治疗,随访7个月局部无复发,但CT提示肝及腹膜后淋巴结转移。
3 讨论
对于浅表黏膜内的食管早癌患者推荐采用ESD术已越来越多的被广大医生及患者所接受。术前精细评估病灶大小和预测浸润深度对预防术后残留非常重要。本研究中,浸润至sm1的患者均为HGIN患者或者癌变患者,且肿瘤的分化程度也相对较低;3例垂直切缘与水平切缘均为阳性的患者浸润深度也均达sm1。有研究[4]指出表浅型食管鳞癌ESD术后切缘阳性率为11.4%,肿瘤越大、浸润越深,切缘阳性风险越大。切缘阳性意味着未达到治愈性切除[5],如未达到治愈性切除则需根据患者的情况决定接受补充外科手术或放疗。本组中有3例切缘阳性患者及1例贲门进展期腺癌追加了进一步治疗,随访期内未出现复发及转移。对于发现脉管内转移或淋巴组织转移的患者更应重视后续放化疗等序贯治疗。本组1例脉管内转移患者随访13个月虽胃镜未发现局部复发,但CT提示已腹腔淋巴结转移,随访16个月后死亡。另有1例浸润深度达m1的HGIN患者,垂直及水平切缘均为阴性,随访7个月局部无复发,但CT提示肝及腹膜后淋巴结转移,考虑如下原因可能:①食管的淋巴系统分布于食管除肌层外的各层,即黏膜层、黏膜下层和外膜均有交汇成网的淋巴管分布,且纵行淋巴管远比横行淋巴管丰富,早期发生双向性转移及跳跃性转移的可能性增加。虽然该患者病理类型较早但仍有早期转移可能;②ESD术局限性在于无法行淋巴结清扫,淋巴结有无早期转移依赖于CT或超声内镜等影像学诊断。CT等影像学对于淋巴结转移判断主要基于淋巴结大小,对于部分径线较小的淋巴结转移可能造成漏诊。因此,食管早癌患者ESD术后的CT等随访也十分重要,可以及时发现转移灶以进一步追加放化疗等措施以延缓肿瘤的进展。对于切缘阳性的患者本组资料中由于一些原因并未全部追加手术或放疗,未追加治疗的患者随访期内也并未发现局部复发或转移。发生上述这种现象的原因,一方面可能与ESD术中所定边界距离病灶太近,切缘正常组织回缩,导致病灶紧临切缘所致[6];另一方面可能与随访时间较短有关,尚需进一步密切随访观察。本组资料中尚有8例切缘为LGIN及4例淋巴组织反应性增生的患者,随访中并未出现复发或转移,也需进一步随访观察。
2例特殊病理类型的食管肿瘤,1例为基底样鳞状细胞癌,是WAIN等1986年报道的一类罕见的鳞状细胞癌变异型,食管是其好发部位之一。其病理特点为基底样细胞形态为:细胞小、胞浆少、核圆形、深染、一致、无核仁、细胞异型性不明显,但核分裂象多见;肿瘤形成大小不等的癌巢,部分癌巢中央可见粉刺样坏死、周边部癌细胞呈栅栏状排列,部分癌巢呈筛状结构,癌巢周围有较多基底膜样物质沉积。肿瘤的早期阶段易向食管腔内呈隆起性生长,而出现溃疡的均为浸润至深肌层及浆膜层的进展期,推测与肿瘤生长迅速和发生在黏膜基底部有关[7]。基底样鳞状细胞癌具有明显的侵袭性,有资料[8]表明50.0%~80.0%的病例就诊时已有淋巴结转移,本例患者随访17个月后出现复发行手术治疗。另有1例为浅表微小神经内分泌癌,分级达到G3,属于低分化类型,也是一种恶性程度高的少见肿瘤,其预后与分期、治疗方式相关。目前随访期内尚未发现复发及转移。对于上述少见病理类型,早期诊断、早期发现,提供准确的分期与合理的综合治疗对于患者生存有重要影响。
在本组随访患者中有7例双病灶患者,其中1例随访期发现第3处病灶,并再次追加ESD术;2例患者ESD术后复发追加手术,需考虑多源性食管癌或残留癌[5]。SZANTO等[9]认为多源性食管癌的遗漏将是食管癌术后及放疗后复发或转移的重要危险因素。对于这类患者,更应该密切随访,通过染色、放大内镜和窄带成像(narrow-band imaging,NBI)[10]等手段及时尽可能发现存在的多发癌灶和癌前病变的部位和范围。
术前准确判断癌灶浸润深度及判断有无淋巴结转移是决定患者治疗方式的重要依据,术后评估病灶是否达到了治愈性切除(包括标本大小、病变大小、病变性质、分化程度、边缘基底是否暴露、浸润深度和脉管浸润等),密切随访有无局部复发及淋巴结、远处转移则决定是否需要追加手术及放疗。
[1]KUWANO H, NISHIMURA Y, OYAMA T, et al. Guidelines for Diagnosis and Treatment of Carcinoma of the Esophagus April 2012 edited by the Japan Esophageal Society[J]. Esophagus, 2015, 12: 1-30.
[2]周平红, 姚礼庆, 马丽黎, 等. 内镜黏膜下剥离术治疗食管早期癌及癌前病变[J]. 中华消化内镜杂志, 2008, 25(11): 570-573.
[3]ONO S, FUJISHIRO M, NIIMI K, et al. Long-term outcomes of endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms[J]. Gastrointest Endosc, 2009, 70(5): 860-866.
[4]WEN J, LINGHU E, YANG Y, et al. Relevant risk factors and prognostic impact of positive resection margins after endoscopic submucosal dissection of superficial esophageal squamous cell neoplasia[J]. Surg Endosc, 2014, 28(5): 1653-1659.
[5]中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜专业委员会. 中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)[J]. 胃肠病学, 2015, 20(4): 220-239.
[6]刘杰, 令狐恩强, 卢忠生, 等. 上消化道癌前病变及早期癌内镜黏膜下剥离术切除标本阳性的多因素分析[J]. 中华消化内镜杂志, 2012, 29(10): 554-557.
[7]钟定荣, 安广群, 宋欣, 等. 食管基底样鳞状细胞癌17例临床病理分析[J]. 中国肿瘤临床, 2004, 31(2): 99-103.
[8]穆殿斌, 仲伟霞, 孙菊杰, 等. 43例食管基底样鳞状细胞癌临床病理分析[J]. 临床与实验病理学杂志, 2005, 21(6): 673-675.
[9]SZANTO I, ALTORJAY A, KISS J, et al. Determination of the upper margin of superficial esophageal cancer by intraoperative endoscopic examination and toluidine blue staining[J]. Orv Hetil, 1998, 139(3): 127-129.
[10]齐艳荣, 钱晶瑶, 高建新, 等. 内镜窄带成像技术对Barrett食管合并早期食管腺癌的诊断价值[J]. 中国内镜杂志, 2014, 20(12): 1239 -1243.
(吴静编辑)
Endoscopic submucosal dissection with the following surgery or radiotherapy for early esophageal carcinoma
Ting Shen, Yun Zhuang, Jing Sun, Fu Xu, Li-jun Yang, Jian-ping Chen
[Department of Digestive Diseases, The First People’s Hospital of Changzhou (the Third Affi liated Hospital of Soochow University), Changzhou, Jiangsu 213003, China]
Objective To evaluate the basis of following surgery or radiotherapy after endoscopic submucosal dissection (ESD) in patients with early esophageal carcinoma. Methods From July 2009 to October 2015, 112 patients with early esophageal carcinoma underwent ESD, and the characteristics of clinical information, post-op pathology results and follow-up were recorded. Results Among the patients, 7 cases
the following therapy, including 3 with esophageal radical surgery, 1 with gastric cardia radical surgery and chemotherapy for the lymphatic metastasis, 1 with another ESD and 2 with radiotherapy. Invasive depth in these 7 patients was epithelium (ml) in 3 cases, upper 1/3 in submucosa (sm1) in 3 and muscularis mucosa (m3) in 1. Vascular metastasis was found in 1 case, without endoscopic local recurrence under endoscopic follow-up. However, CT revealed abdominal lymph node metastasis, and the patient died 16 months after the procedure. In another patient with high-grade intraepithelial neoplasia (HGIN) in the depth of m1, the surrounding margin of the lesion was negative without local recurrence in the following up for 7 months. CT found the liver and retroperitoneal lymph node metastasis. Conclusion The exact evaluation of invasive depth of the lesion and lymph node metastasis were the basis of the therapies. And following surgery or radiotherapy depended on the radical resection, local recurrence, lymph node and distant metastasis in the follow up.
early esophageal carcinoma; endoscopic submucosal dissection; therapy
10.3969/j.issn.1007-1989.2016.11.023
1007-1989(2016)11-0100-05
R735.1
B
2016-05-03
陈建平,E-mail:cjp7668@sina.com
