急性脑梗死患者血Lp-PLA2 Hcy UA与颈动脉斑块的相关性分析
2016-12-09顾汉沛葛剑青王光胜
顾汉沛 葛剑青 王光胜
1)江苏沭阳县人民医院神经内科 沭阳 223600 2)南京脑科医院神经内科 南京 210029
急性脑梗死患者血Lp-PLA2 Hcy UA与颈动脉斑块的相关性分析
顾汉沛1)葛剑青2)王光胜1)
1)江苏沭阳县人民医院神经内科 沭阳 223600 2)南京脑科医院神经内科 南京 210029
目的 研究血浆脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)、同型半胱氨酸(homocysteine,Hcy)和尿酸(uric acid,UA)水平与脑梗死颈动脉斑块的关系,探讨其在颈动脉斑块形成中的临床意义。方法 选取住院治疗的急性脑梗死患者86例,均行颈动脉超声检测和血Lp-PLA2、Hcy、UA检查,其中斑块组54例,无斑块组32例。结果 斑块组、无斑块组的血Lp-PLA2水平分别为(289.31±107.41)ng/mL和(224.00±104.72)ng/mL,Hcy水平分别为(16.03±4.64)μmol/L和(14.09±2.72)μmol/L,UA水平为(316.24±97.34)μmol/L和(268.76±77.13)μmol/L,差异均有统计学意义(P<0.05)。Logistic逐步回归分析显示,血Lp-PLA2、Hcy和UA均与颈动脉斑块的发生显著相关(P=0.012,OR=1.004,95%CI=1.003~1.108;P=0.029,OR=1.238,95%CI=1.040~1.474;P=0.039,OR=1.000,95%CI=0.995~1.006)。结论 血Lp-PLA2、Hcy和UA水平参与动脉粥样硬化斑块的形成,联合检测并控制能更有力的预防控制动脉粥样硬化斑块导致血栓事件的发生。
脂蛋白相关磷脂酶A2;同型半胱氨酸;尿酸;颈动脉斑块
脑血管疾病特别是脑梗死具有高发病率、致残率、复发率及病死率等特点,给家庭及社会带来了很大负担。研究证实,脑梗死的发生与动脉粥样硬化(atherosclerosis,AS)具有密切相关性[1]。近年来,研究证明血Lp-PLA2、Hcy和UA均为AS的炎症性标志物,能产生促炎介质,损伤血管内皮细胞,对AS斑块的发生发展及稳定性起重要作用[2-4]。本研究通过回顾性分析急性脑梗死患者血Lp-PLA2、Hcy和UA水平,探讨其在脑梗死患者颈动脉斑块形成中的意义。
1 资料与方法
1.1 临床资料 选取2015-04—2015-08入住南京脑科医院神经内科的脑梗死患者86例。诊断符合2014年中国急性缺血性卒中诊治指南[5],并于24 h后行颅脑CT或MRI扫描证实,排除外伤、房颤、血管炎症、肿瘤、血液病等特殊病因引起的缺血卒中者。男27例,女29例;平均年龄(67.65±12.88)岁。
1.2 方法 颈动脉超声检测双侧颈总、颈内、颈外动脉内膜-中层厚度(IMT)、有无斑块形成及狭窄,斑块超声诊断IMT≥1.2 mm及形成斑块或引起管腔狭窄为斑块组,达不到上述标准为非斑块组。
所有患者抽取晨(空腹12 h)肘静脉血5 mL,放入促凝剂管中,送实验室,离心后取血清,采用全自动生化分析仪及配套试剂测定血清尿酸(uric acid,UA)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesferol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、空腹血糖浓度,同时抽血采用酶联免疫吸附法检测Lp-PLA2水平,配套试剂及荧光检测血Hcy水平,并详细记录有无高血压史、糖尿病史。

2 结果
2.1 颈动脉斑块与血Lp-PLA2、Hcy、UA、TC、TG、HDL-C、LDL-C的单因素分析 颈动脉超声检查结果示,86例患者中,颈动脉斑块54例(62.8%),无斑块32例。斑块组血Lp-PLA2、Hcy、TC、LDL-C、UA水平均高于无斑块组,HDL-C低于无斑块组,差别有统计学意义(P<0.05)。见表1。

表1 2组生化指标比较
2.2 单因素分析 2组间高血压、糖尿病、吸烟史差异均有统计学意义(P<0.05),性别、年龄差异无统计学意义(P>0.05)。见表2。
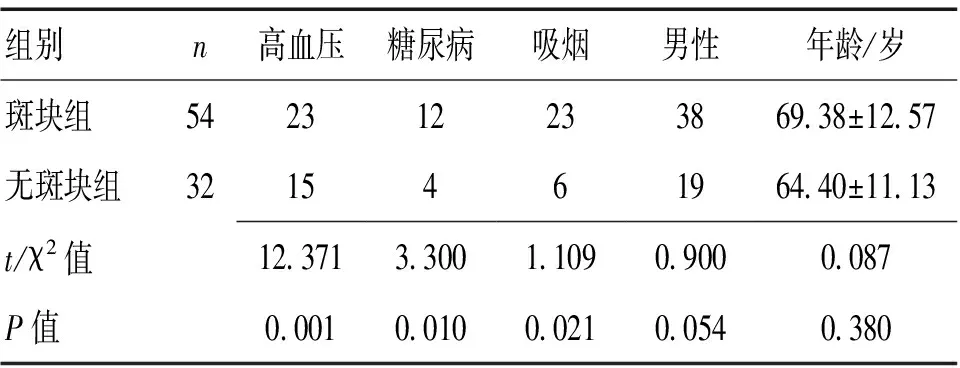
表2 2组一般资料比较 (n)
2.3 颈AS斑块危险因素Logistic回归分析 以颈动脉斑块(无-0,有-1)为因变量,上述差异有统计学意义的指标为自变量,进行Logistic逐步回归分析。Logistic逐步回归分析显示,血Lp-PLA2、Hcy、UA水平为颈动脉斑块发生呈显著正相关(P=0.012,OR=1.004,95%CI=1.003~1.108;P=0.029,OR=1.238,95%CI=1.040~1.474;P=0.039,OR=1.000,95%CI=0.995~1.006)。其中高血压、糖尿病史、LDL-C水平也是颈动脉斑块发生的独立危险因素,见表3。

表3 血Lp-PLA2、Hcy、UA水平与颈动脉斑块的Logistic逐步回归分析
3 讨论
AS是脑梗死及其他血栓性事件的根本原因[1],Lp-PLA2、Hcy和UA为近年动AS性炎症性标志物的研究热点,对AS斑块的发生发展及稳定性起重要作用[2-4]。血Lp-PLA2又称血小板活化因子乙酰水解酶,可水解内皮下间隙氧化低密度脂蛋白产物能刺激黏附因子和细胞因子产生,促进巨核细胞生成,吞噬氧化低密度脂蛋白变成泡沫细胞,形成动脉硬化斑块[6]。Lp-PLA2对氧化脂蛋白代谢增强,局部氧化压力升高,引起内皮细胞受损和功能失调,引起局部炎症导致AS斑块形成[7]。而高Hcy导致血管壁弹力纤维断裂、平滑肌细胞局灶性增生肥大;导致细胞内活性氧产生增加和内皮细胞释放一氧化氮减少,内皮细胞结构功能改变,诱发AS[3]。UA盐结晶可沉积于血管壁引起炎性反应,直接损伤血管内膜,促进血小板聚集;刺激血管平滑肌细胞的增生和诱导内皮细胞功能的异常,抑制内皮祖细胞分化,使血管内皮的修复功能受损;高UA可与高血压、胰岛素抵抗并存,引起脂质代谢紊乱,使纤溶系统紊乱,血液高凝;血尿酸可致LDL-C的氧化及脂质的过氧化,伴随氧自由基生成的增加并参与炎性反应,参与AS形成[4]。而斑块又能释放细胞因子和蛋白酶,降解纤维帽的平滑肌和胶原基质,使得斑块变脆、破裂,影响稳定性,最终导致血栓事件的发生[8]。
本研究结果表明,脑梗死患者颈动脉斑块发生率62.8%,动脉硬化性斑块的发生与TC、TG、HDL-C和高血压、糖尿病史等均呈正相关,与LDL-C呈负相关,与以往研究基本一致。同时本研究还显示,斑块组血Lp-PLA2、Hcy和UA水平均明显高于无斑块组,差异有统计学意义(P<0.05)。提示血Lp-PLA2、HCY和UA水平的升高与AS及斑块形成有明确关系,而Logistic逐步回归分析显示,血Lp-PLA2、Hcy和UA均为颈动脉斑块发生的独立危险因素(P=0.012,OR=1.004,95%CI=1.003~1.108;P=0.029,OR=1.238,95%CI=1.040~1.474;P=0.039,OR=1.000,95%CI=0.995~1.006)。付斌等等[9]研究认为,Lp-PLA2水平与颈动脉硬化斑块具有相关性(P<0.05)。臧卫平等[10]分析显示,颈动脉内膜增厚组、软斑块组、混合斑块组、硬斑块组血浆Hcy的平均水平均高于对照组,差异有统计学意义(P<0.05)。施洪等[11]分析显示,Hcy为AS的独立危险因素。研究显示[4],随着SUA水平的增高,颈动脉斑块的发生率逐渐增高(P=0.013),调整性别、年龄、吸烟饮酒、糖尿病病程等因素后,SUA水平在最高四分位数较最低四分位数的斑块发风险增加2.71倍(95%CI=1.62~4.47)。动物实验也证实,SUA增加与HDL-C降低和LDL-C、TC、TG的增加一样均是颈AS斑块形成的危险因素[12]。
综上所述,血Lp-PLA2、Hcy和UA水平的升高与AS斑块的发生明显相关,对评估颈动脉硬化斑块的发生,预防及控制血栓性事件具有要临床意义。
[1] Yao Q,Zhang C,Zhang X,et al.Synergistic effect if ALOX5AP polymorphisms and cigarette smoking on the risk of atherosclerotic cerebral infarction in a Northern Han Chinese population[J].J Clin Neurosci,2014,21(6):975-979.
[2] Epps KC,Wilensky RL.Lp-PLA2—a novel risk factor for high risk coronary and carotid artery disease[J].J Intern Med,2011,269(1):96-106.
[3] Kim J,Song TJ,Song D,et al.Non-relevant cerebral atherosclerosis is a strong prognostic factor in acute cerebral infarction[J].Stroke,2013,44(7):2 013-2 015.
[4] Li Q,Yang Z,Lu B,et al.Serum uric acid level and its association with metabolic syndrome and carotid atherosclerosis in patients with type 2 diabetes[J].Cardiovasc Diabetol,2011,10:72.
[5] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性卒中诊治指南2014[J].中华神经科杂志,2014,48(4):246-257.
[6] Winkler K,Winkelmann BR,Scharnagl H,et al.Platelet-activating factor acetylhydrolase activity indicates angiographic coronary artery disease independently of systemic inflammation and other risk factors:the LUdwigshafen risk and cardiovascular health study[J].Circulation,2005,111(8):980-987.
[7] Perssom M,Hedblad B,Nelson JJ,et al.Elevated Lp-PLA2 levels add prognostic in formation to the metabolic syndrome on incidence ofcardiovascular events among middle-aged.Nondiabetic subjects[J].Arterioscler Thromb Vasc Biol,2007,27(6):1 411-1 416.
[8] Long L,Wang ZM,Chen Z,et al.The relationship of Plasma Lp-PLA2 level with the stability of neurological impairment in patients with acute ischemic stroke[J].Lab Med,2013,28(10):885-889.
[9] 付斌,陈文华,冯可群.腔隙性脑梗死患者脂蛋白相关磷脂酶A2水平变化及与颈动脉粥样硬化斑块的相关性研究[J].白求恩医学杂志,2015,13(1):77-78.
[10] 臧卫平,刘海涛,冯来会,等.脑卒中患者血浆同型半胱氨酸低密度脂蛋白与颈动脉斑块的相关性研究[J].中国实用神经疾病杂志,2015,18(5):78-79.
[11] 施洪,郭润达,刘辉强,等.颈动脉粥样硬化与同型半胱氨酸、血脂、血糖、尿酸相关性研究[J].中国实用神经疾病杂志,2015,18(1):38-40.
[12] Yur'Eva EA,Sukhorukov VS,Murashov AN,et al.Biochemical indicators of atherogenic and protective activity of xydiphone in experimental animals[J].Bull Exp Biol Med,2012,153(4):459-462.
(收稿2016-03-08)
R743.33
A
1673-5110(2016)23-0039-03
