高蛋白中间水分食品贮藏过程中品质和AGEs含量的变化
2016-12-07谷满屯盛占武郝旺珺商文婷郑丽丽艾斌凌张伟敏
谷满屯,盛占武*,郝旺珺,商文婷,郑丽丽,3,艾斌凌,3,张伟敏,*
(1.海南大学食品学院,海南 海口 570228;2.中国热带农业科学院海口实验站, 海南 海口 570102;3.海口市香蕉生物学重点实验室,海南 海口 570102)
高蛋白中间水分食品贮藏过程中品质和AGEs含量的变化
谷满屯1,2,盛占武2,3,*,郝旺珺2,商文婷1,郑丽丽2,3,艾斌凌2,3,张伟敏1,*
(1.海南大学食品学院,海南 海口 570228;2.中国热带农业科学院海口实验站, 海南 海口 570102;3.海口市香蕉生物学重点实验室,海南 海口 570102)
通过改变贮藏环境的水分活度和添加外源抗氧化剂白藜芦醇到高蛋白食品模型体系中,评价不同白藜芦醇用量、水分活度和贮藏时间对食品美拉德反应程度、质构、颜色、可溶和不可溶性蛋白聚集等指标的影响。结果表明,高蛋白食品在水分活度0.560的环境中贮藏时,美拉德反应、硬度和不可溶性蛋白聚集呈现不断增加趋势,晚期糖基化终末产物(AGEs)含量较水分活度0.751时明显增加;白藜芦醇的添加可降低食品贮藏过程中的美拉德反应程度,增加食品颜色的L*值,降低b*值和a*值;综合各组测定指标,水分活度0.751、白藜芦醇用量500 μg/g时,30 ℃条件下贮藏的高蛋白中间水分食品模型的品质及安全性最优;水分迁移是导致高蛋白食品贮藏过程中蛋白聚集和质地硬化的主要原因。
高蛋白中间水分食品;晚期糖基化终末产物;白藜芦醇;质地变硬;水分迁移
高蛋白中间水分食品是水分含量在10%~40%、蛋白质含量在30%~50%、水分活度在0.5~0.9范围的一类食品,具有加工能耗低、品质好、口感柔软、食用方便等优点[1]。近年来,高蛋白中间水分食品的研发呈现快速增长趋势,不仅用于军用、航天以及应急救援食品,还用于休闲和运动营养食品[2-3]。在常温条件下其保质期一般为6~12 个月;对于军事、航天以及应急救援等特殊用途,保质期要求达到36 个月[3]。目前,高蛋白食品发展的新趋势是制造与传统糖果营养棒口味相似,且更具营养、功能及保藏性的高蛋白营养棒[4]。
高蛋白中间水分食品在贮藏过程中易发生美拉德反应、水分迁移、相分离等物理和化学变化,且随着时间的延长质地不断硬化,货架期大大缩短[2,5]。此外,在贮藏过程中还会产生晚期糖基化终末产物 (advanced glyca tion end products,AGEs),如营养棒(6.96 mg羧甲基赖氨酸/100 g食品,1 784.38 mg羧甲基赖氨酸/kg蛋白质,羧甲基赖氨酸为AGEs的一种)[6]。AGEs是由还原糖的羰基和蛋白质、脂质或核酸等的氨基反应形成的稳定聚合产物[7]。AGEs结构复杂、种类繁多,大多具有交联性、荧光性、对酶稳定、不易被降解等特性。已鉴定的AGEs目前有20多种,包括羧甲基赖氨酸、吡咯素、交联素、戊糖苷素等[8],其生成途径主要有美拉德反应、葡萄糖氧化、脂肪过氧化和多元醇途径[7,9]。AGEs分为内源和外源型两类。内源型AGEs在体内产生,其积累与一些慢性病如肾病、糖尿病等的发病机理密切相关[9]。外源型AGEs主要来源于食品与烟叶等,外源性AGEs是内源型AGEs的重要来源[7],可诱发多种疾病。因此,如何有效控制硬化和AGEs的产生是高蛋白中间水分食品贮藏过程中亟待解决的难题。
多酚类物质与蛋白质可发生络合反应,适量的络合有助于提高蛋白及其酶解物的抗氧化活性[10]。高蛋白中间水分食品品质变硬与蛋白聚集有关[1],而蛋白聚集又与AGEs有关,如蛋白质在二羰基化合物如丙酮醛、乙二醛和3-脱氧葡萄糖醛酮等的作用下,生成赖氨酸二聚体[11]、精氨酸-赖氨酸聚集体[12]等蛋白交联产物。Lavelli等[13]研究表明,添加茶多酚可提高中间水分苹果 产品的抗氧化能力,降低产品中AGEs的含量,提升产品的营养价值。因此,将多酚类物质添加到高蛋白中间水分食品中,不仅可改善食品品质,而且还能抑制AGEs的形成。本研究通过改变贮藏环境的水分活度和添加白藜芦醇到高蛋白中间水分食品中的方式,评价食品贮藏过程中的美拉德反应、硬度、颜色等指标,以期明确高蛋白中间水分食品贮藏过程中的品质和AGEs形成的变化,为高蛋白食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
乳清分离蛋白、葡萄糖、甘油(均为食品级)、三氯乙酸、丙烯酰胺、甲叉双丙烯酰胺、磷酸氢二钠、磷酸二氢钠、考马斯亮蓝G-250、考马斯亮蓝R-250、Tris-Base(均为分析纯) 国药集团化学试剂有限公司;白藜芦醇单体 美国Sigma公司;碱性蛋白酶 丹麦Novozymes A/S公司。
1.2 仪器与设备
SPX-250B-2型恒温生化培养箱 上海博迅实业有限公司;UV-1800紫外分光光度计、F-4500荧光分光光度计日本岛津公司;SHA-CA数显水浴恒温振荡器 常州普天仪器制造有限公司;HygroPalm AM1水分活度仪瑞士罗卓尼克公司;CR-400色差仪 日本柯尼卡美能达公司;CT3 10K质构仪 美国Brookfi eld公司;凝胶电泳仪 美国伯乐公司;G BOX/EF2凝胶成像系统英国Syngene公司。
1.3 方法
1.3.1 高蛋白中间水分食品模型体系的建立
参照余园芳[1]方法。模型体系配方为乳清分离蛋白、葡萄糖、甘油和水,质量分数分别为45%、12.5%、30%和12.5%。制备步骤:将葡萄糖溶解于水,添加不同用量的白藜芦醇(溶于食用乙醇),加入甘油,搅拌均匀;再加入乳清分离蛋白粉,用手揉成均匀的蛋白团。将蛋白团放入水分活度密闭容器中,室温条件下平衡2 h,测定水分活度(0.552~0.600)。设对照组和实验组。对照组为未添加抑制剂的蛋白团;实验组分别为不同用量的白藜芦醇AGEs抑制剂,用量梯度依次为50、200、350、500 μg/g。
1.3.2 贮藏实验
参照Lavelli等[13]方法。将蛋白团放在覆有保鲜膜的自制细铁丝架上一起放入食品保鲜盒,盒内分别装入饱和氯化钠溶液(30 ℃,水分活度0.751±0.001)和饱和溴化钠溶液(30 ℃,水分活度0.560±0.004),然后在
30 ℃条件下恒温培养45 d。在贮藏期内,根据所测指标按期从不同水分活度的对照组和实验组中取样测定。
1.3.3 美拉德反应程度测定
样品美拉德反应程度的测定采用酶解比色法[14]。取250 mg蛋白团样品,用锡箔纸封口,放入冰箱(4 ℃)冷藏24 h,然后将样品分别溶于10 mL pH 8的磷酸盐缓冲溶液(10 mmol/L),磁力搅拌(转速500 r/min)80 min,加入12 μL碱性蛋白酶,放入55 ℃水浴恒温振荡器中振荡15 min。取出后加入1 mL三氯乙酸(800 g/L)溶液以沉淀蛋白和终止反应,过滤取滤液,在420 nm波长条件下测定吸光度。取10 mL pH 8的磷酸盐缓冲液(10 mmol/L)作为空白,方法与样品液相同。每组实验重复进行3 次。
1.3.4 质构的测定
样品质构特性用硬度衡量,选取直径为2 mm的圆柱探头,硬度是以此探头用1 mm/s的速率下压样品高度25%的过程中测得的最大作用力来表征。测定前将所有样品放在室温条件下平衡2 h。每组实验重复进行3 次。
1.3.5 色度的测定
样品的表面颜色用色差仪测定,每个蛋白团样品取4 个不同位置进行测定,记录参数L*、a*和b*的平均值。其中L*代表明度(0表示黑色,100表示白色),a*和b*代表彩色特性,+a*表示红色增加,-a*表示绿度增加,+b*表示黄度增加,-b*表示蓝度增加。每组实验重复进行3 次。
1.3.6 蛋白聚集的测定
不可溶性蛋白聚集的测定采用考马斯亮蓝染色法测定可溶性蛋白总量来推算[1]。考马斯亮蓝试剂配制:称取100 mg考马斯G-250,溶于50 mL 95%乙醇溶液中,加入100 mL质量分数85%的磷酸溶液,用水定容至1 000 mL。试剂常温条件下避光保存。以乳清蛋白作为标准蛋白,以超纯水为空白,绘制的标准曲线R2=0.996。取500 mg蛋白团样品,溶于10 mL超纯水,搅拌(转速500 r/min)80 min,随后经离心机(转速4 000 r/min)离心30 min,取其上清液2 mL,加入2 mL NaN3溶液(0.5 g/L),混匀后置于冰箱冷藏(4 ℃)。测定样品的具体过程:将制备好的样液200 μL稀释60 倍,取1 mL稀释液,加入5 mL考马斯亮蓝溶液,振荡10 s,静置20 min,595 nm波长条件下测定吸光度。用60 μg/mL的标准蛋白液校正。以0 d的吸光度为基准算出所有样品蛋白质的溶解率,再推导出不可溶性蛋白含量。

可溶性蛋白聚集的测定采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法[15],蛋白Marker为SDS-PAGE低分子质量蛋白Marker(14.4~116 kU)。配制10%的分离胶和5%的浓缩胶。取500 mg蛋白团样品,溶于10 mL超纯水,搅拌(转速500 r/min)80 min,随后经离心机(转速4 000 r/min)离心30 min,取其上清液2 mL,加入2 mL NaN3溶液(0.5 g/L),混匀后置于冰箱冷藏(4 ℃)。将凝胶电泳样品缓冲液与样品上清液以1∶1比例混匀,沸水浴 3 min,冰水冷却后上样(10 μL)。电泳结束后,取下胶版用考马斯亮蓝染色液振荡染色4~6 h。染色结束后,倒出所有染色液,倒入脱色液脱色,直至胶版上的条带清晰。脱色结束后的胶版进行拍照,放在含有10%的甘油保护液中保存。
1.3.7 AGEs含量的测定
蛋白团样品中AGEs含量测定采用荧光光谱法[16]。取500 mg蛋白团样品,溶于10 mL超纯水,搅拌(转速500 r/min)80 min,样品离心30 min后,取4 mL上清液冻藏(-20 ℃)。在激发波长370 nm、发射波长440 nm,狭缝宽度为5 nm条件下,用荧光分光光度计测定处理后各样品液的荧光度,以荧光度表示AGEs含量。每组实验重复进行3 次。
1.4 数据统计分析
运用Excel 2007进行数据统计与分析,并以各组数据平均值作图,且作出相应的误差线。用SPSS 19.0软件进行显著差异性分析。
2 结果与分析
2.1 美拉德反应程度的变化
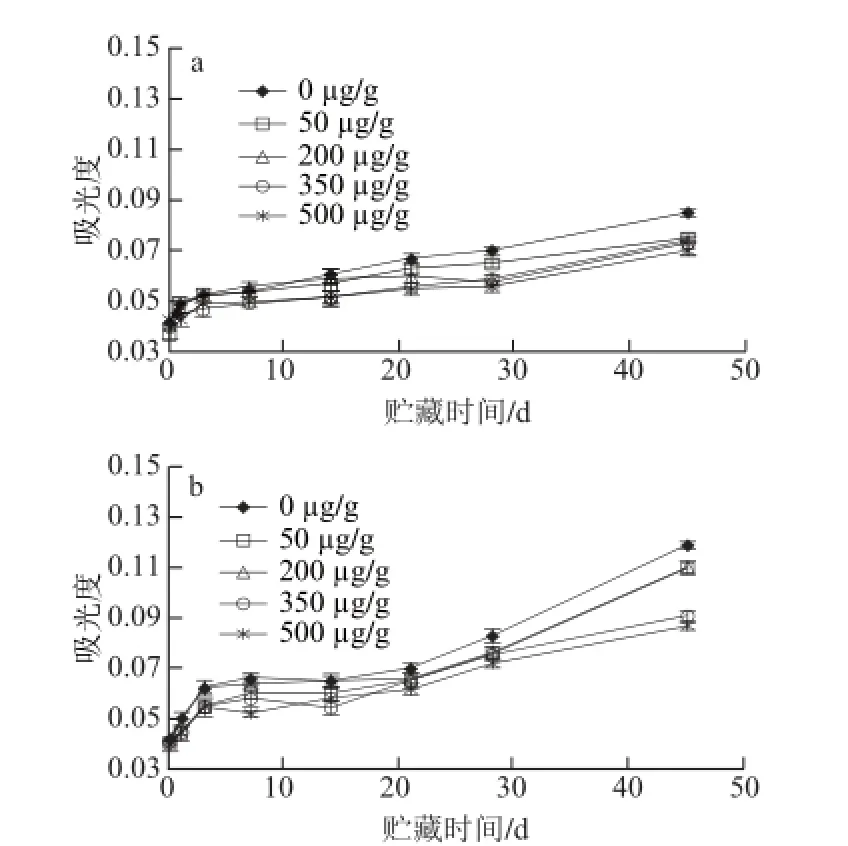
图1 食品模型在水分活度0.751(a)和水分活度0.560(b)贮藏过程中美拉德反应程度的变化Fig. 1 Time courses of Maillard reaction in model food system during storage at aw= 0.751 (a) and aw= 0.560 (b)
由图1所示,不同水分活度条件下贮藏的样品,随着贮藏时间的延长,各组吸光度逐渐升高,并在28 d后
呈现明显上升趋势。其中,水分活度0.751时,对照组及白藜芦醇用量为500 μg/g的实验组在第45天的吸光度分别为0.085±0.002、0.070±0.003,而同一贮藏时 间,水分活度0.560的相应各组的吸光度分别为0.119±0.002和0.087±0.002,即水分活度0.560贮藏的样品吸光度显著高于水分活度0.751(P<0.05),表明其美拉德反应较为剧烈,这一结果与Malec等[17]研究结果一致,即在温度恒定的条件下,水分活度在0.52附近的美拉德反应速率高于其他水分活度(0.33、0.43、0.69、0.85和0.98)。Pereyra等[18]研究表明水分活度会对美拉德反应产生影响,主要是由于不同水分活度对反应物产生了不同的集中或扩散作用所致。从图1可以看出,样品在贮藏21 d后,实验组样品的吸光度比对照组低,说明在贮藏后期白藜芦醇对食品中美拉德反应的抑制效果开始显现,且随着用量增加抑制效果增强,这可能是由于贮藏后期属于美拉德反应的高级阶段,白藜芦醇具有清除乙二醛、甲基乙二醛和3-脱氧葡萄糖醛酮等活性羰基化合物的能力[19],进而抑制了美拉德反应。
2.2 食品硬度的变化
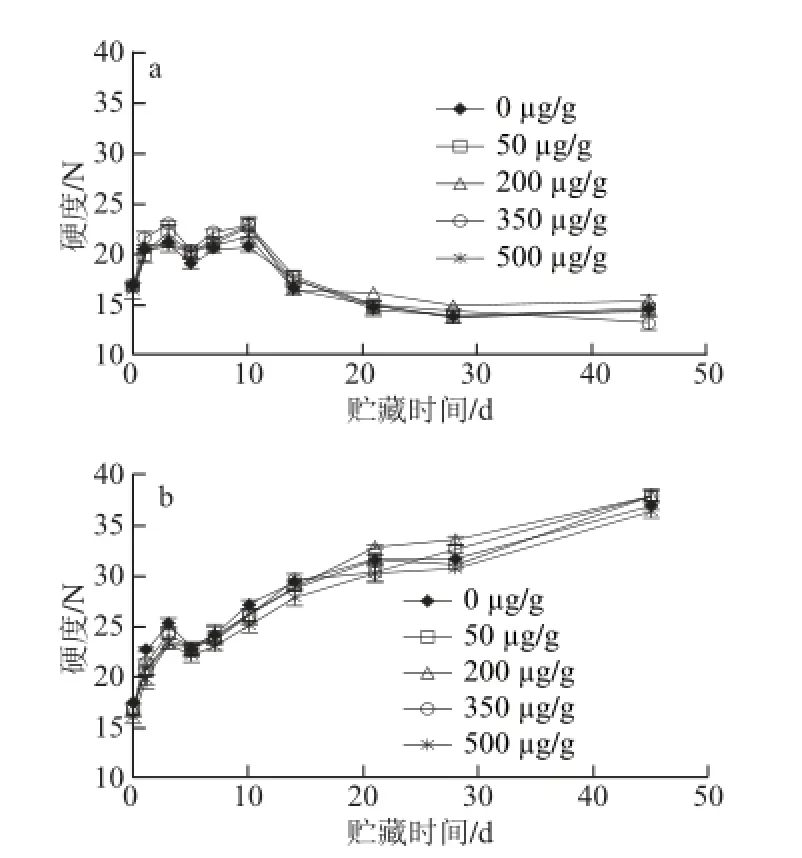
图2 食品模型在水分活度0.751(a)和水分活度0.560(b)贮藏过程中质构的变化Fig. 2 Changes in the hardness of model food system during storage at aw= 0.751 (a) and aw= 0.560 (b)
高蛋白食品在贮藏过程中会因小分子物质迁移、相分离及蛋白质聚集等作用不断发生硬化[1]。如图2所示,样品在两种不同水分活度条件贮藏过程中,硬度变化各异。在水分活度0.560的环境下,样品硬 度较高,这与其美拉德反应结果一致,即美拉德反应越剧烈,赖氨酸二聚体、精氨酸-赖氨酸聚集体等蛋白共价交联产物越多[11-12],导致蛋白聚集进而使食品的硬度增强。水分活度0.751贮藏的样品,除美拉德反应的影响外,高水分活度环境为其提供了吸附周边水分的机会,使因甘油等小分子发生迁移而变硬的蛋白团逐渐软化[20]。不同水分活度贮藏的实验组与对照组样品间的硬度差异较小,这可能是由于小分子迁移引起的体系结构改变是高蛋白食品贮藏初期发生硬化的主要原因[21],而非美拉德反应。可见,贮藏环境的水分活度对食品硬度影响较大,添加抗氧化剂对食品硬度的影响较小。
2.3 食品颜色的变化
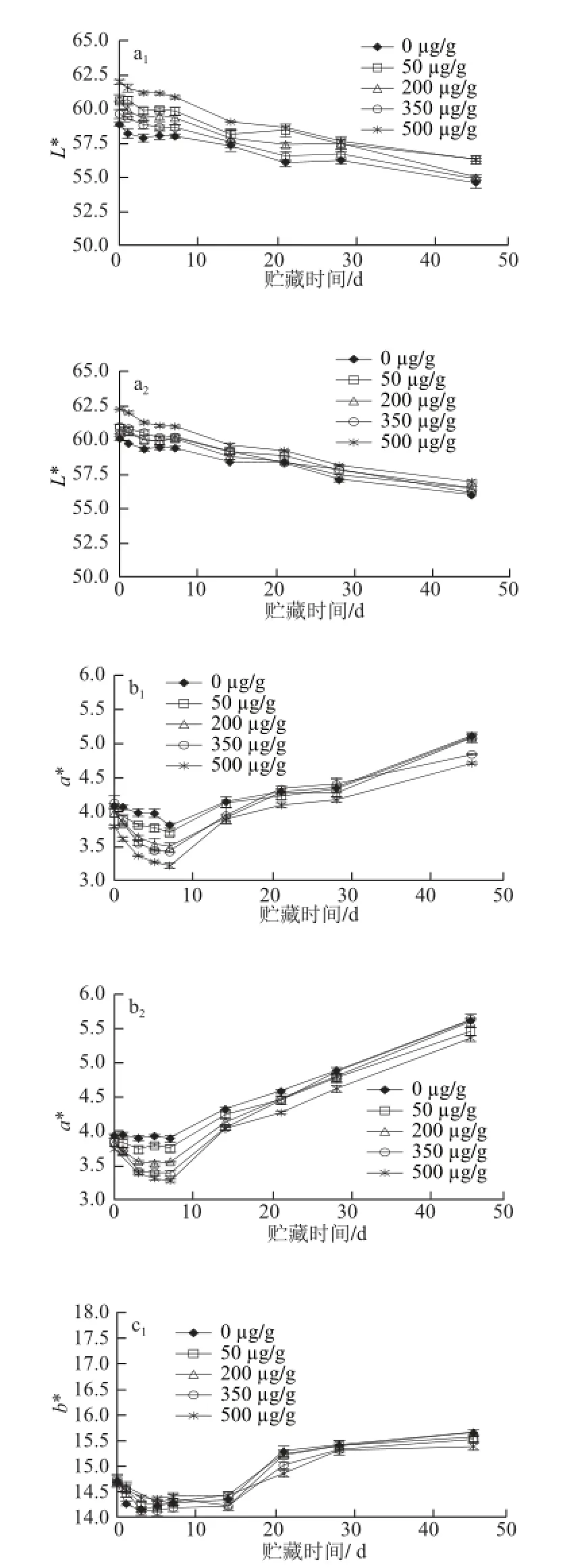

图3 食品模型在不同水分活度条件下贮藏过程中色度的变化Fig. 3 Changes in the chroma of model food system during storage at different water activities
由图3a1、3a2所示,不同水分活度条件贮藏的样品,随着时间的延长亮度均呈现下降趋势,实验组样品的L*值比对照组高,且随着白藜芦醇用量的增加L*值下降幅度降低,水分活度对L*值无明显影响。样品的a*值变化则呈现先降后升的趋势(图3b1、3b2),贮藏前期a*值逐渐降低主要是由于美拉德反应初始阶段生成了大量无色的反应中间体所致[22];随着美拉德反应的进行,各组蛋白团a*值不断上升,这与美拉德反应后期生成的产物类黑素有关[23];从添加白藜芦醇的抑制效果看,实验组样品的a*值普遍比对照组低,这也印证了样品的美拉德反应在一定程度上得到了抑制的结果。样品b*值的变化趋势(图3c1、3c2)与a*值变化趋势相同。由此可见,高蛋白食品在贮藏过程中,通过添加抗氧化剂可以在一定程度上提高食品的L*值,降低食品的a*值和b*值,贮藏环境的水分活度对食品颜色影响较小。
2.4 食品中不可溶性蛋白聚集的变化

图4 食品模型在水分活度0.751(a)和水分活度0.560(b)贮藏过程中不可溶性蛋白聚集的变化Fig. 4 Changes in insoluble protein aggregates of model food system during storage at aw= 0.751 (a) and aw= 0.560 (b)
蛋白聚集是蛋白质通过巯基/二硫键交换重组和非共价键作用的自聚集交联,美拉德反应以及小分子迁移、相分离等物理作用引起的聚集[24]。如图4所示,随贮藏时间的延长,样品中不可溶性蛋白含量均呈上升趋势,表明随着美拉德反应的进行,蛋白质大分子之间通过共价交联(非二硫键)形成了大量的蛋白聚集体[22]。其中,第45天对照组在水分活度0.751时的不可溶性蛋白含量为(27.83±0.40)%,与该组在水分活度0.560时的不可溶性蛋白含量(25.12±0.53)%相比有显著性差异(P<0.05),即样品在水分活度0.751时所含的不可溶性蛋白含量较水分活度0.560时的高。这与其美拉德反应程度相反,说明在贮藏过程中不可溶性蛋白的聚集主要是小分子迁移、相分离等物理作用引起的聚集,其次是美拉德反应, 该结果与张靓等[21]研究高蛋白食品体系质地硬化的结论一致。添加白藜芦醇的实验组与对照组相比,不可溶性蛋白含量无明显差异,表明抗氧化剂的添加对蛋白聚集没有影响,蛋白聚集会导致食品质地变硬,这也进一步印证了添加抗氧化剂不改变高蛋白食品贮藏过程中硬度的结论。
2.5 食品 中可溶性蛋白聚集的变化
高蛋白食品模型的可溶性蛋白聚集采用SDS-PAGE测定,如图5所示,随贮藏时间的延长,酪蛋白/乳球蛋白二聚体条带呈现上移和逐渐变宽的趋势,说明蛋白糖基化反应导致更大分子质量蛋白的产生,如乳白蛋白二聚体的生成[1],这主要是由于蛋白糖基化反应具有随机和非均一性,还原糖随机与蛋白潜在的糖基化位点链接,从而形成非糖基化和糖基化程度不同的蛋白所致[23]。各组样品的乳球蛋白和乳白蛋白条带不断变浅,同时在胶版上方观察到可溶性高分子质量蛋白聚集体(*)的产生,表明部分乳球蛋白和乳白蛋白参与了可溶性蛋白聚集体的形成并发生了交联[25]。由此可见,美拉德反应可导致高蛋白中间水分食品质构变硬,反应初期影响较小,随着反应的进行,蛋白发生糖基化修饰并通过共价键形成高分子质量的聚集体,从而使蛋白质构变硬;而贮藏过程中的水分活度和抗氧化剂的添加对高蛋白食品中可溶性蛋白聚集的影响较小。
2.6 食品中AGEs含量的变化

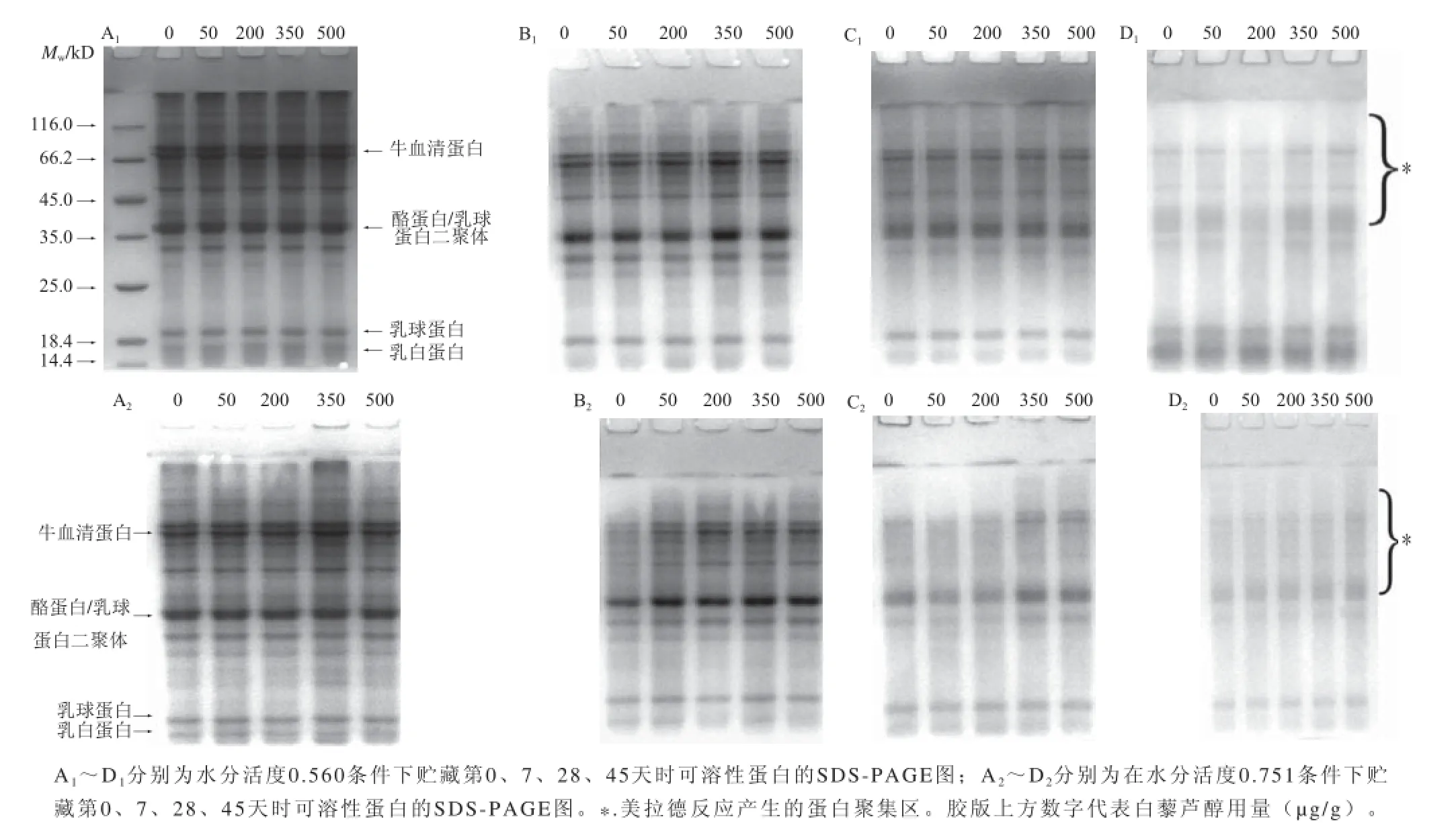
图5 食品模型贮藏过程中可溶性蛋白聚集的变化Fig. 5 Gel electrophoresis of soluble protein fractions in model food systems

图6 食品模型在水分活度0.751(a)和水分活度 0.560(b)贮藏过程中AGEs含量变化Fig. 6 Changes in AGEs content of model food system during storage at aw= 0.751 (a) and aw= 0.560 (b)
食源性AGEs是体内AGEs的重要来源,降低食品中AGEs的暴露量,可以有效防范其对人体构成危害[9]。高蛋白中间水分食品贮藏过程中的AGEs含量变化如图6所示,随着贮藏时间的延长,各组样品的AGEs含量均呈现先降后增的趋势,在水分活度0.751贮藏样品的AGEs含量下降较为明显。高蛋白食品在贮藏过程中,前期是由乳清蛋白的氨基酸和葡萄糖通过亲和加成反应,形成可逆的席夫碱,席夫碱再发生Amadori重排形成稳定的酸胺类产物,这些早期糖基化产物大多不具有荧光性质,加之蛋白质本身含有一些具有荧光性质的氨基酸,随着反应的不断进行,氨基酸含量不断下降,导致测定的AGEs含量呈现下降趋势[7,9]。随着贮藏时间的延长,Amadori产物经过缓慢的脱氧、氧化和重排反应产生活性羰基化合物,如丙酮醛、乙二醛等[7],活性羰基化合物再与蛋白质的自由氨基、巯基等反应[26],最终形成稳定的AGEs,这就导致贮藏至28 d以后,样品中AGEs的含量呈现上升趋势。水分活度对样品中AGEs含量的影响结果与其美拉德反应程度一致,在水分活度0.560贮藏的样品,其美拉德反应速率快,因此AGEs含量也相对较高。添加白藜芦醇虽然未曾从根本上改变AGEs含量变化趋势,但从实验组和对照组的AGEs含量可以看出,随着白藜芦醇剂量的增加,AGEs含量普遍存在下降趋势,这可能与白藜芦醇清除Amadori产物重排过程中的活性羰基化合物有关[19,27]。
3 讨 论
高蛋白食品的品质主要受贮藏过程中水分迁移、相分离等物理变化和美拉德反应、脂肪氧化等化学变化的影响,质地硬化是目前困扰其发展的突出问题[21,25]。硬化形成的机理主要有糖结晶、蛋白质聚集和水分迁移[21]。本研究结果显示,贮藏环境的水分活度影响高蛋白食品的硬度,提高水分活度可阻止食品质地变硬。Loveday等[24]研究也表明,高蛋白食品中质地硬化是由于水分从蛋白质向葡萄糖和甘油迁移所致。因此,高蛋白食品在贮藏过程中水分在食品内部不同组分/区域间会发生迁移运动和重新分布。贮藏过程中的美拉德反应导致颜色的变化,但对硬度影响不大,表明水分迁移是贮藏过程中引
起蛋白聚集的主要原因;添加白藜芦醇对食品的颜色和美拉德反应程度虽有一定程度的改善,但对食品硬度没有影响,由此可以推断水分迁移是高蛋白食品体系贮藏过程中质地变硬的主要原因。
外源抗氧化剂的添加可抑制食品中AGEs的形成,如竹叶抗氧化物、迷迭香提取物、茶多酚添加到曲奇[28],槲皮素、阿魏酸和硫胺素添加至油炸麻花[29],其作用机理主要是基于添加物的抗氧化活性,作用方式是通过清除美拉德反应生成的活性羰基化合物[28-29],进而抑制了AGEs的形成。白藜芦醇是公 认的抗氧剂,美国将其作为膳食补充剂,日本将其作为食品添加剂[30]。本研究结果显示,添加白藜芦醇可抑制高蛋白食品贮藏过程中的美拉德反应和减少AGEs的产生,其作用效果与添加量有关。我国市售虎杖提取物中白藜芦醇含量在10%~98%不等,价 格与其他抗氧剂相当,后续可将其添加至食品体系中满足大量应用的需求。然而,对于白藜芦醇是否也通过清除乙二醛、丙酮醛等活性羰基化合物方式阻断高蛋白食品中AGEs的产生,及其对乳清蛋白的糖基化作用位点和蛋白结构的影响仍需要进一步的深入研究。
4 结 论
高蛋白食品在水分活度0.560的环境中贮藏时,美拉德反应程度、硬度和不可溶性蛋白聚集呈现不断增加趋势,AGEs的含量较水分活度0.751时明显增加,而水分活度对食品贮藏过程中的颜色、可溶性蛋白聚集的影响较小。外源抗氧化剂-白藜芦醇的添加可降低食品贮藏过程中的美拉德反应程度,增加食品的L*值,降低b*值、a*值,而对食品的硬度、可溶性蛋白和不可溶性蛋白聚集影响较小。综合所测指标,水分活度0.751、白藜芦醇用量500 μg/g时,更有利于改善高蛋白中间水分食品模型在30 ℃条件下贮藏的品质及安全性。高蛋白食品在贮藏过程中水分在食品内部不同组分/区域间会发生迁移运动和重新分布,水分迁移是导致高蛋白食品贮藏过程中蛋白聚集和质地硬化的主要原因。
[1] 余园芳. 高蛋白中间水分食品中美拉德反应对蛋白聚集的影响[D].无锡: 江南大学, 2011.
[2] LOVEDAY S M, HINDMARSH J P, CREAMER L K, et al. Physicochemical changes in a model protein bar during storage[J]. Food Research International, 2009, 42(7): 798-806. DOI:10.1016/ j.foodres.2009.03.002.
[3] 郑岩, 邹建. 中间水分食品在军用食品中的应用[J]. 江西食品工业, 2007(3): 43-46. DOI:10.3969/j.issn.1674-2435.2007.03.014.
[4] PURWANTI N, van d er GOOT A J, BOOM R, et al. New directions tow ards structure formation and stability of protein-rich foods from globular proteins[J]. Trends in Food Science and Technology, 2010, 21(2): 85-94. DOI:10.1016/j.tifs.2009.10.009.
[5] ZHOU Peng, GUO Mufan, LIU Dasong, et al. Maillard reaction induced modification and aggregation of proteins and hardening of texture in protein bar model systems[J]. Journal of Food Science, 2013, 78(3): C437-C444. DOI:10.1111/1750-3841.12061.
[6] URIBARRI J, WOODRUFF S, GOODMAN S, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of the American Dietetic Association, 2010, 110(6): 911-916.
[7] LUEVANO-CONTRERAS C, CHAPMAN-NOVAKOFSK I. Dietary advanced glycation end products and aging[J]. Nutrients, 2010, 2: 1247-1265. DOI:10.3390/nu2121247.
[8] ZHANG Qibin, AMES J M, SMITH R D, et al. A perspective on the Maillard reaction and the analysis of protein glycation by mass spectrometry: probing the pathogenesis of chronic disease[J]. Journal of Proteome Research, 2009, 8(2): 754-769. DOI:10.1016/ j.cemconres.2007.04.010.
[9] POULSEN M W, HEDEGAARD R V, ANDERSEN J M, et al. Advanced glycation end products in food and their effects on health[J]. Food and Chemical Toxicology, 2013, 60: 10-37. DOI:10.1016/ j.fct.2013.06.052.
[10] ROHN S, RAWEL H M, KROLL J. Antioxidant activity of proteinbound quercetin[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4725-4729.
[11] BIEMEL K M, REIHL O, CONRAD J, et al. Formation pathways for lysine arginine cross-links derived from hexoses and pentoses by maillard processes[J]. The Journal of Biological Chemistry, 2001, 276(26): 23405-23412.
[12] CHELLAN P, NAGARAJ R H. Protein cross linking by the maillard reaction: dicarbonyl derived imidazolium cross links in aging and diabetes[J]. Archives of Biochemistry and Biophysics, 1999, 368(1): 98-104. DOI:10.1006/abbi.1999.1291.
[13] LAVELLI V, COREY M, KERR W, et al. Stability and anti-glycation properties of intermediate moisture apple products fortified with green tea[J]. Food Chemistry, 2011, 127(2): 589-595. DOI:10.1016/ j.foodchem.2011.01.047.
[14] LABUZA T P, SALTMARCH M. Kinetics of browning and protein quality loss in whey powders during steady state and nonsteady state storage conditions[J]. Journal of Food Science, 1981, 47(1): 92-96. DOI:10.1111/j.1365-2621.1982.tb11035.x.
[15] LIU Qin, KONG Baohua, HAN Jianchun, et al. Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions[J]. Food Structure, 2014, 1(2): 145-154. DOI:10.1016/j.foostr.2013.11.004.
[16] 冯建勋. 食物中晚期糖基化终产物对5/6肾切除大鼠的肾脏损害作用及其机制[D]. 广州: 第一军医大学, 2006.
[17] MALEC L S, PEREYRA G A S, NARANJO G B, et al. Infl uence of water activity and storage temperature on lysine availability of a milk like system[J]. Food Research International, 2002, 35(9): 849-853. DOI:10.1016/S0963-9969(02)00088-1.
[18] GONZALES A S P, NARANJO G B, LEIVA G E, et al. Maillard reaction kinetics in milk powder: effect of water activity at mild temperatures[J]. International Dairy Journal, 2010, 20(1): 40-45. DOI:10.1016/j.idairyj.2009.07.007.
[19] LÜ Lishuang, SHAO Xi, WANG Liyan, et al. Stilbene glucoside from Polygonum multifl orum Thunb.: a novel natural inhibitor of advanced glycation end product formation by trapping of methylglyoxal[J]. Journal of Agricultural and Food Chemistry, 2010, 58(4): 2239-2245. DOI:10.1021/jf904122q.
[20] BAIER S K, GUTHRIE B D, ELMOREL D L, et al. Influence of extrusion on protein conformation and shelf-life extension of nutritional bars[C]//International Symposium on the Properties of Water X, Bangkok, Thailand, September 2-7, 2007.
[21] 张靓. 分子迁移对高蛋白食品体系质地硬化的影响[D]. 无锡: 江南大学, 2014.
[22] WARMBIER H C, SCHNLCKELS R A, LABUZA T P. Effect of glycerol on nonenzymatic browning in a solid intermediate moisture model food system[J]. Journal of Food Science, 1976, 41(3): 528-531. DOI:10.1111/j.1365-2621.1976.tb00663.x.
[23] GAN C Y, CHEN L H, EASA A M. Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments of microbial transglutaminase and Maillard cross-linking[J]. Food Research International, 2008, 41(6): 600-605. DOI:10.1016/j.foodres.2008.03.015.
[24] LOVERDAY S M, HINDMARSH J P, CREAMER L K, et al. Physicochemical changes in intermediate-moisture protein bars made with whey protein or calcium caseinate[J]. Food Research International, 2010, 43(5): 1321-1328. DOI:10.1016/ j.foodres.2010.03.013.
[25] CORZO-MARTINEZM M, MORENO F J, OLANO A, et al. Structural characerization of bovine beta-lactoglobulin-galactose/ tagatose Maillard complexes by electrophoretic, chromatographic and spectroscopic methods[J]. Journal of Agriculture and Food Chemistry, 2008, 56: 4244-4252. DOI:10.1021/jf7036714.
[26] WU Juwen, HSIEH C L, WANG H Y, et al. Inhibitory effects of guava (Psidium guajava L.) leaf extracts and its active compounds on the glycation process of protein[J]. Food Chemistry, 2009, 113(1): 78-84. DOI:10.1016/j.foodchem.2008.07.025.
[27] WANG W, YAGIZ Y, BURAN T J, et al. Phytochemicals from berries and grapes inhibited the formation of advanced glycation end-products by scavenging reactive carbonyls[J]. Food Research International, 2011, 44(9): 2666-2673. DOI:10.1016/j.foodres.2011.05.022.
[28] 周燕琼. 植物多酚抑制食品中晚期糖基化终末产物的形成的作用机理研究[D]. 杭州: 浙江大学, 2015.
[29] 刘荟萃. 油炸食品加工与贮藏过程中晚期糖基化末端产物的形成分析及抑制[D]. 杨凌: 西北农林科技大学, 2014.
[30] 陆瑶. 白黎芦醇对人体P450酶活性影响及与降压药物相互作用的研究[D]. 长沙: 中南大学, 2014.
Changes in Quality and Advanced Glycation End Products Contnet of Intermediate Moisture Foods Containing High Protein during Storage
GU Mantun1,2, SHENG Zhanwu2,3,*, HAO Wangjun2, SHANG Wenting1, ZHENG Lili2,3, AI Binling2,3, ZHANG Weimin1,*
(1. College of Food Science and Technology, Hainan University, Haikou 570228, China; 2. Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Haikou 570102, China; 3. Haikou Key Laboratory of Banana Biology, Haikou 570102, China)
This study aimed to evaluate the effect of antioxidant and storage conditions with different water activities (aw) on intermediate moisture foods (IMFs) containing high protein. A model system consisting of resveratrol was established. The degree of Maillard reaction, texture, color, insoluble protein aggregates, soluble protein aggregation and other indexes of the samples under different conditions of resveratrol concentration, water activity and storage time were investigated. The results indicated that the degree of Maillard reaction, insoluble protein aggregates, advanced glycation end products (AGEs) concentration and hardness of high-protein IMFs stored at a water activity of 0.560 were higher than those at water activity 0.751. The Maillard reaction of the model system with added resveratrol was inhibited, the color value L* was increased, and the color values b* and a* were decreased. Overall, at 30 ℃, the safety and quality of IMFs food model turned out to be the best when the concentration of resveratrol was added at 500 μg/g and water activity was 0.751. Moisture migration induced microstructure changes and decreased molecular mobility, which was the key factor that causes the aggregation of protein and hardening of high-protein IMFs during storage.
intermediate moisture foods containing high protein; advanced glycation end products; resveratrol; hardening of foods; moisture migration
10.7506/spkx1002-6630-20161040
TS201.4
A
1002-6630(2016)10-0232-08
谷满屯, 盛占武, 郝旺珺, 等. 高蛋白中间水分食品贮藏过程中品质和AGEs含量的变化[J]. 食品科学, 2016, 37(10): 232-239. DOI:10.7506/spkx1002-6630-201610040. http://www.spkx.net.cn
GU Mantun, SHENG Zhanwu, HAO Wangjun, et al. Changes in quality and advanced glycation end products contnet of intermediate moisture foods containing high protein during storage[J]. Food Science, 2016, 37(10): 232-239. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610040. http://www.spkx.net.cn
2015-09-17
国家自然科学基金青年科学基金项目(31201303);海南省应用技术研究与开发项目(ZDXM2014104)
谷满屯(1991—),男,硕士研究生,研究方向为天然产物的研究与开发。E-mail:gumantunde163@163.com
*通信作者:盛占武(1981—),男,副研究员,博士研究生,研究方向为天然产物化学。E-mail:shengzhanwu100@163.com张伟敏(1979—),男,副教授,硕士,研究方向为食品质量安全。E-mail:zhwm1979@163.com
