顶空固相微萃取联合气相色谱-质谱检测葡萄酒中2,4,6-三氯苯甲醚
2016-12-07赵英莲牟德华
赵英莲,牟德华,李 艳
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
顶空固相微萃取联合气相色谱-质谱检测葡萄酒中2,4,6-三氯苯甲醚
赵英莲,牟德华,李 艳*
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
利用响应面法优化采用顶空固相微萃取联合气相色谱-质谱技术检测葡萄酒中2,4,6-三氯苯甲醚(2,4,6-trichloroanisole,TCA)。对萃取头进行了选择,并优化固相微萃取参数:样品体积、萃取温度、平衡时间和萃取时间等对TCA萃取效果的影响。结果表明,用聚二甲基硅氧烷/二乙烯基苯(65 μm)萃取头进行TCA萃取的最佳条件:样品9.8 mL、2 g NaCl、33 ℃平衡10 min、萃取90 min进行气相色谱-质谱分析,以TCA-d5为内标物进行定量。该方法的相关系数R2为0.999 9,重复性的相对标准偏差为1.03%,加标回收率范围在95.7%~106.1%之间,检出限和定量限分别为0.3 ng/L和1 ng/L。检测7 种市售葡萄酒产品的TCA含量在0~7.6 ng/L之间,干白葡萄酒中TCA含量低于干红葡萄酒。该方法操作简单、可靠,适用于葡萄酒中TCA的测定。
响应面法;顶空固相微萃取;气相色谱-质谱;2,4,6-三氯苯甲醚;葡萄酒
2,4,6-三氯苯甲醚(2,4,6-trichloroanisole,TCA)是“软木塞污染”的主要肇事者[1]。它能使葡萄酒产生霉味或者是令人不愉快的味道,降低葡萄酒的品质。据报道,每年因TCA给葡萄酒行业造成的损失达到100亿 美金[2]。Prescott等[3]研究了消费者对葡萄酒中TCA的排斥阈和刺激值,结果表明,排斥阈和刺激值分别为3.1×10-12g/L和2.1×10-12g/L。在如此低质量浓度的情况下,消费者便难以接受。此外,加州大学戴维斯分校的酿酒专家Christian Butzke称,一汤匙量的TCA就可以败坏美国全年的葡萄酒,可见其危害之大[4]。
针对于TCA的检测采用是气相色谱-质谱(gas chromatography mass spectrometry,GC-MS)联用法[5-8]、气相色谱电子捕获技术联用法[9-11]、气相色谱原子发射光谱联用技术[12]、生物传感器[13]、气相色谱离子迁移谱[14]以及电子鼻等。但是GC-MS是首选,主要是因为它灵敏性高、定性能力强、定量分析简单等特点。GC-MS结合顶空固相微萃取(headspace solid-phase micro-extraction,HS-SPME)方法是目前最常用的检测葡萄酒及软木塞中TCA含量的方法。此外还有其他的前处理方法如液液萃取[15-16]、固相萃取[17-19]、搅拌棒吸附萃取[20-21]、吹扫补集技术以及渗透汽化膜技术[22]等。由于HS-SPME无需使用有机溶剂、样品用量少、快速灵敏、选择性高、检出限低、重复性好和准确度高,成为TCA萃取中最常用的方法。目前,国内虽然有关于TCA的报道,但是没有关于以响应面优化葡萄酒中TCA的检测方法的报道。
本实验采用HS-SPME-GC-MS通过对萃取温度、萃取时间和样品体积进行响应面优化设计,建立了可靠的葡萄酒中TCA检测方法。
1 材料与方法
1.1 材料、试剂与仪器
酒样 石家庄市北国超市。TCA(纯度99%)、内标物[2H5]TCA(TCA-d5,纯度为98%) 美国Sigma公司;乙醇(色谱纯,纯度99.9%) 韩国德山药业工厂;NaCl(分析纯) 国药集团化学试剂有限公司;酒石酸、正丙醇、异丁醇、异戊醇、乳酸乙酯(均为分析纯) 天津永大化学试剂有限公司;实验用纯净水杭州哇哈哈集团有限公司。
7890A气相色谱-5975质谱仪、HP-5色谱柱(30.0 m×0.25 mm,0.25 μm) 美国Agilent公司;DF-101S集热式恒温加热磁力搅拌器 巩义市英峪予华仪器厂;20 mL顶空瓶 石家庄大晋科技有限公司;手动固相微萃取手柄、磁子及聚二甲基硅氧烷(polydimethylsiloxane,PDMS,100 μm)、PDMS/二乙烯基苯(divinylbenzene,DVB,65 μm)、聚丙烯酸酯(polyacylate,PA,85 μm)涂层的萃取头 美国Sigma公司。
1.2 方法
1.2.1 溶液的配制
合成酒的配制:用1 mol/L氢氧化钠溶液将含有3.5×103mg/L的酒石酸体积分数12%乙醇溶液,调pH值为3.5;复杂合成酒的配制:用1 mol/L氢氧化钠溶液将含有3×103mg/L的糖、3.5×103mg/L的酒石酸和一些挥发性物质(丙醇18.5 mg/L+异丁醇11.73 mg/L+异戊醇29.8 mg/L+乳酸乙酯99.32 mg/L)体积分数为12%乙醇溶液,调pH值为3.5;标准溶液的配制:称取0.05g的TCA溶于50mL的乙醇容溶液,配制成质量浓度为1 g/L的储备液,再用12%乙醇溶液将其配制成2×10-4、4×10-4、8×10-4、15×10-4、50×10-4mg/L的工作液,4 ℃冰箱存放;内标物溶液的配制:称取0.01 g的TCA-d5溶于25 mL的乙醇溶液,配制质量浓度为4×10-1g/L的储备液,再用12%乙醇溶液将其稀释成2×10-3mg/L,4 ℃冰箱存放。
1.2.2 仪器条件
色谱条件:50 ℃保持2 min,10 ℃/min升至90 ℃保持25 min,再以25 ℃/min升至260 ℃保持3 min。传输线温度280 ℃;载气:高纯氦气;流速1 mL/min;进样量1 μL。
质谱条件:电子电离源;电离能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;溶剂延迟时间20 min;采用选择离子监测模式条件下对样品进行分析,根据定性离子和保留时间对物质进行定性,内标法定量。TCA和TCA-d5的特征离子见表1。

表1 TCA和TCAA--dd5的特征离子和定量离子Table 1 Characteristic ions and quantitative ions for TCA and TCA-d5
1.2.3 样品处理
称取2 g NaCl置于顶空进样瓶,加入9.8 mL酒样和100 μL 2×10-3mg/L的内标物TCA-d5,用含有硅胶密封垫的铝盖密封,将萃取头插入萃取瓶,置于恒温加热磁力搅拌器中,33 ℃平衡10 min,萃取90 min,260 ℃解吸3 min。
2 结果与分析
2.1 模拟酒样的选择
为了得到更精确的方法,更好地模拟葡萄酒,共选择了3 种不同合成酒与真实的干白酒、干红酒和桃红酒进行比较。其中3 款模拟酒为:1)12%乙醇溶液;
2)3.5×103mg/L酒石酸+12%乙醇溶液,pH 3.5;3)3×103mg/L 糖+3.53.5×103mg/L酒石酸+12%乙醇+挥发性物质(丙醇18.5 mg/L+异丁醇11.73 mg/L+异戊醇29.8 mg/L+乳酸乙酯99.32 mg/L)pH 3.5[23]。由图1可以看出,复杂模拟酒样、干白、干红和桃红的线性方程几乎重合,因此选择复杂模拟酒样作为空白基质进行下一步的实验研究。

图1 合成酒与真实酒样的线性比较Fig. 1 Linear comparison between synthetic liquor and real wine sample
2.2 萃取头的选择
TCA是属于小分子质量的极性物质,所以主要考察了PDMS、PDMS/DVB、PA这3 种萃取头的萃取效果。方法为35 ℃平衡15 min,萃取25 min[11]。结果见图2,由此可见PDMS/DVB,65 μm这种萃取头的萃取效果最好。
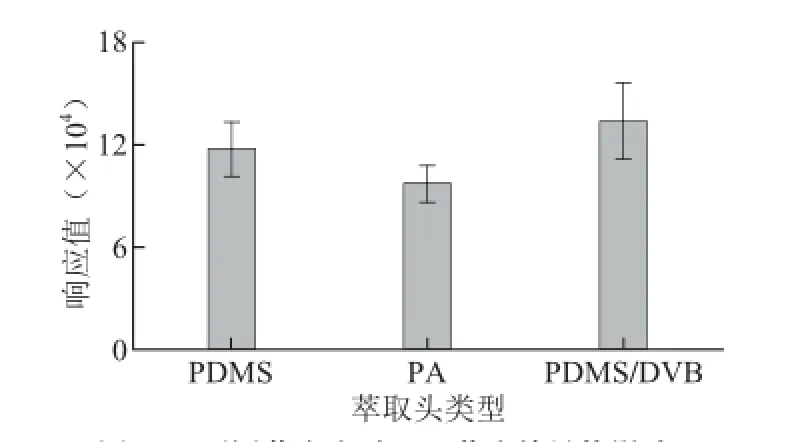
图2 不同萃取头对TCA萃取效果的影响Fig. 2 Effect of fi ber types on the extraction effi ciency of TCA
2.3 方法的优化
2.3.1 NaCl加入量

图3 NaCl加入量对TCA萃取效果的影响Fig. 3 Effect of sodium chloride addition to the extraction solvent on the extraction effi ciency of TCA
适当增加溶液中的离子浓度可以减少被分析物在溶液中的可溶性,能使更多的挥发性物质挥发至溶液的顶空,吸附到纤维头上,从而提高方法的灵敏性。离子强度的影响通过加入NaCl的量进行研究。本实验以PDMS/ DVB,65 μm为萃取头,35 ℃平衡15 min,萃取25 min,分别研究了0、2、3、4 g NaCl对萃取效果的影响。从图3可以看出,NaCl加入量为2 g时,萃取效果最好,所以NaCl的加入量为2 g。
2.3.2 搅拌对萃取的影响
搅拌也是影响萃取的一个因素,主要是因为它能加速待测物从基质中分离到顶部,吸附到萃取头中。在PDMS/DVB,65 μm为萃取头,35 ℃平衡15 min,萃取25 min,2 g NaCl的前提下,考察了搅拌速率对其影响。结果发现,随着搅拌速率加大,萃取峰面积越大。所以在以后的实验中,搅拌速率均调至最大。
2.3.3 萃取温度的考察
温度是影响萃取的重要因素,它能促进待测物从液体基质中分离,增强顶部空间的压力,进而加速待测物扩散至萃取涂层。由图4可见,随着温度的升高,TCA的响应值先增加后降低,温度为30 ℃时,峰面积最大。温度越高,峰面积降低,可能是由于TCA属于低沸点、弱极性物质,吸附在PDMS/DVB极性萃取头的TCA随着温度的升高,又发生了解吸现象,因此峰面积降低。
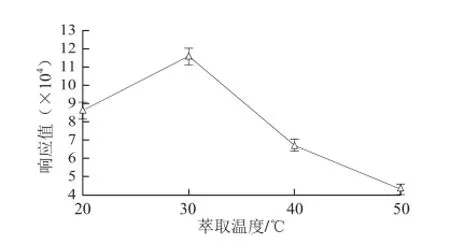
图4 萃取温度对TCA萃取效果的影响Fig. 4 Infl uence of extraction temperature on the extraction effi ciency of TCA
2.3.4 平衡时间的影响
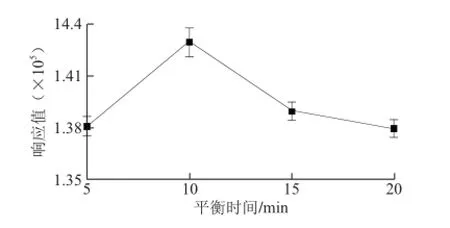
图5 平衡时间对TCA萃取效果的影响Fig. 5 Infl uence of equilibration time on the extraction effi ciency of TCA
顶空萃取模式主要包括2 个步骤:第一待测物从液相中扩散到气相中,即平衡过程;第二待测物从气相吸附到萃取的固定相中,即吸附过程。本实验以PDMS/ DVB,65 μm为萃取头,2 g NaCl,30 ℃萃取25 min,
分别研究了平衡时间为5、10、15、20 min对萃取效果的影响。从图5可以看出,平衡时间为10 min时,TCA的响应值最大。平衡时间的延长,TCA的响应值先增加后降低,可能是由于一开始随着时间的延长,TCA从基质中扩散到气相中,使气相中TCA的质量浓度增加,但是当气相中TCA的质量浓度大于基质中的,造成TCA重新扩散到液相基质中,从而造成TCA的响应值降低。
2.3.5 萃取时间的影响
萃取时间是判定待测物在基质和固定相之间达到平衡的重要的因素。因此,本研究以PDMS/DVB,65 μm为萃取头,2 g NaCl,30 ℃平衡10 min,考察了萃取时间为30、40、50、60、70、80、90、100、120 min,对萃取效果的影响。由图6可看出,随着萃取时间的延长,TCA的响应值不断增加。由于,当萃取条件保持不变,在非平衡状态下对SPME的定量是不会造成影响的[24]。此外,60 min后,TCA响应值仍然增加,但是趋于平缓。
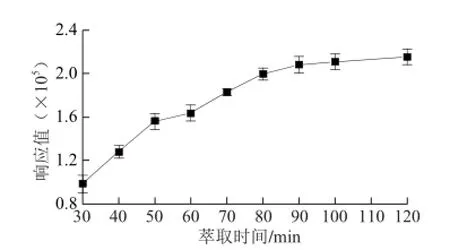
图6 萃取时间对TCA萃取效果的影响Fig. 6 Infl uence of extraction time on the extraction effi ciency of TCA
2.3.6 样品体积对萃取的影响
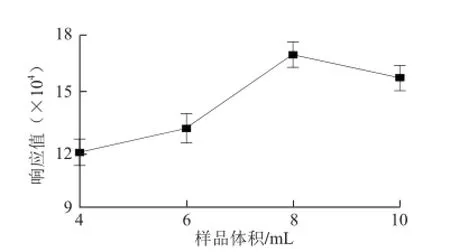
图7 样品体积对TCA萃取效果的影响Fig. 7 Infl uence of sample volume on the extraction effi ciency of TCA
对于HS-SPME方法来说,样品体积也是影响待测物萃取的一个直接因素。因为降低样品体积,可以增大顶空体积,使TCA在两相间的分配平衡偏向顶空气相,更多TCA挥发至顶空。以PDMS/DVB,65 μm为萃取头,35 ℃平衡15 min,萃取25 min,2 g NaCl为条件,对样品体积进行考察,以求找到最适样品体积。由图7可以看出,随着样品体积的增加,TCA的峰面积先增加后降低。这主要是因为样品体积过低,顶空体积过大,会造成TCA质量浓度的稀释,使TCA的峰面积下降。本实验取8 mL为取样量。
2.3.7 响应面的优化试验
为了得到更加精确的方法,在单因素试验的基础上,以样品体积、萃取温度和萃取时间为影响因素,TCA峰面积为响应值,运用Box-Behnken试验设计原理进行响应面分析。确定HS-SPME法萃取葡萄酒中的TCA的最佳萃取条件。其中萃取温度(20~40 ℃)、萃取时间(30~90 min)和样品体积(6~10 mL)为自变量,分别由A、B、C表示。试验设计及结果见表2。
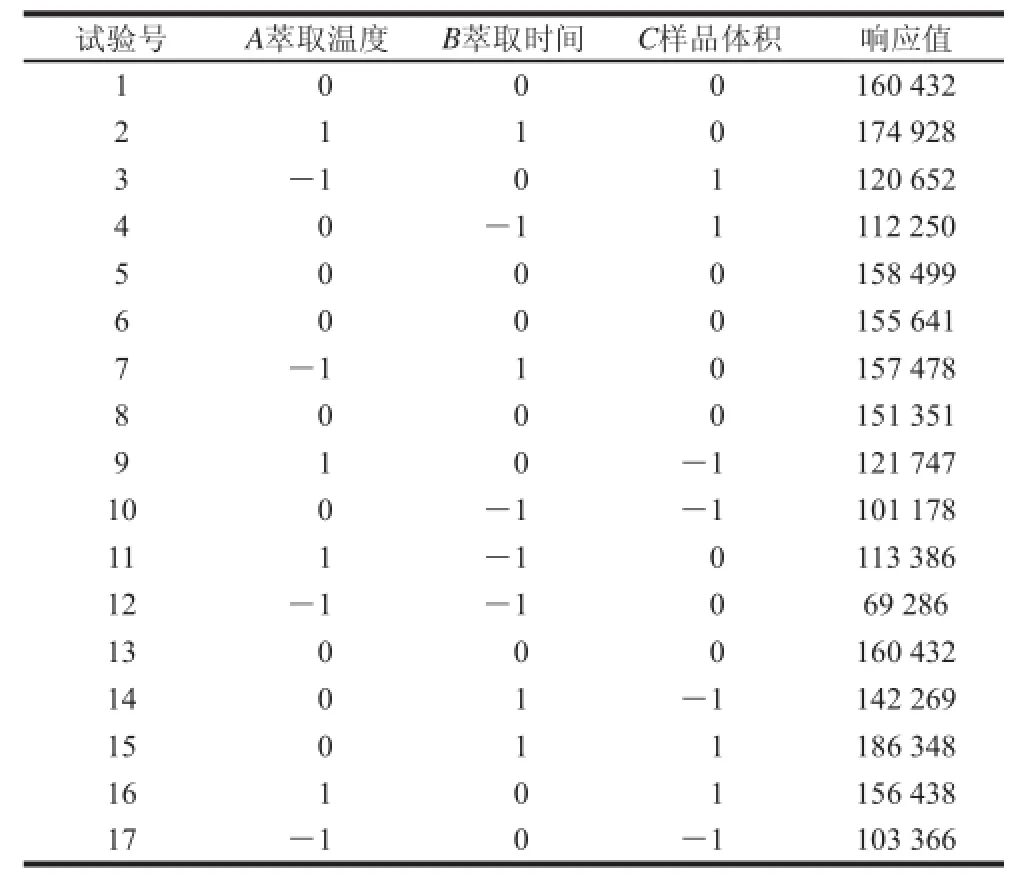
表2 响应面分析试验设计及结果Table 2 The experimental design and results for respond surface analysis
通过利用Design Expert 7.0软件对表2中实验数据进行回归分析,得到二次多元回归模型为R1=-337 649+ 12 577A+1 905.91B+41 873.4C-22.2085AB+217.563AC+ 137.531BC-192.309A2-10.300 5B2-3 122.29C2。该模型的方差分析见表3。
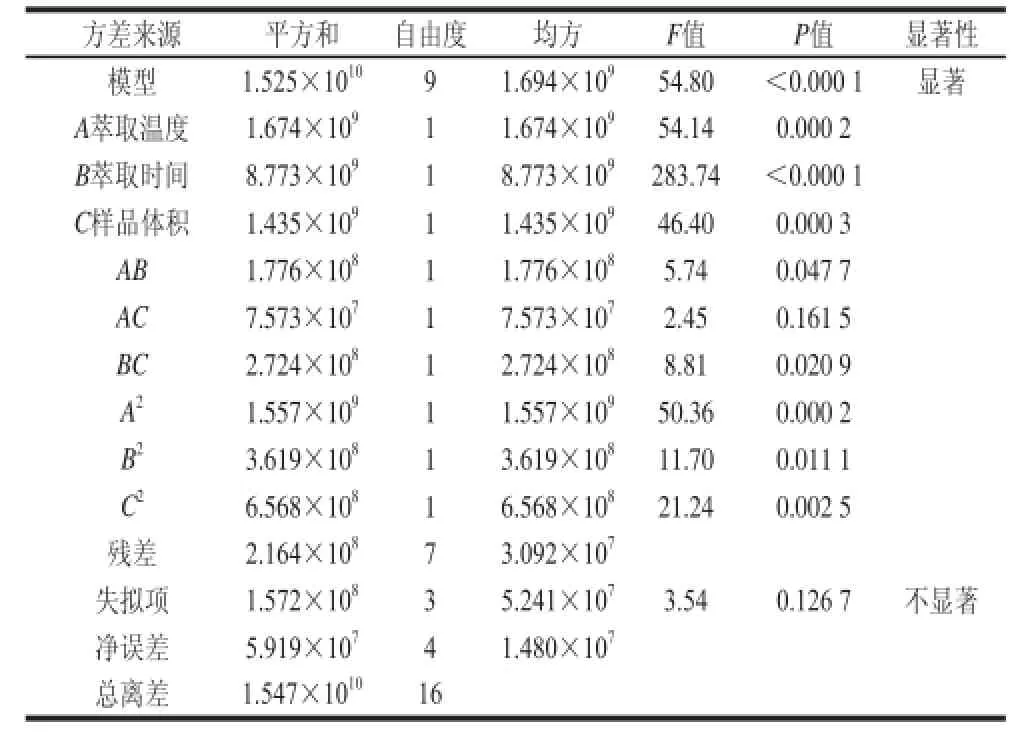
表3 回归模型方差分析Table 3 Analysis of variance (ANOVA) for response surface quadratic mooddeell
由表3可知,模型P值<0.000 1,小于0.01,模型回归极显著;失拟项P值0.126 7,大于0.05,失拟项不显著,因此模型选择正确。A、B、C、A2、C2项P值均小于0.01,为极显著;AB、BC和B2项P值均大于0.01而小于0.05,为显著;AC项P值均大于0.05,为不显著。这说明线性项、二次项都有显著影响,各个试验因素对响应值的影响不是简单的线性关系,它们之间有交互作用。图8表示AB、BC和AC交互作用的立体图。从图8也可以可直观反映出3 个变量之间交互作用的显著程度(圆形表示两因素交互作用不显著,椭圆形表示两因素交互作用显著)。
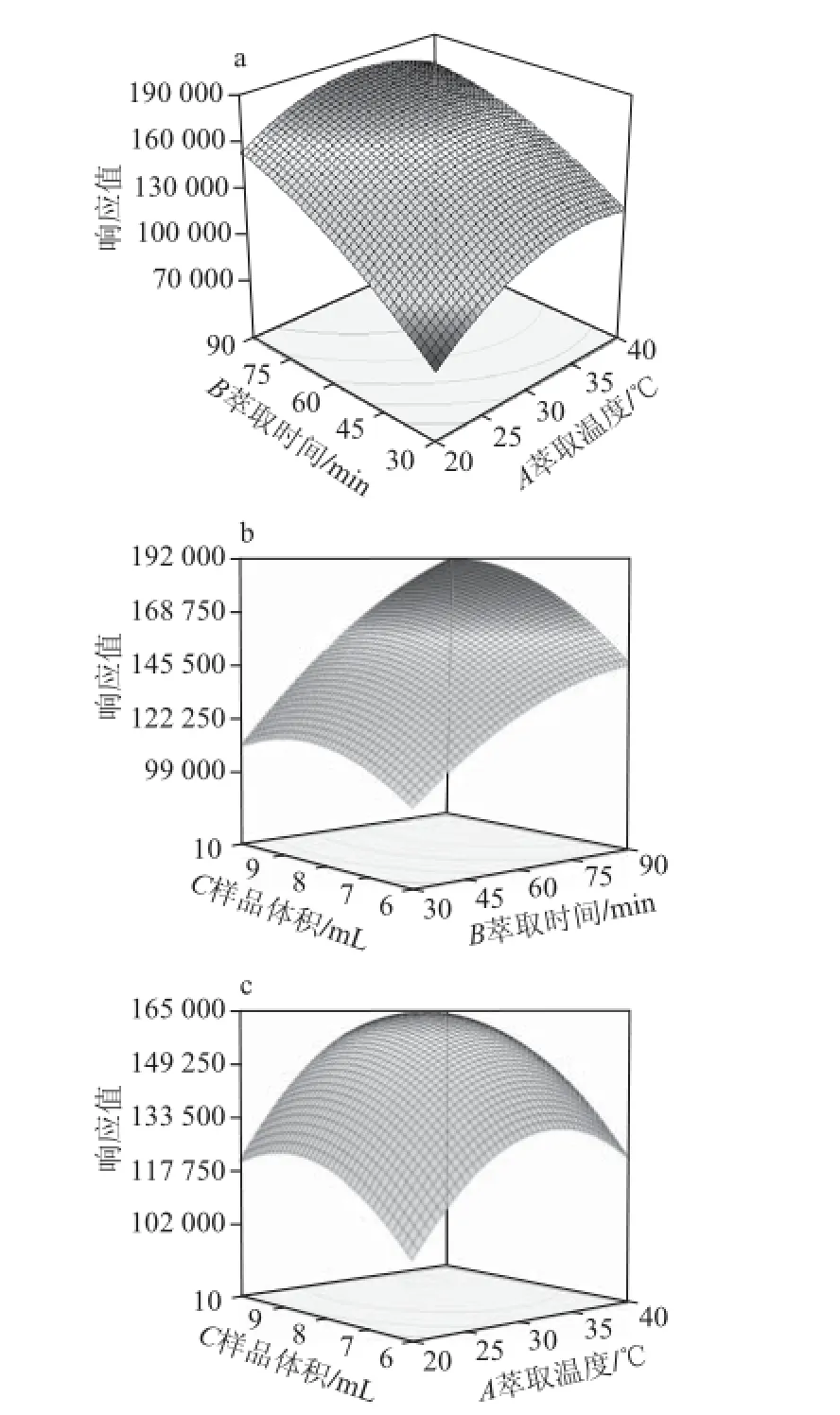
图8 萃取时间和温度(a)、萃取时间和样品体积(b)、萃取温度和样品体积(c)的响应面Fig. 8 Response surface plots showing the effect of extraction time and extraction temperature (a), extraction time and sample volume (b), and extraction temperature and sample volume (c) on TCA extraction
因此,可以利用回归模型来分析和预测HS-SPME萃取葡萄酒中TCA的最佳条件。其中该模型的复相关系数的平方R2=0.986 0,校正复相关系数为0.968 0,说明该模型可以解释96.80%实验所得色谱峰面积的变化,表明方程拟合较好。Y的变异系数(coefficient of variation,CV)表示实验的精确度,CV值越低,实验的可靠性越高,本实验中CV=4.03%<10%,说明实验方法可靠。
运用Design Expert 7.0软件对回归模型进行分析,寻求最大出峰面积稳定点及对应的因素水平。当因素A、B、C取值分别为33.072 ℃、90 min、9.842 mL时,响应值Y达到最大值192 267,即TCA峰面积最大。考虑到实际应用过程中的可操作性,A、B、C的取值分别取整为:萃取温度33 ℃、萃取时间90 min、样品体积9.8 mL。经验证实验证实,实际出峰面积为192 962,是预测值的100.4%,说明该模型优化的结果能够很好地反映出TCA的萃取面积。
2.4 方法的验证
按照优化的结果再结合GC-MS对方法参数(如 相关系数、相对标准偏差、检出限、定量限和回收率)进行考察,结果见表4。线性关系是以不含TCA污染的葡萄酒为空白基质,往其加入TCA-d5和TCA,最终TCA-d5的质量浓度为2×10-8g/L,TCA质量浓度分别为2×10-9、4×10-9、8×10-9、15×10-9g/L和50×10-9g/L。按照优化的结果进行萃取,结合GC-MS进行分析,以TCA的质量浓度为横坐标,TCA和TCA-d5的峰面积之比为纵坐标进行相关性分析。准确度和精密度实验通过加标回收率和相对标准偏差来评价。检出限为信噪比3时,对应的TCA质量浓度,定量限为信噪比时,对应的TCA质量浓度。

表4 优化后方法的相关系数、重复性、检出限、定量限和回收率Table 4 Correlation coeffi cient, reproducibility (RSD), detection limit, quantitation limit and recovery of the optimized method
由表4可以看出,该方法的相关系数为0.999 9,表明线性关系良好,能够用于方法的定量。重复性的相对标准偏差为1.03%,回收率在95.7%~106.1%之间,说明该方法准确、可靠。检出限为0.3 ng/L低于TCA在葡萄酒中的阈值。所以该方法能用于葡萄酒TCA的检测。
2.5 样品的检测
采用优化后的检测方法,对选购的7 种市售山东烟台产区的干红葡萄酒和干白葡萄酒进行了检测,检测结果见表5。其中不含TCA的贵人香干白葡萄酒和含TCA污染蛇龙珠干白的葡萄酒的色谱图见图9。

表5 不同类型葡萄酒酒精度和TCA含量Table 5 Alcohol content and TCA content of different types of wines
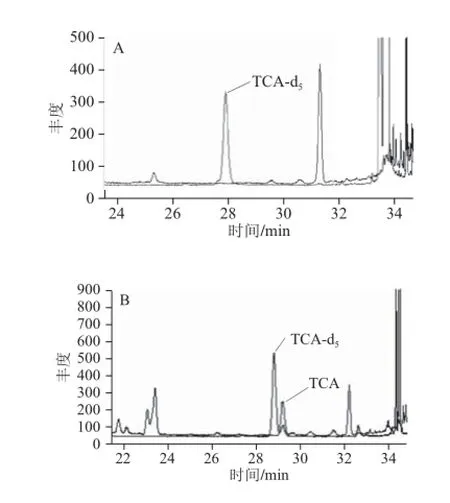
图9 贵人香葡萄酒样品(A)和蛇龙珠葡萄酒样品(B)离子图Fig. 9 Ion chromatograms of TCA in Italian Riesling wine (A) and Cabernet Gernischt wine (B)
由表5可见,干白葡萄酒中未检出TCA,4 种干红葡萄酒中均检出了TCA,其含量在2.44~7.60 ng/L之间。而葡萄酒中的TCA来源可能有4 方面:第1,与葡萄原料有关。葡萄在筛选时,可能带入一些腐烂葡萄;第2,酿造过程中。一些生产设备上清洗不彻底,滋生霉菌,与含氯的水或清洗剂接触产生TCA,从而使酒含有TCA;第3,葡萄酒陈酿过程中,一些橡木桶发霉产生了TCA,导致葡萄酒含有TCA;第4,葡萄酒在封装时,使用了TCA含量较高的软木塞,使软木塞中的TCA转移到了葡萄酒中。
3 结 论
本实验采用响应面优化设计结合HS-SPME-GC-MS建立了一种简单和可靠的检测葡萄酒中TCA的方法,且应用此方法检测7 种不同类型的葡萄酒中TCA的检测,其TCA含量在0~7.6 ng/L之间,其中干白葡萄酒中TCA含量低于干红葡萄酒。该方法简单、灵敏度高、准确性好以及线性关系良好,适用于葡萄酒中TCA的测定。
[1] RIU M, MESTRES M, BUSTO O, et al. Determination of 2,4,6-trichloroanisole in wines by headspace solid-phase microextraction and gas chromatography-electron-capture detection[J]. Journal of Chromatography A, 2002, 977(1): 1-8. DOI:10.1016/S0021-9673(02)01276-1.
[2] 张亚莲, 柳菡, 王岁楼, 等. 葡萄酒和软木塞中2,4,6-三氯苯甲醚检测方法的研究进展[J]. 食品科学, 2014, 35(15): 304-309. DOI:10.7506/ spkx1002-6630-201415060.
[3] PRESCOTT J, NORRIS L, KUNST M, et al. Estimating a“consumer rejection threshold” for cork taint in white wine[J]. Food Quality and Preference, 2005, 16(4): 345-349. DOI:10.1016/ j.foodqual.2004.05.010.
[4] 丁燕. 法国消除软木塞污染新措施[J]. 中外葡萄与葡萄酒, 2003(3):73-74.
[5] INSA S, ANTICÓE, FERREIRA V. Highly selective solidphase extraction and large volume injection for the robust gas chromatography-mass spectrometric analysis of TCA and TBA in wines[J]. Journal of Chromatography A, 2005, 1089(1): 235-242. DOI:10.1016/j.chroma.2005.06.061.
[6] MARTÍNEZ-URUÑUELA A, GONZÁLEZ -SÁIZ J M, PIZARRO C. Multiple solid-phase microextraction in a non-equilibrium situation:application in quantitative analysis of chlorophenols and chloroanisoles related to cork taint in wine[J]. Journal of Chromatography A, 2005, 1089(1): 31-38. DOI:10.1016/j.chroma.2005.06.063.
[7] LIZARRAGA E, IRIGOYEN A, BELSUE V, et al. Determination of chloroanisole compounds in red wine by headspace solid-phase microextraction and gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2004, 1052(1): 145-149. DOI:10.1016/ j.chroma.2004.08.046.
[8] PIZARRO C, PÉREZ-DEL-NOTARIO N, GONZÁLEZ -SÁIZ J M. Multiple headspace solid-phase microextraction for eliminating matrix effect in the simultaneous determination of haloanisoles and volatile phenols in wines[J]. Journal of Chromatography A, 2007, 1166(1): 1-8. DOI:10.1016/j.chroma.2007.08.031.
[9] PIZARRO C, PÉREZ-DEL-NOTARIO N, GONZÁLEZ -SÁIZ J M. Optimisation of a headspace solid-phase microextraction with on-fi ber derivatisation method for the direct determination of haloanisoles and halophenols in wine[J]. Journal of Chromatography A, 2007, 1143(1):26-35. DOI:10.1016/j.chroma.2007.01.023.
[10] NAEENI M H, YAMINIY, REZAEE M, et al. Microwave-assisted extraction combined with dispersive liquid-liquid microextraction as a new approach to determination of chlorophenols in soil and sediments[J]. Journal of Separation Science, 2012, 35(18): 2469-2475. DOI:10.1002/jssc.201100978.
[11] 张哲琦, 王玉春, 陈臣, 等. 顶空固相微萃取与气相色谱-电子捕获技术联用检测软木塞中2,4,6-三氯苯甲醚[J]. 食品科学, 2014, 35(12):148-150. DOI:10.7506/spkx1002-6630-201412029.
[12] CAMPILLO N, AGUINAGA N, VIÑAS P, et al. Purge-and-trap preconcentration system coupled to capillary gas chromatography with atomic emission detection for 2,4,6-trichloroanisole determination in cork stoppers and wines[J]. Journal of Chromatography A, 2004, 1061(1): 85-91. DOI:10.1016/j.chroma.2004.11.005.
[13] APOSTOLOU T, PASCUA N, MARCO M P, et al. Extraction-less, rapid assay for the direct detection of 2,4,6-trichloroanisole (TCA) in cork samples[J]. Talanta, 2014, 125: 336-340. DOI:10.1016/ j.talanta.2014.03.023.
[14] MÁRQUEZ-SILLERO I, CÁRDENAS S, VALCÁRCEL M. Direct determination of 2,4,6-tricholoroanisole in wines by single-drop ionic liquid microextraction coupled with multicapillary column separation and ion mobility spectrometry detection[J]. Journal of Chromatography A, 2011, 1218(42): 7574-7580. DOI:10.1016/j.chroma.2011.06.032.
[15] PIZARRO C, SÁENZ-GONZÁLEZ C, PÉREZ-DEL-NOTARIO N, et al. Development of an ultrasound-assisted emulsificationmicroextraction method for the determination of the main compounds causing cork taint in wines[J]. Journal of Chromatography A, 2012, 1229: 63-71. DOI:10.1016/j.chroma.2012.01.033.
[16] PEÑA-NEIRA A, de SIMÓN B F, GARCÍA-VALLEJO M C, et al. Presence of cork-taint responsible compounds in wines and their cork stoppers[J]. European Food Research and Technology, 2000, 211(4):257-261. DOI:10.1007/s002170000193.
[17] MARTÍNEZ-URUÑUELA A, RODRÍGUEZ I, CELA R, et al. Development of a solid-phase extraction method for the simultaneous determination of chloroanisoles and chlorophenols in red wine using gas chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2005, 549(1): 117-123. DOI:10.1016/j.aca.2005.06.016.
[18] PATIL S H, BANERJEE K, UTTURE S C, et al. Development and validation of a simple analytical method for the determination of 2,4,6-trichloroanisole in wine by GC-MS[J]. Food Chemistry, 2011, 124(4): 1734-1740. DOI:10.1016/j.foodchem.2010.07.113.
[19] MAGGI L, ZALACAIN A, MAZZOLENI V, et al. Comparison of stir bar sorptive extraction and solid-phase microextraction to determine halophenols and haloanisoles by gas chromatography-ion trap tandem mass spectrometry[J]. Talanta, 2008, 75(3): 753-759. DOI:10.1016/ j.talanta.2007.12.013.
[20] CALLEION R M, TRONCOSO A M, MORALES M L. Analysis for chloroanisoles and chlorophenols in cork by stir bar sorptive extraction and gas chromatography-mass spectrometry[J]. Talanta, 2007, 71(5):2092-2097. DOI:10.1016/j.talanta.2006.09.020.
[21] CACHO J I, CAMPILLO N, VIÑAS P, et al. Stir bar sorptive extraction polar coatings for the determination of chlorophenols and chloroanisoles in wines using gas chromatography and mass spectrometry[J]. Talanta, 2014, 118: 30-36. DOI:10.1016/ j.talanta.2013.09.047.
[22] GÓMEZ-ARIZA J L, GARCIA-BARRERA T, LORENZO F, et al. Use of multiple headspace solid-phase microextraction and pervaporation for the determination of off-fl avours in wine[J]. Journal of Chromatography A, 2006, 1112(1): 133-140. DOI:10.1016/ j.chroma.2005.12.093.
[23] 李记明, 李华. 葡萄酒成分分析与质量研究[J]. 食品与发酵工业, 1994(2): 30-35.
[24] MARTÍNEZ-URUÑUELA A, GONZÁLEZ-SÁIZ J M, PIZARRO C. Optimisation of a headspace solid-phase microextraction method for the direct determination of chloroanisoles related to cork taint in red wine[J]. Journal of Chromatography A, 2004, 1056(1): 49-56. DOI:10.1016/j.chroma.2004.06.136.v
Optimization of Headspace Solid-Phase Microextraction Coupled to Gas Chromatography-Mass Spectrometry for the Determination of 2,4,6-Trichloroanisole in Wine
ZHAO Yinglian, MOU Dehua, LI Yan*
(College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China)
The objective of this study was to develop an analytical method for the determination of 2,4,6-trichloroanisole (TCA) in wine by headspace solid-phase microextraction combined with gas chromatography-mass spectrometry (HSSPME-GC-MS). Important extraction parameters such as fi ber type, sample volume, extraction temperature, equilibration time and extraction time were optimize using response surface method with the software Design Expert 7.0. The results indicated that when polydimethylsiloxane/divinylbenzene (PDMS/DVB, 65 μm) was selected as the extraction fi ber, and optimised parameters for SPME were 9.8 mL of wine, 2 g of NaCl, temperature 33 ℃, equilibration time 10 min and extraction time 90 min, followed by analysis by GC-MS and quantifi cation using TCA-d5as internal standard. The presented method was shown to be adequate for the purpose, with a correlation coeffi cient R2of 0.999 9, RSD of 1.03%, and recovery rates between 95.7% and 106.1%. The limit of detection (LOD) and the limit of quantifi cation (LOQ) were 0.3 and 1 ng/L, respectively. This method was applied to analyze 7 commercial wine samples and the results revealed that the content of TCA varied between 0 and 7.6 ng/L, lower in dry white red than in dry red wine. This method is simple and reliable, a nd can be applied to the determination of TCA in wine.
response surface method; headspace solid-phase microextraction; GC-MS; 2,4,6-trichloroanisole; wine
10.7506/spkx1002-6630-201610038
TS262.6
A
1002-6630(2016)10-0219-07
赵英莲, 牟德华, 李艳. 顶空固相微萃取联合气相色谱-质谱检测葡萄酒中2,4,6-三氯苯甲醚[J]. 食品科学, 2016, 37(10): 219-225. DOI:10.7506/spkx1002-6630-201610038. http://www.spkx.net.cn
ZHAO Yinglian, MOU Dehua, LI Yan. Optimization of headspace solid-phase microextraction coupled to gas chromatography-mass spectrometry for the determination of 2,4,6-trichloroanisole in wine[J]. Food Science, 2016, 37(10): 219-225. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610038. http://www.spkx.net.cn
2015-07-27
河北省科技支撑计划课题(13397107D);河北科技大学2015年研究生创新资助项目(2015-12)
赵英莲(1989—),女,硕士研究生,主要从事食品成分分析检测研究。E-mail:1363149012@qq.com
*通信作者:李艳(1958—),女,教授,学士,主要从事传统发酵工程创新技术研究。E-mail:lymdh5885@163.com
