高效液相色谱-串联质谱测定猪肉中万古霉素、去甲万古霉素和替考拉宁
2016-12-07范素芳
卢 剑,范素芳,李 强,夏 静,李 挥,张 岩,*
(1.江苏省产品质量监督检验研究院,江苏 南京 210029;2.河北省食品检验研究院,河北 石家庄 050091;3.河北省食品安全重点实验室,河北 石家庄 050091)
高效液相色谱-串联质谱测定猪肉中万古霉素、去甲万古霉素和替考拉宁
卢 剑1,范素芳2,3,李 强2,3,夏 静2,3,李 挥2,3,张 岩2,3,*
(1.江苏省产品质量监督检验研究院,江苏 南京 210029;2.河北省食品检验研究院,河北 石家庄 050091;3.河北省食品安全重点实验室,河北 石家庄 050091)
建立猪肉样品中万古霉素、去甲万古霉素和替考拉宁的高效液相色谱-串联质谱测定方法,采用选择反应监测方式,外标法定量。猪肉样品经0.1%甲酸-乙腈(85∶15,V/V)溶液提取,正己烷脱脂后,万古霉素和去甲万古霉素经阳离子交换柱净化、替考拉宁经C18固相萃取柱净化,以乙腈-0.1%甲酸为流动相梯度洗脱,经C18柱分离、质谱进行测定。添加量为10、20 μg/kg和50 μg/kg时,方法回收率范围为75.3%~83.3%,相对标准偏差小于9%。猪肉中万古霉素、去甲万古霉素的检出限、定量限分别为2 μg/kg和4 μg/kg,替考拉宁的检出限、定量限分别为4 μg/kg和8 μg/kg。该方法适用于猪肉样品中万古霉素、去甲万古霉素和替考拉宁的定性、定量检测。
猪肉;万古霉素;去甲万古霉素;替考拉宁;高效液相色谱-串联质谱
万古霉素和去甲万古霉素属于三环糖肽类抗生素[1],可用于治疗由严重耐甲氧西林金黄色葡萄球菌和耐甲氧西林表皮葡萄球菌引起的感染[2]。替考拉宁也属于糖肽类抗菌药物[3],是一种对革兰氏阳性菌和厌氧微生物起作用的新型糖肽类抗生素[4]。万古霉素的作用主要是抑制细菌细胞壁的合成,由于其较强的抗菌作用,万古霉素在临床上使用较少[5]。万古霉素等糖肽类抗生素对牛乳腺炎等疾病具有较好的治疗效果[1]。近年来,一些养殖者和饲料生产企业在动物饲喂过程中添加万古霉素等抗生素,对人类安全造成威胁[5]。
目前,万古霉素、去甲万古霉素和替考拉宁的测定方法主要有高效液相色谱法[6-12]、高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法[1,4-5,13-19]、化学发光免疫法[20-21]、荧光偏振免疫法[2]等,多为测定血浆中浓度。由于万古霉素、去甲万古霉素和替考拉宁易溶于水,微溶于甲醇、乙腈等有机溶剂,因此前处理多采用高比例水相为提取液,后续还要经固相萃取柱净化。
本实验拟建立基于HPLC-MS/MS法的猪肉中万古霉素、去甲万古霉素和替考拉宁的快速测定方法。
1 材料与方法
1.1 材料与试剂
猪肉 市购;乙腈(色谱纯) 美国Fisher Scientific公司;正己烷(分析纯) 北京化学试剂公司;去离子水 屈臣氏集团(香港)有限公司;万古霉素、去甲万古霉素和替考拉宁(A2-2)标准品(纯度大于98%) 中国食品药品检定研究院;甲酸(色谱纯)美国Supelco公司。
1.2 仪器与设备
UltimateTM3000高效液相色谱仪(配有电喷雾离子源的Quantiva质谱仪) 美国Thermo Scientific公司;3K13高速冷冻离心机 美国Sigma公司;VORTEX 3涡旋混匀仪 德国IKA公司;KQ-500DB超声波清洗器昆山市超声仪器公司;C18色谱柱(2.1 mm×100 mm,1.7 μm)、阳离子交换柱(3 mL、60 mg) 美国Waters公司;C18固相萃取柱(3 mL、100 mg) 美国Agilent公司。
1.3 方法
1.3.1 标准溶液的配制
万古霉素、去甲万古霉素和替考拉宁标准储备溶液的配制:分别准确称取10.20 mg万古霉素、去甲万古霉素和替考拉宁的标准品于10 mL容量瓶中,加入少量去离子水溶解,并用去离子水定容至刻度,制得的1 mg/mL万古霉素、去甲万古霉素和替考拉宁的标准储备溶液于4 ℃条件下存储。
万古霉素、去甲万古霉素和替考拉宁混合标准工作溶液的配制:分别取万古霉素、去甲万古霉素和替考拉宁的标准储备溶液1 mL于10 mL容量瓶中,用去离子水定容至刻度,得质量浓度为100 μg/mL的万古霉素、去甲万古霉素和替考拉宁混合标准工作溶液。
1.3.2 样品提取与净化
提取:称取5.0 g猪肉样品,加入20 mL 0.1%甲酸-乙腈(85∶15,V/V)溶液,涡旋混匀3 min,超声提取15 min,于4 ℃ 9 500 r/min离心5 min,取上清液10 mL待净化。
净化:向10 mL待净化液中加入10 mL正己烷,涡旋混匀1 min,4 ℃ 9 500 r/min离心5 min,取下层清液过定性滤纸。万古霉素、去甲万古霉素:采用阳离子交换柱净化,上样前固相萃取柱依次用甲醇和0.1 mol/L盐酸各3 mL活化,上样后用3 mL甲醇淋洗,3 mL 体积分数5%氨水-甲醇溶液洗脱,收集洗脱液于40 ℃氮吹至干,用1 mL 0.1%体积分数甲酸溶液复溶,过0.22 μm微孔滤膜后,HPLC-MS/MS测定。替考拉宁:采用C18固相萃取柱净化,上样前依次用3 mL甲醇和3 mL水活化,3 mL 0.1%甲酸-乙腈(9∶1,V/V)溶液平衡,上样后,分别用2 mL 0.1%甲酸-乙腈(9∶1,V/V)溶液和1 mL体积分数50%甲醇溶液淋洗,弃去淋洗液,然后用8 mL甲醇洗脱,收集洗脱液于40 ℃氮吹至干,用1 mL体积分数0.1%甲酸溶液复溶,过0.22 μm微孔滤膜后,HPLC-MS/MS测定。
1.3.3 HPLC-MS/MS条件
1.3.3.1 HPLC条件
采用Waters ACQUITY UPLC BEH Shield C18色谱柱(2.1 mm×100 mm,1.7 μm)进行目标化合物的分离,乙腈和0.1%甲酸溶液为流动相,采用梯度洗脱模式,梯度洗脱条件见表1。流速0.3 mL/min,进样体积2 μL。分析时间与色谱柱平衡时间为13 min。

表1 梯度洗脱条件Table 1 Gradient elution conditions
1.3.3.2 MS条件
电离方式:电喷雾离子源;离子传输管温度333 ℃;扫描模式:正离子模式;喷雾电压3 500 V;鞘气压力40 arb;辅助气压力12 arb;雾化器温度317 ℃。本实验采用选择反应监测模式,具体MS参数见表2。
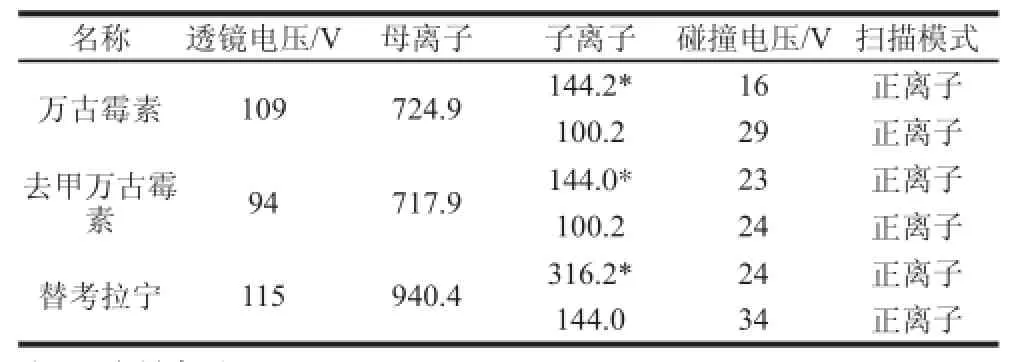
表2 监测离子对及MS参数Table 2 Monitored ion pairs and mass spectral parameters
2 结果与分析
2.1 MS条件的优化
采用针泵注射的方式进行MS条件的优化,50.0 μg/mL的万古霉素、去甲万古霉素和替考拉宁标准溶液在正离子模式下扫描,通过一级扫描找到分析物的母离子,通过二级MS扫描找到母离子对应的碎片离子。万古霉素、去甲万古霉素和替考拉宁分子质量大,进入一级MS后很容易与H+结合,产生双电荷的离子。3 种化合物均选择[M+H]2+作为母离子,通过优化碰撞能找到相应的子离子。3 种分析物的MS条件见表2。
2.2 HPLC条件的优化
万古霉素和去甲万古霉素的结构十分类似,简单的等度洗脱无法将二者分开,因此采用梯度洗脱模式。正离子模式下,流动相中加入少量甲酸能提高离子化效率,改善峰型,但甲酸含量高时会抑制离子化,本实验选择0.1%甲酸溶液为流动相。有机相考察甲醇、乙腈,结果表明选用乙腈时分析物峰形的对称性更好。因此选择乙腈-0.1%甲酸溶液为流动相,具体梯度洗脱条件见表1。
在该条件下万古霉素、去甲万古霉素和替考拉宁的保留时间分别为1.65、1.48 min和5.08 min,如图1所示。


图1 3 种分析物的HPLC-MS/MS图Fig. 1 Chromatography-mass spectrometry profi les of three analytes
2.3 前处理方法的优化
已有文献[1,5,15]报道的前处理过程大都为液液提取、固相萃取柱净化,而固相萃取柱集中在阳离子交换柱、HLB柱和C18柱等。用去离子水配制100 ng/mL的万古霉素、去甲万古霉素、替考拉宁的混合标液,采用标准溶液直接过固相萃取柱净化的方式考察不同固相萃取柱的影响。结果表明,阳离子交换柱(3 mL、60 mg)净化和HLB柱(6mL、500 mg)时,万古霉素和去甲万古霉素的回收率在75%左右,而替考拉宁的回收率只有20%左右;用C18柱(3 mL、100 mg)净化时,替考拉宁的回收率80%左右,但万古霉素和去甲万古霉素的回收率低于10%。因此,万古霉素、去甲万古霉素采用阳离子交换柱净化,替考拉宁采用C18柱净化。
液液提取步骤考察了0.1%甲酸溶液、0.1%甲酸-乙腈(90∶10,V/V)溶液、0.1%甲酸-乙腈(85∶15,V/V)溶液、0.1%甲酸-乙腈(70∶320,V/V)溶液的影响。以0.1%甲酸溶液提取时,所得净化液不够澄清,分析物的出峰拖尾严重;随着乙腈相比例的提高,分析物峰形有所改善,但乙腈相比例超过20%时影响替考拉宁的回收率。最后选择0.1%甲酸-乙腈(85∶15,V/V)溶液作为提取液。
猪肉样品经0.1%甲酸-乙腈(85∶15,V/V)溶液超声提取、离心后,增加了正己烷除脂步骤,取10 mL上清液加入等体积的正己烷,涡旋混匀1 min后离心,可以看到正己烷层明显有油脂析出,说明正己烷除脂效果比较明显。
2.4 方法验证
2.4.1 方法的线性范围、检出限和定量限
采用外标法定量,万古霉素、去甲万古霉素和替考拉宁基质匹配标液的峰面积为纵坐标y,以其质量浓
度(ng/mL)为横坐标x做标准曲线。万古霉素的基质匹配标准曲线方程为y= 1.37×104x-186.8,线性范围为10~100 ng/mL,线性相关系数为0.999 5;去甲万古霉素的基质匹配标准曲线线性方程为y=8.41×103x-26.7,线性范围为10~100 ng/mL,线性相关系数为0.999 3;替考拉宁基质匹配标准曲线线性方程为y=2.23×104x+ 9.82×103,线性范围为20~100 μg/mL,线性相关系数为0.999 1。以分析物信噪比为3时添加水平为检出限,以分析物信噪比为10时添加水平为定量限,万古霉素、去甲万古霉素的检出限、定量限分别为2 μg/kg和4 μg/kg,替考拉宁的检出限、定量限分别为4 μg/kg和8 μg/kg。
2.4.2 方法的准确度与精密度
用回收率来判定方法的准确度,分别作10、20 μg/kg和50 μg/kg 3 个水平添加,每个水平设5 个重复。方法的精密度用该5 次平行实验的相对标准偏差(relative standard deviation,RSD)表示。万古霉素、去甲万古霉素和替考拉宁在3 个水平的回收率范围为75.3%~83.3%,RSD小于9%,具体数据见表3。

表3 方法的回收率与精密度Table 3 Recoveries and precision of the method
2.4.3 方法的基质效应评价
基质是指除分析物之外的组分,在质谱的测定过程中与分析物共流出的样品基质会干扰分析物的离子化过程,造成离子化受到抑制或得到增强,这种现象称为基质效应[22-23]。Paul等[24]于1993年研究电喷雾原理时发现了基质效应的存在。本实验用万古霉素、去甲万古霉素和替考拉宁基质匹配标线的斜率与纯溶剂中标曲斜率的比来评价基质效应。本实验中基质效应以下式表示:

式中:ME为基质效应;Slopematrix和Slopeslovent分别表示基质匹配标曲的斜率和纯溶剂(去离子水)标准曲线的斜率。
ME大于100%时代表存在离子增强效应,ME小于100%时代表存在离子抑制效应。万古霉素、去甲万古霉素和替考拉宁的ME分别为75.7%、82.5%和90.2%,表示3 种分析物都存在离子化抑制效应,并且万古霉素和去甲万古霉素的基质效应比较严重。
2.5 实际样品的测定
采用本方法,对当地超市购买的20 份猪肉样品进行测定,结果均未检出。
3 结 论
本实验建立猪肉样品中万古霉素、去甲万古霉素和替考拉宁的HPLC-MS/MS测定方法,采用选择反应监测方式,外标法定量。5.0 g猪肉样品,加入20 mL 0.1%甲酸-乙腈(85∶15,V/V)溶液,经涡旋混匀、超声提取、离心后,提取液经正己烷脱脂后,万古霉素和去甲万古霉素经阳离子交换柱净化、替考拉宁经C18固相萃取柱净化后用HPLC-MS/MS测定。添加水平10、20 μg/kg和50 μg/kg时,方法回收率范围为75.3%~83.3%,RSD小于9%。猪肉中万古霉素、去甲万古霉素的检出限、定量限分别为2 μg/kg和4 μg/kg,替考拉宁的检出限、定量限分别为4 μg/kg和8 μg/kg。
[1] 朱万燕, 朱万兰, 徐豪, 等. 高效液相色谱-串联质谱法同时测定猪肝中万古霉素、去甲万古霉素和替考拉宁糖肽类抗生素[J]. 分析实验室, 2015, 34(10): 1164-1168. DOI:10.13595/j.cnki.issn1000-0720.2015.0253.
[2] 郭志磊, 范捷, 于洋. 固相萃取-HPLC测定人血清万古霉素、去甲万古霉素浓度及其与荧光偏振免疫法测定结果的比较[J]. 中国现代应用药学, 2015, 32(4): 478-482. DOI:10.13748/j.cnki.issn1007-7693.2015.04.023.
[3] 艾又生, 徐楚鸿, 陈志祥, 等. 高效液相色谱法测定替考拉宁和血药浓度[J]. 中国现代应用药学, 2005, 25(3): 254-256. DOI:10.3321/ j.issn:1001-5213.2005.03.030.
[4] 左利民, 姚静, 王强, 等. 在线固相萃取柱-二维液相色谱串联质谱法测定人脑脊髓液中替考拉宁浓度[J]. 分析化学, 2014, 42(12): 1773-1778. DOI:10.11895/j.issn.0253-3820.140758.
[5] 贾涛. 液相色谱-串联质谱法检测饲料中万古霉素的方法[J]. 饲料广角, 2013(23): 32-35. DOI:10.3969/j.issn.1002-8358.2013.23.011.
[6] 崔艳丽, 武峰. HPLC法同时快速测定万古霉素和去甲万古霉素的血药浓度[J]. 中国医院用药评价与分析, 2011, 11(10): 920-922.
[7] 林秀丽, 朱金平, 费燕. HPLC法快速测定万古霉素和去甲万古霉素的血药浓度[J]. 中国临床药学杂志, 2011, 20(4): 231-234.
[8] 李红宇, 徐小燕, 张莉, 等. HPLC法测定万古霉素和去甲万古霉素血清药物浓度[J]. 湖北民族学院学报, 2010, 27(2): 25-27. DOI:10.3969/j.issn.1008-8164.2010.02.009.
[9] 江泓颖, 曹薇, 陈永刚, 等. RP-HPLC法测定人血浆中替考拉宁的浓度[J]. 广东药学院学报, 2011, 27(5): 496-498. DOI:10.3969/ j.issn.1006-8783.2011.05.014.
[10] 张波. 发酵液中替考拉宁含量的HPLC法测定[J]. 中国实用医药, 2011, 6(23): 38-39. DOI:10.3969/j.issn.1673-7555.2011.23.021.
[11] 耿艳辉, 刘素彦, 贺广锋. 替考拉宁的HPLC法测定[J]. 现代中西医结合杂志, 2014, 23(3): 307-309. DOI:10.3969/ j.issn.1008-8849.2014.03.036.
[12] 胡萨萨, 庞成森, 董海燕, 等. 危重症感染患者血清中替考拉宁浓度测定[J]. 中国医院药学杂志, 2011, 31(9): 753-755.
[13] 张萌萌, 史国兵, 颜鸣, 等. LC-MS/MS法测定人血浆中去甲万古霉素的血药浓度[J]. 中国药师, 2013, 16(7): 990-993. DOI:10.3969/ j.issn.1008-049X.2013.07.020.
[14] 唐云彪, 张萌萌, 隋因, 等. LC-MS/MS法测定人血浆中万古霉素的血药浓度[J]. 药物分析杂志, 2013, 33(9): 1501-1506.
[15] 冼燕萍, 陈立伟, 罗海英, 等. UPLC-MS/MS法测定猪肉中万古霉素与去甲万古霉素[J]. 分析测试学报, 2013, 32(2): 162-167. DOI:10.3969/j.issn.1004-4957.2013.02.004.
[16] 綦艳, 李锦清, 赵明桥, 等. 固相萃取/超高效液相色谱-串联质谱法测定乳与乳制品中万古霉素、去甲万古霉素残留[J]. 分析测试学报, 2013, 32(6): 768-771. DOI:10.3969/j.issn.1004-4957.2013.06.021. [17] 祝仕清, 牛长群. 替考拉宁中主要组分的LC-MS法测定[J]. 分析测试学报, 2008, 27(增刊1): 23-25. DOI:10.3969/j.issn.1004-4957.2008. z1.012.
[18] OYAERT M, PEERSMAN N, KIEFFER D, et al. Novel LC-MS/ MS method for plasma vancomycin: comparison with immunoassays and clinical impact[J]. Clinica Chimica Acta, 2015, 441: 63-70. DOI:10.1016/j.cca.2014.12.012.
[19] BIJLEVELD Y, HAAN T, TOERSCHE J, et al. A simple quantitative method analyzing amikacin, gentamicin, and vancomycin levels in human newborn plasma using ion-pair liquid chromatography/ tandem mass spectrometry and its applicability to a clinical study[J]. Journal of Chromatography B, 2014, 951/952: 110-118. DOI:10.1016/ j.jchromb.2014.01.035.
[20] 王维忠, 钱南萍, 陈斌, 等. 高效液相色谱法和化学发光免疫法测定万古霉素的血药浓度[J]. 中国药业, 2012, 21(20): 27-29. DOI:10.3969/j.issn.1006-4931.2012.20.013.
[21] KHATAEE A R, HASANZADEH A, IRANIFAM M, et al. CuO nanosheets-enhanced flow-injection chemiluminescence system for determination of vancomycin in water, pharmaceutical and human serum[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 122: 737-743. DOI:10.1016/j.saa.2013.12.014.
[22] 范素芳, 李强, 马俊美, 等. 改进的QuEChERS方法结合液相色谱-串联质谱法测定腐竹和豆干中的二甲基黄和二乙基黄[J]. 色谱, 2015, 33(6): 657-661. DOI:10.3734/SP.J.1123.2015.01046.
[23] MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M. Strategies for the asswssment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Analytical Chemistry, 2003, 75(13): 3019-3030. DOI:10.1021/ac020361s.
[24] PAUL K, TANG L. From ions in solution to ions in the gas phase:the mechanism of electrospray mass spectrometry[J]. Analytical Chemistry, 1993, 65(22): 972A-986A.
Determination of Vancomycin, Norvancomycin and Teicoplanin in Pork by High Performance Liquid Chromatography-Tandem Mass Spectrometry
LU Jian1, FAN Sufang2,3, LI Qiang2,3, XIA Jing2,3, LI Hui2,3, ZHANG Yan2,3,*
(1. Jiangsu Provincial Supervising and Testing Research Institute for Products Quality, Nanjing 210029, China; 2. Hebei Food Inspection and Research Institute, Shijiazhuang 050091, China; 3. Heibei Food Safety Key Laboratory, Shijiazhuang 050091, China)
A high performance liquid chromatography-tandem mass spectrometry method was developed for the determination of vancomycin, norvancomycin and teicoplanin in pork samples. The selective reaction monitoring mode was applied in the experiment and an external standard method was used for quantifi cation. Pork samples were weighed, extracted with deionized water containing 0.1% formic acid-acetonitrile (85:15, V/V). Hexane was added to decrease fatty acid. Vancomycin and norvancomycin were cleaned on a cation exchange column, while teicoplanin was cleaned up on an SPE C18cartridge. Acetonitrile-water containing 0.1% formic acid was used as mobile phase and gradient elution was used in the experiment. The analytes were separated on a C18column and then detected by mass spectrometry. The average recoveries of the method were in range of 75.3%□83.3% at spike levels of 10, 20 and 50 μg/kg, with relative standard deviations (RSDs) lower than 9%. The Limit of detection (LOD) and the limit of quantitation (LOQ) were 2 and 4 μg/kg for vancomycin, and 4 and 8 μg/kg for norvancomycin, respectively. The method could be used for the qualitative and quantitative detection of vancomycin, norvancomycin and teicoplanin in pork samples.
pork; vancomycin; norvancomycin; teicoplanin; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)
10.7506/spkx1002-6630-201610033
TS207.3
A
1002-6630(2016)10-0193-05
卢剑, 范素芳, 李强, 等. 高效液相色谱-串联质谱测定猪肉中万古霉素、去甲万古霉素和替考拉宁[J]. 食品科学, 2016, 37(10): 193-197. DOI:10.7506/spkx1002-6630-201610033. http://www.spkx.net.cn
LU Jian, FAN Sufang, LI Qiang, et al. Determination of vancomycin, norvancomycin and teicoplanin in pork by high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2016, 37(10): 193-197. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610033. http://www.spkx.net.cn
2016-02-29
国家自然科学基金青年科学基金项目(31401584);河北省自然科学基金面上项目(C2015321005)
卢剑(1978—),男,高级工程师,硕士,研究方向为食品安全技术。E-mail:lujian_hzp@163.com
*通信作者:张岩(1979—),男,教授级高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com
