UPLC快速测定葡萄酒中酚类物质的方法
2016-12-07张星星郭安鹊韩富亮张予林
张星星,郭安鹊,2,韩富亮,2,张予林,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨陵 712100;2.陕西省葡萄与葡萄酒工程技术中心,陕西 杨陵 712100)
UPLC快速测定葡萄酒中酚类物质的方法
张星星1,郭安鹊1,2,韩富亮1,2,张予林1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨陵 712100;2.陕西省葡萄与葡萄酒工程技术中心,陕西 杨陵 712100)
建立一种新型、快速测定葡萄酒中多种单体酚的超高效液色谱方法。采用Waters BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);色谱条件:流动相A为1%乙酸溶液,流动相B为乙腈;流速为0.2 mL/min;检测波长为210~400 nm;梯度洗脱15 min。方法精密度(n=6)实验的17 种酚类物质的平均相对标准偏差为0.25%~0.66%,对葡萄酒进行加标回收率实验的17 种酚类物质回收率范围为85.10%~102.33%。该方法简单省时、精确可靠、重复性好,非常适用于葡萄酒中酚类物质的定性与定量分析。
超高效液相色谱;葡萄酒;单体酚;测定方法
适量规律性地饮用葡萄酒有益身体健康,葡萄酒特别是红葡萄酒中种类、含量丰富的酚类物质,具有抗癌、抗氧化及预防心血管疾病等多种功能,是葡萄酒中营养成分的主要来源[1-3]。同时,作为葡萄酒的“骨架”成分,酚类物质不仅决定着葡萄酒涩味和苦味的强弱,而且影响着葡萄酒的色泽及生物化学稳定性[4-5],也是决定葡萄酒品质的关键因素。因此,建立快速、准确分析葡萄酒中酚类物质的方法对全面评价葡萄酒营养价值、进而提高葡萄酒的质量具有重要意义。
葡萄酒中酚类物质主要的测定方法有光谱法[6]、电化学法[7-8]、色谱法[9-18],其中色谱法是目前酚类物质最常用的检测方法。高效液相色谱(high performance liquid chromatography,HPLC)结合多种检测器可实现对葡萄酒中多种酚类物质的定性与定量分析[9-13],但该法存在分析时间长、有机溶剂消耗多等缺点。超高效液相色谱(ultra performance liquid chromatography,UPLC)柱采
用粒径为1.7 μm的填料,柱效高,能获得更好的线速度范围从而提高分析速率与灵敏度,具备快速、灵敏、分离度高的技术特点[14],国外已有将其应用于葡萄酒中酚类物质检测的研究[15-18]。国内利用UPLC主要用于葡萄酒中食品添加剂、工业色素等物质的检测分析[19-21],有关酚类物质分析的较少。赵建勇等[14]建立了一种测定葡萄酒中7 种单体酚含量的UPLC检测方法。
本研究利用离心代替传统分液漏斗萃取,通过改进成宇峰等[22]的前处理方法,有效降低有机溶剂与酒样的使用量。同时,采用多波长检测,提高不同种类酚类物质定量检测的精确性和准确性;建立UPLC测定葡萄酒中酚类物质色谱条件,提高色谱峰分离度并缩短测定时间;最终建立一种能够快速、高效测定葡萄酒中单体酚的UPLC分析方法。
1 材料与方法
1.1 材料与试剂
实验中一共10 款供试酒样,酒样具体信息如表1所示。

表1 葡萄酒供试样品Table 1 Information of wine samples
标准样品:香草酸、阿魏酸、水杨酸 美国Fluka公司;安息香酸、反式白藜芦醇 美国Alorich公司;绿原酸、香豆素、桑色素、芦丁、咖啡酸、香豆酸、儿茶素、没食子酸、表儿茶素、槲皮素、橘皮素、山奈酚、丁香酸 美国Sigma公司。
甲醇、乙腈(色谱级),乙酸、乙酸乙酯(分析纯),均为国产试剂。
1.2 仪器与设备
UPLC I-Class仪(Empower色谱工作站、二极管阵列检测器、自动进样器) 美国Waters公司;BT25S 十万分之一天平 德国Startorius公司;A.9901S真空抽滤器、AS 3120B超声波脱气机 奥特赛恩斯公司;watef Millipore纯水机 英国Millipore公司;RE-52AA薄膜旋转蒸发仪 上海亚荣生化仪器;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司。
1.3 方法
1.3.1 标准样品制备
单体酚单个标准样品制备:用十万分之一天平,准确称取17 种单体酚的标准物质,分别加入10 mL容量瓶中,用色谱甲醇溶解并定容至10 mL,配成不同质量浓度不同单体酚的标准物质储备液。
单体酚混合标准样品制备:用十万分之一天平,准确称取17 种单体酚的标准物质加入10 mL容量瓶中,用色谱甲醇溶解并定容至10 mL,配成混合标准样品母液。配制的单体酚混合标准溶液梯度质量浓度如表2所示。
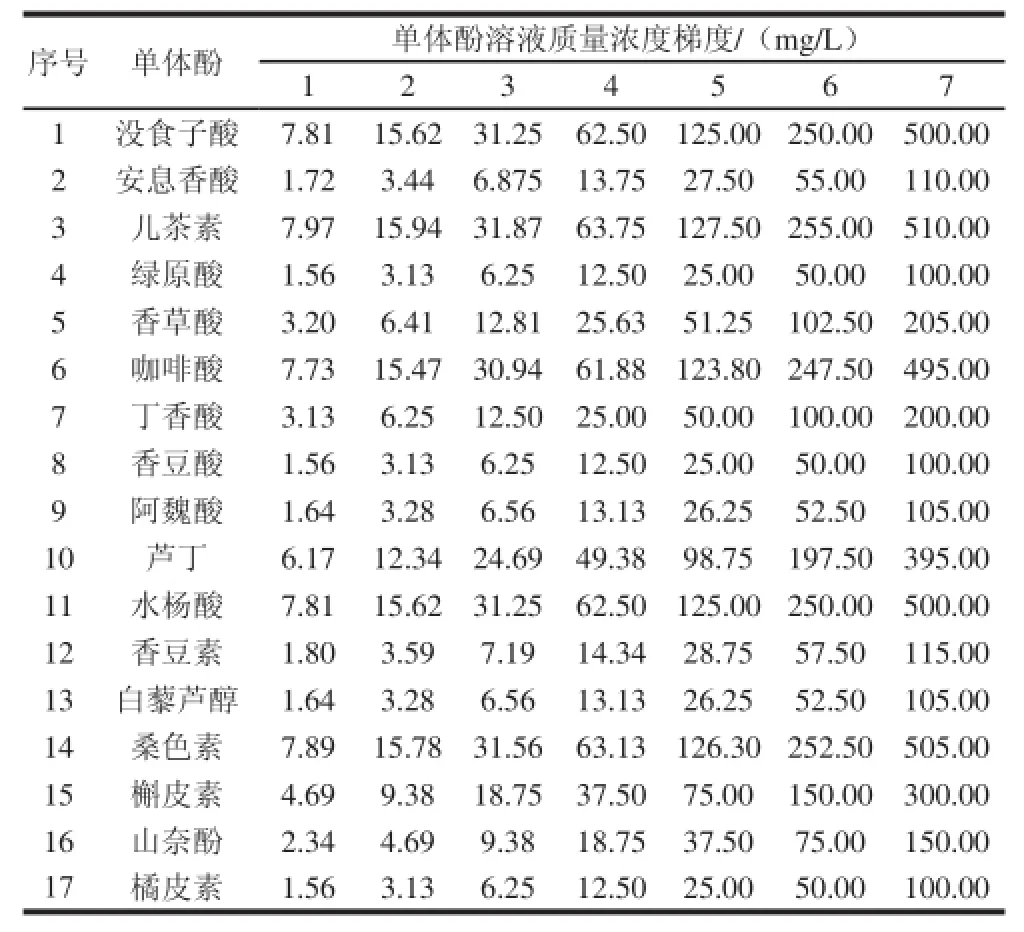
表2 混合标准样品不同浓度梯度Table 2 Different levels of mixed standard solutions
1.3.2 前处理
实验改进成宇峰等[22]单体酚提取方法;取10 mL酒样加入等体积的乙酸乙酯旋涡振荡后离心,取上层清液于100 mL圆底烧瓶,重复萃取3 次合并上清液于减压蒸馏旋干(35 ℃),甲醇溶解残渣,-20 ℃冰箱保存,留作色谱分析。
1.3.3 色谱条件
色谱柱:BEH C18反相色谱柱(2.1 mm×50 mm,1.7 μm);流速0.2 mL/min;柱温30 ℃;检测波长210~400 nm;流动相:A相为体积分数为1%乙酸,B相为乙腈;梯度洗脱。
梯度洗脱程序:0~3 min,B相3%~6%,3~7 min,B相为6%~15%,7~11 min,B相为15%~30%,11~13 min,B相为30%,13~15 min,B相为30%~3%。
2 结果与分析
2.1 UPLC测定葡萄酒酚类物质色谱条件的确定
2.1.1 流动相与洗脱梯度的确定

图1 不同乙酸体积分数条件下混合标准样品色谱图(λ=280 nm)0 nmFig. 1 Chromatogram of mixed standard in acetic acid solutions of different concentrations (λ = 280 nm)
根据张予林等[23]测定单体酚HPLC色谱条件,利用HPLC-UPLC方法器转换得到初级洗脱梯度:0~3 min,B相为3%~6%;3~7 min,B相为6%~15%;7~11 min,B相为15%~30%;11~13 min,B相为30%;13~16 min,B相为30%~3%。采用2%乙酸-乙腈流动相体系,为使峰分离效果更好,实验调整乙酸溶液的质量浓度,将流动相A调整为体积分数3%、2%、1%、0.5%乙酸溶液,对混合标准样品进行色谱分析。由图1可知,流动相乙酸体积分数为1%时,17 种单体酚均达到基线峰分离,分离效果最佳。因此选择A(1%乙酸)-B(乙腈)作为流动相。在原有的洗脱梯度上调整,得到最终流动相及洗脱梯度如表3所示。

表3 流动相与洗脱梯度Table 3 Mobile phase composition for gradient elution
2.1.2 色谱柱检测温度
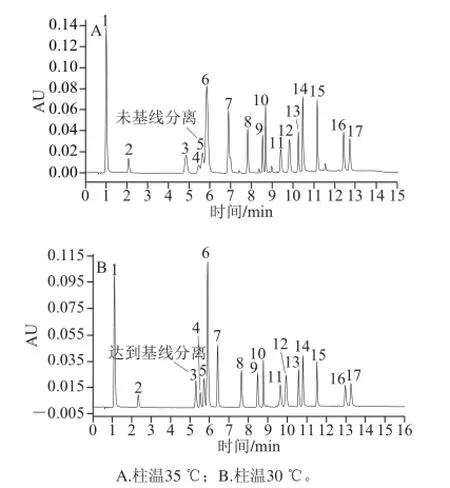
图2 不同柱温条件下混合标准样品色谱图( =280 nm)Fig. 2 Chromatograms of mixed standard at different column temperatures (λ = 280 nm)
UPLC柱检测温度一般设定为高于室温5 ℃,过高温度对酚类物质结构会有影响,因此本实验设定2 个柱温:35 ℃与30℃,测定结果如图2所示。当色谱柱检测温度为35 ℃,较高的柱温导致物质分配系数减小,17 种单体酚标样色谱峰未达到基线分离;当柱温为30 ℃时,17 种单体酚色谱峰均达到基线分离。因而最终选择30 ℃作为色谱柱检测温度。
2.1.3 UPLC测定酚类物质色谱条件
最终确定的UPLC条件如表4所示,在此色谱条件下分别对17 种单体酚单个标准样品进样,确定每种物质最大吸收波长与保留时间,如表5所示。根据单个标准样品的最大吸收波长与保留时间对混合标准样品中17 种单体酚进行定性,测定结果如图3所示。

表4 测定17 种单体酚最终UPLC色谱条件Table 4 Optimal UPLC chromatographic conditions for 17 monophenols
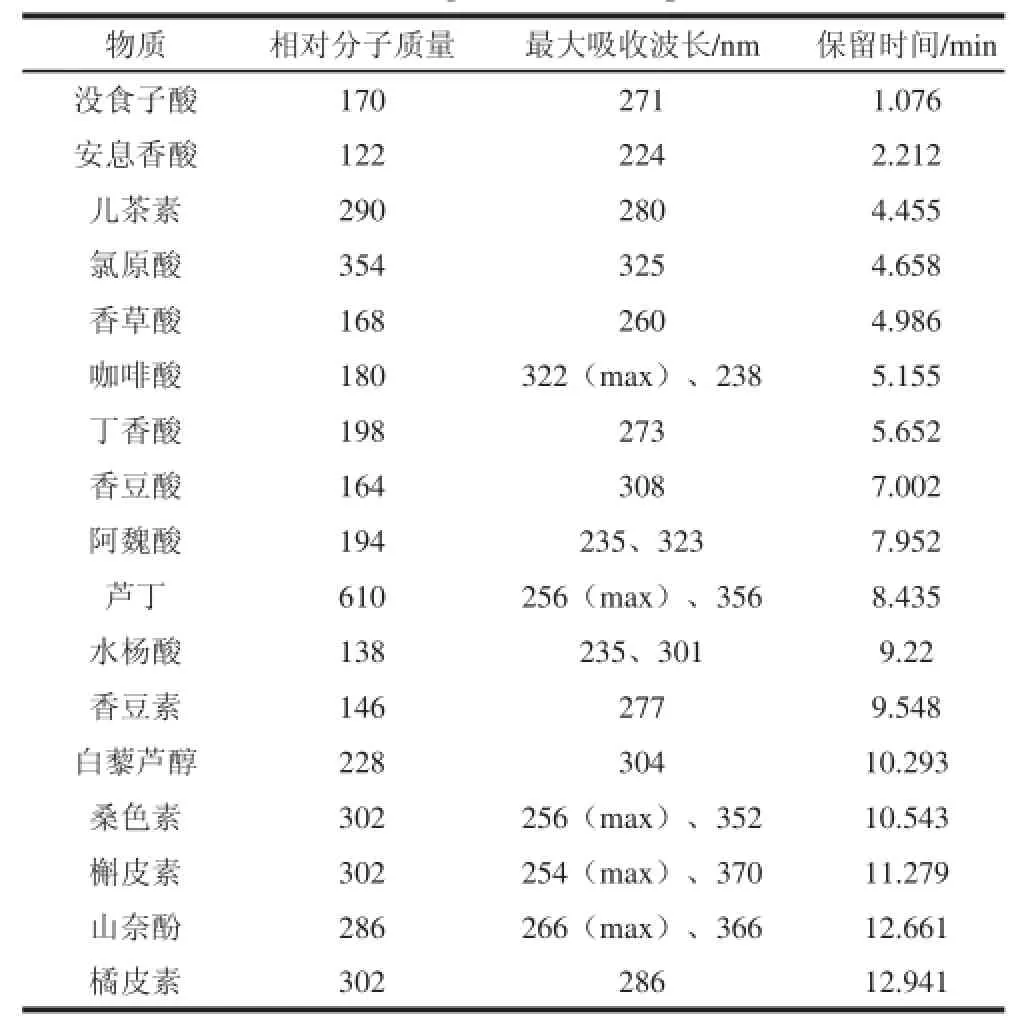
表5 17 种单体酚最大吸收波长、保留时间与相对分子质量Table 5 Maximum absorbance wavelengths, retention times, and molecular weights of 17 mono-phenols
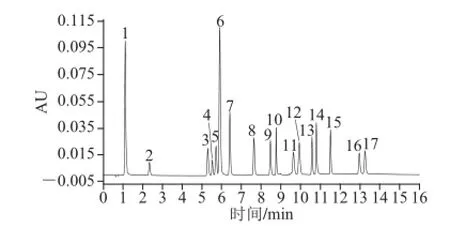
图3 17 种单体酚测定色谱图(λ=2800 nnmm)Fig. 3 Chromatogram of a mixture of 17 standards (λ = 280 nm)
2.2 UPLC测定葡萄酒中酚类物质方法评价结果
2.2.1 标准样品及标准曲线方程
按照表2配制7 种不同质量浓度梯度的混合标准样品,按照表4色谱条件,分别进样测定。以质量浓度(mg/L)为横坐标,峰面积为纵坐标,得到17 种单体酚的标准曲线方程,如表6所示。由标准曲线方程可知,17 种单体酚线性关系决定系数均在0.999 8~1.000 0,说明单体酚在质量浓度范围内线性关系良好。

表6 17 种单体酚最大吸收波长、保留时间与标准曲线Table 6 Maximum absorbance wavelengths, retention times, and regression equations for 17 monophenols
2.2.2 方法精密度
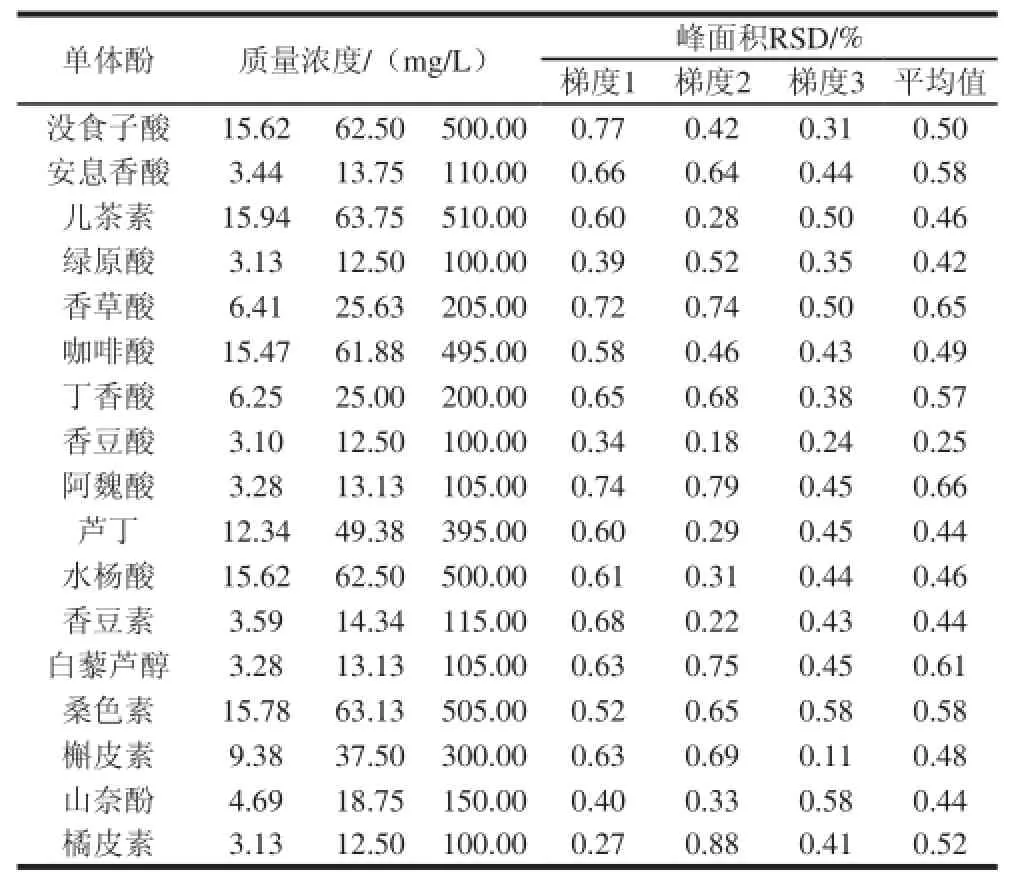
表7 17 种单体酚精密度实验结果Table 7 Results of precision for 17 monophenols (n = 6)
在确定的UPLC条件下测定高中低3 个质量浓度的混合标准样品,重复测定6 次,计算测定结果的相对标准偏差(relative standard deviation,RSD),如表7所示。17 种单体酚在高中低3 个质量浓度梯度峰面积的平均RSD范围为0.25%~0.66%,说明方法精密度良好。
2.2.3 方法回收率
加标葡萄酒与原葡萄酒利用改进前处理方法提取单体酚,利用UPLC测定17 种单体酚含量,计算每种单体酚的回收率,如表8所示。UPLC测定葡萄酒中17 种单体酚加标回收率范围为85.10%~102.33%,说明方法的准确度高。
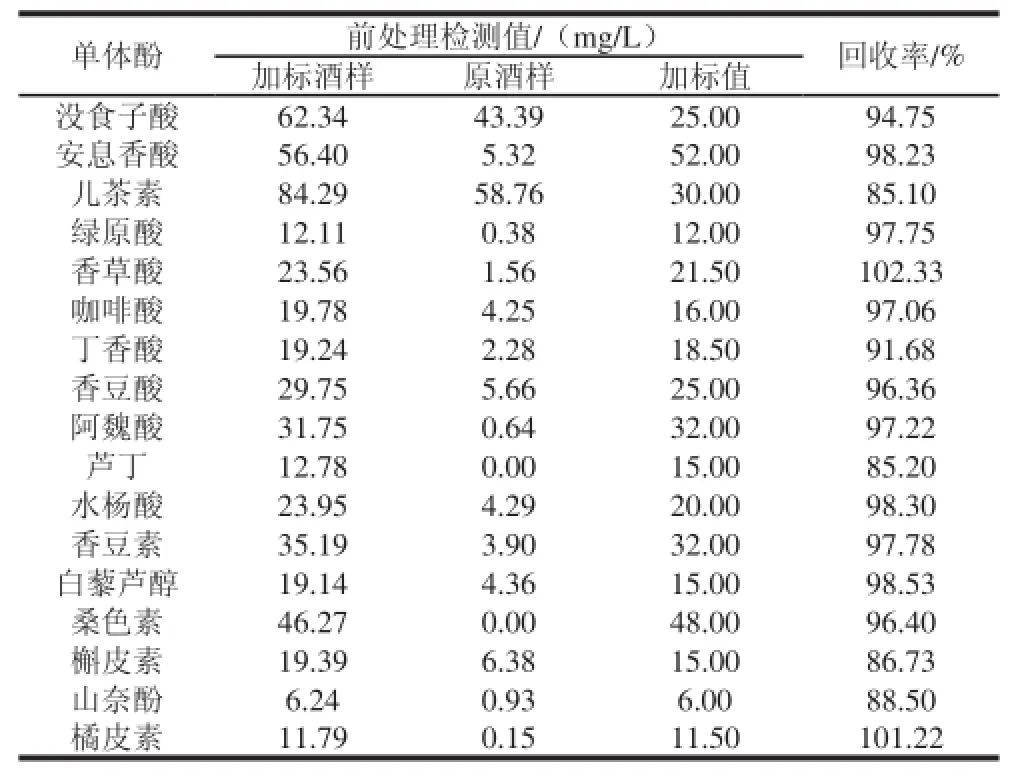
表8 17 种单体酚回收率实验结果(n==33)Table 8 Results of recovery for 17 monophenols (n == 33))
2.2.4 方法重复性

表9 17 种单体酚重复性实验结果(n =3)Table 9 Results of repeatability for 17 monophenols (n =3)
同一葡萄酒酒样利用改进的前处理方法提取单体酚,重复处理3 次,UPLC测定得到17 种单体酚含量,计算3 次测定结果RSD,如表9所示。UPLC测定葡萄酒中17 种单体酚,结果表明含量RSD为0.394%~10.367%,说明方法的重复性较好。
2.3 UPLC测定葡萄酒中酚类物质含量结果
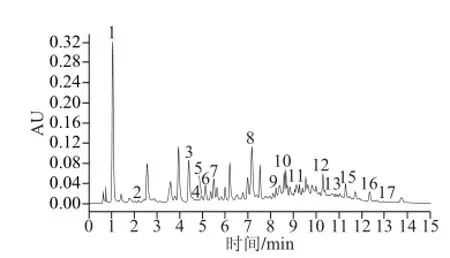
图4 葡萄酒样2色谱图(λ=2800 nnmm)Fig. 4 Chromatogram of wine sample (λ = 280 nm)
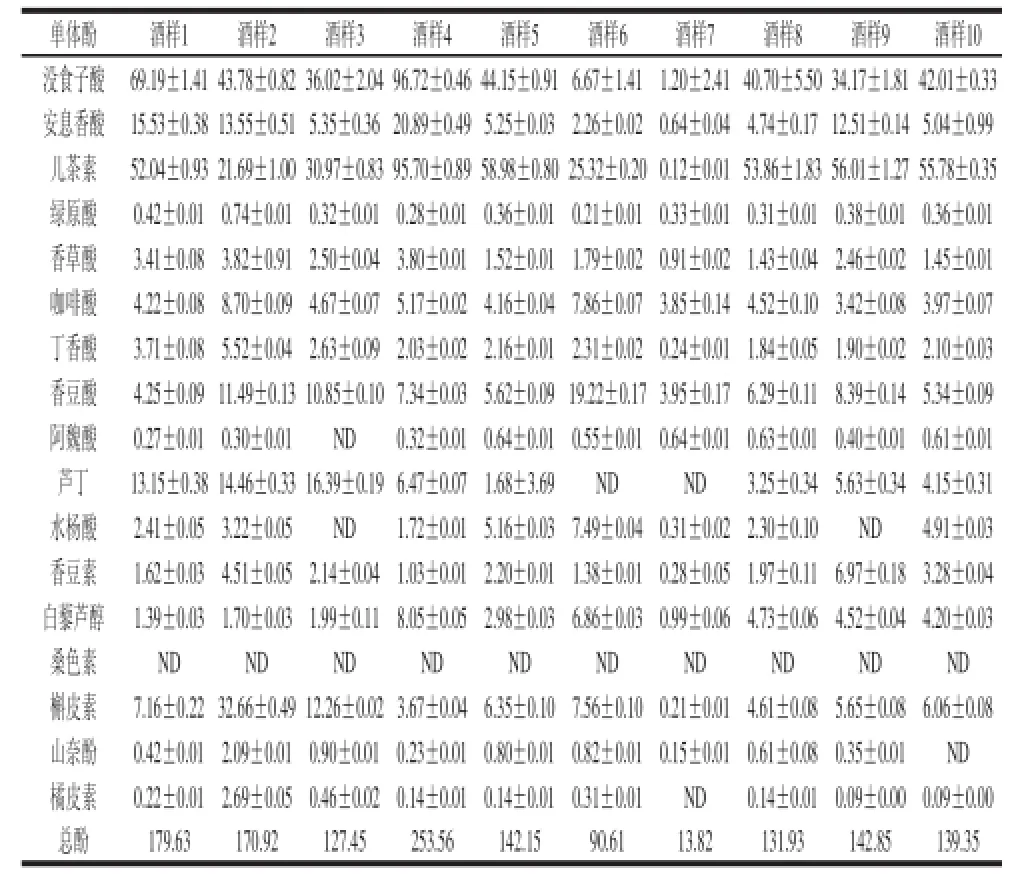
表10 10 种葡萄酒样单体酚含量(n==33)Table 10 Contents of 17 monophenols in 10 different wine samples (n == 33)) mg/L
利用改进的前处理方法提取葡萄酒中单体酚,重复处理3 次,利用确定的UPLC条件测定葡萄酒中17 种单体酚含量,计算3 次处理单体酚含量的RSD。如图4、表10所示,10 种葡萄酒中17 种单体酚总含量在13.82~253.56 mg/L,其中酒样7为威代尔白葡萄酒单体酚总含量较低为13.82 mg/L;红葡萄酒单体酚总含量较高在131.93~253.56 mg/L。供试酒样中桑色素均未检测出。
3 讨 论
前处理方法是UPLC法测定葡萄酒中酚类物质的关键步骤[1],实验利用离心代替分液漏斗萃取。分液漏斗萃取过程单体酚与空气接触时间长易与氧气反应,造成损失[24]。实验采用离心降低单体酚在前处理过程中的损失,提高了测定方法的准确性。
利用色谱法对多组分体系进行测定时,由于各组分的最大吸收波长不尽相同,利用恒定波长很难准确测定组分的真实含量[25]。实验选择二极管阵列检测器,在波长210~400 nm处对17 种待测单体酚进行全波长扫描,根据测定结果在每种单体酚的最大吸收波长处对其定性与定量分析,提高了测定方法的准确度与灵敏度。
本实验利用建立的UPLC条件对10 种供试葡萄酒单体酚进行测定,桑色素均未检出。桑色素化学名为3,5,7,2’,4’-五羟基黄酮,属黄酮醇类物质,空气中易氧化为黄色。目前测定葡萄酒中桑色素结果大都表明未检出[26-27]。分析原因主要是酒样中桑色素含量很少,可通过扩大样品数量,进一步研究葡萄酒中桑色素的含量。
4 结 论
本实验建立了分析葡萄酒中单体酚的UPLC条件,对葡萄酒中17 种单体酚进行分析检测,主要研究结果如下:
确定了UPLC分析葡萄酒中17 种单体酚的方法。前处理方法:取10 mL酒样加入等体积的乙酸乙酯旋涡振荡后离心,重复萃取3 次合并上清液于减压蒸馏旋干(35 ℃),甲醇溶解残渣,0.22 μm膜过滤,-20 ℃保存。色谱条件:BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)反相色谱柱;流动相A为体积分数1%乙酸溶液,流动相B为乙腈;洗脱梯度为B相0~3 min为3%~6%,3~7 min为6%~15%,7~11 min,为15%~30%,11~13 min为30%,13~15 min为30%~3%;进样量0.5 μL;流速0.2 mL/min;色谱柱检测温度30 ℃;色谱柱平衡时间2.1 min;梯度洗脱时间15 min。
建立的UPLC测定葡萄酒中酚类物质方法,精密度实验结果表明,17 种单体酚含量的RSD在0.25%~0.66%;加标回收率实验表明,加标回收率在85.10%~102.33%之间;方法重复性实验结果,单体酚含量的相对标准偏差在0.394%~10.367%,说明方法的精密度、重复性好、准确度高。
通过对10 种供试葡萄酒单体酚测定,实验结果表明,葡萄酒中单体酚含量丰富,不同单体酚质量浓度差异较大;供试葡萄酒酒样中桑色素均未检出。
[1] LORRAIN B, KY I, PECHAMAT L, et al. Evolution of analysis of polyhenols from grapes, wines, and extracts[J]. Molecules, 2013, 18(1): 1076-1100. DOI:10.3390/molecules18011076.
[2] GARRIDO J, BORGES F. Wine and grape polyphenols-a chemical perspective[J]. Food Research International, 2011, 44(10): 3134-3148. DOI:10.1016/j.foodres.2011.11.001.
[3] ROUSSIS I G, LAMBROPOULOS I, TZIMAS P, et al. Antioxidant activities of some greek wines and wine phenolic extracts[J]. Journal of Food Composition and Analysis, 2008, 21(8): 614-621. DOI:10.1016/ j.jfca.2008.02.011.
[4] 刘一健, 孙剑锋, 王颉. 葡萄酒酚类物质的研究进展[J]. 中国酿造, 2009, 28(8): 5-9. DOI:10.3969/j.issn.0254-5071.2009.08.002.
[5] JENSEN J S, DEMIRAY S, EGEBO M, et al. Prediction of wine color attributes from the phenolic profi les of red grapes (Vitis vinifera)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(3): 1105-1115. DOI:10.1021/jf072541e.
[6] 赵芳, 郝亚楠, 战吉宬. 光谱技术在葡萄酒原产地识别中的应用进展[J]. 中国酿造, 2014, 33(8): 1-5. DOI:10.11882/ j.issn.0254-5071.2014.08.001.
[7] 刘芳华, 彭友元, 叶建农. 毛细管电泳-电化学检测法测定葡萄和葡萄酒中的白藜芦醇[J]. 分析测试学报, 2005, 24(3): 125-127. DOI:10.3969/j.issn.1004-4957.2005.03.035.
[8] ARRIBAS A S, MARTÍNEZ-FERNÁNDEZ M, CHICHARRO M. The role of electroanalytical techniques in analysis of polyphenols in wine[J]. TrAc Trends in Analytical Chemistry, 2012, 34: 78-96. DOI:10.1016/j.trac.2011.10.015.
[9] BURIN V M, ARCARI S G, BORDIGNON-LUIZ M T, et al. Determination of some phenolic compounds in red wine by RP-HPLC: method development and validation[J]. Journal of Chromatographic Science, 2011, 49(8): 647-651. DOI:10.1093/chrsci/49.8.647.
[10] 于贞, 李记明. 用HPLC法测定干红葡萄酒中的酚类物质[J]. 酿酒, 2002, 29(2): 88-89. DOI:10.3969/j.issn.1002-8110.2002.02.036.
[11] 成宇峰, 张振文, 岳泰新, 等. HPLC同时检测葡萄酒中10 种单体酚的方法[J]. 食品科学, 2008, 29(4): 287-290. DOI:10.3321/ j.issn:1002-6630.2008.04.060.
[12] 陈建业, 温鹏飞, 战吉成, 等. 葡萄酒中11 种酚酸的反相高效液相色谱测定方法研究[J]. 中国食品学报, 2007, 6(6): 133-138. DOI:10.3969/j.issn.1009-7848.2006.06.027.
[13] 陈曦, 周小平, 韩舜愈, 等. HPLC测定葡萄和葡萄酒中花色苷[J]. 光谱实验室, 2013, 30(4): 1704-1709. DOI:10.3969/ j.issn.1004-8138.2013.04.044.
[14] 赵建勇, 任水英. UPLC法同时检测新疆葡萄酒中的7 种单体酚[J]. 中国酿造, 2015, 34(2): 139-141. DOI:10.11882/ j.issn.0254-5071.2015.02.031.
[15] SCHWARZ M, RODRÍGUEZ M C, GUILLÉN D A, et al. Development and validation of UPLC for the determination of phenolic compounds and furanic derivatives in Brandy de Jerez[J]. Journal of Separation Science, 2009, 32(11): 1782-1790. DOI:10.1002/ jssc.200800706.
[16] SILVA C L, PEREIRA J, WOUTER V G, et al. A fast method using a new hydrophilic-lipophilic balanced sorbent in combination with ultra-high performance liquid chromatography for quantification of signifi cant bioactive metabolites in wines[J]. Talanta, 2011, 86: 82-90. DOI:10.1016/j.talanta.2011.08.007.
[17] FRACASSETTI D, LAWRENCE N, TREDOUX A G J, et al. Quantification of glutathione, catechin and caffeic acid in grape juice and wine by a novel ultra-performance liquid chromatography method[J]. Food Chemistry, 2011, 128(4): 1136-1142. DOI:10.1016/ j.foodchem.2011.04.001.
[18] GRUZ J, NOVÁK O, STRNAD M. Rapid analysis of phenolic acids in beverages by UPLC-MS/MS[J]. Food Chemistry, 2008, 111(3): 789-794. DOI:10.1016/j.foodchem.2008.05.014.
[19] 陈欣欣, 谢娅黎, 肖汉, 等. 超高效液相色谱快速检测葡萄酒中5 种合成着色剂[J]. 现代食品科技, 2009, 25(9): 1098-1100. DOI:10.3969/j.issn.1673-9078.2009.09.030.
[20] 赵珊, 张晶, 杨奕, 等. 超高效液相色谱-电喷雾串联四极杆质谱法检测果汁和葡萄酒中的27 种工业染料[J]. 色谱, 2010, 28(4): 356-362. DOI:10.3724/SP.J.1123.2010.00356.
[21] 王丽娟, 柯润辉, 王冰, 等. 超高效液相色谱-电喷雾串联质谱法直接测定黄酒和葡萄酒中氨基甲酸乙酯[J]. 色谱, 2012, 30(9): 903-907. DOI:10.3724/SP.J.1123.2012.05007.
[22] 成宇峰, 张振文, 岳泰新. HPLC测定葡萄酒中单体酚样品预处理方法的优化[J]. 酿酒科技, 2008(2): 116-118.
[23] 张予林, 王威, 郭安鹊. HPLC同时测定葡萄酒中18 种单体酚方法的研究[C]//第八届国际葡萄与葡萄酒学术研讨会论文集. 西安: 陕西人民出版社, 2013: 251-258.
[24] DIAS D A, SMITH T A, GHIGGINO K P, et al. The role of light, temperature and wine bottle colour on pigment enhancement in white wine[J]. Food Chemistry, 2012, 135(4): 2934-2941. DOI:10.1016/ j.foodchem.2012.07.068.
[25] 张昂, 房玉林, 王华, 等.高效液相色谱切换波长法同时测定葡萄组织中单体酚[J]. 分析化学, 2007, 35(11): 1614-1618. DOI:10.3321/ j.issn:0253-3820.2007.11.014.
[26] TANG K, MA L, HAN Y H, et al. Comparison and chemometric analysis of the phenolic compounds and organic acids composition of Chinese wines[J]. Journal of Food Science, 2015, 80(1): C20-C28. DOI:10.1111/1750-3841.12691.
[27] FANG F, LI J M, ZHANG P, et al. Effects of grape variety, harvest date, fermentation vessel and wine ageing on fl avonoid concentration in red wines[J]. Food Research International, 2008, 41(1): 53-60. DOI:10.1016/j.foodres.2007.09.004.
Fast Determination of Phenolics and Polyphenolics in Wine by Ultra Performance Liquid Chromatography
ZHANG Xingxing1, GUO Anque1,2, HAN Fuliang1,2, ZHANG Yulin1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China)
The aim of study was to develop a novel method using ultra-performance liquid chromatography (UPLC) to rapidly determine monophenols in wine. The UPLC system equipped with C18BEH analytical column (2.1 mm × 50 mm, 1.7 μm) was kept at 30 ℃ by column oven, utilizing A 1% acetic acid and B acetonitrile mobile phase in the gradient elution mode within 15 min. The fl ow rate was 0.2 mL/min. A diode array detector (DAD) was used to monitor signals at 210□400 nm. The method precision (n = 6) for 17 compounds expressed as RSD was 0.25%□0.66% and average recovery rates of spiked wine samples were 85.10%□102.33%. The new method was simple, time-saving, accurate, reliable and prefect reproducible. Therefore, it is a promising method for the identifi cation and quantitation of phenolic compounds in wine.
ultra performance liquid chromatography (UPLC); wine; monophenols; assay
10.7506/spkx1002-6630-201610022
O657.7
A
1002-6630(2016)10-0128-06
张星星, 郭安鹊, 韩富亮, 等. UPLC快速测定葡萄酒中酚类物质的方法[J]. 食品科学, 2016, 37(10): 128-133. DOI:10.7506/spkx1002-6630-201610022. http://www.spkx.net.cn
ZHANG Xingxing, GUO Anque, HAN Fuliang, et al. Fast determination of phenolics and polyphenolics in wine by ultra performance liquid chromatography[J]. Food Science, 2016, 37(10): 128-133. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610022. http://www.spkx.net.cn
2015-09-27
国家现代农业产业技术体系建设专项(CARS-30-zp-9);中央高校基本科研业务费专项(QN2011098)
张星星(1992—),女,硕士研究生,研究方向为发酵工程专业。E-mail:18740351864@163.com
*通信作者:张予林(1975—),男,讲师,硕士,研究方向为葡萄酒分析与检验。E-mail:zhangyl@nwsuaf.edu.cn
