丙烯酰胺对斑马鱼各器官的毒性作用及生殖细胞的DNA损伤
2016-12-06曹秀明罗飞樊宇
曹秀明,罗飞,*,樊宇
1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076
2.上海罗氏制药有限公司,上海200000
丙烯酰胺对斑马鱼各器官的毒性作用及生殖细胞的DNA损伤
曹秀明1,罗飞1,*,樊宇2
1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076
2.上海罗氏制药有限公司,上海200000
在我国,聚丙烯酰胺(PAM)主要应用于石油开采,其长期暴露于环境中可以降解成有毒的丙烯酰胺(AM)。为探究在降解过程中AM的毒性作用,选择斑马鱼作为受试动物,进行AM长期毒性暴露40 d,考察了对斑马鱼的肝脏、脑组织、心脏、腮等器官的影响情况。结果表明:在2.04mg·L-1、6.12mg·L-1和18.36mg·L-1暴露浓度下,形态学观察斑马鱼的鳃丝,鳃小片和鳃细胞有严重的受损现象;随着浓度的升高斑马鱼肝脏、脑组织和心脏中MDA含量、LDH活力的升高,SDH和Na+-K+-ATPase活力的降低,均对其肝脏、脑组织和心脏造成氧化损伤作用,从而影响了斑马鱼体内细胞能量代谢过程。采用彗星试验检测斑马鱼的生殖腺细胞DNA损伤,结果显示暴露于浓度为2.04mg·L-1~18.36mg·L-1的AM后,斑马鱼的DNA损伤均表现为显著差异(P<0.01)。上述研究结果均确定了AM对斑马鱼的毒性效应并可造成其生殖腺细胞的DNA损伤。
丙烯酰胺;斑马鱼;氧化损伤;DNA损伤
目前,在石油开采过程中主要应用聚丙烯酰胺(PAM)来调节絮凝剂的絮凝、增稠和对流体流变性,它是由AM均聚或与其他单体共聚而成,含50%以上的线性及水溶性高分子化学产品的总称[1-4]。但在生产使用过程中,PAM难免会发生一系列的降解,对其性能产生影响,社会各界对其极为关注。在自然条件下,PAM会发生缓慢的物理降解(热、机械)、化学降解(水解、氧化以及催化氧化)和生物降解,最终生成各种低聚物以及具有剧毒的AM单体[5]。如果直接将含有PAM的污水排放,将在环境中逐渐积累,危害环境[6]。AM可对生殖、皮肤、消化道、肌肉、神经组织产生毒性[7],其致癌性已引起世界卫生组织(WHO)和国际粮农组织(FAO)的关注,国际癌症研究中心(IARC)将AM列为“可能人类致癌物”。但是关于AM和PAM的广泛使用对环境尤其是水生态环境影响的研究较少,本文将斑马鱼长期暴露于PAM的单体AM中,研究AM对斑马鱼体的毒性作用。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:解剖镜XTL-2400(北京福凯仪器有限公司);FA1004分析天平(上海上平仪器有限公司);721型可见分光光度计(上海精密仪器仪表有限公司);Anke TDL80-2B离心机(上海安亭科学仪器厂);Allegra 64R型低温高速离心机(Beckman-Coulter公司);SUNRISE酶标仪(瑞士TECAN公司);S3400N型扫描电镜(日本日立公司);H7650型透射电镜(日本日立公司);MX-E型小型固定式混匀仪(BIOSHARP公司);磁力搅拌器(上海一科仪器设备有限公司);电泳仪(北京六一仪器厂);荧光显微镜(德国Leica公司)。
试剂:丙烯酰胺购自BIOSHARP公司;BCA蛋白测定试剂盒购自碧云天生物技术研究所;丙二醛测定试剂盒、乳酸脱氢酶试剂盒、琥珀酸脱氢酶试剂盒、钠钾ATP酶试剂盒均购自南京建成生物工程研究所;冰乙酸购自天津市天力化学试剂有限公司;胰蛋白酶购自Invitrogen公司;胎牛血清购自杭州四季青生物工程材料有限公司;Tris购自天津市博迪化工有限公司;肌氨酸钠购自上海晶纯生化科技股份有限公司;二甲基亚砜购自天津市博迪化工有限公司;TritonX-100购自天津富德士科技有限公司;正常熔点琼脂糖、低熔点琼脂糖购自北京白晶生物技术有限公司;溴化乙锭购自天津市博迪化工有限公司;戊二醛购自哈尔滨医科大学生理学馆电镜室。
1.2 实验材料
实验用斑马鱼,购于哈尔滨市香坊区花卉大市场,雌雄不限,发育良好。实验前先驯养7 d,每天定时定量喂食2次,水温约25℃,光暗比例14 h:10 h。实验用水采用人工曝气48 h的自来水,并确保水质符合OECD实验要求[6]。每天早上清理鱼缸内的排泄物和其他杂质,在此期间死亡率不得超过5%。
1.3 实验方法
在预驯养1周后的斑马鱼中选取平均体重为(0.42±0.05)g,平均体长为(3.67±0.50)cm进行AM暴露处理。本实验主要对 1/45LC50、1/15LC50、1/ 5LC503个剂量组进行实验(其中低剂量组为2.04mg·L-1、中剂量组为6.12mg·L-1、高剂量组为18.36mg·L-1),并设置空白对照组。在体积为20 L的玻璃鱼缸中分别配置上述浓度的试液14 L,每组20条,雌雄平均,隔天换去一半水,空白组条件一样,每天清理缸内杂质和排泄物,其余条件与驯养期间相同,40 d后可进行实验。
1.3.1 鱼鳃的组织形态学观察
暴露时间结束后,分别从各给毒组和对照组中随机抽取5条斑马鱼(雌雄不限),麻醉处理后立即解剖,各组斑马鱼解剖摘取单片的鱼鳃,每条鱼摘取完整无损的鱼鳃1~2片即可。摘下鱼鳃后迅速用适量PBS缓冲液冲洗掉鳃片表面的粘液,然后再用适量的胰酶冲洗鳃片2次,每次大约间隔30 s,目的是消化掉鳃片表面附着的组织和细胞以便于电镜下观察。最后再用PBS清洗2次后将鱼鳃放入1.5 mL EP管中,在EP管中加入适量(没过鳃片即可)戊二醛,在4℃条件下固定24 h后送哈尔滨医科大学生理学馆电镜室,做扫描电镜和透射电镜观察成像。
1.3.2 MDA含量、LDH、SDH、Na+-K+-ATPase酶活性测定
暴露时间结束后,分别从各给毒组和对照组中随机抽取10条斑马鱼(雌雄不限),麻醉处理后立即解剖,分别取出肝脏、脑组织、心脏,3种组织器官,用生理盐水洗净,相同的组织器官放在一起称重,称重后的组织器官分为分两部分,将其制成含量分别为10%和0.2%的组织匀浆液。用移液器分别吸取等量组织匀浆液和PBS缓冲液进行配平,4℃, 12 000 r·min-1条件下离心15 min。取10%的组织与匀浆上清液用于蛋白、丙二醛(MDA)、琥珀酸脱氢酶(SDH)和钠钾ATP酶(Na+-K+-ATPase)含量的测定;0.2%的组织匀浆液用于乳酸脱氢酶(LDH)的测定。以上严格按照说明书的操作步骤进行操作。
1.3.3生殖腺细胞的DNA损伤分析
从对照组和3个暴露浓度组中取出的雌性斑马鱼放置在碎冰上麻醉处死。然后在解剖镜下解剖取出生殖腺,取0.25%胰酶100μL,将生殖腺冲入EP管中,将其混匀1 min,放入37℃的水浴锅中5 min,取少量混悬液在显微镜下观察,大部分组织已消化成单细胞即可终止消化。过滤混悬液,细胞悬液3 000 r·min-1、离心10 min,去上清,吸取100μL PBS缓冲液加入管内反复吹打沉淀直至均匀混悬于PBS缓冲液中,得到斑马鱼生殖腺细胞悬液。调节细胞浓度为106~108个·mL-1,放入冰盒中保存。将双层胶的载玻片放入表面皿中,倒入细胞裂解液,避光置于4℃冰箱中。1.5 h后将其取出,放置在电泳仪的阳极附近,缓缓加入电泳缓冲液至淹没玻片胶层,同时防止气泡产生,避光静置30 min。解旋后,电泳仪调至25 V、300 mA,15 min。取出载玻片,用PBS避光冲洗3次,每次5 min。用滤纸吸去余液后进行EB染色,避光染色15 min后用双蒸水反复冲洗3遍,吸去多余水分。在荧光显微镜下观察,激发波长为515~560 nm。
2 结果(Results)
2.1 鱼鳃的组织形态学观察
如图1所示,图1a鳃丝结构清晰,完整,无粘连;图1b鳃小片结构清晰,上皮及基底膜完整,柱状细胞排列整齐;图1c鳃丝结构尚清晰,局部有粘连;图1d鳃小片结构尚清晰,上皮及基底膜部分缺失,柱状细胞排列不整齐,个别细胞有肿大现象;图1e鳃丝粘连,结构不完整,局部有塌陷;图1f鳃小片结构不完整,上皮及基底膜全部缺失,柱状细胞肿大,排列不整齐;图1g鳃丝结构不完整,大部分鳃丝塌陷,粘连;图1h鳃小片结构不完整,上皮及基底膜彻底缺失,柱状细胞排列杂乱,细胞肿大,局部细胞有脱落。
实验结果表明不同浓度AM暴露对斑马鱼鳃造成不同程度的损伤。损伤程度随暴露浓度升高而加重,既有鳃丝和鳃小片组织结构的损伤也有鳃细胞的损伤,1/45LC50浓度时斑马鱼鳃的组织结构局部被破坏,鳃丝有粘连现象,鳃细胞结构也发生一定的变化,柱状细胞肿大,排列不整齐等;当浓度达到1/5LC50时斑马鱼鳃丝和鳃小片的组织结构基本被完全破坏,局部鳃细胞出现脱落现象。
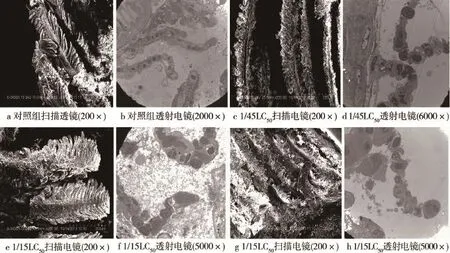
图1 对照组和各丙烯酰胺(AM)暴露组斑马鱼鳃扫描电镜和透射电镜图像Fig.1 Scanning electron and transmission electron microscope of zebrafish gill in control and acrylamide(AM)exposure groups
2.2 对斑马鱼肝脏、脑组织和心脏中细胞的氧化损伤及能量代谢酶的影响
2.2.1 AM长期暴露对斑马鱼肝脏、脑组织和心脏中MDA含量的影响
AM长期暴露下斑马鱼肝脏、脑组织和心脏中MDA含量测定结果见表1。结果表明,1/45LC50暴露浓度的斑马鱼肝脏、脑组织和心脏MDA含量无显著性差异,1/15LC50暴露浓度的斑马鱼肝脏和心脏MDA含量升高显著,且脑组织中MDA含量升高显著,1/5LC50暴露浓度的斑马鱼肝脏、脑组织和心脏中MDA含量升高显著。暴露浓度斑马鱼肝脏、脑组织和心脏中MDA含量随着AM暴露浓度升高而增大。
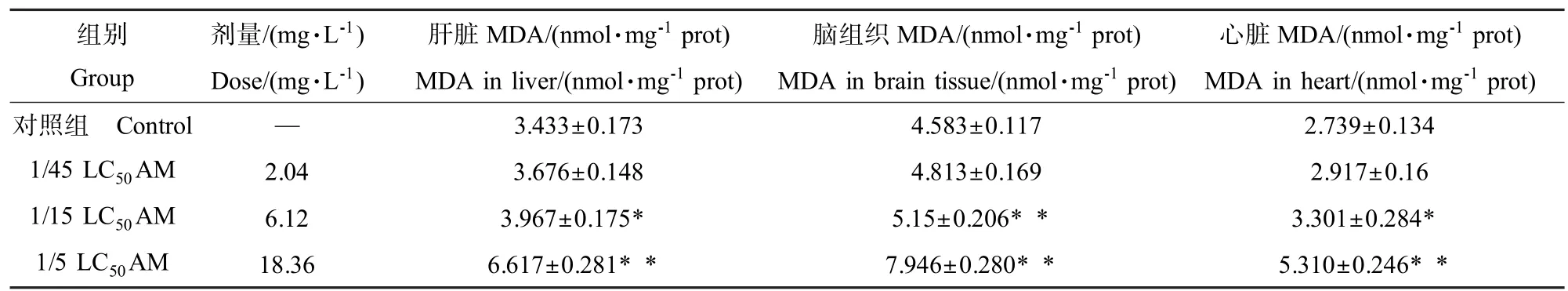
表1 AM对斑马鱼肝脏、脑组织和心脏中MDA含量的影响(x—±s,n=10)Table 1 Effect of AM on zebrafish MDA content in liver,brain and heart(x—±s,n=10)
2.2.2 乳酸脱氢酶(LDH)活性的影响
图2结果表明,与对照组相比,长期暴露于AM后各个暴露浓度组的斑马鱼肝脏、脑组织和心脏中LDH活性均显著升高,LDH活性随着AM暴露浓度增大而升高。
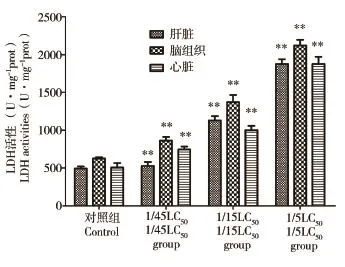
图2 AM长期暴露对斑马鱼肝脏、脑组织、心脏乳酸脱氢酶(LDH)酶活性影响注:**P<0.01。Fig.2 The effects of AM lone-term exposure on lactate dehydrogenase(LDH)activities of the liver,brain and heart of zebrafishNote:** P<0.01 vs Control.
2.2.3 琥珀酸脱氢酶(SDH)活力的影响
图3表明与对照组相比,长期暴露于AM后各个暴露浓度组的斑马鱼肝脏、脑组织和心脏中SDH活力显著降低。SDH活力随着AM暴露浓度增大而降低。
2.2.4 钠钾ATP酶(Na+-K+-ATPase)活力的影响
图4表明与对照组相比,长期暴露于AM后各个暴露浓度组中斑马鱼肝脏、脑组织和心脏中Na+-K+-ATPase活力显著降低。Na+-K+-ATPase活力随着AM暴露浓度的增大而降低。

图3 AM长期暴露对斑马鱼肝脏、脑组织、心脏琥珀酸脱氢酶(SDH)酶活性影响注:与对照组相比,**P<0.01。Fig.3 The effects of AM lone-term exposure on synchronous digital hierarchy(SDH)activities of the liver,brain and heart of zebrafishNote:**P<0.01 vs Control.
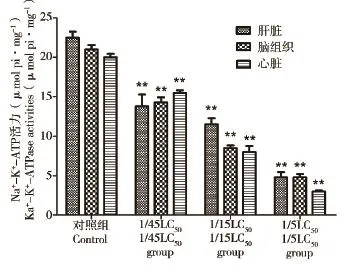
图4 AM长期暴露对斑马鱼肝脏、脑组织、心脏Na+-K+-ATPase酶活性影响注:与对照组相比,**P<0.01。Fig.4 The effects of AM lone-term exposure on Na+-K+-ATPase activities of the liver,brain and heart of zebrafishNote:** P<0.01 vs Control.
结果表明:在40 d的长期毒性暴露后,与对照组相比3个暴露浓度组斑马鱼肝脏、脑组织和心脏中LDH活性均出现显著升高,SDH和Na+-K+-ATPase活力均出现显著降低。LDH活性随着AM暴露浓的增大而升高,SDH和Na+-K+-ATPase活力随着AM暴露浓度的增大而降低。
实验结果说明一定浓度的AM长期暴露对斑马鱼肝脏、脑组织和心脏中细胞能量代谢相关的酶活性与对照组相比有显著影响,差异有统计学意义。
2.3 生殖腺细胞的DNA损伤分析
结果显示:不同浓度AM处理下,雌性斑马鱼生殖腺细胞SCGE结果如图5所示。图5a为对照组;图5b-d,可以明显看到细胞受损,经电泳后DNA断裂离开核DNA,产生像彗星一样的图像。且随着染毒浓度的增加,细胞核逐渐变得疏松,体积逐渐变大, DNA的迁移量逐渐增加。当浓度增加到1/5LC50时,大部分DNA迁移出了细胞核,使细胞核成为一个镂空的组织,表明AM长期暴露处理能后引起DNA损伤。
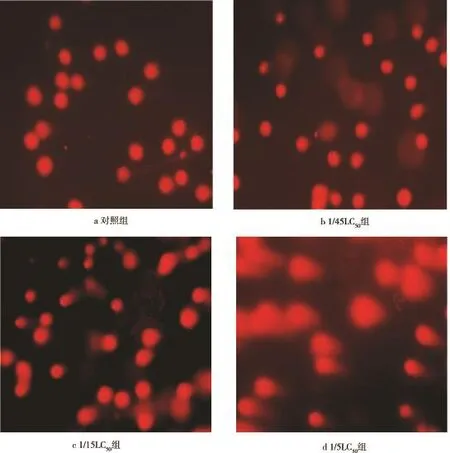
图5 AM长期暴露下斑马鱼生殖腺细胞DNA的彗星图像(400×)Fig.5 DNA comet images of zebrafish germen cells after AM lone-term exposure(400×)

表2 AM对生殖腺细胞DNA的损伤(x—±s,n=50)Table 2 DNA damages of gonad cells induced by AM(x—±s,n=50)
3 讨论(Discussion)
鳃是斑马鱼的基本呼吸器官,像肺一样,鳃有巨大的表面积以供呼吸,也是溶解性化学物质进行交换的重要场所。AM的长期暴露下,观察到斑马鱼鳃已造成了严重的损伤,导致了其呼吸系统的损害以及对自身的保护作用降低。鳃小片上皮细胞肿大降低了鳃与外界进行气体交换的效率,导致鳃吸收氧的能力下降,氧摄取量的不足还将影响机体的代谢活动。初步揭示了AM对腮造成了影响。
一般生物体暴露在污染环境中,毒物会通过很多途径进入生物体体内,先经过一系列氧化、还原、水解或结合等生物化学反应后被代谢成无毒或低毒代谢物而逐渐排出体外,此外,毒物也可能转化成更毒的代谢物作用于不同的靶器官。其次毒物或活性代谢物与受体进行还原反应,使受体性质发生改变,随后引起生物化学反应,如酶活性诱导或抑制、细胞膜破坏、蛋白质合成受阻等;最后将会引起一系列病理生理的继发反应,表现整个生物机体可能观察到的毒性反应[8]。
MDA是自由基攻击膜不饱和脂肪酸形成的产物,同时也可以与蛋白质的游离氨基作用,引起蛋白质分子内和分子间交联,导致细胞损伤。正常生理状态下,生物体内的MDA含量很低,其含量的高低可以反映机体细胞受到自由基攻击的程度[9]。在AM暴露下,斑马鱼肝脏、脑组织、心脏中的MDA含量均随浓度升高,说明高浓度的外源污染物导致机体产生过剩氧自由基,斑马鱼机体的抗氧能力有限,过剩的氧自由基与生物膜中的多不饱和脂肪酸发生脂质过氧化作用,形成脂质过氧化物,MDA含量随浓度的增加而增加,说明高浓度的外源污染物对机体的氧化损伤在进一步加重。
LDH是糖酵解过程中一种重要的酶,主要分布于胞质内,参与糖的有氧氧化和无氧酵解。任何原因引起的细胞损伤均可导致乳酸脱氢酶溢出,引起乳酸脱氢酶活力增加[10]。在AM暴露下,斑马鱼肝脏、脑组织、心脏中的LDH活性呈上升趋势,这主要可能是由于AM在斑马鱼肝脏、脑组织、心脏中的积累导致AM对其细胞造成了一定的损伤,且AM质量浓度越大对其细胞造成的损伤越强烈,从而使LDH活性升高,且AM质量浓度越大LDH活性升高程度越大。SDH作为参与三羧酸循环的关键酶,是反映线粒体功能的标志酶之一,其活性一般可作为评价三羧酸循环运行程度的指标[11]。在AM暴露下,斑马鱼肝脏、脑组织、心脏中的SDH活性呈下降趋势,这可能使氢受体FAD与电子的结合受到阻滞,从而阻碍FADH2的生成,导致FADH2与酶不能完全结合,最终造成FADH2传递给酶中Fe3+的电子数量减少。位于细胞膜上的钠钾ATP酶,促进钠与钾离子的主动转运。此酶的作用有矢量性,每水解一分子ATP催化3个Na+流出和2个K+流入,利用ATP水解把Na+泵出,而把K+泵入细胞。存在于动物细胞质膜上,是维持细胞膜电位的重要蛋白质[12]。在AM暴露下,斑马鱼肝脏、脑组织、心脏中的Na+-K+-ATPase活性呈下降趋势,其原因主要可能由于AM在斑马鱼肝脏和腮中的积累,破坏了细胞膜上的离子平衡,使生物膜功能遭到破坏,导致机体抗自由基的防御能力减弱,影响了Na+-K+-ATPase活性中心的某些基团的解离,酶活性中心的亲核催化作用也受到影响,从而导致Na+-K+-ATPase酶活力降低。LDH含量的升高、SDH和Na+-K+-ATPase含量的降低进一步说明了AM对斑马鱼肝脏、脑组织、心脏造成了氧化损伤。
在环境监测中,彗星实验主要用于水环境污染的生物监测和污染治理效果的生物评价[13]。细胞在正常状态下,经过细胞裂解液裂解后,细胞膜破裂,细胞中的RNA、蛋白质等会进入到凝胶中,电泳结束后,细胞核中的DNA会保持在原来的位置,染色后在荧光显微镜下,会呈现圆形状。如果细胞DNA受到了损伤,形成DNA碎片,在SCGE过程中, DNA碎片会进入到凝胶中,在电泳时DNA碎片会形成拖尾,染色后会呈现出彗星状,彗星的尾长、尾部DNA含量以及尾矩越大,表示细胞DNA受损情况越严重[14]。本实验应用细胞凝胶电泳技术测定了AM对斑马鱼生殖腺DNA损伤,实验结果显示,当AM剂量高于1/45LC50(2.04mg·L-1)时,会使斑马生殖腺细胞中的DNA链断裂并产生DNA不同程度的碎片,彗星拖尾长度、尾矩值均随之增加,从而导致DNA损伤,并且随着AM剂量增加到1/15LC50(6. 12mg·L-1)和1/5LC50(18.36mg·L-1)时,DNA损伤随之增加。
氧化损伤过程中产生的自由基(包括活性氧),可使细胞产生DNA断裂、碱基互换、姐妹染色体交换、染色体基因突变等遗传毒理学效应,甚至还造成蛋白裂解、机体离子损失等,以上过程是机体遗传突变、癌变过程中的重要事件,因此氧化损伤所导致的DNA损伤效应被认为是启动和促进人和动物机体发生癌变的重要因素之一[15]。本实验的研究结果显示,在外来污染物影响下,MDA、LDH、SDH、Na+-K+-ATPase在斑马鱼体内协同作用下,在逆境胁迫中保护机体免于受损,但是由于AM的毒性作用,还是造成了一定程度上DNA的损伤和氧化损伤。
综上所述,本实验选取的5项指标之间的关系能够对研究AM对生物机体的毒性机制提供一个基本的理论支撑。
[1]Smith E A,Prues S L,Oehme F W.Environmental degradation of ploy-acrylamides.1.Effects of artificial environmental conditions:Temperature,light,and pH[J].Ecotoxicology and Environmental Safety,1996,35(2):121-135
[2]Chen Y,Cui J M.Study on the feasibility of degradation HPAM by photocatalysis oxidation[J].Journal of Northeast Petroleum University,2001,25(2):82-83
[3]Kay-Shoemake J L,Watwood M E,Lentz R D,et al. Polyacrylamide as an organic nitrogen source for soil microorganisms with potential effects on inorganic soil nitrogen in agricultural soil[J].Soil Biology&Biochemistry,1998,30(8-9):1045-1052
[4]韩昌福,李大平,王晓梅.聚丙烯酰胺生物降解研究进展[J].应用与环境生物学报,2005,11(5):648-650
[5]张学佳,纪巍,康志军,等.聚丙烯酰胺降解的研究进展[J].油气田环境保护,2008,18(2):41-45
[6]柳荣伟.油田污水中聚丙烯酰胺降解机理研究[J].石油化工应用,2010,29(4):1-5
[7]Tsuda H,Shimizu C S,Taketomi M K,et al.Acrylamide: Induction of DNA damage,chromosomal aberrations and cell transformation without gene[J].Mutagenesis,1993,8 (1):23-29
[8]OECD.OECD Guideline for the Testing of Chemicals, OECD TG230.21-DayFishAssay:A Short-Term Screening for Oestrogenic and Androgenic Activity,and Aromatase Inhibition[R].Paris,France:OECD,2009
[9]毛德寿,同宗灿,王志远,等.环境生化毒理学[M].沈阳:辽宁大学出版社,1986:100-102
[10]孙文平,卢延旭,张晓宇.可卡因对小鼠脾细胞内ATP酶、LDH和SDH活性的影响[J].法医学杂志,2010(2):81-83
[11]张德新,王福元,王瑞绵.氟化钠对离体培养大鼠心肌细胞内糖原及琥珀酸脱氢酶的影响[J].中国职业医学, 2010(1):76-77
[12]贾秀英,陈志伟.镉对鲫鱼酶活性毒性的研究[J].浙江农业学报,2002,14(3):155-158
[13]杨红莲,蔡磊明,谢明.彗星试验在农药安全评价中的应用[J].农药,2004,43(12):532-533,536
[14]Akturk O,Demirin H,Sutcu R,et al.The effects of diazinon on lipid peroxidation and antioxidant enzymes in rat heart and ameliorating role of vitamin E and vitamin C [J].Cell Biology and Toxicology,2006,22(6):455-461
[15]Collins A,Harrington V.Repair of oxidative DNA damage:Assessing its contribution to cancer prevention[J]. Mutagenesis,2002,17:489-493
Toxic Effects of Acrylamide on Zebrafish Organs and DNA Damage of Germ Cell
Cao Xiuming1,Luo Fei1,*,Fan Yu2
1.Research Center on Life Sciences and Environmental Sciences,Harbin University of Commerce,Harbin 150076,China
2.Shanghai Roche Pharmaceuticals Ltd.,Shanghai 200000,China
20 November 2015 accepted 19 February 2016
Polyacrylamide(PAM)is widely utilized in oil production in China.It may degrade into toxic acrylamide(AM)after long-term environmental exposure.This study was initiated to enhance our insight into the aquatic environmental impact of AM.Zebrafish were exposed to AM for 40 d to examine its toxic effect on gill,liver, brain,heart and DNA in germ cells.The results showed that the gill filaments and gill cells were damaged seriously in the 2.04,6.12 and 18.36mg·L-1exposure concentration.With the concentration increased zebrafish liver,brain and heart MDA content and LDH activity increased,and the activity of SDH and Na+-K+-ATPase reduced.Comet Assay showed that AM induced DNA damage in germ cells,indicating a statistically significant difference(P<0.01) in the 2.04 to 18.36mg·L-1exposure concentration.These results suggest that AM induce a does-dependent toxici-ty effect on organs of zebrafish and DNA damage in their gonads.
acrylamide;zebra fish;oxidative damage;DNA damage
2015-11-20 录用日期:2016-02-19
1673-5897(2016)1-382-07
X171.5
A
10.7524/AJE.1673-5897.20151120001
曹秀明,罗飞,樊宇.丙烯酰胺对斑马鱼各器官的毒性作用及生殖细胞的DNA损伤[J].生态毒理学报,2016,11(1):382-388
Cao X M,Luo F,Fan Y.Toxic effects of acrylamide on zebrafish organs and DNA damage of germ cell[J].Asian Journal of Ecotoxicology,2016,11(1): 382-388(in Chinese)
黑龙江省自然科学基金项目(C201123):有机絮凝剂聚丙烯酰胺及其单体丙烯酰胺的水生态毒理学研究
曹秀明(1964-),女,副研究员,博士,研究方向为生态毒理学,E-mail:caoxiuming_smzx@163.com;
),E-mail:fifi_only@qq.com
简介:曹秀明(1964-),女,副研究员,博士,研究方向生态毒理学。
