基于秀丽隐杆线虫的微量水样环境毒理学研究
2016-12-06郭肖颖王磊李敏王斌赵竑绯李虹颖徐文静施六林
郭肖颖,王磊,李敏,王斌,赵竑绯,李虹颖,徐文静,施六林,*
1.安徽省农业科学院农业工程研究所,合肥230031
2.安徽省农业科学院土壤与肥料研究所,合肥230031
基于秀丽隐杆线虫的微量水样环境毒理学研究
郭肖颖1,王磊1,李敏2,王斌1,赵竑绯1,李虹颖2,徐文静1,施六林1,*
1.安徽省农业科学院农业工程研究所,合肥230031
2.安徽省农业科学院土壤与肥料研究所,合肥230031
目前,环境水样个体水平的毒理学检测成本较高、耗时长,且检测后的水样若处理不当易造成环境的二次污染。通过使用易于培养和观察、个体微小的模式生物—秀丽隐杆线虫作为实验对象,利用毛细玻璃管的虹吸原理将线虫暴露于微量的环境水样进行染毒培养,实现微量水样在个体水平的毒理学评价。为了验证该方法的可行性,检测了暴露组线虫与对照组线虫的生殖腺细胞损伤水平、活性氧自由基(ROS)产生量、氧化应激水平、脱氧核糖核酸(DNA)损伤水平等生物终点的差异性。研究结果有助于为微量环境水样在个体水平的毒理学分析提供一种快速、可行、廉价的评价手段。
秀丽隐杆线虫;微量环境水样;毒理学评价;评价体系
个体水平的毒理学分析是评价复杂污染物共存的环境水体综合生物效应的有效手段之一,并有利于进一步解析环境水体生物毒性的内在作用机制[1-3]。底栖动物、鱼类、鸟类、大型蚤类等动物模型是水环境生物毒性评价常用的指示生物[4-6],而由于这些实验动物发育周期较长,使得环境水体毒理学评价的耗时长,短期内很难获得大量具有统计意义的实验结果;另外,这些实验动物个体相对较大,培养条件亦较为复杂,以其为模型进行环境水样生物毒性评价所需的实验成本相对较高;再者,较大的实验动物模型暴露所需的环境水样量亦较多,水样的采集、运输、保存及后处理成本亦随之增加,并且,若供试水样处理不当,直接或间接地排放到周边的水域,还会造成二次污染[7]。因此,选择适宜的、个体微小的实验动物模型,开展微量环境水样的生物毒性评价,发展快速、实时、综合的评价方法,减少实验成本,避免二次污染是当前环境水体生物毒性评价的重要课题,亦是本研究的关键所在。
秀丽隐杆线虫(Caenorhabditis elegans,C.elegans)因其虫体微小且通体透明、生命周期短、易于培养、遗传与发育背景清楚、操作简单等优点使其成为水环境生物毒性研究的一种理想模式动物,并被广泛应用于工业废水、城市废水、重金属废水等的水质安全评价中[8-10]。秀丽隐杆线虫用于水环境生物毒性评价的主要指标包括生理、生化和行为3个方面,其中生理指标主要应用于致死性和衰老的研究,包括对生殖、发育和繁殖等生理现象检测;行为指标主要通过对线虫运动、学习、记忆等行为的监测剖析水环境潜在的神经毒性;生化标志物主要包括蛋白、酶活性及脱氧核糖核酸(DNA)等生物大分子,具有更高的灵敏度,是从分子水平上解析水环境作用于生物体的毒性机制[11-14]。目前,应用秀丽隐杆线虫进行水环境生物安全性评价已得到一定程度的肯定,2009年国际标准化组织(ISO)颁布了将秀丽隐杆线虫用于水体毒理学评价的标准化指南。本文以秀丽隐杆线虫作为实验动物模型,以毛细玻璃管作为暴露体系,发展微量环境水样的生物毒性评价方法。通过虹吸原理将线虫暴露于透明毛细玻璃管内的微量环境水样进行染毒培养,易于实现毒性效应的实时监测。基于线虫低氧耐受能力强的优势,利用凝胶将毛细玻璃管两端密封,有效减少由于水分蒸发造成的实验误差。并通过检测暴露于以双氧水为代表的环境水样中线虫生殖系细胞凋亡、氧化损伤和DNA损伤等多个生物终点的变化,进一步验证了该环境水样暴露方法的可行性。结果表明,基于秀丽隐杆线虫的微量水样暴露检测方法能够在个体生物水平上实现微量环境水样毒理学效应的实时监测,且该方法简单、快速、廉价。
1 材料与方法(Materials and methods)
1.1 实验材料
实验所用秀丽隐杆线虫品系为N2 Bristol野生型,CF1553:sod-3;muIs84,muIs84基因型表示在sod-3基因上融合了GFP表达蛋白,WS1433:hus-1 (op241)I;unc-119(ed3)III;opIs34,opIs34基因型表示在hus-1基因上融合了GFP表达蛋白,线虫品系由美国NIH资助的国际线虫种质中心(CGC)赠送。
1.2 实验方法
1.2.1 线虫培养
线虫的培养方法参照Brenner的文献[15]。将妊娠期线虫的卵取出,并进行24 h的同步化处理, 95%以上的孵化成L1期幼虫时,接入NGM培养基,20℃恒温条件下将线虫培养至所需的时期。
1.2.2 环境水样的处理及暴露
将环境水样通过0.22μm的微孔滤膜进行灭菌处理,将发育至早期成虫的线虫挑至过滤后的水样中,添加2%的E.coliOP50浓缩菌作为线虫的食物,并通过虹吸作用使线虫和水样同时进入到毛细玻璃管中。该毛细玻璃管是内径75μm,外径100μm的圆柱形物体,1.5~2.0μL体积的线虫和水样混合液可以填充毛细管的长度为33.9~45.3 mm,一根毛细管可培养线虫20~30条(附图1)。在毛细玻璃管两端使用2%的琼脂进行密封,进行线虫在微量环境水样的暴露处理。本实验以含8.84μmol·L-1H2O2的环境水样为代表,进行微量水样毒理学方法的研究和相关毒理学终点的检测。
1.2.3 细胞凋亡检测
细胞凋亡的测定依据Kelly等[16]的修改,并进行了适当的调整。在毛细玻璃管中添加吖啶橙染色液,使其终浓度为50μg·mL-1,避光染色1~1.5 h。染色后将线虫置于含有OP50的35 mm NGM培养皿上,在20℃的培养箱中恢复20~40 min,选取30~40条线虫置于载玻片上的20 mmol·L-1叠氮钠溶液(NaN3)液滴中,待虫子全部麻醉后置于DP70荧光显微镜下观察,凋亡的细胞呈亮绿色或橙黄色,这是DNA片断化的一个重要标志,而未凋亡的细胞呈现均匀的浅绿色[16]。
1.2.4 ROS含量的检测[17]
在毛细玻璃管中加入CM-H2DCFDA荧光探针,使其终浓度为1μmol·L-1,20℃培养30 min,将处理后的线虫取出,于2%琼脂上以60μg·mL-1左旋咪唑麻醉,在Leica TCS SP2型激光共聚焦显微镜上,以488 nm激发波长和510 nm发射波长,对每一条虫子进行拍照,使用Image pro plus 6.0进行图像处理,记录线虫身体的绿色荧光强度,作为ROS的相对值。
1.2.5 SOD-3表达量的检测[18]
SOD-3是细胞内的超氧化物歧化酶,在线粒体附近发挥其调控氧化压力的作用。通过使用sod-3:: gfp的线虫品系CF1553,可以观察sod-3在线虫体内的分布和表达量的变化。本实验将环境水样暴露组和对照组CF1553品系的线虫分别移至滴有200μmol·L-1NaN3麻醉剂的载破片上,待线虫麻醉后,使用488 nm的激发光进行激发,观察线虫体内绿色荧光蛋白的亮度和分布变化,并对每条线虫进行独立拍照,最后使用Image-Pro©Plus version 6.0软件对每个虫体的SOD-3::GFP表达进行定量。
1.2.6 DNA损伤水平的检测
HUS-1是DNA损伤检测点蛋白,正常情况下呈弥散状分散在细胞质中[19]。当细胞发生DNA损伤时,HUS-1会转移至细胞核中,对损伤的DNA位点进行修复[19]。WS1433是hus-1::gfp的转基因线虫品系,通过观察GFP荧光蛋白的分布情况,即可观测到HUS-1蛋白在线虫体内的位置,进而反映DNA损伤的情况。本实验将环境水样暴露组和对照组WS1433品系的线虫分别移至滴有200μmol·L-1NaN3麻醉剂的载玻片上,待线虫麻醉后对每条线虫进行独立拍照,重点针对生殖腺细胞的细胞核位置进行拍照。使用488 nm的激发光进行激发,观察线虫体内绿色荧光蛋白的分布变化。
1.3 数据统计与分析
所有数据均应用Orign 8.0软件分析,以平均数±标准误的形式表示,以Turkey多重比较检验不同水样的毒性效应,利用双尾t检验检测线虫环境水样暴露所导致的损伤差异,显著性水平为P<0.05。文章中荧光强度的定量均由Image pro plus 6.0软件进行处理和统计。所有实验结果均由三次以上独立实验完成。
2 结果(Results)
2.1 基于秀丽隐杆线虫的微量环境水样毒理学评价方法研究
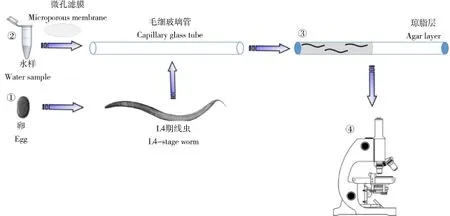
图1 毛细管微量水样的线虫暴露过程Fig.1 Exposure process ofC.elegansto trace water in capillary
基于秀丽隐杆线虫的微量环境水样毒理学评价方法实验流程如如图1所示。采用毛细玻璃管作为微量环境水样的暴露体系是由于玻璃的透明特性,可以实现暴露于环境水样中线虫生长发育、运动、存活等多个生物终点的实时监测,并且在利用荧光染料在进行虫体组织的染色过程中,亦可实时观察染色效果。而使用琼脂糖进行毛细玻璃管两端的密封,其主要目的在于减少由于水分的蒸发改变环境水样中有毒成分浓度变化的可能性,从而确保试验的准确性和精确性。再者,线虫成虫的长度仅为1 mm,线虫的身体直径为40~60μm,所选择的毛细玻璃管尺寸保证了线虫可进入毛细管中且不会造成重叠或挤压。同时线虫又是低氧耐受能力很强的生物,24 h乏氧环境可保证存活率在95%以上。因此,以内径75μm,外径100μm的毛细玻璃管为暴露体系,以琼脂糖密封保证水分不流失,可以很好地构建基于秀丽隐杆线虫的微量水样暴露体系,顺利完成环境水样的线虫暴露过程。
为了验证该暴露体系和方法的可行性和毒理学效应评价的准确性,文章以8.84μmol·L-1 H2O2的环境水样为代表,以线虫的生殖细胞凋亡、ROS产量、氧化损伤以及DNA损伤为生物检测终点,进行了以下几个方面的验证试验。
2.2 基于秀丽隐杆线虫的微量环境水样毒理学评价体系的生殖腺细胞凋亡检测
细胞凋亡是机体生命活动的需要。正常培养条件下,在固定的时间点,线虫的每条生殖腺约有2、3个细胞会进入生理性的凋亡过程[20]。同时,线虫生殖细胞对外界环境胁迫非常敏感,在遭遇内外环境胁迫条件下,其生殖腺除了具有生理性的细胞凋亡,还表现出明显的胁迫诱导的生殖细胞凋亡[21]。由图2A和B可见,野生型线虫暴露于毛细管微量水样体系中,其生殖腺细胞凋亡数目约为2~3个,与实验室培养条件下的野生型线虫品系的正常凋亡数目接近[20]。此结果表明本文所采用的毛细管微量水样暴露体系并未对线虫的生殖腺细胞凋亡诱导造成显著性影响。而通过观察8.84μmol·L-1的双氧水实验组的生殖腺细胞凋亡数目可以看出,环境水样处理组引起了线虫生殖腺细胞凋亡数目的显著性升高,表明该环境水样诱导了线虫生殖腺细胞凋亡数目的显著增加,该结果与实验室常规培养条件下环境水样诱导线虫的生殖腺凋亡数目接近,因而,上述研究结果表明毛细管微量水样暴露体系可用于测量环境水样造成的线虫的生殖腺细胞凋亡水平变化。

图2 微量水样诱导的线虫生殖细胞凋亡注:A)同步化生长的早期成虫暴露于不同的评价体系,24 h后测定其生殖细胞死亡数目;B)荧光显微镜下观察的凋亡细胞(红色箭头所指的亮点)。所有数据均为平均数±标准误,n≥20,*表示与对照具有显著差异,P<0.05。Fig.2 Trace water induced germ cell apoptosis inC.elegansNote:A)Synchronized young adult worms were cultivated by two methods for 24 h,and germ cell corpses were counted after AO staining. B)Apoptotic germ cells were observed under an Olympus IX71 fluorescence microscope(Olympus,Tokyo,Japan). All values are represented by means±SE;n≥20.* represents statistical significance(P<0.05)as indicated.
2.3 基于秀丽隐杆线虫的微量环境水样毒理学评价体系的氧化损伤检测
活性氧是造成细胞损伤的主要原因之一。细胞内的活性氧基团可以通过氧化还原反应破坏细胞内部的蛋白质、DNA、RNA等重要的生物活性分子,从而影响细胞的新陈代谢速率,进而影响机体的正常生理功能[22]。而氧化应激是生物体应对活性氧分子大量产生时的一种保护机制。当生物体内活性氧分子数量高于正常水平时,机体通过调节能够分解活性氧分子的酶类的活性和表达量,来避免过高的活性氧可能造成的损伤[23]。因此,表征机体的氧自由基水平以及分解活性氧分子的酶的表达量,能够在一定程度上反映环境胁迫造成的氧化损伤。环境水样中的许多有毒成分都可造成生物体内活性氧水平的升高,如重金属离子、农药的有机成分、自来水处理中的氯离子等。检测环境水样对生命个体活性氧水平的影响,对于评价环境水样的毒理学效应,具有重要意义。本实验首先通过使用活性氧分子的特异性化学探针进行荧光标记,对线虫体内的活性氧水平进行示踪和定量,从而在个体水平研究水样对机体各器官组织的活性氧水平的影响。实验分别应用线虫微量环境水样暴露新体系和常规试验方法开展的ROS水平的检测,图3A和B的研究结果显示,实验组线虫经过2种方法的暴露处理后,比对照组线虫的活性氧水平均具有显著性的提高,并达到显著性的差异(P<0.05)。该结果表明毛细管微量水样暴露体系能够真实地反映环境水样造成秀丽隐杆线虫体内活性氧水平的变化。进而,通过表征线虫体内超氧化物歧化酶SOD-3的表达进一步检查了环境水样作用于机体的氧化损伤。如图4A和B所示,应用新的染毒培养体系的处理中,在对照组线虫体内,SOD-3::GFP的表达主要集中在线虫的头部和尾部;而在环境水样处理后的线虫体内,SOD-3:: GFP除了在头部和尾部表达外,还集中在肠道组织表达,生殖腺及卵细胞中SOD-3::GFP的表达亦有不同程度的提升,因而,线虫体内SOD-3::GFP的表达变成了全身性的,说明微量的以双氧水为代表的环境水样显著提升了线虫体内超氧化物岐化酶SOD-3的表达。在常规方法的实验中,我们亦发现了基本一致的研究结果,同时新方法与常规方法相比,染毒培养后线虫体内的SOD-3::GFP表达水平未发生显著性的差异(图4A),也就是说,本文所提微量环境水样的暴露方法未改变常规试验方法获得的实验结果,因此可以利用该体系进行线虫机体响应微量环境水样氧化应激的检测。
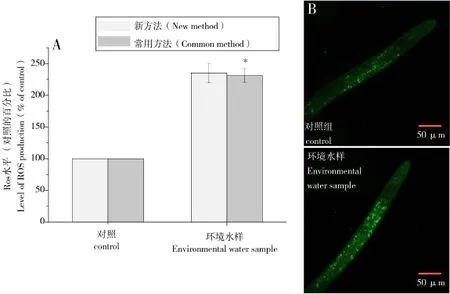
图3 微量水样显著提高线虫体内ROS的表达水平A)同步化生长早期成虫暴露于不同的评价体系,24 h后测定ROS产量,环境水样暴露的线虫个体ROS表达显著上调;B)荧光显微镜下观察的ROS表达。所有数据均为平均数±标准误,n≥20,*表示与对照具有显著差异,P<0.05。Fig.3 Trace water enhanced the ROS production inC.elegansA)Synchronized young adult worms were cultivated by two methods for 24 h,and the relative ROS production were measured using Image pro plus 6.0. B)The ROS level was observed under an Olympus IX71 fluorescence microscope(Olympus,Tokyo,Japan).All values are represented by means±SE;n≥20.* represents statistical significance(P<0.05)as indicated.

图4 微量水样显著提高线虫体内SOD-3的表达水平A)同步化生长的早期成虫暴露于不同的评价体系,24 h后测定ROS产量,环境水样暴露的线虫个体ROS表达显著上调;B)荧光显微镜下观察的ROS表达。所有数据均为平均数±标准误,n≥20,*表示与对照具有显著差异,P<0.05。Fig.4 Trace water enhanced the SOD-3 level inC.elegansA)Synchronized young adult worms were cultivated by two methods for 24 h,and the relative SOD-3 levels were measured using Image pro plus 6.0. B)The SOD-3 level was observed under an Olympus IX71 fluorescence microscope(Olympus,Tokyo,Japan).All values are represented by means±SE;n≥20.* represents statistical significance(P<0.05)as indicated.
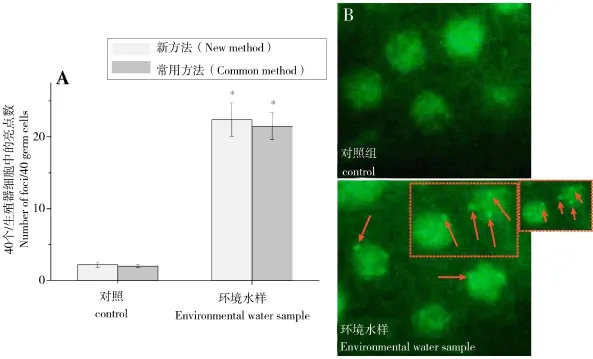
图5 微量水样诱导线虫生殖细胞HUS-1蛋白发生点聚集A)同步化生长的早期成虫暴露于不同的评价体系,24 h后通过统计40个有丝分裂细胞中的HUS-1::GFP聚集点的进行环境水样诱导线虫生殖细胞DNA损伤的定量分析。B)荧光显微下观察到的HUS-1::GFP聚集点。所有数据均为平均数±标准误,n≥10,*表示与对照具有显著差异,P<0.05。Fig.5 Trace water caused the significant foci of HUS-1 inC.elegansgerm cellsA)Quantification of HUS-1::GFP foci in the mitotic germ cells after worms were treated for 24 h.Foci were scored in 40 proliferating germ cells. B)HUS-1::GFP foci were observed under an Olympus IX71 fluorescence microscope(Olympus,Tokyo,Japan).All values are represented by means±SE;n≥10.* represents statistical significance(P<0.05)as indicated.
2.4 基于秀丽隐杆线虫的微量环境水样毒理学评价体系的线虫生殖细胞DNA损伤检测
DNA损伤反应机制是生物体遭受外界环境胁迫的一种重要的损伤响应方式。当细胞中的DNA损伤感应基因检测到DNA损伤发生时,将启动一系列的DNA损伤修复机制,而未有效修复的细胞将诱导凋亡的发生,否则DNA损伤将传递至后代,形成遗传损伤[21]。HUS-1是线虫DNA损伤修复的检验点蛋白,在线虫DNA损伤修复中有不可替代的重要作用。正常情况下,HUS-1在细胞质中均匀分布,而当DNA损伤发生时,HUS-1就从细胞质被募集到细胞核中,并对DNA损伤的位点进行识别和修复。HUS-1标记上GFP荧光蛋白后,细胞发生DNA损伤时,随着HUS-1的聚集,GFP将呈现点状的亮绿色,WS1433是当前已构建的HUS::GFP线虫品系,常通过对GFP点聚集的检测和统计,反应环境胁迫造成机体的DNA损伤[21]。基于此,实验分别将WS1433线虫品系通过毛细玻璃管微量环境水样暴露新体系和常规试验方法进行HUS::GFP点聚集的检测。图5A和B的研究结果显示,经过2种方法的暴露处理后的WS1433线虫品系,其环境水样暴露组线虫生殖细胞发现了明显的GFP聚集亮点,数量显著高于对照组线虫,并达到显著性的差异(P<0.05)。该结果表明,毛细管微量水样暴露体系可以应用于微量水环境引致线虫生殖细胞DNA损伤的检测,并通过HUS-1的点聚集使得线虫生殖细胞DNA损伤发生的位点可视化,并可进行定量分析。
3 讨论(Discussion)
环境水体安全性的生物毒性评价体系较多,而与其他的实验动物模型相对,线虫具有其独特的优势:线虫个体微小、结构简单,生物检测终点多样,不同的检测终点均可敏感响应环境水体复杂的生物毒性效应,这是实现微量环境水样生物毒性检测的基础;线虫通体透明,易于在活体状态下实现多种生物检测终点的实时监测;线虫的遗传背景清楚,遗传操作简便,利于从分子水平解析环境水体的致毒机理,并且线虫40%的基因序列和人类基因组具有同源性,利用线虫获得的研究结果很多可以直接应用于高等动物,甚至人类本身[8-10]。应用秀丽隐杆线虫进行环境水体的安全性评价及生物毒性检测已逐步获得肯定,并取得大量的研究成果。但当前基于秀丽隐杆线虫进行环境水样生物毒性的分析多应用塑料培养皿或培养板进行线虫的染毒培养,体系所需的水样量较大,且水分蒸发快;塑料制品对水环境中的部分污染物具有一定的吸附作用,这就可能造成环境水样污染物分散的均一性,降低实验结果的可比性,增加实验误差。本文利用毛细玻璃管作为环境水样的暴露体系,并以琼脂糖进行玻璃管两端的密封,有效减少了环境水样中有毒成分的吸附作用以及水分蒸发的难题,同时,还有利于在活体状态下进行多种生长、生殖检测终点的联合监测。但本方法亦存在不足之处。由于毛细玻璃管体积所限,暴露于环境水样中的线虫量约在20~30条,因而本方法不适宜进行大量线虫个体的染毒培养。另外,由于毛细玻璃管的两端应用琼脂糖密封,不利于空气的流通,长期乏氧环境将影响线虫正常的生长发育,因而本方法不适宜进行线虫长时间的染毒处理。
近年来,环境污染问题受到前所未有的关注,自然资源的安全是工农业产品安全的前提和保障,是人类健康的基础。本研究旨在为水资源生态环境生物安全的预警和评价提供行之有效的技术方法,尽可能地避免因污染造成的健康风险,并为水体生态环境监测和修复提供新的视角和思路。
[1]高小辉,杨峰峰,何圣兵,等.水质的生物毒性检测方法[J].净水技术,2012,31(4):49-54 Gao X H,Yang F F,He S B,et al.Testing methods of biological toxicity detection for water quality[J].Water Purification Technology,2012,31(4):49-54(in Chinese)
[2]Wang S C,Geng Z Z,Wang Y,et al.Essential roles ofp53 and MAPK cascades in microcystin-LR-induced germline apoptosis inCaenorhabditis elegans[J].EnvironmentalScience&Technology,2012,46(6):3442-3448
[3]COHIBA project.Innovative Approaches to Chemicals Control of Hazardous Substances,WP3 Final Report[R]. Helsinki:COHIBA project,2011
[4]刘大胜,赵岩,傅莹,等.工业废水排放环境监管中的新手段:鱼类急性毒性试验应用[J].环境保护,2008, 400:50-52
[5]Connon R,Dewhu R,Crane M,et al.Haemperoxidase activity inDaphnia magna:A biomarker for sublethal toxicity assessments of kerosenecont aminated ground water [J].Ecotoxicology,2003,12:387-395
[6]Venkateswara Rao J,Srikanth K,Arepalli S K,et al.Toxic effects of acephate onParamecium caudatumwith special emphasis on morphology,behaviour,and generation time[J].Pesticide Biochemistry and Physiology,2006,86: 131-137
[7]刘德春,杨定明,钟国清.高校化学实验室废水的处理技术研究进展[J].科技资讯,2012,17:102
[8]Leung M C K,Williams P L,Benedetto A,et al.Caenorhabditis elegans:An emerging model in biomedical and environmental toxicology[J].Toxicological Sciences, 2008,106(1):5-28
[9]Martinez-Finley E J,Aschner M.Revelations from the nematodeCaenorhabditis eleganson the complex interplay of metal toxicological mechanisms[J].Journal of Toxicology,2011:895236
[10]齐丽娟.秀丽隐杆线虫在生态毒理学评价中应用研究进展[J].毒理学杂志,2015,29(1):60-65
[11]Ruan Q L,Ju J J,Li Y H,et al.Chlorpyrifos exposure reduces reproductive capacity owing to a damaging effect on gametogenesis in the nematodeCaenorhabditis elegans [J].Journal of Applied Toxicology,2012,32(7):527-535
[12]Wren J F,Kille P,Spurgeon D J,et al.Application of physiologically based modeling and transcriptomics to probe the systems toxicology of aldicarb forCaenorhabditis elegans(Maupas 1990)[J].Ecotoxicology,2011,20: 397-408
[13]张燕芬,王大勇.利用模式动物秀丽线虫建立环境毒物毒性的评估研究体系[J].生态毒理学报,2008,3(4): 313-322 Zhang Y F,Wang D Y.Establishment of toxicity evaluation system using model organism ofCaenorhabditis elegans[J].Asian Journal of Ecotoxicology,2008,3(4):313-322(in Chinese)
[14]Helmcke K J,Avila D S,Aschner M.Utility ofCaenorhabditis elegansin high throughput neurotoxicological research[J].Neurotoxicology and Teratology,2010,32(1): 62-72
[15]Brenner S.The genetics ofCaenorhabditis elegans[J]. Genetics,1974,77:71–94
[16]Kelly K O,Dernburg A F,Stanfield G M,et al.Caenorhabditis elegans msh-5is required for both normal and radiation-induced meiotic crossing over but not for completion of meiosis[J].Genetics,2000,156(2):617-630
[17]Zhu C,Ji C B,Zhang C M,et al.Thelin-4gene controls fat accumulation and longevity inCaenorhabditis elegans [J].International Journal of Molecular Sciences,2010,11: 4814-4825
[18]Ye K,Ji C B,Lu X W,et al.Resveratrol attenuates radiation damage inCaenorhabditis elegansby preventing oxidative stress[J].Journal of Radiation Research,2010,51: 473–479
[19]Hofmann E R,Milstein S,Boulton S J,et al.Caenorhabditis elegansHUS-1 is a DNA damage checkpoint protein required for genome stability and EGL-1-mediated apoptosis[J].Current Biology,2002,12:1908-1918
[20]Gartner et al.Germline survival and apoptosis[DB]. WormBook:TheC.elegansResearch Community,http:// www.wormbook.org
[21]Craig A L,Moser S C,Bailly A P,et al.Methods for studying the DNA damage response in theCaenorhabditis elegansgerm line[J].Methods Cell Biology,2012,107: 321-352
[22]Keshari R S,Verma A,Barthwal M K,et al.Reactive oxygen species-induced activation of ERK and p38 MAPK mediates PMA-induced NETs release from human neutrophils[J].Journal of Cellular Biochemistry,2013,114: 532-540
[23]Okano H.Effects of static magnetic fields in biology: Role of free radicals[J].Frontiers in Bioscience-landmark,2008,13:6106–6125
Environmental Toxicology Study of Trace Water Samples with Caenorhabditis elegans
Guo Xiaoying1,Wang Lei1,Li Min2,Wang Bin1,Zhao Hongfei1,Li Hongying2,Xu Wenjing1,Shi Liulin1,*
1.Institute of Agricultural Engineering,Anhui Academy of Agricultural Science,Hefei 230031,China
2.Institute of Soil and Fertilizer,Anhui Academy of Agricultural Science,Hefei 230031,China
6 May 2015 accepted 6 July 2015
In the present,test methods used for environmental water sample toxicology evaluation on individual scale are usually costly and time consuming,and without appropriate treatment,processed water samples would cause secondary pollution.Toxicology evaluation of trace water samples was realized with a kind of tiny model organisms,Caenorhabditis elegans,as experiment subjects who are easy to cultivate and observe;C.eleganscould be exposed to trace environment water samples through siphon principle of glass capillary for toxicity cultivation.In order to verify the applicability of this evaluation method,biological end points such as germline cell apoptosis, ROS generation,SOD-3 expression and DNA damage ofC.eleganswere measured.This research helps to provide a swift,applicable and economical evaluation method for individual scale toxicology evaluation in trace environmental water sample.
Caenorhabditis elegans;trace environmental water sample;toxicology evaluation;assessment system
2015-05-06 录用日期:2015-07-06
1673-5897(2016)1-345-08
X171.5
A
10.7524/AJE.1673-5897.20150506002
郭肖颖,王磊,李敏,等.基于秀丽隐杆线虫的微量水样环境毒理学研究[J].生态毒理学报,2016,11(1):345-352
Guo X Y,Wang L,Li M,et al.Environmental toxicology study of trace water samples withCaenorhabditis elegans[J].Asian Journal of Ecotoxicology, 2016,11(1):345-352(in Chinese)
安徽省科技攻关计划项目(1301042115);安徽省农业科学院科技创新团队建设项目(14C1308);国家自然科学基金(21407002);安徽省自然科学基金(1508085MB39);安徽省农业科学院学科建设项目(14A1009)
郭肖颖(1979-),女,副研究员,研究方向为农业生态和环境毒理学,E-mail:gxy2@mail.ustc.edu.cn
),E-mail:shiliulin386@126.com
简介:施六林(1964—),男,硕士,研究员,主要研究方向为生态环境治理修复利用等。
