高Cu、高Zn对白星花金龟幼虫的毒性作用
2016-12-06尹素真于冲李光德刘玉升赵杰张心怡
尹素真, 于冲, 李光德,*, 刘玉升, 赵杰, 张心怡
1.山东农业大学资源与环境学院,泰安271018
2.山东省高校农业环境重点实验室,泰安271018
3.土肥资源高效利用国家工程实验室,泰安271018
4.山东省莱芜市莱城区环境保护局,莱芜271100
5.山东农业大学植物保护学院,泰安271018
高Cu、高Zn对白星花金龟幼虫的毒性作用
尹素真1,2,3, 于冲4, 李光德1,2,3,*, 刘玉升5, 赵杰1,2,3, 张心怡1,2,3
1.山东农业大学资源与环境学院,泰安271018
2.山东省高校农业环境重点实验室,泰安271018
3.土肥资源高效利用国家工程实验室,泰安271018
4.山东省莱芜市莱城区环境保护局,莱芜271100
5.山东农业大学植物保护学院,泰安271018
Cu(铜)和Zn(锌)是环境中最常见的重金属污染元素,为探究其对白星花金龟幼虫的毒性,采用滤纸接触法、人工土壤法和菌渣培养法研究了高Cu、高Zn对白星花金龟幼虫的生长及氧化胁迫效应。结果表明,滤纸接触法和人工土壤法中试验浓度Cu、Zn对白星花金龟幼虫死亡率无明显影响。菌渣培养法中虫体的取食抑制率和体重增长抑制率均与Cu、Zn浓度呈显著性正相关关系;Cu处理诱导了虫体可溶性蛋白含量的增加,抑制了SOD(超氧化物歧化酶)、GST(谷胱甘肽转移酶)的活性和MDA(丙二醛)的产生,对CAT(过氧化物酶)活性没有显著影响;Zn浓度为3 500和5 000mg·kg-1的处理组可溶性蛋白含量被显著诱导、MDA含量被显著抑制,浓度为2 000和6 500mg·kg-1处理组的SOD活性被激活(P>0.05),Zn胁迫未对CAT、GST活性造成明显影响。表明Cu、Zn污染对白星花金龟幼虫生长具有毒性效应,在评价高浓度的重金属污染对虫体的毒性作用时,不能仅采用SOD、CAT、GST等指标作为标志物,需要综合其他指标进行分析。
Cu;Zn;白星花金龟幼虫;毒性作用
随着我国畜牧养殖业的飞速发展,每年都会产生大量的畜禽粪便[1]。根据国家农业部《农业生物质能产业发展规划(2007—2015年)》,2015年我国规模化养殖场畜禽粪便资源的实物量可达32.5亿t。畜禽粪便的大量堆积和不合理排放,在制约畜牧养殖业发展的同时,也会对周边地区环境造成严重污染[2]。因此,畜禽粪便的无害化处置是当今社会普遍关注和亟待解决的热点问题。然而,畜禽粪便的成分与以往比已经发生了质的改变,由于畜禽饲料中普遍采用高Cu、高Zn等添加剂,使得畜禽粪便的重金属污染问题越来越突出[3]。根据 Bonazzi等[4]的研究,畜禽饲料中有72%~80%的Cu随粪便排出体外,Zn的比例则高达92%~96%。根据对江苏省大型养殖场的饲料和畜禽粪便中金属元素含量的调查,发现其中以Cu、Zn污染最为严重[5]。
白星花金龟(Potosia brevitarisLewis)又名白纹铜花金龟、白星花潜,属于鞘翅目(Coleoptera)、金龟甲总科(Scarabaeoidea)、花金龟科(Cetoniidae)。其幼虫俗称蛴螬,是重要的腐食性昆虫,主要在粪堆、菌渣堆、腐烂的作物秸秆堆等里营寄生生活[6],与蚯蚓、蝇蛆、黑水虻等一起,素有“清道夫”的美称[7]。其幼虫不仅可以入药,营养物质含量也很丰富,被誉为“蛋白质饲料宝库”[8];同时,幼虫过腹转化畜禽粪便及其他农业废弃物后得到的蛴螬粪具有良好的团粒结构特性,可作为有机肥。因此,白星花金龟的养殖业近年来不断发展。
目前对白星花金龟幼虫的研究主要集中在对废弃物的转化利用方面[9],但对污染物对其毒理方面的研究还鲜有报道。因此本研究选取白星花金龟的3龄幼虫作为供试材料,采用OECD推荐的方法,研究了高浓度的重金属Cu、Zn单一作用下对其的毒性效应,以期为白星花金龟幼虫生产中预防重金属污染危害提供一定的实践指导,并为进一步开展利用白星花金龟幼虫提取或固定畜禽粪便中重金属等的研究积累数据。
1 材料与方法(Materials and methods)
1.1 试验材料
1.1.1 供试生物
试验所用生物为在实验室条件下连续饲养至第3代的白星花金龟幼虫,选取长势一致的健康3龄幼虫进行试验。
1.1.2 供试重金属
CuSO4·5H2O(99%,AR),购自天津市凯通化学试剂有限公司,ZnSO4·7H2O(99.5%,AR),购自天津市巴斯夫化工有限公司。
1.2 试验方法
1.2.1 滤纸接触毒性试验
根据OECD推荐的滤纸接触法,首先配制Cu、Zn浓度均为0(CK)、0.4、4、40、400和4 000mg·L-1的溶液;在直径为7 cm的养虫盒底部垫入直径为8 cm的滤纸,取预先配制好的重金属溶液各2 mL均匀洒在滤纸上,使Cu、Zn的染毒浓度分别为0(CK)、0.0159、0.159、1.59、15.9和159mg·cm-2,每个处理设3个平行,每个平行分别投放预先清肠24 h并清洗干净的3龄幼虫6头,然后用保鲜膜封口,用解剖针将保鲜膜扎孔后置于温度为(25±1)℃、湿度为70%的生化培养箱中培养。分别于试验开始的第24、48和72小时观察和记录其中毒症状和死亡情况,以白星花金龟幼虫头部和尾部对机械刺激无反应视为死亡。
1.2.2 人工土壤毒性试验
根据OECD中的标准方法配制人工土壤:由10%的苔藓泥炭细土,20%的高岭粘土(高岭土大于50%),69%的工业石英砂(含50%以上0.05~0.2 mm的细小颗粒)和1%的CaCO3(化学纯)组成。
分别将一定浓度的重金属水溶液与500 g人工土充分混合(人工土以干重计),使人工土中Cu、Zn的浓度分别为100、1 000、3 000、6 000和8 000mg·kg-1,同时设未添加重金属的作为空白对照(CK),加适量去离子水调整人工土壤的含水率在35%左右,转移到1 L冲洗干净的大烧杯中平衡48 h,选择长势一致的白星花金龟3龄幼虫(预先清肠24 h)投入烧杯中,每个处理设3个平行,每个平行投放10头,用保鲜膜封口,并用解剖针在保鲜膜上扎孔后置于(25±1)℃的生化培养箱中无光照连续培养。分别于培养后的第7、14天记录白星花金龟幼虫的中毒症状及存活状况,以白星花金龟幼虫头部和尾部对机械刺激无反应视为死亡。
1.2.3 菌渣毒性试验
供试菌渣为平菇菌渣,分别将一定浓度的重金属水溶液与400 g菌渣充分混合(菌渣以干重计),使菌渣中Cu和Zn的浓度分别为500、2 000、3 500、5 000和6 500mg·kg-1,同时设置未添加重金属的作为空白对照(CK),加适量去离子水调整含水率至约60%,转移到1 L冲洗干净的大烧杯中平衡48 h,选择长势一致的白星花金龟3龄幼虫(预先清肠24 h)投入烧杯中,每个处理设3个平行,每个平行投放10头,培养方法同人工土壤毒性试验。试验浓度下虫体未出现死亡,分别于培养后的第7、14天记录白星花金龟幼虫的生长情况,并在试验结束后取幼虫测定高浓度的Cu、Zn对白星花金龟幼虫的氧化胁迫情况,包括对其体内可溶性蛋白含量、SOD活性、CAT活性、GST活性、MDA含量及取食量等的影响。
1.3 测定方法
可溶性蛋白含量参照Bradford[10]的方法,以牛血清白蛋白为标准蛋白,在595 nm进行比色测定;SOD活性参照Beauchamp和Fridovich[11]的方法,酶的活力采用抑制NBT光化还原50%为一个活力单位,用U·mg-l蛋白表示;CAT活性测定参照徐镜波等[12]的方法,以每1 min催化1μmol H2O2分解的酶量定义为一个酶活力单位(mol·g-lFW);GST活性测定采用1-氯-2,4-二硝基苯(CDNB)比色法[13],还原型谷胱甘肽(GSH)与CDNB反应生成2,4-二硝基-谷胱甘肽复合物(GS-CDNB),该复合物的生成量可以反映GST的活性,以每分钟生成1 nmol的产物为一个活力单位,用nmol·min-1·mg-l蛋白表示。菌渣毒性试验结束后分离虫体、虫粪和剩余菌渣,测定试验结束时的虫体质量和剩余菌渣的干重,计算白星花金龟幼虫的体重增长率和取食量。体重增长率(%) =(试验开始时的虫体鲜重-试验结束时的虫体鲜重)/试验开始时的虫体鲜重×100;体重增长抑制率(%)=(CK组的体重增长率-处理组的体重增长率)/ CK组的体重增长率×100;取食量(g)=试验开始时的菌渣干重-试验结束时的菌渣干重;取食抑制率(%)=(CK组的取食量-处理组的取食量)/CK组的取食量×100。
1.4 数据分析
实验所得数据使用 Microsoft Excel 2013和SPSS17.0软件进行处理,实验结果用平均数±标准误表示(Mean±SE),并利用单因素方差分析法进行空白(CK)组与处理组之间的差异显著性分析,同时利用线性回归分析进行相关参数的拟合。
2 结果(Results)
2.1 Cu和Zn对白星花金龟幼虫的毒性
2.1.1 滤纸接触毒性
表1为Cu和Zn对白星花金龟幼虫的滤纸接触毒性试验结果。滤纸接触法中各时间段白星花金龟幼虫的中毒症状均不明显,但各处理组与CK组随着培养时间的延长,均出现虫体身体变软、活力下降等现象。由表1可以看出,试验设计的Cu和Zn浓度与白星花金龟幼虫的死亡率无显著规律性,说明试验浓度Cu和Zn对白星花金龟幼虫的死亡率影响很小,Cu和Zn对白星花金龟幼虫无明显的接触毒性。
2.1.2 人工土壤毒性
表2为Cu、Zn对白星花金龟幼虫的人工土壤毒性试验结果。人工土壤法中白星花金龟幼虫的中毒症状重于滤纸接触法,主要表现为虫体取食量减少、体重减轻、活力降低、体表环节皱缩等,这种症状随Cu、Zn浓度的升高而加剧,在高浓度(8 000mg·kg-1)时虫体出现了明显的拒食现象。由表2可以看出,人工土壤法中试验设计的Cu、Zn浓度与白星花金龟幼虫的死亡率也无显著规律性,此外,由于人工土壤环境与白星花金龟幼虫生活的自然环境(畜禽粪、菌渣、秸秆堆等有机质丰富的地方)差别较大, CK组和各处理组虫体的取食量均较少,因此,本试验又对菌渣中Cu、Zn对白星花金龟幼虫的毒性效应进行了研究。
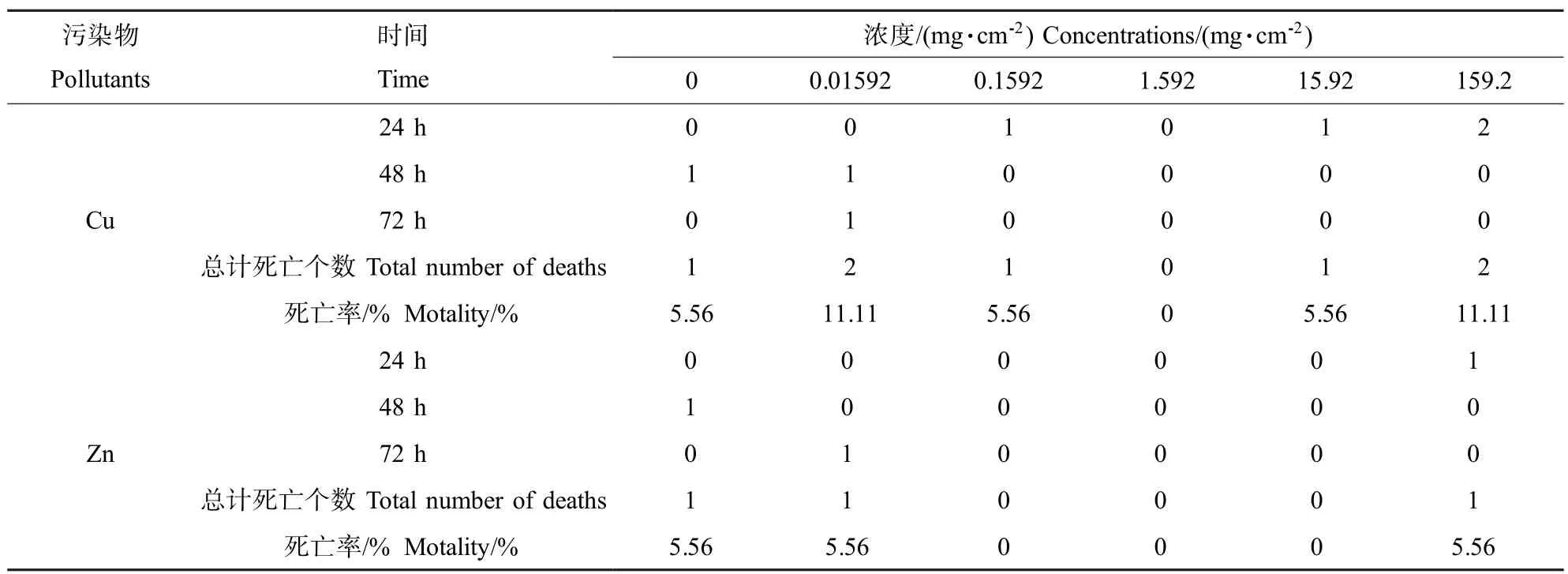
表1 Cu、Zn对白星花金龟幼虫的滤纸接触毒性Table 1 The contact filter paper toxic effect of Cu and Zn onP.brevitarisLewis larvae
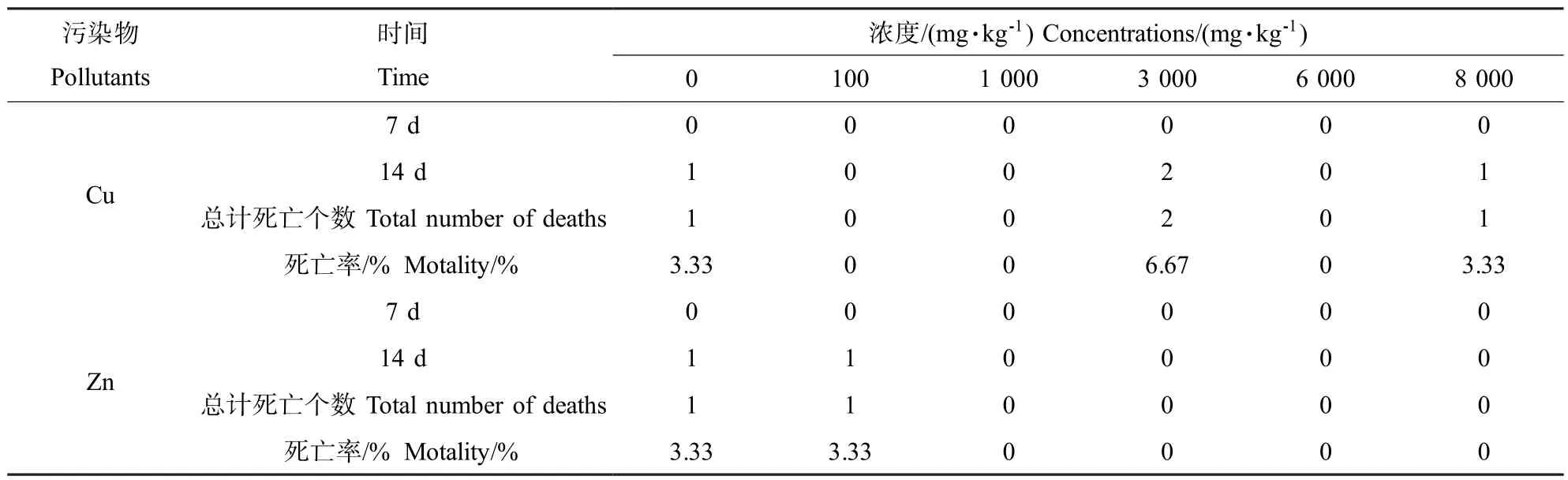
表2 Cu、Zn对白星花金龟幼虫的人工土壤毒性Table 2 The artificial soil toxic effect of Cu and Zn onP.brevitarisLewis larvae
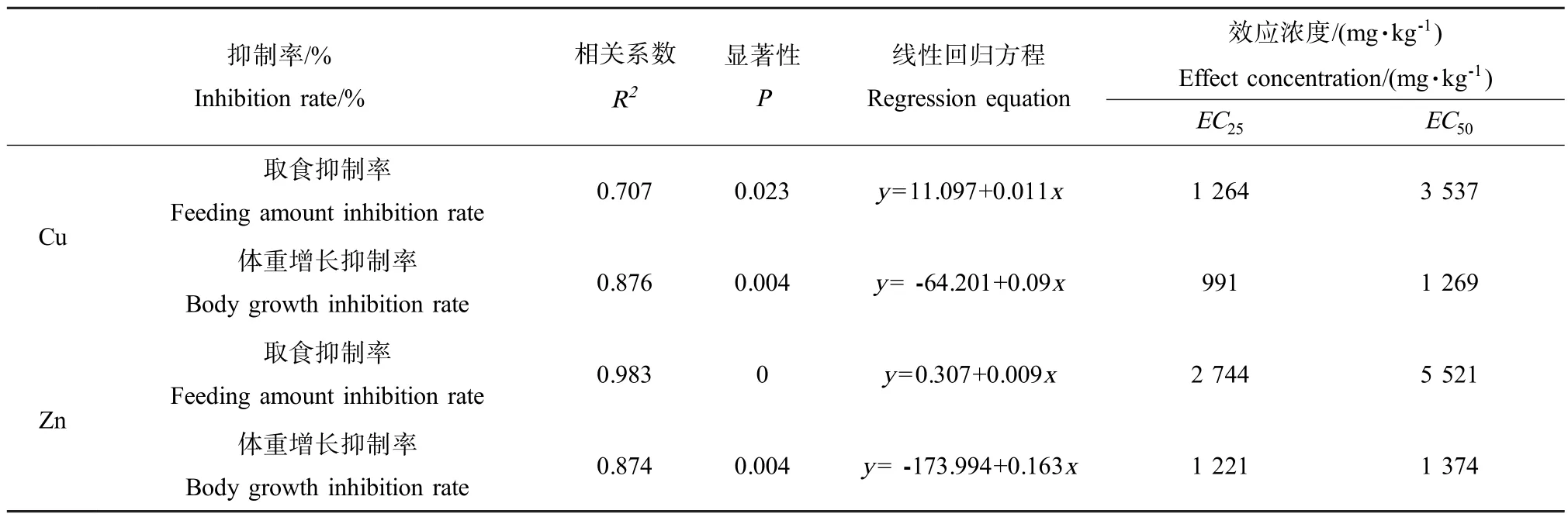
表3 重金属浓度与虫体取食及体重增长抑制率的相关性分析Table 3 Correlation relationships between the feeding amount,body growth inhibition rate and the concentration of heavy metals
2.1.3 菌渣毒性
试验浓度Cu、Zn与白星花金龟幼虫取食及体重增长抑制率的相关性分析如表3所示,对虫体取食量的影响如图1所示,对虫体体重增长率的影响如图2所示。
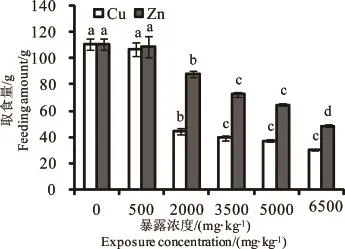
图1 Cu、Zn对白星花金龟幼虫取食情况的影响注:图中不同小写字母表示与CK组比差异显著(P<0.05),下同。Fig.1 Effects of Cu and Zn on the feeding amount of P.brevitarisLewis larvaeNote:Different letters indicated significant differences compared with the control group(P<0.05),the same below.
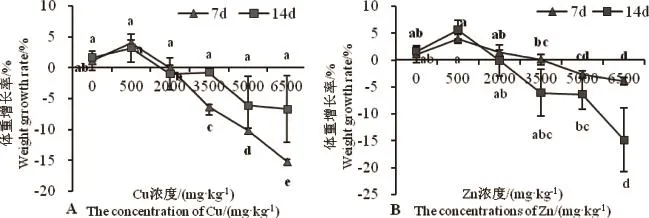
图2 Cu、Zn对白星花金龟幼虫体重增长率的影响Fig.2 Effects of Cu and Zn on the weight growth rate ofP.brevitarisLewis larvae
2.1.3.1 Cu、Zn对白星花金龟幼虫取食情况的影响
由图1可以看出,随着菌渣中Cu、Zn含量的升高,各处理组的白星花金龟幼虫取食量呈逐渐降低的趋势,并且均低于CK组,但低浓度的Cu、Zn(500mg·kg-1)处理组的虫体取食量与CK组均无显著性差异(P>0.05)。浓度为2 000mg·kg-1的Cu处理组虫体取食量显著下降(P<0.05),比CK组低59.7%;随着Cu浓度的升高(3 500、5 000、6 500mg·kg-1),虫体取食量继续逐渐下降,且显著低于CK组和低浓度处理组(P>0.05),说明食物中高浓度的Cu能够抑制虫体的取食(P<0.05)。除低浓度Zn(500mg·kg-1)处理组外,其他Zn处理组的虫体取食量也显著低于CK组(P<0.05),说明高浓度的Zn作用也会抑制虫体的取食,使虫体出现拒食现象。此外,相同浓度的Cu作用下的虫体取食量均低于Zn作用。
通过对Cu、Zn浓度与白星花金龟幼虫取食抑制率的回归分析可知(见表3),Cu浓度与虫体取食抑制率呈显著正相关关系(P=0.023,R2=0.707),通过回归方程得到当抑制率达到25%(EC25)和50% (EC50)时的Cu浓度分别为1 264和3 537mg·kg-1。Zn浓度与虫体取食抑制率表现为极显著正相关关系(P=0,R2=0.983),通过回归方程得到当抑制率达到25%(EC25)和50%(EC50)时的Zn浓度分别为2 744、5 521mg·kg-1。Cu的EC25、EC50均小于Zn,说明Cu对白星花金龟幼虫取食的抑制作用大于Zn。
2.1.3.2 Cu、Zn对白星花金龟幼虫体重增长率的影响
由图2A可以看出,随着Cu浓度的升高,白星花金龟幼虫体重增长率呈先升高后逐渐下降的趋势。当Cu浓度为500mg·kg-1时,第7、14天时的幼虫体重增长率均高于CK组,但无显著性差异(P>0.05)。随着菌渣中Cu浓度的继续升高,在第7天时,虫体的体重增长率小于0,并显著低于CK组(P<0.05),各处理组间也表现为显著性差异(P<0.05);第14天时各处理组的幼虫体重增长率与CK组均无显著性差异(P>0.05)。CK组和高浓度(3 500、5 000、6 500mg·kg-1)处理组虫体第14天时的体重增长率均高于第7天,可能与虫体对添加高浓度Cu菌渣的逐渐适应有关。
由图2B可以看出,随着Zn浓度的升高,白星花金龟幼虫体重增长率也呈先升高后下降的趋势。当Zn浓度为500mg·kg-1时,第7、14天时的幼虫体重增长率均升高,但与CK组均无显著性差异(P>0.05)。在第7天时,低浓度处理组(500、2 000mg·kg-1)与CK组无显著性差异(P>0.05),其他处理组则显著低于CK组(P<0.05);第14天时,除浓度为6 500mg·kg-1的处理组外,其他处理组与CK组均无显著性差异(P>0.05)。此外,除500mg·kg-1处理组外,其他处理组虫体第14天时的体重增长率均低于第7天。
通过对Cu、Zn浓度与白星花金龟幼虫体重增长抑制率的回归分析可知(见表3),Cu、Zn浓度与虫体体重增长抑制率均表现为极显著正相关关系(P= 0.004)。通过回归方程计算可知,当抑制率达到25%(EC25)和50%(EC50)时的Cu浓度分别为991、1 269mg·kg-1,Zn浓度分别为1 221、1 374mg·kg-1。Cu的EC25、EC50均小于Zn,说明Cu对白星花金龟幼虫体重增长的抑制作用大于Zn。
2.2 Cu、Zn对白星花金龟幼虫的氧化胁迫效应
白星花金龟幼虫暴露于Cu、Zn污染的菌渣中体内SOD、CAT、GST活性的变化如图3中所示,可溶性蛋白含量和MDA含量的变化如图4所示。
2.2.1 SOD活性
由图3A可以看出,随着Cu浓度的升高,白星花金龟幼虫体内SOD活性呈先降低后升高又降低的变化趋势,当 Cu含量为500mg·kg-1时,虫体SOD活性最小,比CK组低30.33%,被显著抑制(P<0.05);当Cu含量为3 500、5 000、6 500mg·kg-1时,虫体SOD活性与CK组差异不显著(P>0.05)。但各处理组的SOD活性均小于CK组,被不同程度的抑制。随着Zn浓度的升高,虫体SOD活性呈先降低后升高降低后又升高的波动变化趋势,当Zn含量为3 500mg·kg-1时,虫体SOD活性被显著抑制(P<0.05);当Zn含量为2 000和6 500mg·kg-1时,SOD活性被激活,分别比CK组高了14.30%和20.47%,但差异不显著(P>0.05)。

图3 Cu、Zn对虫体SOD、CAT、GST活性的影响Fig.3 Effects of Cu and Zn on the SOD,CAT,GST activities ofP.brevitarisLewis larvae
2.2.2 CAT活性
由图3B可以看出,随着Cu浓度的升高,白星花金龟幼虫体内CAT活性变化趋势与SOD相同,并且各处理组与CK组差异均不显著(P>0.05),除Cu含量为3 500mg·kg-1的处理组外,各处理组的CAT活性均低于CK组,也受到了一定的抑制。随着Zn浓度的升高,虫体CAT活性呈先升高后降低又逐渐升高的波动变化趋势,各处理组也与CK组差异不显著(P>0.05),除Zn含量为500mg·kg-1的处理组外,其他各处理组的 CAT活性也均低于CK组。
2.2.3 GST活性
由图3C可以看出,随着Cu浓度的升高,白星花金龟幼虫体内GST活性变化不稳定,当Cu含量为500mg·kg-1时,GST活性最小,比CK组低了57.45%,被显著抑制(P<0.05),其他各处理组的GST活性则与CK组均无显著性差异(P>0.05),但各处理组的GST活性均低于CK组,即试验浓度Cu对GST主要表现为抑制作用。随着Zn浓度的升高,虫体GST活性呈先升高后降低、升高后又降低的波动变化趋势,各处理组的GST活性均高于CK组,试验浓度Zn对GST则主要表现为激活作用,但差异不显著(P>0.05)。
2.2.4 可溶性蛋白含量
由图4A可以看出,随着Cu浓度的升高,白星花金龟幼虫体内可溶性蛋白含量总体上呈先升高后降低的变化趋势,各处理组的可溶性蛋白含量均显著高于CK组(P<0.05),说明Cu作用诱导了白星花金龟幼虫体内可溶性蛋白含量的生成;在Cu含量为500mg·kg-1时,虫体可溶性蛋白含量达最高,并且与其他处理间差异显著(P<0.05),即Cu在500mg·kg-1时对虫体内可溶性蛋白的诱导效应最强。随着Zn浓度的升高,虫体可溶性蛋白含量呈先降低后升高又降低的变化趋势,其中3 500、5 000mg·kg-1Zn处理组的可溶性蛋白含量显著高于CK组(P<0.05),其他处理组的可溶性蛋白含量均低于CK组(P>0.05),说明Zn在一定浓度范围内能够诱导虫体可溶性蛋白含量的升高。
2.2.5 MDA含量
由图4B可以看出,随着Cu浓度的升高,白星花金龟幼虫体内的MDA含量呈先降低后升高的变化趋势,当Cu浓度为3 500mg·kg-1时,虫体MDA含量最低,显著低于CK组25%(P<0.05),其他各处理组的MDA含量也均低于CK组,但差异不显著(P>0.05)。随着Zn浓度的升高,虫体MDA含量呈先升高后降低又升高的变化趋势,当Zn含量为500、2 000mg·kg-1时,虫体MDA含量高于CK组,但差异不显著(P>0.05),随着Zn浓度的进一步升高,虫体MDA含量降低,当Zn为5 000mg·kg-1时,虫体MDA含量最小,比CK组低了41.67%,与CK组差异显著(P<0.05)。
3 讨论(Discussion)
Cu、Zn是生物进行正常生理活动的必需元素,但当摄取过量时,则会对机体产生一定的毒害作用。本文采用滤纸接触法、人工土壤法和与白星花金龟幼虫生活环境较为相似的菌渣培养法研究了Cu、Zn单一作用对其的生态毒性效应。
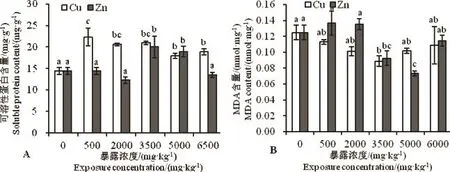
图4 Cu、Zn对虫体可溶性蛋白、MDA含量的影响Fig.4 Effects of Cu and Zn on the content of the soluble protein and MDA ofP.brevitarisLewis larvae
从研究结果可以看出,滤纸接触法和人工土壤法中Cu、Zn的试验浓度对白星花金龟幼虫的死亡率无明显影响,这与李桂亭等[14]对稀土的研究结果相似,在他们设计的稀土试验剂量范围内(滤纸接触法:0~3 000mg·L-1;自然土壤法:0~3 000mg·kg-1),蛴螬死亡率受稀土试验浓度的影响很小,可能与虫体本身具有较强的耐受性有关。菌渣培养法中试验虫体均未出现死亡,当Cu、Zn浓度为500mg·kg-1时,幼虫体重增长率均高于CK组(P>0.05),说明低浓度Cu、Zn能够促进虫体的生长,但高浓度的Cu、Zn明显抑制了虫体的取食和生长,并且这种抑制程度随Cu、Zn浓度的增大而逐渐增强,分析可能是白星花金龟幼虫应对外界环境胁迫的一种重要机制,由于高浓度的Cu、Zn的侵染,幼虫会减少对食物的摄取,而与此同时,虫体解毒代谢活动加剧了对自身能量的消耗,进而导致虫体重下降[15-17]。
通过对Cu、Zn浓度与白星花金龟幼虫取食抑制率和体重增长抑制率的回归分析可知,取食抑制率和体重增长抑制率均与Cu、Zn浓度表现为显著性正相关关系,说明白星花金龟幼虫在对畜禽粪污等的Cu、Zn污染生态风险评估方面,具有一定的应用价值。通过计算可知,虫体的取食抑制率和体重增长抑制率达到25%(EC25)和50%(EC50)时的Cu浓度均小于Zn浓度,表明Cu对白星花金龟幼虫的毒害作用大于Zn,同时重金属对动物的毒性作用不仅与其浓度有关,也与重金属的性质有关[18]。
根据Mosleh等[19]的研究,重金属、有机物、寒、旱等外来胁迫会使动、植物体内可溶性蛋白的合成能力发生改变,这是动、植物受到外界胁迫的一种直接指示。研究发现,Cu处理组的虫体可溶性蛋白含量均显著高于CK组(P<0.05),Zn含量为3 500、5 000mg·kg-1处理组的可溶性蛋白含量也显著高于CK组(P<0.05),分析可能是白星花金龟幼虫应对Cu、Zn胁迫所产生的应激反应,通过合成更多可溶性蛋白减轻机体受到的毒害。
在长期进化过程中,昆虫同其他动物一样,体内也形成了一套有效抵御自由基损伤的抗氧化防御系统,包括SOD、CAT、GST等,它们能够使昆虫体内自由基的产生和清除处于平衡状态[20-21],从而保证生物体各项生理活动的正常进行。SOD能够将超氧阴离子自由基转化为H2O2,然后由CAT进一步将H2O2迅速分解为H2O和O2,SOD和CAT协作构成了生物体抵御外界胁迫的第一道防线。GST属于生物体内第二代谢阶段的酶,不仅可以催化GSH与亲电子代谢物的结合[22],其自身还可以与亲脂性物质结合,从而生成水溶性的化合物排出体外,起到解毒和阻断生物体脂质过氧化的作用[23]。在受到逆境条件胁迫时,生物体内的自由基含量发生变化,从而诱导酶活水平改变,自由基所具有的超强的氧化能力也会导致生物体的功能分子损伤,使细胞功能受到威胁。MDA是生物体内膜脂质过氧化反应的主要代谢产物,其含量越高,表明机体受到的过氧化损伤越严重,此外,MDA能够与蛋白质中的游离氨基作用,使蛋白质发生分子内与分子间的交联,进而导致细胞损伤[24]。
本研究中,在受到 Cu胁迫后,低浓度(500、2 000mg·kg-1)处理组的 SOD活性低于高浓度(3 500、5 000、6 500mg·kg-1)处理组,可能与低浓度下幼虫取食了大量的菌渣,在摄入的大量Cu胁迫下超氧阴离子的生成量超出了机体清除能力,导致SOD活性下降,而在Cu高浓度时,虫体由于拒食而维持了体内SOD活力的相对稳定。而各处理组虫体的SOD活性均低于CK组,可能是由于生物体内的自由基超出了自身的承受范围,此时机体产生的SOD已经不能有效清除自由基的伤害,SOD的活力就会降低[25],这与关于高浓度污染物对蚯蚓[26-28]、家蚕[29]、果蝇[30]等的研究结果相似。各处理组CAT活性变化规律与SOD一致,并且各处理组CAT活性均与CK组无显著性差异(P>0.05),试验处理对CAT活性没有显著影响。在Cu含量为500mg·kg-1时, GST活性被显著抑制(P<0.05),可能是低浓度下摄入的大量Cu对虫体的毒害作用超过了GST的解毒作用,使其活力中心遭到破坏,导致活性降低[26];其他处理组GST活性也低于CK组但差异不显著(P>0.05),分析原因同SOD变化,虫体通过减少摄食降低了对GST的毒害作用。各处理组MDA含量均低于CK组,除3 500mg·kg-1处理组MDA含量显著低于CK组外(P<0.05),其他各处理组均与CK组无显著性差异(P>0.05),进一步说明试验浓度水平下Cu未对白星花金龟幼虫造成明显过氧化损伤,虫体内的解毒系统在抵抗外来胁迫所导致的损伤时有效发挥了作用。
在受到Zn胁迫后,浓度为2 000和6 500mg·kg-1的处理组SOD活性被激活,其他处理组的SOD活性被抑制,但除3 500mg·kg-1处理组的SOD活性显著低于CK组外(P<0.05),其他处理组均与CK组差异不显著(P>0.05),说明虫体可以通过调节SOD酶的活性来抵御一定量外源重金属的氧化胁迫。除500mg·kg-1处理组外,其他各处理组的CAT活性均低于CK组,与受到Cu胁迫相同,Zn胁迫也未对CAT活性造成明显影响,此外,Zn作用下的GST活性也与CK组无显著性差异(P>0.05),说明试验浓度Zn未对虫体造成严重的过氧化影响,可能与虫体自身的调节作用有关,一方面虫体自身的耐受性较强,另一方面虫体通过拒食或排泄作用维持了体内抗氧化系统的相对平衡。除3 500和5 000mg·kg-1处理组虫体的MDA含量显著低于CK组(P<0.05)外,其他处理组均与CK组无显著性差异(P>0.05),进一步说明了虫体通过自身的调节系统维持了体内代谢的相对稳定。
试验未发现虫体的可溶性蛋白含量、SOD、CAT、GST活性和MDA含量的变化与Cu、Zn的浓度有明显的关系,这可能与昆虫体内存在的多种解毒机制有关[31],昆虫的解毒机制与抗氧化系统之间存在着复杂的生物学关系[23],抗氧化系统中各种酶的活性也会受到各种因素的影响,进而导致这种关系不明显。综合分析试验浓度Cu、Zn对虫体的取食、抗氧化酶系统影响的结果,高浓度污染物作用下的虫体取食量显著低于CK组,也可能是Cu、Zn引起了虫体的消化系统毒性,由于无法取食进而导致产生的一些次生效应,并非真正的拒食[32],其机理还有待进一步研究。此外,在不影响白星花金龟幼虫正常取食情况下Cu、Zn污染对其的生态毒性的研究也在进行中。
[1]高定,陈同斌,刘斌,等.我国畜禽养殖业粪便污染风险与控制策略[J].地理研究,2006,25(2):311-319
[2]聂春芬,王应军,马星宇,等.固定化活性污泥实现短程硝化反硝化处理畜禽废水[J].环境工程学报,2013, 7(5):1807-1812 Nie C F,Wang Y J,Ma X Y,et al.Immobilized activated sludge to achieve shortcutnitrification-denitrification treatment of livestock wastewater[J].Chinese Journal of Environment Engineering,2013,7(5):1807-1812(in Chinese)
[3]杨子仪,吴景贵,冯娜娜,等.不同畜禽粪与化肥配施对黑土中Cu有效性的影响及相关因素分析[J].环境科学学报,2015,35(1):294-301 Yang Z Y,Wu J G,Feng N N,et al.Effects of different combinations of livestock manures with chemical fertilizers on Cu availability in black soil and relevant factors analysis[J].Acta Scientiae Circumstantiae,2015,35(1): 294-301(in Chinese)
[4]Bonazzi G,Cortellini L,Piccinini S.Presenza di rame e zineo nei liquami suinieoli e risehio di eontaminazione dei suoli[J].L.Informatore Agrario,1994,36:55-59
[5]Cang L,Wang Y,Zhou D,et al.Heavy metals pollution in poultry and livestock feeds and manures under intensive farming in Jiangsu Province,China[J].Journal of Environmental Sciences,2004,16(3):371-374
[6]王菲菲,刘玉升,姬小雪,等.白星花金龟成虫肠道细菌的分离鉴定[J].中国微生态学杂志,2009,21(9):798-800 Wang F F,Liu Y S,Ji X X,et al.The isolation and identification of intestinal microflora of adultPotosia brevitarsis [J].Chinese Journal of Microecology,2009,21(9):798-800(in Chinese)
[7]刘新民.粪食性金龟子对家畜粪的分解作用研究[J].内蒙古师范大学学报:自然科学汉文版,2006,35(4): 477-481
[8]刘伟,赵艳.蛴螬的养殖与开发[J].安徽农业科学, 2009,37(27):13109-13110 Liu W,Zhao Y.Culture and development of grubs[J]. Journal of Anhui Agricultural Science,2009,37(27): 13109-13110(in Chinese)
[9]杨诚,刘玉升,徐晓燕,等.白星花金龟幼虫对酵化玉米秸秆取食效果的研究[J].环境昆虫学报,2009,37(1): 122-127 Yang C,Liu Y S,Xu X Y,et al.The study on the effect ofProtaetia brevitarisLewis larvae transformation the corn straw[J].Journal of Environmental Entomology, 2009,37(1):122-127(in Chinese)
[10]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254
[11]Beauchamp C.Superoxide dismutase:Improved assays and applicable to acrylamide gels[J].Analytical Biochemistry,1971,44(1):276–287
[12]徐镜波,袁晓凡,郎佩珍.过氧化氢酶活性及活性抑制的紫外分光光度测定[J].环境化学,1997,16(1):73-76
[13]Saint-Denis M,Labrot F,Narbonne J F,et al.Glutathione, glutathione-related enzymes,and catalase activities in the earthwormEisenia fetida andrei[J].Environmental Contamination and Toxicological,1998,35(4):602-614
[14]李桂亭,江俊起,陈洁,等.稀土元素对土栖动物群落结构的影响及对蛴螬的生态毒性[J].应用生态学报, 2006,17(1):159-162 Li G T,Jiang J Q,Chen J,et al.Effects of rare earth elements on soil fauna community structure and their ecotoxicity toHolotrichia parallela[J].Chinese Journal of Ap-plied Ecology,2006,17(1):159-162(in Chinese)
[15]Edwards C A,Lofty J R.戴爱云,范围仪,译.蚯蚓生物学[M].北京:科学出版社,1984:18-45
[16]Rowe C L,Hopkins W A,Zehnder C,et al.Metabolic costs incurred by crayfish(Procambarus acutus)in a trace element-polluted habitat:Further evidence of similar responses among diverse taxonomic groups[J].Comparative Biochemistry and Physiology D-Genomics&Proteomics,2001,129(3):275-283
[17]Ribeiro S,Sousa J P,Nogueira A J,et al.Effect of endosulfan and parathion on energy reserves and physiological parameters of the terrestrial isopodPorcellio dilatatus [J].Ecotoxicology and Environmental Safety,2001,49(2): 131-138
[18]李晓勇,骆永明,柯欣,等.土壤跳虫(Folsomia candida)对食物中铜污染物的吸收和排泄[J].生态毒理学报, 2012,7(4):395-400 Li X Y,Luo Y M,Ke X,et al.Assimilation and excretion of copper contained in food by soil collembolan(Folsomia candida)[J].Asian Journal of Ecotoxicology,2012,7 (4):395-400(in Chinese)
[19] Mosleh Y Y,Paris-Palacios S,Couderchet M,et al. Effects of the herbicide isoproturon on survival,growth rate,and protein content of mature earthworms(Lumbricus terrestrisL.)and its fate in the soil[J].Applied Soil Ecology,2003,23(1):69-77
[20]Allen R G,Balin A K.Oxidative influence on development and differentiation:An overview of a free radical theory of development[J].Free Radical Biology and Medicine,1989,6(6):631-639
[21]Bolter C J,Chefurka W.Extramitochondrial release of hydrogen peroxide from insect and mouse liver mitochondria using the respiratory inhibitors phosphine,myxothiazol, and antimycin and spectral analysis of inhibited cytochromes[J].Archives of Biochemistry and Biophysics, 1990,278(1):65-72
[22]张薇,宋玉芳,孙铁珩,等.土壤低剂量芘污染对蚯蚓若干生化指标的影响[J].应用生态学报,2007,18(9): 2097-2103 Zhang W,Song Y F,Sun T Y,et al.Effects of low dosage pyrene pollution on biochemical characters of earthworm (Eisenia fetida)in soil[J].Chinese Journal of Applied E-cology,2007,18(9):2097-2103(in Chinese)
[23]肖龙云,程嘉翎,王俊,等.家蚕氟化物中毒后血淋巴中脂质过氧化物和抗氧化物含量及抗氧化酶活性的变化[J].蚕业科学,2010,36(6):1047-1051 Xiao L Y,Cheng J L,Wang J,et al.Changes of lipid peroxide and antioxidant contents and antioxidant enzymatic activity in hemolymph of fluoride poisonedBombyx mori larvae[J].Science of Sericulture,2010,36(6):1047-1051 (in Chinese)
[24]Papadimitriou E,Loumbourdis N S.Exposure of the frog Rana ridibundato copper impact on two biomarkers,lipid peroxidation,and glutathione[J].Bulletin of Environment Contamination and Toxicology,2002,69(6):885-891
[25]舒迎花,马洪辉,杜艳,等.Bt玉米秸秆杀虫蛋白对赤子爱胜蚓酶活性的影响[J].应用生态学报,2011,22(8): 233-239 Shu Y H,Ma H H,Du Y,et al.Effects ofBtcorn straw insecticidal proteins on enzyme activities ofEisenia fetida [J].Chinese Journal of Applied Ecology,2011,22(8): 233-239(in Chinese)
[26]曹佳,刁晓平,胡继业,等.异恶草酮对蚯蚓抗氧化酶活性及DNA损伤的研究[J].农业环境科学学报,2013, 32(5):925-931 Cao J,Diao X P,Hu J Y,et al.Effects of clomazone on antioxidative enzymes activity and DNA damage of earthworm(Eisenia foetida)[J].Journal of Agro-Environment Science,2013,32(5):925-931(in Chinese)
[27]Wu S J,Zhang H X,Hu Y,et al.Effects of 1,2,4-trichlorobenzene on the enzyme activities and ultrastructure of earthwormEisenia fetida[J].Ecotoxicology and Environmental Safety,2012,76(2):175-181
[28]Du L,Li G D,Liu M M,et al.Biomarker responses in earthworms(Eisenia fetida)to soils contaminated with din-butyl phthalates[J].Environmental Science&Pollution Research International,2014,22(6):4660-4669
[29]袁红霞,褚峰,秦粉菊,等.镉胁迫对家蚕脂肪体脂质过氧化物含量及抗氧化酶活性和mRNA表达的影响[J].昆虫学报,2014,57(2):168-175 Yuan H X,Chu F,Qin F J,et al.Effects of cadmium exposure on the lipid peroxide content and the antioxidant enzyme activity and mRNA expression in the fat body in the silkworm,Bombyx mori[J].Acta Entomologica Sinica,2014,57(2):168-175(in Chinese)
[30]Huang S F,Li Z Y,Wang X Q,et al.Cerium caused life span shortening and oxidative stress resistance inDrosophila melanogaster[J].Ecotoxicology and Environmental Safety,2010,73(1):89-93
[31]侯成香,桂仲争.家蚕谷胱甘肽硫转移酶的组织分布及发育期变化规律[J].蚕业科学,2007,33(3):409-413 Hou C X,Gui Z Z.Tissue distribution of glutathione S-T ransferases in silkworm,Bombyx moriand changes in developmental stages[J].2007,33(3):409-413(in Chinese)
[32]李静,颜钫,何文兴,等.麻疯树萜醇I对家蚕的毒性及作用机理研究[J].农药学学报,2001,7(1):29-34 Li J,Yan F,He W X,et al.Toxicity and mechanism of jatropherolI to silkworm,Bombys moriL[J].Chinese Journal of Pesticide Science,2001,7(1):29-34(in Chinese)
Toxicological Effects of Excessive Cu and Zn on Protaetia brevitaris Lewis Larvae
Yin Suzhen1,2,3,Yu Chong4,Li Guangde1,2,3,*,Liu Yusheng5,Zhao Jie1,2,3,Zhang Xinyi1,2,3
1.College of Resource and Environment,Shandong Agricultural University,Taian 271018,China
2.Key Laboratory of Agricultural Environment in Universities of Shandong,Taian 271018,China
3.National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources,Taian 271018,China
4.Laicheng District Environment-Protection Bureau of Laiwu City,Laiwu 271100,China
5.College of Plant Protection,Shandong Agricultural University,Taian 271018,China
15 May 2015 accepted 17 July 2015
Three methods(the contact filter paper method,the artificial soil method and the edible fungi residue culture method)were used to study the toxic effects of Cu and Zn onProtaetia brevitarisLewis larvae.The resultsshowed that the concentration of Cu and Zn had no significant effect on the mortality ofP.brevitarislarvae in the contact filter paper method and artificial soil method.In the edible fungi residue culture method,the feeding amount and body growth were significantly inhibited as the concentration of Cu and Zn increased,besides,the feeding inhibition rate and weight growth inhibition rate showed a significantly positive correlation with the concentration of Cu and Zn.The elements(Cu)applied to theP.brevitarislarvae induced the soluble protein content,inhibited the activities of SOD and GST and the content of MDA,and had no significant effects on the activities of CAT. The soluble protein content was significantly induced by 3 500 and 5 000mg·kg-1Zn,while the content of MDA was significantly inhibited.The SOD activities were induced by 2 000 and 6 500mg·kg-1Zn(P>0.05).The CAT and GST activities showed no significant change with the Zn application.The results indicated that Cu and Zn had an ecotoxicological effect onP.brevitarislarvae.However,to estimate the toxicity of heavy metals with high concentrations toP.brevitarislarvae,except for SOD,CAT and GST as biomarkers,other indicators should be taken into account for a comprehensive analysis.
copper(Cu);zinc(Zn);Protaetia brevitarisLewis larvae;toxic effects
2015-05-15 录用日期:2015-07-17
1673-5897(2016)1-313-10
X171.5
A
10.7524/AJE.1673-5897.20150515003
尹素真,于冲,李光德,等.高Cu、高Zn对白星花金龟幼虫的毒性作用[J].生态毒理学报,2016,11(1):313-322
Yin S Z,Yu C,Li G D,et al.Toxicological effects of excessive Cu and Zn onProtaetia brevitarislewis larvae[J].Asian Journal of Ecotoxicology,2016, 11(1):313-322(in Chinese)
尹素真(1989-),女,硕士研究生,研究方向为环境生态学,E-mail:ysz0504@126.com;
),E-mail:lgd107@sdau.edu.cn
简介:李光德(1962-),男,学士,副教授,主要从事环境污染的修复,生态毒理和污染生态等方面的研究。
