二甲苯、蒽、苯并[α]芘对虾夷扇贝幼贝血清SOD、CAT活性的影响
2016-12-06关晓燕王摆董颖李姝熳高杉刘卫东周遵春
关晓燕,王摆,#,董颖,李姝熳,高杉,刘卫东,周遵春,*
1.辽宁省海洋水产科学研究院,大连116023
2.山东省南四湖水质监测中心站,济宁272100
二甲苯、蒽、苯并[α]芘对虾夷扇贝幼贝血清SOD、CAT活性的影响
关晓燕1,王摆1,#,董颖1,李姝熳2,高杉1,刘卫东1,周遵春1,*
1.辽宁省海洋水产科学研究院,大连116023
2.山东省南四湖水质监测中心站,济宁272100
以虾夷扇贝(Mizuhopecten yessoensis)为受试生物,设置3种不同浓度的二甲苯、蒽、苯并[α]芘处理健康的虾夷扇贝,检测血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性变化情况,结果发现:0.01~1.0mg·L-1的二甲苯、0.002~0.2mg·L-1的蒽、0.001~0.1mg·L-1的苯并[α]芘处理6、12 h后,虾夷扇贝血清SOD活性升高,处理12 h后对血清SOD活性诱导率均高于处理6 h的;处理6 h后,血清CAT活性降低,而处理12 h后,血清CAT活性升高;具有显著的剂量-效应关系和时效关系,表明二甲苯、蒽、苯并[α]芘对虾夷扇贝具有氧化胁迫作用,可能导致其氧化损伤。相关性分析发现,3种污染物处理6 h后,血清SOD活性与CAT活性变化呈显著负相关;而处理12 h后,血清SOD活性与CAT活性变化呈显著正相关。上述结果为开展二甲苯、蒽、苯并[α]芘对海洋贝类毒性评价提供基础数据。
二甲苯;蒽;苯并[α]芘;虾夷扇贝;氧化胁迫;超氧化物歧化酶;过氧化氢酶
由于突发海洋溢油事故和沿海石油化工业的发展,石油类污染物入海量逐年增加,成为潜在的危害我国海洋生态环境安全的重要因素之一。单环芳烃和多环芳烃(PAHs)是石油类重要组分,在我国近岸海洋环境中均有检出。2009年,朱四喜等[1]报道舟山潮间带沉积物二甲苯质量浓度在40.24~124.45mg·kg-1。渤海西北部海域表层海水和表层沉积物中PAHs含量范围分别为14.1~254 ng·L-1、1.26~483.38 ng·g-1,其中,包括蒽和苯并[α]芘[2-3]。海洋贝类作为海洋生态系统中重要底栖生物类群,主要滤食浮游动植物,对有机污染物及其代谢产物具有生物蓄积作用,常被用作海洋环境及河口区有机污染指示生物和受试生物。研究表明,海洋生物在代谢芳香烃类化合物时产生大量的活性氧(reactive oxygen species,ROS),如超氧自由基(O2-)、过氧化氢(H2O2)等[4-6],这些活性氧与蛋白质、膜脂、DNA碱基等反应,造成细胞的氧化损伤甚至死亡[7-10]。SOD和CAT是生物体内重要的抗氧化酶,在污染物胁迫下,生物体通过调节抗氧化酶水平,清除体内过量的活性氧,降低污染物对生物体的氧化损伤,也常被用作污染物生物监测和评价指标[7-9,11]。
前期研究发现二甲苯可导致仿刺参(Apostichopus japonicus)体内的脂质过氧化[12],呼吸树和肠组织的氧化胁迫[13-14],造成虾夷扇贝(M.yessoensis)精子超微结构损伤,抑制精卵结合,导致胚胎和幼体畸形,具有生殖毒性作用[15]。而有关二甲苯、蒽和苯并[α]芘对虾夷扇贝的氧化胁迫作用研究尚未见报道。本文选择虾夷扇贝为受试生物,设置3种不同浓度的二甲苯、蒽和苯并[α]芘处理健康虾夷扇贝,检测血清中SOD和CAT活性与3种污染物的处理浓度和处理时间的变化情况,分析虾夷扇贝血清SOD、CAT活性与二甲苯、蒽和苯并[α]芘的剂量-效应关系和时效关系,为开展3种污染物对海洋生物毒性评价筛选敏感的指标。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:Sunrise多功能酶标仪(瑞士 Tecan), CT15RE型台式微量高速离心机(日本Hitachi),YSI proplus多参数水质分析仪(美国YSI)。
试剂:二甲苯、二甲基亚砜试剂均为分析纯,购自中国国药有限公司;蒽、苯并[α]芘均为分析纯,购自美国阿拉丁公司。
1.2 实验材料
虾夷扇贝(M.yessoensis)的幼贝取自辽宁省海洋水产科学院海水养殖引育种中心,壳长(4.3±0.3) cm,壳高(4.3±0.3)cm,体重(7.8±1.0)g。幼贝放于经砂滤后的清洁海水驯养2周,挑选健康个体用于毒性实验。
1.3 虾夷扇贝的处理及取样
根据预实验结果,二甲苯(X)处理浓度设置为: 0.01、0.1、1.0mg·L-1;蒽(A)处理浓度设置为:0.002、0.02、0.2mg·L-1;苯并[α]芘(B)处理浓度设置为: 0.001、0.01、0.1mg·L-1。同时设置空白对照组(Cont.),空白对照组和各处理组均设置4个重复。用二甲基亚砜配制各处理组1 000倍母液,在25 L玻璃缸中加15 mL母液配制15 L实验溶液,每个处理组4个重复中各加10只虾夷扇贝。试验条件:水温10℃,盐度30,pH 8.0,间断性充氧,确保溶解氧大于4.5mg·L-1,避光。处理6 h、12 h后,取各处理组虾夷扇贝4只放于冰上,用2 mL灭菌注射器从扇贝闭壳肌血窦中抽取血液1.5 mL,4℃,700×g离心5 min,取上清,所得样品-80℃保存。
1.4 酶活性检测
SOD和CAT分别活性采用南京建成生物工程研究所的T-SOD和CAT试剂盒测定。
1.5 数据处理
采用SPSS 17.0软件,在P=0.05,P=0.01的置信水平对SOD和CAT活性变化进行ANOVA分析,并用Origin 7.5软件作图;在P=0.05的置信水平对3种污染物处理后SOD活性与CAT活性变化趋势进行Pearson相关性分析。
2 结果(Results)
2.1 二甲苯、蒽、苯并[α]芘对虾夷扇贝血清SOD活性的影响
二甲苯、蒽、苯并[α]芘对虾夷扇贝血清SOD活性的影响见图1。与对照组相比,二甲苯、蒽、苯并[α]芘处理6 h、12 h后均导致虾夷扇贝血清SOD活性上升,呈显著的剂量-效应正相关。处理6 h,二甲苯对血清SOD活性诱导率为4.9%~36.1%;处理12 h,二甲苯对血清SOD活性诱导率为11.9%~54.2%(见图1a)。处理6 h,蒽对血清SOD活性诱导率为0.0%~18.7%;处理12 h,蒽对血清SOD活性诱导率为6.9%~37.5%(见图1b)。处理6 h,苯并[α]芘对血清SOD活性诱导率为7.4%~15.5%;处理12 h,苯并[α]芘对血清SOD活性诱导率为37.7%~51.2%(见图1c)。3种污染物处理12 h对虾夷扇贝血清SOD活性诱导率高于6 h的。
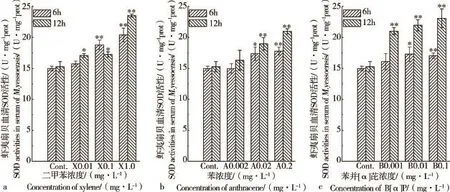
图1 二甲苯(a)、蒽(b)、苯并[α]芘(c)对虾夷扇贝血清SOD活性的影响注:*P<0.05,表示差异显著;**P<0.01,表示差异极显著。Fig.1 The effects of Xylene(a),Anthracene(b),Benzo[α]pyrene(c)on the SOD activities ofM.yessoensisserumsNote:* P<0.05,means significant difference;** P<0.01,means extremely significant difference.
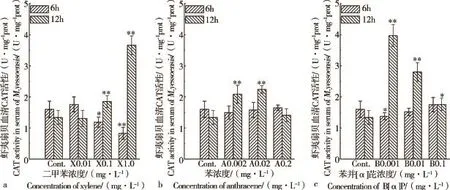
图2 二甲苯(a)、蒽(b)、苯并[α]芘(c)对虾夷扇贝血清CAT活性的影响注:*P<0.05,表示差异显著;**P<0.01,表示差异极显著。Fig.2 The effects of Xylene(a),Anthracene(b),Benzo[α]pyrene(c)on the CAT activities ofM.yessoensisserumsNote:* P<0.05,means significant difference;** P<0.01,means extremely significant difference.
2.2 二甲苯、蒽、苯并[α]芘对虾夷扇贝血清CAT活性的影响
二甲苯、蒽、苯并[α]芘对虾夷扇贝血清CAT活性的影响见图2。与对照组相比,二甲苯、蒽、苯并[α]芘处理6 h,虾夷扇贝血清CAT活性降低;而处理12 h,虾夷扇贝血清CAT活性升高。高、中浓度二甲苯处理6 h,对血清CAT活性抑制率为25.6%~48.1%;二甲苯处理12 h,对血清CAT活性诱导率为38.0%~173.1%(见图2a)。高、中浓度蒽处理6 h,对血清CAT活性抑制率为1.2%~6.2%;蒽处理12 h,对血清CAT活性诱导率为5.2%~56.0%(见图2b)。中、高浓度苯并[α]芘处理6 h,对血清CAT活性抑制率为5.0%~13.8%;苯并[α]芘处理12 h,对血清CAT活性诱导率为31.3%~196.3%(见图2c)。
2.3 虾夷扇贝血清SOD活性与CAT活性变化的相关性分析
二甲苯、蒽、苯并[α]芘处理6 h后,虾夷扇贝血清SOD活性与CAT活性变化呈显著负相关,相关系数R=-0.707;处理12 h后,血清SOD活性与CAT活性变化存在显著正相关,相关系数R=0.562。二甲苯、蒽、苯并[α]芘处理6 h后,血清SOD活性与12 h后的呈相同变化趋势,相关系数R=0.623;而二甲苯、蒽、苯并[α]芘处理6 h后,血清CAT活性与12 h后的呈相反变化趋势,相关系数R=-0.663。

表1 二甲苯、蒽、苯并[α]芘暴露虾夷扇贝血清SOD活性与CAT活性的相关性Table 1 The correlation between SOD and CAT activities of in xylene-,anthracene-,and benzo[α]pyrene-exposedM.yessoensisserums
3 讨论(Discussion)
海洋无脊椎动物在有机污染物的I相代谢过程中产生大量副产物—活性氧[16],过量的活性氧会导致生物体的氧化损伤[7-9,17]。SOD和CAT是活性氧酶清除系统中重要抗氧化酶,首先SOD将细胞内O-2歧化成H2O2和O2;再经CAT将H2O2进一步催化成H2O和O2[18-19]。污染物胁迫下生物体通过调节抗氧化酶(如:SOD、CAT、GPx等)水平,清除细胞和组织因有机污染物代谢产生过量活性氧,降低污染物的的氧化胁迫和氧化损伤;SOD和CAT活性变化也可以反映污染物暴露造成生物体的氧化胁迫水平。前期研究发现,单环芳烃苯、甲苯、乙基苯和二甲苯暴露12 h可导致仿刺参体腔液脂质过氧化,造成仿刺参呼吸树和肠组织中CAT活性及CAT、GPx基因mRNA相对表达量变化,可能造成仿刺参体内的氧化损伤[12-14]。本文研究发现,0.01~1.0mg·L-1的二甲苯处理6、12 h后,虾夷扇贝血清SOD活性显著升高,CAT活性先降低,后升高;表明二甲苯对虾夷扇贝具有氧化胁迫作用,可能导致其体内的氧化损伤。
蒽和苯并[α]芘作为典型的多环芳烃化合物,低浓度暴露通常导致水生生物抗氧化酶活性的显著变化[11,20]。2014年,Gravato等[9]报道1 024μg·L-1的蒽暴露96 h,锯齿长臂虾(Palaemon serratus)消化腺CAT活性极显著升高。冯涛等[22]研究发现30μg·L-1的苯并[α]芘暴露3 d后大弹涂鱼(Boleophthalmus pectinirostris)肝脏SOD活性显著升高,随后逐渐降至对照组水平;而苯并[α]芘对大弹涂鱼肝脏CAT活性无显著影响。王悠等[23]研究发现2、20μg·L-1的苯并[α]芘暴露6~18 d,鲈鱼(Lateolabrax japonicus)肝脏组织中SOD活性显著升高,而CAT活性无显著变化。本文结果表明,0.002~0.2mg·L-1的蒽、0.001~0.1mg·L-1的苯并[α]芘造成虾夷扇贝体内的氧化胁迫;通过对比分析发现,苯并[α]芘对虾夷扇贝的氧化胁迫作用高于蒽。这与 Palanikumar等[21]研究结果相似,0.011~0.176mg·L-1的蒽, 0.001~0.031mg·L-1的苯并[α]芘暴露,导致遮目鱼(Chanos chanos)的头、鳃和背鳍肌肉组织CAT活性显著上升,并随着暴露浓度增加CAT活性升高,呈显著的剂量-效应正相关性,且苯并[α]芘对3种组织CAT活性诱导率高于蒽。上官旖旎等[24]报道0.16、0.80μmol·L-1的对–二甲苯暴露72 h导致大弹涂鱼肝脏和白肌组织SOD活性显著升高,4.0μmol·L-1的对–二甲苯对肝脏和白肌组织SOD活性没有影响;肝脏和白肌组织中CAT活性不随对–二甲苯浓度变化而显著变化。苯并[α]芘和蒽对虾夷扇贝的胁迫作用均高于二甲苯,3种污染物对虾夷扇贝的氧化胁迫作用大小与其logKow值具有显著的正相关性。
不同规格、种类扇贝对污染物耐受性可能存在差异,自然状态下,扇贝体内的抗氧化酶活性与其年龄,生长和繁殖有关,1龄卡塔琳娜州扇贝(Argopecten ventricosus)体内CAT活性高于2龄的[25],而3龄栉孔扇贝(Chlamys farreri)体内SOD和CAT活性均高于2龄贝的[26]。原油水溶性组分处理壳长7~11 cm北极扇贝(C.islandica),第2天其体内谷胱甘肽(GSH)总含量显著降低,脂质过氧化物(MDA)含量逐渐升高,造成冰岛扇贝氧化损伤[27]。本文选择壳长(4.3±0.3)cm 1龄虾夷扇贝作为受试生物,发现二甲苯、蒽、苯并[α]芘处理6 h后,虾夷扇贝血清SOD与CAT活性变化呈显著负相关;处理12 h后,血清SOD与CAT活性变化存在显著正相关。这可能与1龄虾夷扇贝对3种污染物较为敏感有关,同时与2种抗氧化酶在活性氧酶清除系统催化的反应先后顺序有关。虾夷扇贝体内代谢3种污染物时产生O-2,先诱导SOD活性升高,SOD将O-2歧化为H2O2和O2;当H2O2在体内过量累积后,CAT活性被诱导,进一步将H2O2催化为H2O和O2,这与Tripathi等[19]的研究结果相似。而有关二甲苯、蒽、苯并[α]芘导致虾夷扇贝血清SOD与CAT活性变化的分子作用机制尚有待于深入研究。
[1]朱四喜,周唯,杨红丽,等.浙江舟山潮间带沉积物中二甲苯的检测[J].广东化工,2010,37(2):125–127 Zhu S X,Zhou W,Yang H L,et al.Determination of xylene in interdial sediments in Zhoushan,Zhejiang Province[J].Guangdong Chemical Industry,2010,37(2):125–127(in Chinese)
[2]张耀丹,田胜艳,刘宪斌,等.渤海西北部海域表层水体中PAHs的分布,来源及风险评价[J].海洋与湖沼, 2013,44(1):255-261 Zhang Y D,Tian S Y,Liu X B,et al.Distribution,source and ecological risk assessment of polycyclic aromatic hydrocarbons in surface water from the northwest BohaiSea, China[J].Oceanologia et Limnologia Sinica,2013,44(1): 255-261(in Chinese)
[3]张耀丹,田胜艳,田婵,等.渤海西北部海域表层沉积物PAHs分布及来源分析[C].持久性有机污染物论坛2012暨第七届持久性有机污染物全国学术研讨会论文集,天津,2012:2
[4]D'adamo R,Pelosi S,Trotta P,et al.Bioaccumulation and biomagnification of polycyclic aromatic hydrocarbons in aquatic organisms[J].Marine Chemistry,1997,56(1):45-49
[5]Kipopoulou A M,Manoli E,Samara C.Bioconcentration of polycyclic aromatic hydrocarbons in vegetables grown in an industrial area[J].Environmental Pollution,1999, 106(3):369-380
[6]赵云英,马永安.天然环境中多环芳烃的迁移转化及其对生态环境的影响[J].海洋环境科学,1998,17(2): 68-72 Zhao Y Y,Ma Y A.Transport process and ecological impact of polycyclic aromatic hydrocarbons in the natural environment[J].Marine Environmental Science,1998,17 (2):68-72(in Chinese)
[7]Livingstone D R.Oxidative stress in aquatic organisms in relation to pollution and aquaculture[J].Revue de Medecine Veterinaire,2003,154(6):427-430
[8]Richardson B J,Mak E,De Luca-Abbott S B,et al.Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (Perna viridis):Do mussels“integrate”biomarker responses?[J].Marine Pollution Bulletin,2008,57(6):503-514
[9]Gravato C,Almeida J R,Silva C,et al.Using a multibiomarker approach and behavioural responses to assess the effects of anthracene inPalaemon serratus[J].Aquatic Toxicology,2014,149(8):94-102
[10]王隽媛,边红枫,金香琴,等.萘对斑马鱼(Danio rerio)内脏团抗氧化防御系统的胁迫与生物响应[J].环境科学,2009,30(2):516-521 Wang J Y,Bian H F,Jin X Q,et al.Stress and biological response of naphthalene on the defense system in visceral mass of zebrafish(Danio rerio)[J].Environmental Science,2009,30(2):516-521(in Chinese)
[11]Orbea A,Ortiz-Zarragoitia M,Solé M,et al.Antioxidant enzymes and peroxisome proliferation in relation to contaminant body burdens of PAHs and PCBs in bivalve molluscs,crabs and fish from the Urdaibai and Plentzia estuaries(Bay of Biscay)[J].Aquatic Toxicology,2002, 58(1):75-98
[12]姜北,刘薇,周遵春,等.苯系物对仿刺参体内脂质过氧化程度的影响[J].水产科学,2014,33(1):15-21 Jiang B,Liu W,Zhou Z C,et al.Effects of benzene,toluene,ethybenzene,and xylene(BTEX)on lipid peroxidation in sea cucumberApostichopus japonicus[J].Fisher-ies Science,2014,33(1):15-21(in Chinese)
[13]高士博,王摆,董颖,等.苯系物对仿刺参catalase基因表达及酶活性的影响[J].生态毒理学报,2015,10(2): 297-305 Gao S B,Wang B,Dong Y,et al.The effects of BTEXs on the catalase gene expression and catalase activities in respiratory tree and intestine of sea cucumberApostichopus japonicus[J].Asian Journal of Ecotoxicology,2015, 10(2):297-305(in Chinese)
[14]董颖,王摆,崔程,等.苯系物对仿刺参肠、呼吸树谷胱甘肽过氧化物酶基因表达的影响[J].水产科学,2015, 34(5):311-315 Dong Y,Wang B,Cui C,et al.The effects of BTEXs on the glutathione peroxidase gene expression in intestine and respiratory tree of sea cucumberApostichopus japonicus[J].Fisheries Science,2015,34(5):311-315(in Chinese)
[15]王摆,贺凌,高杉,等.6种苯系物对虾夷扇贝的生殖毒性作用[J].生态毒理学报,2014,9(6):1083-1090 Wang B,He L,Gao S,et al.The reproductive toxicities of six BTEXs to Japanese scallop(Mizuhopecten yessoensis) [J].Asian Journal of Ecotoxicology,2014,9(6):1083-1090(in Chinese)
[16]Livingstone D R.Organicxenobiotic metabolism in marine invertebrates[M]//Advances in Comparative&Environmental Physiology.Springer:Berlin Heidelberg,1991,7: 45-185
[17]Apel K,Hirt H.Reactive oxygen species:Metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2014,55(1):728-749
[18]Ken C F,Hsiung T M,Huang Z X,et al.Characterization of Fe/Mn-superoxide dismutase from diatomThallassiosira weissflogii:Cloning,expression,and property[J].Journal of Agricultural and Food Chemistry,2005,53(5): 1470-1474
[19]Tripathi B N,Mehta S K,Amar A,et al.Oxidative stress inScenedesmussp.during short-and long-term exposure to Cu2+and Zn2+[J].Chemosphere,2006,62(4):538-544
[20]Torres M A,Barros M P,Campos S C,et al.Biochemical biomarkers in algae and marine pollution:A review[J].Ecotoxicology&Environmental Safety,2008,71(1):1-15
[21]Palanikumar L,Kumaraguru A K,Ramakritinan C M,et al.Biochemical response of anthracene and benzo[a]pyrene in milkfishChanos chanos[J].Ecotoxicology&Environmental Safety,2012,75(3):187-197
[22]冯涛,郑微云,洪万树,等.苯并(a)芘对大弹涂鱼肝脏抗氧化酶活性影响的初步研究[J].应用生态学报, 2001,12(3):422-424 Feng T,Zhen W Y,Hong W S,et al.Effect of benzo[α]pyrene on antioxidant enzyme activities inBoleophthalmus pectinirostrisliver[J].Chinese Journal of Applied E-cology,2001,12(3):422-424(in Chinese)
[23]王悠,姜爽,赵晓玮,等.2种有机污染物对鲈鱼生化标志物系统的影响及作用评价[J].环境科学,2010,31(3): 801-807 Wang Y,Jiang S,Zhao X W,et al.Effects of two organic pollutants on biomarker system of fishLateolabrax japonicusand the pollution assessment[J].Environmental Science,2010,31(3):801-807(in Chinese)
[24]上官旖旎,赵金龙,陈婷,等.对二甲苯对大弹涂鱼肝脏和白肌抗氧化酶活性的影响[J].水产科学,2011,30 (1):6-10 Shangguan Y N,Zhao J L,Chen T,et al.Effects ofp-xylene on antioxidant enzymes in liver and white muscle of Boleophthalmus pectinirostris[J].Fishery Science,2011, 30(1):6-10(in Chinese)
[25]Guerra C,Zenteno-Savín T,Maeda-Martínez A N,et al. Changes in oxidative stress parameters in relation to age, growth and reproduction in the short-lived catarina scallop Argopecten ventricosusreared in its natural environment [J].Comparative Biochemistry&Physiology Part A Molecular&Integrative Physiology,2012,162(26):1637-1640
[26]费来华,邵雁群,李赟.栉孔扇贝不同组织SOD、CAT和MPO活力的比较分析[J].海洋湖沼通报,2008(3): 128-132 Fei L H,Shao Y Q,Li Y.Comparitive analysis of the activity of SOD,CAT and MPO in different tissues of the scallopChlamys farreri[J].Transactions of Oceanology and Limnology,2008(3):128-132(in Chinese)
[27]Hannam M L,Bamber S D,Moody A J,et al.Immunotoxicity and oxidative stress in the Arctic scallopChlamys islandica:Effects of acute oil exposure[J].Ecotoxicology &Environmental Safety,2010,73(6):1440||1448
*共同通讯作者(Co-),E-mail:wangbai1980@hotmail.com
Effects of Xylene,Anthracene,and Benzo[α]pyrene on Enzymatic Activities of SOD and CAT in the Japanese Scallop(Mizuhopecten yessoensis)Serums
Guan Xiaoyan1,Wang Bai1,#,Dong Ying1,Li Shuman2,Gao Shan1,Liu Weidong1,Zhou Zunchun1,*
1.Liaoning Ocean and Fisheries Science Research Institute,Dalian 116023,China
2.Shandong Province Monitoring Center of Water Quality in the Nansi Lake,Jining 272100,China
11 June 2015 accepted 17 August 2015
The present study is aimed to evaluate the effects of xylene,anthracene and benzo[α]pyrene on the activities of superoxide dismutase(SOD)and catalase(CAT)in the Japanese scallop(Mizuhopecten yessoensis)serums.Three different concentrations of xylene,anthracene and benzo[α]pyrene were selected to treat the healthy Japanese scallop individuals.The results showed that the SOD activities of Japanese scallop serums were remarkably induced at 6 and 12 hours after the treatments of 0.01-1.0mg·L-1xylene,0.002-0.2mg·L-1anthracene and0.001-0.1mg·L-1benzo[α]pyrene.Compared to controls;the CAT activities were remarkably inhibited at 6 h,but induced at 12 h,showing remarkable dose-effect and time-effect relationship.This suggested that the xylene,anthracene and benzo[α]pyrene had oxidative stress on Japanese scallop,and might cause oxidative damages.Correlation analysis showed that the SOD activity was remarkably negative correlated with the CAT activity of Japanese scallop serums treated with three pollutants at 6 h,but SOD activity was remarkably positive correlated with the CAT activity at 12 h.These results will provide the basic data for toxic assessment of the xylene,anthracene and benzo[α]pyrene on the Japanese scallop.
xylene;anthracene;benzo[α]pyrene;Japanese scallop(Mizuhopecten yessoensis);oxidative stress; SOD;CAT
2015-06-11 录用日期:2015-08-17
1673-5897(2016)1-289-06
X171.5
A
10.7524/AJE.1673-5897.20150611002
关晓燕,王摆,董颖,等.二甲苯、蒽、苯并[α]芘对虾夷扇贝幼贝血清SOD、CAT活性的影响[J].生态毒理学报,2016,11(1):289-294
Guan X Y,Wang B,Dong Y,et al.Effects of xylene,anthracene,and benzo[α]pyrene on enzymatic activities of SOD and CAT in the Japanese scallop (Mizuhopecten yessoensis)serums[J].Asian Journal of Ecotoxicology,2016,11(1):289-294(in Chinese)
海洋公益性行业科研专项(201205012-7);大连市科学技术基金(2012J21DW029)
关晓燕(1983-),女,硕士,助理研究员,研究方向为海洋生态学,E-mail:guanxiaoyan201@163.com
),E-mail:zunchunz@hotmail.com
简介:周遵春(1967—),男,海洋生物学博士,研究员,主要研究方向海洋生物学,发表学术论文80余篇。
王摆(1981—),男,海洋生物学博士,副研究员,主要研究方向海洋生态毒理学,发表学术论文20余篇。
