土壤残留氯磺隆和镉联合胁迫对菠菜代谢产物的影响
2016-12-06赵丽娟张洪解静芳刘瑞卿李萌刘佩佳王雅帅
赵丽娟,张洪,解静芳,*,刘瑞卿,#,李萌,刘佩佳,王雅帅
1.山西大学环境与资源学院,太原030006
2.山西省分析科学研究院,太原030006
土壤残留氯磺隆和镉联合胁迫对菠菜代谢产物的影响
赵丽娟1,张洪2,解静芳1,*,刘瑞卿1,#,李萌1,刘佩佳1,王雅帅1
1.山西大学环境与资源学院,太原030006
2.山西省分析科学研究院,太原030006
通过盆栽试验,评价土壤长残效期除草剂氯磺隆与重金属镉单一污染及复合污染对后茬作物菠菜生长、代谢产物的影响。基于GC-MS技术对3个不同处理组菠菜的代谢产物进行了辨识和分析。主成分分析结果表明,3个处理组的代谢物含量存在显著差异。具体表现为:1)与空白对照相比,氯磺隆诱导菠菜多种氨基酸、与能量代谢相关的3种糖类物质、苹果酸、γ-氨基丁酸、乳酸和腐胺的含量显著上升(*P<0.05);肌醇显著下降(*P<0.05);镉诱导菠菜多种氨基酸、与能量代谢相关的5种糖类物质、参与三羧酸循环的苹果酸和柠檬酸含量显著上升(*P<0.05);肌醇和腐胺含量显著下降(*P<0.05)。2)与单一污染相比较,复合污染诱导菠菜多种氨基酸,多种糖类物质和苹果酸等含量显著下降(*P<0.05)。由此可见,复合污染减弱了氯磺隆和镉单一污染时对氨基酸代谢和能量代谢的上调作用;氯磺隆和镉之间没有协同作用,相反对某些特定的代谢物存在拮抗作用。
氯磺隆;镉;菠菜;代谢物;GC-MS
环境中多种因素都会影响植物的生长和代谢。植物的产量和质量最终来源于植物体内的各种生理生化代谢活动。植物体内的代谢可分为初生代谢和次生代谢。一般来讲,初生代谢形成产量,次生代谢形成质量。而植物代谢产物的变化,对植物主要营养成分的功能发挥有重要影响,而不同代谢产物对人体健康又会产生重要影响。现代农业大量使用除草剂导致其在土壤中残留,同时长期污废水灌溉又导致了土壤重金属污染。这样的污染对作物、蔬菜代谢产物有无影响?影响机制如何?引起了研究者的广泛关注。
磺酰脲类除草剂由于品种繁多、田间使用量少且除草效果好,销量仅次于草甘膦。氯磺隆是磺酰脲类除草剂的第一个品种,其在土壤的降解与土壤的性质有着密切关系。由于其在土壤中残效期长,已于2013年禁止使用,但有研究表明,先前与土壤结合的氯磺隆母体在植物生长过程中可能会被释放并转化为可被甲醇提取的残留物[1-4]。研究表明,在酸性土壤(pH 5.6)中,氯磺隆降解半衰期为13.3 d;而偏碱性土壤(pH 7.5)中,其半衰期达70 d[5]。此外,氯磺隆在碱性土壤中降解到最初施药量的1% (DT99)需要3~5 y的时间,且此残留水平会对后茬敏感作物产生潜在危害[6]。氯磺隆对植物的危害表现在抑制根尖细胞的分裂,抑制植物根部亚精胺的积累[7],从而抑制植物的生长,最终导致植物畸形或死亡。因此本文选择磺酰脲类除草剂代表品种氯磺隆进行研究。
众所周知,土壤中的镉主要来源于污水灌溉。在我国大部分地区,污水灌溉可以缓解水资源短缺的问题。太原市是中国污水灌溉的典型城市之一, 1990年太原市污水灌溉面积达3 000公顷[8]。高等植物对镉(Cd)较为敏感,尽管镉对植物生长不是必需的,但植物仍然可以通过根系吸收并运输到整个植株。因此,土壤环境中积累的Cd也会对植物生长造成危害[9]。Cd可以导致植物碳同化下降,产生氧化应激反应,从而抑制叶绿素的合成,减少营养物质的吸收,进而破坏植物光合作用,阻碍植物生长[10-14]。对于一些 Cd敏感的植物如甘蓝型油菜(Brassica napus),低浓度(100mg Cd/kg dry soil)也可造成其生长抑制,叶绿素含量下降,植物气孔关闭,蒸腾速率下降等[14-16]。因此,Cd在植物中的吸收和积累能引起植物一系列的形态、生理生化上的变化。
除草剂的使用和污水灌溉在农业生产中必不可少,但残留除草剂和重金属积累都会对后茬作物产生危害。目前还未有关于重金属是加重还是缓解氯磺隆对植物药害的报道。本文通过气质联用技术,研究了除草剂氯磺隆残留与重金属镉单一和联合存在时对菠菜代谢物的影响,从而为农产品安全食用、蔬菜种植及土壤污染物的指示提供科学的依据。
1 材料与方法(Materials and methods)
1.1 试验材料和试剂
实验菠菜种子为日本翠玉大菠(山西侯马农人种业有限公司)。试验土壤采自山西省太原市小店区0~20 cm深的土壤。实验盆钵规格为上部直径18 cm,高度16 cm,底部有排水孔。盆土重约400 g取其中一部分用于土壤质地的测定。氯磺隆25%可湿性粉剂购自江苏省激素研究所股份有限公司,农药登记证号:PD20081325;氯化镉(AR.)购自南京化学试剂有限公司。
1.2 实验步骤和方法
根据ISO11269-2(2013)[17]的方法,并做适当的修改,进行种子发芽和幼苗生长实验。土壤风干后过2 mm筛,消毒,备用。土壤质地为粘壤土,pH值8.08,有机质含量1.21%,阳离子交换量25.4 cmol·kg-1。称干土重为400 g的实验土壤,装入到圆筒形塑料实验盆钵中。实验过程中每周定时、定量给每个盆钵添加自来水。幼苗出土后,待长出2片真叶后,每盆定植5株,进行后续观察和实验。实验共进行第40天时,取不同处理菠菜植株用于代谢物测定。试验共进行了3次,测定结果稳定。
通过预实验,选择单一氯磺隆在风干土中的添加剂量为0.5μg·kg-1;单一镉在风干土中的添加剂量为5.0mg·kg-1。2种污染物选择的剂量对菠菜植株生长没有显著影响。复合污染则为二者共同添加到土壤中。试验共设空白对照、氯磺隆单一处理、镉单一处理、氯磺隆和镉复合处理共4个处理,每个处理设6个重复。然后将精选好的菠菜种子播种在土壤表面,用一定量的细土覆盖。所有实验均在温室中进行,温度为(25±2)℃。相对湿度保持在40%~60%之间。
1.3 样品提取及仪器分析条件
称取液氮研磨的植物粉末30mg于离心管中,加入0.5 mL的甲醇和水(1/1,V/V),超声提取30 min,10 000 r·min-1离心10 min,取100μL上清液于进样小瓶中,氮气吹干。加入50μL盐酸甲氧胺吡啶溶液(20 g·L-1),37℃反应90 min,再加入50μL N-甲基-N-(三甲基硅烷)三氯乙酰胺(MSTFA)+ 1%三甲基氯硅烷(TMCS),37℃反应30 min。冷却后,进行GC-MS分析。
美国Thermo Fisher公司DSQ单四极杆气相色谱质谱仪。J&W DB-5MS毛细管柱(0.32 mm×30 m,0.25μm);进样口温度280℃;载气(He)流速1.0 mL·min-1,不分流。升温程序:50℃保持1 min,以每分钟10℃升至100℃,保持1 min;以每分钟10℃升至200℃,保持1 min,以每分钟10℃升至280℃,最后以每分钟10℃升至320℃,保持1 min。溶剂延迟时间为5 min,进样量1μL。
电子轰击(EI)离子源;电子能量70 eV;传输线温度280℃;离子源温度200℃;质量扫描范围m/z 50~650。
1.4 数据处理
采用自动质谱图解卷积和鉴定系统软件The Automatic Mass Spectral Deconvolution and Identification System(AMDIS)对空白组和处理组质谱图进行滤噪、校正漂移、从紧密相邻的共洗脱峰中提取出单个峰等一系列处理。质谱图经AMDIS处理后,根据德国马普的格列姆数据库检索,设置最小匹配值为60%。根据代谢物的保留时间和特征峰,进行积分。结合内标物的峰面积,计算代谢物的相对含量。
2 结果与分析(Results and analysis)
2.1 不同处理组菠菜生长状况
除根长在氯磺隆处理组显著降低(P<0.05)外,菠菜的株高、株型、颜色在不同处理组均没有显著差异。
2.2 不同处理菠菜代谢物的定性分析
总离子色谱图经预处理后,结合正构烷烃的保留时间,计算不同代谢物的保留指数(retention index, RI)。通过代谢数据库检索,结合每种代谢物的保留时间(retention time,tR)、保留指数,分析和确定衍生化后的分子式和分子量。通过保留指数定性分析技术,对不同处理菠菜的代谢产物进行辨识,共鉴定出所有处理共有的39种代谢物,其中包括10种氨基酸、7种糖、14种酸类物质以及其他化合物8种。
2.3 菠菜不同种类代谢物在不同处理组的变化
2.3.1 菠菜中不同种类代谢物主成分分析
对不同处理组菠菜的代谢物进行主成分分析,如图1所示,第1主成分(PC1)和第2主成分(PC2)可以解释76%的原变量信息,4种不同处理组的菠菜代谢物在PCA得分图PC1维上明显区分,即组内聚集,组间很好地分开。

图1 不同处理组菠菜的主成分分析PC1/PC2得分图Fig.1 PC1/PC2 scores ofSpinacia oleraceaL.in different treatments
主成分分析结果表明磷酸酯、苏氨酸、半乳糖等10种代谢物与第1因子的相关程度高(因子得分系数绝对值大于0.8),脯氨酸、γ-氨基丁酸、苹果酸等11种代谢物与第2因子的相关程度高(因子得分系数大于0.8)。具体结果见表1。
2.3.2氨基酸含量的变化
植物体内氨基酸是植物蛋白质合成的基本单元,也是植物体内多种与抗逆性相关代谢产物的合成前体[18]。本研究共检测到丙氨酸族氨基酸3种(丙氨酸、β-丙氨酸和缬氨酸),丝氨酸族氨基酸2种(丝氨酸和甘氨酸),天冬氨酸族氨基酸3种(天冬氨酸、苏氨酸和异亮氨酸),以及谷氨酸族氨基酸2种(谷氨酸和脯氨酸)。结果见表2。
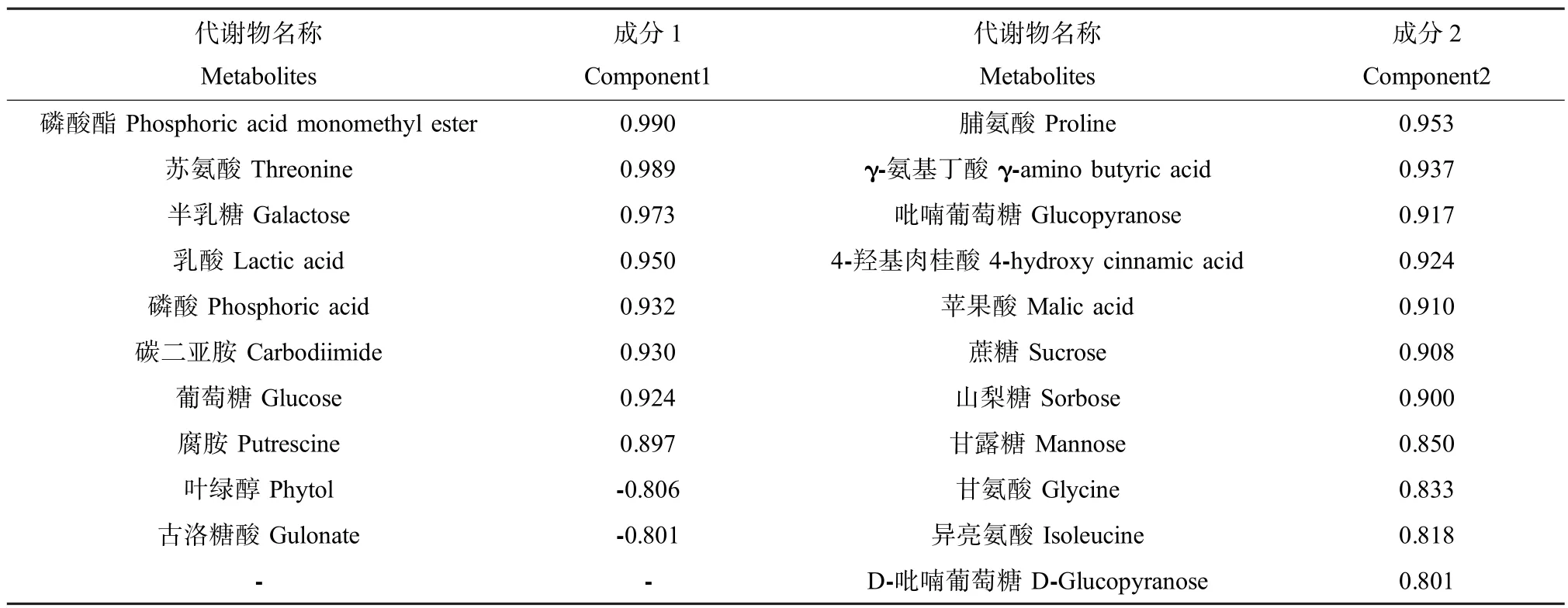
表1 菠菜代谢物因子得分系数Table 1 Component score coefficient of metabolites ofSpinacia oleraceaL.

表2 不同处理组菠菜氨基酸含量的变化分析(mg·g-1FW)Table 2 Changes of amino acids ofSpinacia oleraceaL.in different treatments(mg·g-1FW)
与对照组相比,土壤中残留氯磺隆胁迫下,缬氨酸、异亮氨酸、脯氨酸、甘氨酸、苏氨酸和天冬氨酸含量分别上升了37%、52%、6 796%、99%、178%和38%;丙氨酸、丝氨酸、β-丙氨酸和谷氨酸含量分别下降了42%、29%、40%和73%。
土壤镉胁迫,丙氨酸、缬氨酸、异亮氨酸、脯氨酸、甘氨酸和天冬氨酸含量上升了44%、35%、54%、12 049%、112%和29%。丝氨酸、苏氨酸、β-丙氨酸和谷氨酸含量下降了12%、75%、53%和88%。
复合污染时,丙氨酸、缬氨酸、甘氨酸、丝氨酸、苏氨酸和谷氨酸含量下降了92%、7%、13%、46%、100%和100%。异亮氨酸、脯氨酸、β-丙氨酸和天冬氨酸含量上升了25%、5 400%、124%和56%。
综合比较,氯磺隆和镉单一污染均诱导缬氨酸、异亮氨酸、脯氨酸、甘氨酸和天冬氨酸含量显著(P<0.05)上升;丝氨酸、β-丙氨酸和谷氨酸含量显著(P<0.05)下降。2个处理不同的是氯磺隆诱导丙氨酸含量显著下降,苏氨酸含量显著上升;镉诱导丙氨酸含量显著上升,苏氨酸含量显著下降。与单一污染相比较,异亮氨酸和脯氨酸在复合污染处理的上升率均低于单一污染,天冬氨酸与之相反;丝氨酸和谷氨酸在复合污染处理的下降率高于单一污染处理;缬氨酸和甘氨酸在复合污染处理显著下降,在单一污染处理显著上升,β-丙氨酸与之相反;丙氨酸在复合污染处理的反应与氯磺隆处理一致,与镉处理相反;苏氨酸在复合污染处理的反应与镉处理一致,与氯磺隆相反,且复合污染处理上升率和下降率高于单一污染。
氯磺隆以及其他磺酰脲了除草剂,其作用靶标是乙酰乳酸合成酶(ALS),也称乙酰羟基酸合成酶(AHAS),它抑制支链氨基酸缬氨酸、亮氨酸和异亮氨酸的生物合成[19-24]。然而,实验结果表明氯磺隆处理组支链氨基酸(缬氨酸和异亮氨酸)含量显著上升。Zabalza等(2013)[25]发现ALS抑制剂会诱导短期内总氨基酸在植物叶片和根系中含量的积累,本实验也得到了类似的结果,分析造成这种现象的原因可能是由于蛋白质的分解反应速率大于合成反应速率,从而掩盖了氯磺隆对支链氨基酸合成的抑制作用[21]。镉胁迫也导致了2种氨基酸含量的显著上升。然而残留除草剂和镉复合污染后,菠菜中缬氨酸含量下降,同时异亮氨酸的上升比率也有所下降。
脯氨酸含量升高是植物抗逆反应的重要标记。许多研究表明,氯磺隆对植物根的生长有抑制作用,且植物受到胁迫后脯氨酸含量显著升高[26-27]。Xu等[28]研究表明脯氨酸在缓解Cd对龙葵(Solanum nigrum)幼苗的毒性起着至关重要的作用。本研究也得到了相似的结果,菠菜受到氯磺隆、镉及2种污染物复合胁迫后,脯氨酸含量显著升高,是对照组的55~121倍。
谷氨酸、甘氨酸和丝氨酸是光呼吸乙醇酸途径中3种关键的氨基酸。氯磺隆和镉胁迫均导致了谷氨酸和丝氨酸含量显著下降,甘氨酸含量显著升高,表明氯磺隆和镉对甘氨酸的合成没有影响,但对甘氨酸转变丝氨酸的过程有抑制作用。复合污染则是甘氨酸、谷氨酸和丝氨酸含量均下降,表明2种物质复合污染时光呼吸受到了抑制,即氨的循环受阻。此外,许多研究还表明丝氨酸是植物对生物或非生物胁迫做出反应的重要标志[29-31]。刘清岱等(2010)[32]报道外源丝氨酸能诱导植物衰老。实验表明氯磺隆、镉以及复合污染均未造成菠菜中丝氨酸的积累,从而可以推断氯磺隆、镉以及复合污染并未加快菠菜的衰老。
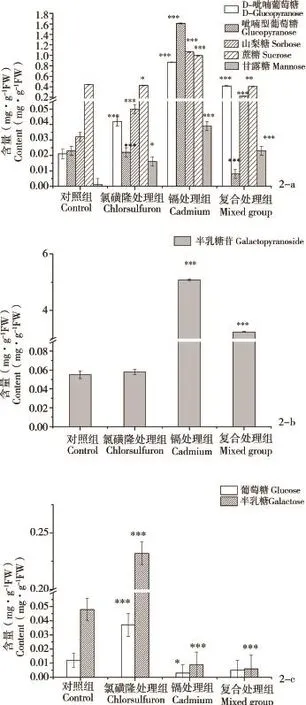
图2 不同处理组菠菜碳水化合物及其衍生物的含量变化注:*P<0.05、**P<0.01、***P<0.001表示处理组与空白对照组之间差异(t-检验,双尾检验)。Fig.2 Changes of carbohydrate and derivative ofSpinacia oleraceaL.in different treatmentsNote:*P<0.05,**P<0.01,***P<0.001,statistical difference t-test (two-tail)compared with control.
2.3.3不同处理碳水化合物含量变化分析
不同处理、不同类碳水化合物含量变化见图2a~c。
从图2a可以看出,镉对菠菜中D型吡喃葡萄糖、吡喃型葡萄糖、山梨糖、蔗糖和甘露糖的影响较大,与对照相比,均显著升高。这与先前研究结果一致。有研究表明,当大米受到镉胁迫时,其茎叶中会积累一定量的碳水化合物并伴随着净光合速率的下降[33]。Kieffe等[34](2008)研究结果显示,各种碳水化合物的积累是镉抑制植物生长的一个重要因素。
此外,还可以看出,氯磺隆对菠菜中糖类物质的影响较小,只有山梨糖的含量是极显著(P<0.001)升高。复合污染处理组,糖类物质的含量较镉处理组显著下降,表明氯磺隆的加入减弱了镉对糖类物质的影响。
从图2b可以看出,半乳糖苷是菠菜中唯一检测到的半乳糖衍生物,其在氯磺隆处理组无显著变化,但镉处理组的含量则是对照组的93倍。复合污染虽较镉处理有所降低,但仍是对照组的59倍。
图2c显示葡萄糖和半乳糖在不同处理中的变化情况。由图可知,氯磺隆处理组显著升高,而镉处理和复合处理则导致了2种物质含量的显著下降。
综上结果表明,植物受到不同污染物胁迫时,积累的碳水化合物的种类和量不同。且2种污染物复合时,植物体内的碳水化合物并不是累加和提高的关系,表明2种污染物之间没有协同作用,相反2种物质在碳水化物的积累上表现为减弱的作用。通常,逆境胁迫下,植物会发生一系列的抗逆反应,如产生活性氧、信号转导分子、以及与抗性相关的蛋白和代谢物[35]。这些反应都需要大量的能量来维持,因此能量代谢的提升是植物抗逆的一个重要标志。Zabalza(2004)等[20]研究表明植株叶片和根部碳水化合物的积累是植物对乙酰乳酸合成酶(ALS)类除草剂的普遍生理反应。
2.3.4 不同处理有机酸含量的变化
植物组织的一个显著特征是有机酸总含量较高,这可能是由有机酸在植物体内具有的重要代谢功能所决定的,有机酸除了参加光合作用和呼吸作用,还可以作为代谢活性溶质,调节渗透压,平衡过多的阳离子,在应对养分缺乏、金属胁迫以及操纵根-土界面、植物-微生物交互作用等代谢过程中,有机酸也是作为关键成分参与其中的[36]。不同处理菠菜有机酸含量变化结果见表3。

表3 不同处理组菠菜中有机酸类代谢物含量变化(mg·g-1FW)Table 3 Changes of organic acid ofSpinacia oleraceaL.in different treatments(mg·g-1FW)
从表2可以看出,与对照组相比,氯磺隆、镉及复合污染均诱导苹果酸、2-氨基丁酸、γ-氨基丁酸(GABA)、4-羟基肉桂酸和十六烷酸含量显著上升,苯甲酸和十八烷酸含量显著下降。氯磺隆胁迫导致了磷酸和乳酸含量的积累,而镉和复合污染胁迫则使得这2种代谢物含量显著下降。乳酸累积在细胞内,会使胞质溶胶酸化,影响酶代谢。γ-氨基丁酸主要是来源于谷氨酸脱羧作用形成,研究发现冷害、缺氧、酸化、干旱等多种胁迫,均能引起植物体内GABA水平升高[37]。本研究也得到了类似的结果,氯磺隆、镉及复合污染均引起了菠菜体内GABA水平升高。苹果酸和柠檬酸是植物体内三羧酸循环中2种主要的有机酸,氯磺隆处理诱导苹果酸含量显著升高,柠檬酸含量显著下降;而镉和复合污染时苹果酸和柠檬酸含量同时显著上升,曾有研究表明,麦类植物受到铝毒害时,苹果酸和柠檬酸的分泌是主要的抗铝机制[38]。结果表明,菠菜对镉毒害的响应与麦类植物对铝毒害的响应相似。
2.3.5 其他物质含量变化
菠菜中共检测到其他类物质9种,包括碳二亚胺、丁胺、酪胺、腐胺、磷酸酯、苯酚、肌醇和叶绿醇。其中,与植物抗逆相关的物质主要有腐胺和肌醇。2种物质的变化结果见图3。
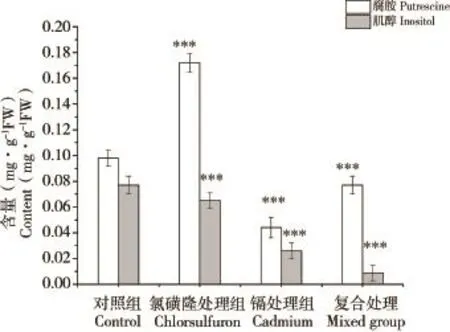
图3 不同处理组菠菜中腐胺和肌醇的含量变化注:*P<0.05、**P<0.01、***P<0.001表示处理组与空白对照组之间差异(t-检验,双尾检验)。Fig.3 Changes of putrescine and inositol ofSpinacia oleraceaL.in different treatmentsNote:*P<0.05,**P<0.01,***P<0.001,statistical differences t-test(two-tail)compared with control.
腐胺是多胺类化合物的一种,可调节植物的生长和发育,以及提高植物的抵抗力[39]。氯磺隆诱导菠菜中腐胺的积累,这与先前研究的结果一致[40]。然而,镉处理及复合处理均未造成腐胺在菠菜中积累。
植物细胞中肌醇分子参与多种生理过程,包括形成植酸等储存物质、调节植物细胞抗逆、促进种子脱水、修饰生长素、参与细胞壁组成等[41]。研究证明,植物细胞中肌醇的原初功能是作为底物合成磷脂酰肌醇以及磷脂酰肌醇磷酸,维持内膜系统的结构完整和运输功能;而内膜系统的结构完整和运输功能又直接影响生长素调控的植物胚胎发育过程。氯磺隆、镉及二者复合污染均导致了肌醇含量显著下降,进而将会影响内膜系统结果完整和运输功能,最终影响植物的发育。
综上所述,气质联用结合解卷积技术,共鉴定出菠菜39种代谢产物。
分析氯磺隆和镉处理代谢物含量变化得出,氯磺隆上调了苏氨酸、葡萄糖、半乳糖、乳酸、苹果酸和腐胺的含量;下调了丙氨酸和柠檬酸的含量;对多种碳水化合物无显著影响。镉上调了丙氨酸、D-型吡喃葡萄糖、吡喃葡萄糖、山梨糖、蔗糖、甘露糖、半乳糖苷、苹果酸、柠檬酸含量;下调了苏氨酸、葡萄糖、半乳糖、腐胺和肌醇含量。
分析复合污染和单一污染代谢物含量变化得出,2种污染物对缬氨酸、异亮氨酸、脯氨酸、甘氨酸、β-丙氨酸、谷氨酸、天冬氨酸、所有碳水化合物物、苹果酸、柠檬酸等有机酸和腐胺存在拮抗作用;对丝氨酸和十八烷酸存在协同作用。此外,镉的加入增强了氯磺隆对丙氨酸的作用;氯磺隆的加入增强了镉对苏氨酸、磷酸、乳酸和古洛糖酸的作用。
由此可得出,2种污染物对菠菜代谢物的影响存在差异,且两种污染物复合时对不同代谢物的影响也不同,对多种代谢产物存在拮抗作用。从这个结果,我们可以推断当菠菜遭受氯磺隆胁迫时,镉能减弱氯磺隆的毒害作用。
[1]Khan S U.Bound residues in soil and plants[J].Residues Reviews,1982,84:1–25
[2]IAEA.Quantification,nature and bioavailability of bound 14C-pesticide residues in soil,plants and food[R].Vien-na,Austria:International Atomic Energy Agency,1986
[3]Dec J,Bollag J M.Microbial release and degradation of cathecol and chlorophenols bound to synthetic humic acid [J].Soil Science Society of America Journal,1988,52: 1366–1371
[4]Ye Q F,Wu J M,Sun J H.Bioavailability of bound residue derived from 14C-labeled chlorsulfuron in soil and its mechanism of phytotoxicity[J].Journal of Environmental Sciences(China),2004,16:262–267
[5]单正军.氯磺隆的环境行为及其对作物的影响[J].农药科学与管理,1998(3):12-14 Shan Z J.Reviews on the environmental behavior of chlorsulfuron and its safety to plants[J].Pesticide Science and Adminstration,1998(3):12-14(in Chinese)
[6]Hollaway K L,Kookana R S,Noy D M,et al.Persistence and leaching of sulfony-lurea herbicides over a 4-year period in the highly alkaline soils of south-eastern Australia [J].Australian Journal of Experimental Agriculture,2006, 46:1069–1076
[7]Giardina M C,Carosi S.Effects of chlorsulfuron on polyamine content in maize seedlings[J].Pesticide Biochemistry and Physiology,1990,36:229–236
[8]栗献峰.太原市污灌区土壤重金属分布特征及风险评价[J].山西农业科学,2012,40(7):42-46,74 Li X F.Distribution characteristics and risk evaluation of heavy metals in soil of sewage irrigation area of Taiyuan City[J].Journal of Shanxi Agricultural Sciences,2012,40 (7):42-46,74(in Chinese)
[9]Wagner G J.Accumulation of cadmium in crop plants and its consequences to human health[J].Advances in Agronomy,1993,1(51):173-212
[10]Baszynski T,Krupa Z.Some aspects of heavy metals toxicity towards photosynthetic apparatus-direct and indirect effects on light and dark reactions[J].Acta Physiologiae Plantarum,1995,17:177–190
[11]Das P,Samantaray S,Rout G.Studies on cadmium toxicity in plants:A review[J].Environmental Pollution,1997, 98:29–36
[12]Padmaja K,Prasad D,Prasad A.Inhibition of chlorophyll synthesis inPhaseolus vulgarisL.seedlings by cadmium acetate[J].Photosynthetica,1990,24:399–405
[13]Pietrini F,Iannelli M A,Pasqualini S,et al.Interaction of cadmium with glutathione and photosynthesis in developing leaves and chloroplasts ofPhragmites australis(Cav.) Trin.ex Steudel[J].Plant Physiology,2003,133:829–883
[14]Baryla A,Carrier P,Franck F,et al.Leaf chlorosis in oil seed rape plants(Brassica napus)grown on cadmium-polluted soil:Causes and consequences for photosynthesis and growth[J].Planta,2001,212:696–709
[15]Larsson E H,Bornman J F,Asp H.Influence of UV-B radiation and Cd2+on chlorophyll fluorescence,growth and nutrient content inBrassica napus[J].Journal of Experimental Botany,1998,49:1031–1039
[16]Böddi B,Oravecz A,Lehoczki E.Effect of cadmium on organization and photoreduction of protochlorphyllide in dark-grown leaves and etioplast inner membrane preparations of wheat[J].Photosynthetica(Czech Republic), 1995,31:411–420
[17]International Organization for Standardization.Soil quality–determination of the effects of pollutants on soil flora. Part 2:Effects of contaminated soil on the emergence and early growth of higher plants.BS EN ISO 11269-2[R]. Geneva,Switzerland:ISO,2012
[18]Xie Y,Hu L X,Du Z M,et al.Effects of cadmium exposure on growth and metabolic profile of bermudagrass [Cynodon dactylon(L.)Pers.][J].PLoS One,2014,9(12): e115279
[19]范志金,钱传范,于维强,等.氯磺隆和苯磺隆对玉米乙酰乳酸合成酶抑制作用的研究[J].中国农业科学, 2003,36(2):173-178 Fan Z J,Qian C F,Yu W Q,et al.Study on enzymatic inhibition of acetolactate synthase from maize(Zea mays L.)by chlorsulfuron and tribenuron-methyl[J].Scientia Agricultura Snica,2003,36(2):173-178(in Chinese)
[20]Zabalza A,Orcaray L,Gaston S,et al.Carbohydrate accumulation in leaves of plants treated with the herbicide chlorsulfuron or imazethapyr is due to a decrease in sink strength[J].Journal of Agricultural and Food Chemistry, 2004,52:7601–7606
[21]Zabalza A,Gonzalez E M,Arrese-Igor C,et al.Fermentative metabolism is induced by inhibiting different enzymes of the branched-chain amino acid biosynthesis pathway in pea plants[J].Journal of Agricultural and Food Chemistry,2005,53:7486–7493
[22]Zhou Q,Liu W,Zhang Y,et al.Action mechanisms of acetolactate synthase-inhibiting herbicides[J].Pesticide Biochemistry and Physiology,2007,89:89–96
[23]Orcaray L,Igal M,Marino D,et al.The possible role of quinate in the mode of action of glyphosate and acetolactate synthase inhibitors[J].Pest Management Science, 2010,66:262–269
[24]Orcaray L,Igal M,Zabalza A,et al.Role of exogenously supplied ferulic and p-coumaric acids in mimicking the mode of action of acetolactate synthase inhibiting herbicides[J].Journal of Agricultural and Food Chemistry,2011,59:10162–10168
[25]Zabalza A,Amaia Z,Gil-Monreal M,et al.Branchedchain amino acid biosynthesis inhibitors:Herbicide efficacy is associated with an induced carbon-nitrogen imbalance[J].Journal of Plant Physiology,2013,170:814-821
[26]Fayeaz K A,Kristen U.The influence of herbicides on the growths and proline content of primary roots and on the ultrastructure of root caps[J].Environmental and Experimental Botany,1996,36:71-81
[27]Deng F.Effects of glyphosate,chlorsulfuron,and methyl jasmonate on growth and alkaloid biosynthesis of jimsonweed(Datura stramoniumL.)[J].Pesticide Biochemistry and Physiology,2005,82:16-26
[28]Xu J,Sun J,Du L,et al.Comparative transcriptome analysis of cadmium responses inSolanum nigrumandSolanum torvum[J].New Phytologist,2012,196:110–124
[29]Ho C L,Saito K.Molecular biology of the plastidic phosphorylated serine biosynthetic pathway inArabidopsis thaliana[J].Amino Acids,2001,20:243–259
[30]Waditee R,Bhuiyan N H,Hirata E,et al.Metabolic engineering for betaine accumulation in microbes and plants [J].Journal of Biological Chemistry,2007,282:34185–34193
[31]Benstein R M,Ludewig K,Wulfert S,et al.Arabidopsis phosphoglycerate dehydrogenase1 of the phosphoserine pathway is essential for development and required for ammonium assimilation and tryptophan biosynthesis[J]. Plant Cell,2013,25:5011–5029
[32]刘清岱,朱晔荣,李洪涛,等.紫萍叶状体衰老过程中的内肽酶谱变化和外源L-丝氨酸对内肽酶谱的影响[J].植物生理学通讯,2010(3):241-244 Liu Q D,Zhu Y R,Li H T,et al.Changes of endopeptidase isoenzymes inSpirodela polyrrhiza thallusduring sene scence and effect of exogenous L-serine on endopeptidase isoenzymes[J].Plant Physiology Communications, 2010(3):241-244(in Chinese)
[33]Moya J,Ros R,Picazo I.Heavy metal-hormone interactions in rice plants:Effects on growth,net photosynthesis, and carbohydrate distribution[J].Journal of Plant Growth Regulation,1995,14:61–67
[34]Kieffer P,Dommes J,Hoffmann L,et al.Quantitative changes in protein expression of cadmium-exposed poplar plants[J].Proteomics,2008,8:2514–2530
[35]漆小泉,王玉兰,陈晓亚.主编.植物代谢组学-方法与应用[M].北京:化学工业出版社,2011 Qi X Q,Wang Y L,Chen X Y.eds.Plant Metabolomics: Methods and Applications[M].Beijing:Chemical Industry Press,2011(in Chinese)
[36]汪建飞,沈其荣.有机酸代谢在植物适应养分和铝毒胁迫中的作用[J].应用生态学报,2006,17(11):2210-2216 Wang J F,Shen Q R.Roles of organic acid metabolism in plant adaptation to nutrient deficiency and a luminum toxicity stress[J].Chinese Journal of Applied Ecology,2006, 17(11):2210-2216(in Chinese)
[37]施征,史胜青,钟传飞,等.γ-氨基丁酸在植物抗逆生理及调控中的作用[J].生命科学研究,2007,11(4):57-61 Shi Z,Shi S Q,Zhong C F,et al.The roles of γ-aminobutyric acid on physiology and regulation under stress in plants[J].Life Science Research,2007,11(4):57-61(in Chinese)
[38]王伟.植物激素及铝对小麦根尖有机酸代谢与分泌的影响[D].武汉:华中农业大学,2008 Wang W.Effect of plant hormone and aluminum on organic acid metablism and secretion in wheat root tapcies [D].Wuhan:Huazhong Agricultural University,2008(in Chinese)
[39]Song Y-J,Diao Q-N,Qi H-Y.Research progress on relationship between polyamine metabolism and plant stress resistance[J].China Vegetables,2012(1):36-42
[40]Giardina M C,Carosi S.Effects of chlorsulfuron on polyamine content in maize seedlings[J].Pesticide Biochemistry and Physiology,1990,36:229-236
[41]Yu L,Qin G,Zhang J,et al.D-myo-inositol-3-phosphate affects phosphatidylinositol-mediated endomembrane function inArabidopsisand is essential for auxin-regulated embryogenesis[J].The Plant Cell,2011,23:1352-1372
*共同通讯作者(Co-),E-mail:liurq@sxu.edu.cn
Joint Effects of Soil Residual Chlorsulfuron and Cadmium on Metabolites of Spinacia oleracea L.
Zhao Lijuan1,Zhang Hong2,Xie Jingfang1,*,Liu Ruiqing1,#,Li Meng1,Liu Peijia1,Wang Yashuai1
1.College of Environment and Resource,Shanxi University,Taiyuan 030006,China
2.Shanxi Academy of Analytical Science,Taiyuan 030006,China
6 September 2015 accepted 31 December 2015
The single and combined stress effects of the long residual herbicide chlorsulfuron and cadmium were evaluated on the growth and metabolites ofSpinacia oleraceaL.in this study.The metabolites ofSpinacia oleracea L.in different treatment groups were identified and analyzed by GC-MS technique.Combined with the results from the control group,there were individually significant differences in the detection of metabolites from the three treatment groups.1)Chlorsulfuron prompted a large increase(*P<0.05)in the content of multiple-amino acids,the three carbohydrates involved in energy metabolism,malic acid,γ-aminobutyric acid(GABA),lactic acid and putrescine,otherwise,an obvious decrease of inositol(*P<0.05).In the other hand,cadmium caused an increase(*P<0.05)in multiple-amino acids,five energy-metabolism-related carbohydrates,malic acid and citric acid,however a decrease(*P<0.05)of putrescine and inositol.2)Unlike the results of single treatment group of chlorsulfuron or Cd,the detection in combination treatment group showed a decrease(*P<0.05)in multiple-amino acids,multiplecarbohydrates and malic acid and et al.Summarizing the results mentioned above,we concluded that the combined effects by soil residual chlorsulfuron and cadmium could obviously impair the up-effects on the amino acids and energy metabolisms induced by any single one of them;in addition,the combination effects by chlorsulfuron and cadmium also did not demonstrate an synergy but an antagonism on some metabolites.
chlorsulfuron;cadmium;Spinacia oleraceaL.;metabolities;GC-MS
2015-09-06 录用日期:2015-12-31
1673-5897(2016)1-274-09
X171.5
A
10.7524/AJE.1673-5897.20150906001
赵丽娟,张洪,解静芳,等.土壤残留氯磺隆和镉联合胁迫对菠菜代谢产物的影响[J].生态毒理学报,2016,11(1):274-282
Zhao L J,Zhang H,Xie J F,et al.Joint Effects of Soil Residual Chlorsulfuron and Cadmium on Metabolites ofSpinacia oleraceaL.[J].Asian Journal of Ecotoxicology,2016,11(1):274-282(in Chinese)
国家自然科学基金(No.30740037);国家公益性行业(农业)科研专项(No.201103024);山西省研究生优秀创新项目(011452901009);山西省自然科学基金(2014011013-2)
赵丽娟(1983—),女,在读博士,研究方向为环境科学,E-mail:zhao6286145@126.com;
),E-mail:xiejf@sxu.edu.cn
简介:解静芳(1961-),女,环境科学博士,教授,主要研究方向为环境毒理化学、环境有机污染化学、环境污染物监测与分析。
